摘 要:用不同外源激素生长素(IAA)和细胞分裂素(6-BA)处理汉麻,探究不同植物激素对汉麻生理代谢以及性别分化的影响,筛选最佳的促雌化激素及最佳浓度。采用30、60、120mg/L的IAA和15、30、60、120mg/L的6-BA喷施汉麻四叶期叶片,以蒸馏水喷施为对照,记录成熟后雌雄株数量。并测定各组雌雄麻叶片的过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)活性,及可溶性糖和可溶性蛋白含量。激素IAA和6-BA对汉麻均具有显著雌化效果。与对照相比,IAA处理组雌雄麻叶片的POD和CAT活性均降低,雌麻在IAA60、120mg/L处理组的SOD活性显著提高(P<0.05),雌雄麻的可溶性糖和可溶性蛋白含量均显著下降(P<0.05)。6-BA处理组中,雌麻POD活性在6-BA 15mg/L处理中显著提高(P<0.05),雄麻无显著差异。而6-BA30mg/L处理组的CAT活性显著高于对照(P<0.05)。60mg/L和120mg/L6-BA处理可使可溶性糖含量显著增加(P<0.05),两种处理对可溶性蛋白含量没有显著影响。外源激素IAA和6-BA对汉麻性别分化均具有促雌化作用,其中,6-BA 60mg/L处理组促雌效果最为显著,且对可溶性糖和可溶性蛋白质含量无明显影响。
关键词:汉麻;性别分化;雌化;外源激素;酶活性;可溶性糖;可溶性蛋白
大麻(Cannabis sativa L.)为一年生草本植物,隶属于大麻科大麻属,也可称为线麻或火麻(张树权,2019)。自然状态下雌雄异株,少见雌雄同株,雌雄植株具有明显的区别性状,大麻具有医药、纺织等多方面的经济价值。工业大麻又名汉麻,是四氢大麻酚(THC)含量低于0.3%,无毒品利用价值的一个大麻品种(胡学礼等,2012;陈璇等,2015;唐慧娟等,2018)。中国是世界上汉麻种植面积最大的国家,迄今为止,中国已将云南和黑龙江两省工业大麻种植和加工合法化。汉麻种子富含优质蛋白质和不饱和脂肪酸,有降压调脂、改善消化系统等功效,其枝茎中的大麻纤维有吸湿、透气等特性,是优良的纺织、造纸原材料;其花、叶中的活性物质广泛应用于医药和化妆品领域(Pasila,2004;常丽等,2018;O'Brien,2022;Sivesindetal.,2022;?miarowskaetal.,2022;Legareetal.,2022)。可见汉麻在生产生活中,具有巨大的开发利用价值。多数汉麻为雌雄异株,少数雌雄同株。生产上,种植纤维含量优质的雄麻多是以收获纤维为目的,而栽培雌麻则多数为了收获籽粒或提取高质量的大麻二酚(CBD)。雌株的CBD含量远高于雄株,但授粉后CBD含量则减少60%。
植物的性别表达除基因决定外,还可借助温度、光、植物激素等因素调控,其中植物激素和光周期是主要的调控因子(傅靖棋等,2022)。生产生活中通过外源激素处理汉麻调控性别,是最简单有效的人为干预处理方法(薛红芬等,2021)。由于汉麻在种期及幼苗期性别检测方法繁琐,且性别表达受多种因素影响。汉麻的性别分化问题使其雌雄株搭配不合理,这严重影响了汉麻产业的壮大和发展(崔丹丹等,2018)。
若能够确定影响汉麻雌化的激素及浓度,便可通过人为的改变来影响汉麻的性别分化,从而提高汉麻的经济价值。但目前还没有形成可以在生产上广泛使用的相关技术标准。因此,本实验致力于运用生理学手段,研究了不同浓度的不同植物激素对汉麻性别诱导的方法,基于前人对外源激素促雌化的研究,筛选有效的植物激素来调节汉麻的性别分化。在诱导过程中检测汉麻发生怎样的生理生化变化,以期形成规范完善的技术体系供生产上应用。
1 结果与分析
1.1 不同浓度IAA和6-BA对汉麻性别分化的影响
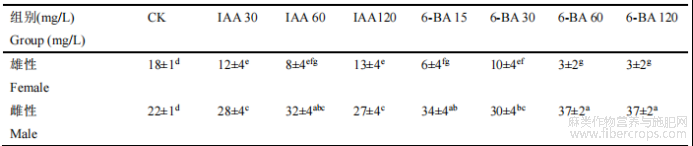
各组选取40株汉麻进行实验,以喷施蒸馏水为对照组,待植株分化出性别表征后,统计各组雌雄株数量,取3组平均数进行统计(表1)。可见激素IAA和6-BA均对汉麻具有显著雌化作用。60mg/L IAA可使雌化率达到80%,60、120mg/L 6-BA对汉麻雌化率可达到92.5%。
表1 汉麻性别分化统计表
1.2 不同浓度IAA和6-BA对汉麻叶片POD活性的影响
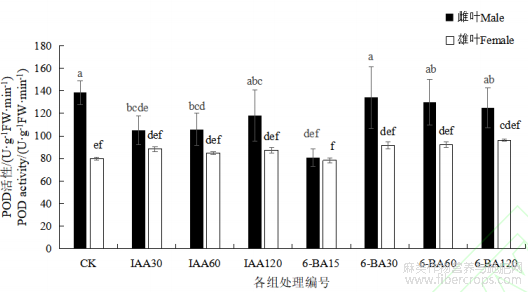
不同处理间POD活性存在差异。与对照相比,IAA处理组中,雌麻叶片POD的活性均降低,并且随IAA浓度的增加,POD活性呈现逐渐上升趋势,但无显著差异。而雄麻的POD活性则无显著变化,且活性均低于相同处理的雌麻。与对照组相比,激素6-BA处理组中,雌麻POD活性均低于对照组,且6-BA 15处理组达到了显著水平(P<0.05)。而雄麻较对照,POD活性无明显差异,除6-BA 15处理组,雄麻POD活性均显著低于雌麻(P<0.05))(图1)。
图1 不同浓度 IAA 和 6-BA 对汉麻叶片 POD 活性的影响
注:不同小写字母表示不同处理间在 P<0.05 水平差异显著
1.3 不同浓度IAA和6-BA对汉麻叶片CAT活性的影响
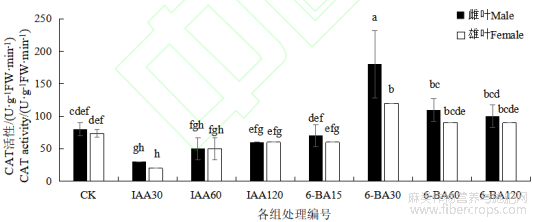
不同处理间CAT活性存在显著差异。与对照相比,IAA处理组中,雌雄麻的CAT活性均低于对照,但随着激素浓度的增加,CAT活性升高。其中,IAA30处理组显著低于对照组(P<0.05)。与对照组相比,6-BA处理组中,仅有6-BA 15处理组降低了CAT活性,其余均提高了雌雄麻叶片中的CAT活性,且6-BA30处理组效果最为显著(P<0.05)。雌雄麻间比较,雄麻的CAT活性均低于雌麻,除6-BA30处理组差异达到显著水平(P<0.05),其余组差异均不显著。
图2 不同浓度 IAA 和 6-BA 对汉麻叶片 CAT 活性的影响
注:不同小写字母表示不同处理间在 P<0.05 水平差异显著
1.4 不同浓度IAA和6-BA对汉麻叶片SOD活性的影响
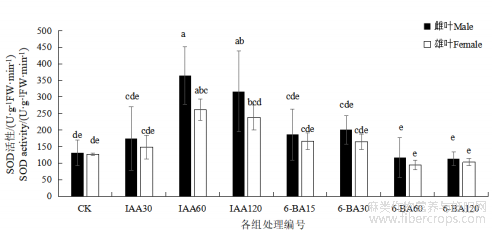
不同处理组间SOD活性存在显著差异。与对照相比,IAA处理组中,雌雄麻SOD活性均有所提高,随激素浓度的增加,呈现先升后降的趋势,其中,在IAA60和IAA 120处理组与对照差异显著(PP<0.05)。6-BA处理组中,只有6-BA 15和6-BA30处理组提高了SOD活性,6-BA 60和6-BA 120处理组相较于对照,SOD活性则有所降低,但差异均不显著。雌雄麻间比较,雄麻的SOD活性均低于雌麻,且差异不显著。
图3 不同浓度 IAA 和 6-BA 对汉麻叶片 SOD 活性的影响
注:不同小写字母表示不同处理间在 P<0.05 水平差异显著
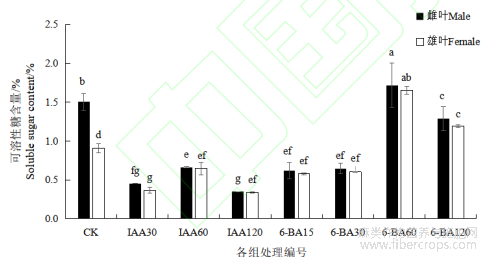
1.5 不同浓度IAA和6-BA对汉麻叶片可溶性糖含量的影响
IAA处理组与对照相比,可溶性糖含量均显著降低(P<0.05)。雌雄麻间比较,,随激素浓度增加,呈先升后降的趋势,其中,IAA 120处理组可溶性糖含量达到最低点。6-BA处理组中,6-BA 60处理组显著提高了可溶性糖含量(P<0.05),除6-BA 120雄麻可溶性糖含量高于对照,其余处理组相较于对照而言,可溶性糖含量均显著降低(P<0.05)。雌雄麻间比较,除对照组中雄麻含量显著低于雌麻(P<0.05),其余组雌雄麻含量差异不显著。
图4 不同浓度 IAA 和 6-BA 对汉麻叶片可溶性糖含量的影响
注:不同小写字母表示不同处理间在 P<0.05 水平差异显著
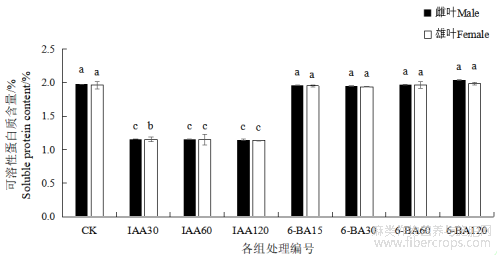
1.6 不同浓度IAA和6-BA对汉麻叶片可溶性蛋白含量的影响
不同激素处理植株叶片可溶性蛋白质含量有所差异。与对照相比,激素IAA处理组中,可溶性蛋白含量均显著降低(P<0.05),不同浓度IAA处理组间差异不显著。激素6-BA处理组中的可溶性蛋白含量与对照相比,无显著差异。雌雄麻间比较,除IAA30组雄麻可溶性蛋白含量显著高于雌麻(P<0.05),其余处理组中,雌雄麻组间无显著差异。
图5 不同浓度 IAA 和 6-BA 对汉麻叶片可溶性蛋白含量的影响
注:不同小写字母表示不同处理间在 P<0.05 水平差异显著
2 讨论
植物体的内源激素会影响黄瓜(Cucumis sativus L.)雌蕊的发育过程和性别分化,生长素(IAA)和乙烯可以起到促雌作用,而赤霉素(GA3)则可以促雄,其中生长素是通过诱导乙烯生成而起到促雌效果(Peterson,1960)。苦瓜(Momordica charantia L.)雌雄花性别分化的过程中,两个月苗龄的苦瓜雌花数目和雌雄比例的提高与茎尖IAA含量的减少有关(汪俏梅等,1997)。而细胞分裂素可通过提高叶片的光合速率达到促雌的效果(魏晓琼等,2022)。王纬等(1983)人认为,生长素及类生长素物质萘乙酸(NAA),3-氧甲基羟吲哚等物质的作用大多都可以促进植物的雌化,并且分析这可能与生长素诱导乙烯合成有关;且细胞分裂素对植物促雌化的效果也很显著。植物的促雌化物质有很多,吴姗(2020)则探究了乙烯利不同周期处理,对汉麻大麻素的含量变化的影响,而不同性别汉麻的大麻素含量不同,这有待进一步研究其对性别分化的影响。
植物通过性别分化形成了性别上的差异(陈学好,2001)。邵宏波等(1993)人对前人研究总结发现,生长素能够调控植物的雌性表达。生长素可影响植物的性别分化,并且这种作用是通过诱导植物器官发育相关调控基因的表达而实现的。研究表明,大麻雌性花序中的生长素含量高于雄性花序中的生长素含量,说明高水平的生长素与大麻雌化相关(景文昭,2020)。本研究发现,植物激素IAA和6-BA对汉麻具有显著的雌化效果。酶活性的高低与植物性别表现有一定的相关性,激素的作用可能是通过某种酶或酶的系统而控制植物性别的表现(强晓霞,2012)。何长征等(2001)对黄瓜的前人研究表明,POD活性和CAT活性与雌性分化相关。本研究中,随IAA浓度的提高,雌雄株叶片的POD活性和CAT活性均降低,而高浓度的IAA处理,雌株叶片的SOD活性显著升高,雄株叶片也随IAA浓度的增加呈现上升趋势。这表明低浓度IAA促进汉麻的雌化,这可能与植株内SOD活性升高呈正相关,而高浓度的IAA显著提高了植株内SOD活性,从而提高了雌雄比。强晓霞(2012)对大麻幼苗喷湿不同的外源植物激素,发现细胞分裂素6-BA可促进大麻雌性分化。研究中,6-BA 15mg/L处理组中雌麻叶片的POD活性显著降低,而雄株较对照则无明显变化。其余处理组的POD活性和SOD活性均无明显变化,这说明激素6-BA对性别分化的影响与POD活性和SOD活性无明显关联性。低浓度的6-BA30mg/L处理组与对照相比,显著增高了植株叶片的CAT活性,但抑制了植株的雌化;高浓度6-BA处理组,植株的CAT活性则无显著变化,这表明过高的CAT活性会起促雄作用,可推测,激素6-BA雌化作用与植株内CAT活性的稳定或降低有关。这与强晓霞(2012)对大麻雌化的研究结果一致。
植物性别分化这一过程需要大量的营养物质来供应,营养物质的积累是性别分化的物质基础(强晓霞,2012)。本研究对处理组雌雄麻叶片可溶性糖和可溶性蛋白的测定结果显示,激素IAA处理组显著降低了可溶性糖和可溶性蛋白质的含量。这表明IAA对性别分化的影响与可溶性糖和可溶性蛋白质含量的降低有关。而糖对维持植物激素IAA的稳定有重要作用,雌花的发育过程则需大量消耗可溶性糖,这很可能是激素IAA处理组可溶性糖含量显著降低的原因(Sairanenetal.,2012)。激素IAA可促进植株茎的发育,IAA处理组可溶性蛋白显著降低可能与蛋白质等营养物质供给茎的发育有关。而雌麻中可溶性糖和可溶性蛋白含量均略高于雄株,这可能是由于成熟期雌麻植株比雄麻高大茂盛,所以雌麻营养物质积累量较高。
综上所述,生长素(IAA)和细胞分裂素(6-BA)对提高汉麻雌雄比例,具有明显促进作用。其中,6-BA 60mg/L处理组促雌效果最为显著,并且与对照组比较,可相对提高汉麻的CAT活性,稳定其SOD活性,且对可溶性糖和可溶性蛋白质含量无明显影响,有利于汉麻的工业制品制备。
3 材料与方法
3.1 实验材料
本研究所用汉麻品种为龙麻5号,由齐齐哈尔大学寒区麻及制品教育部工程研究中心提供。以汉麻苗期叶片为实验材料。
3.2实验方法
根据预实验结果,分别配置不同浓度的IAA和6-BA溶液,各组处理见表2。
表2 不同激素处理浓度

挑选胚完整、饱满的龙麻5号种子,播种前蒸馏水浸种20h,用土质疏松肥沃的砂壤土和蛭石3:1比例混合于50孔深穴育苗盘中育苗,置于汉麻基地育苗棚,25℃自然光下进行萌发。待苗株发育到四叶期,用不同浓度的激素溶液于当日17时喷施叶片;共喷施4次,间隔时间为3d,对照组于相同时间喷施相同次数的蒸馏水,喷施叶面时,当叶面湿润并有液体下滴时停止喷施。每组激素共处理120株汉麻,共3次重复,每个重复40株(薛红芬等,2021)。待植株分化雌雄体征后,统计各组雌雄麻数量并记录。待汉麻植株分化出雌雄体征后,采摘雌雄麻的鲜叶进行POD、CAT及SOD的酶活性测定实验,再将多余样本用液氮速冻并保存于-80℃冰箱备用,用于可溶性糖及可溶性蛋白含量的测定。
采用分光光度法测定POD活性,采用紫外吸收法测定CAT活性,采用氮蓝四唑还原法测定SOD活性。
采用蒽酮比色法测定可溶性糖的含量。
采用考马斯亮蓝G-250染色法测定可溶性蛋白质的含量。
3.3 数据分析
利用Microsoft Office Excel 2010对数据进行制表和作图,SPSS 16.0软件对数据进行方差分析。
参考文献
Chang L., Li J.J., Huang S.Q., Tang H.J., Chen A.G., Zhang C.P., Zhao L.N., and Li D.F., 2018, Research survey on active components and medicinal uses of plant cannabis, Shengming de Huaxue (Chemistry of Life), 38(2): 273-280. (常丽, 李建军, 黄思齐, 唐慧娟, 陈安国, 张翠萍, 赵立宁, 李德芳, 2018, 植物大麻活性成分及其药用研究概况, 生命的化学, 38(2): 273-280.)
Chen X., Guo R., Wan R.X., Xu Y.P., Zhang Q.Y., Guo M.B., Guo H.Y., and Yang M., 2015, Genetic structure evaluation of five dioecious industrial cannabis populations in Yunnan Province, Fenzi Zhwu Yuzhong (Molecular Plant Breeding), 13(9): 2069-2075. (陈璇, 郭蓉, 万睿璇, 许艳萍, 张庆滢, 郭孟璧, 郭鸿彦, 杨明, 2015, 云南省 5 个雌雄异株工业大麻群体遗传 结构评价, 分子植物育种, 13(9): 2069-2075.)
Chen X.H., 2001, Physiological study on sex differentiation of flower in cucumber, Dissertation for Ph.D., Zhejiang University, Supervisors: Zeng G.W., Zhu Z.J. and Cao B.S., pp.11-15. (陈学好, 2001, 黄瓜花性别分化的生理学研究, 博士学位论文, 浙 江大学, 导师: 曾广文, 朱祝军, 曹碚生, pp.11-15.)
Cui D.D., Yang R.F., She W., Li L.L., Su X.H., Wang J.L., and Cui G.X., 2018, Research progress on gender identification of industrial hemp, Zhongguo Maye Kexue (Chinese Hemp Industry Science), 40(5): 244-248. (崔丹丹, 杨瑞芳, 佘玮, 李林林, 苏小惠, 王继龙, 崔国贤, 2018, 工业大麻性别鉴定研究进展, 中国麻业科学, 40(5): 244-248.)
Fu J.Q., Qin B.T., Cai J.Y., and Zhang L.J., 2022, Research progress in plant sex differentiation, Fenzi Zhwu Yuzhong (Molecular Plant Breeding), 20(14): 4833-4839. (傅靖棋, 秦柏婷, 蔡佳友, 张丽杰, 2022, 植物性别分化研究进展, 分子植物育种, 20(14): 4833-4839.)
He C.Z., Ai X., and Kuang F.C., 2001, Differences in protective enzyme activities of cucumber plants of different sexual types, (Journal of Hunan Agricultural University (Natural Science Edition)), (4): 289-291. (何长征, 艾辛, 匡逢春, 2001, 不同性型 黄瓜植株保护酶类活性的差异, 湖南农业大学学报(自然科学版), (4): 289-291.)
Hu X.L., Guo H.Y., Liu X.Y., Hu Z.H., Xu Y.P., Guo M.B., Yang J., Guo L.F., Tang Z.M., Yu L.Q., and Yang M., 2012, Study on the adaptability of Yunnan industrial hemp varieties in Daxinganling area, Heilongjiang, Xinan Nongye Xuebao (Southwest China Journal of Agricultural Sciences), 25(3): 838-841. (胡学礼, 郭鸿彦, 刘旭云, 胡尊红, 许艳萍, 郭孟璧, 杨谨, 郭丽芬, 唐 志敏, 于莉秋, 杨明, 2012, 云南工业大麻品种在黑龙江大兴安岭地区的适应性研究, 西南农业学报, 25(3): 838-841.)
Jing W.Z., 2020, Study on the mechanism of auxin and sugar regulating the development of pistils in Xanthoceras sorbifolia Bunge, Thesis for M.S., Beijing Forestry University, Supervisors: Gao S.M., and Xue D.M., pp.45. (景文昭, 2020, 生长素和蔗糖调控 文冠果不同位置雌蕊发育的机理研究, 硕士学位论文, 北京林业大学, 导师: 高述民, 薛敦孟, pp.45.)
Legare C.A., Raup-Konsavage W.M., and Vrana K.E., 2022, Therapeutic potential of cannabis, cannabidiol, and cannabinoid-based pharmaceuticals, Pharmacology, 107(3-4): 131-149.
O'Brien K., 2022, Cannabidiol (CBD) in Cancer Management, Cancers (Basel), 14(4): 885.
Pasila A., 2004, A biological oil adsorption filter, Marine Pollution Bulletin, 49(11-12): 1006-1012.
Peterson C.E., and Anhder LD, 1960, Induction of staminate flowers on gynoecious cucumbers with gibberellin A3, Science, 131(3414): 1673-1674.
Qiang X.X., 2012, Physiological study on sex differentiation of hemp, Thesis for M.S., Nanjing Agricultural University, Supervisor: Xia B., pp.53-54. (强晓霞, 2012, 大麻性别分化的生理学研究, 硕士学位论文, 南京农业大学, 导师: 夏冰, pp.53-54.)
Sairanen I., Novak O., Pencik A., Ikeda Y., Jones B., Sandberg G., and Ljung K., 2012, Soluble carbohydrates regulate auxin biosynthesis via PIF proteins in Arabidopsis, Plant Cell, 24(12): 4907-4916.
Shao H.B., Chu L.Y., and Jiang E.L., 1993, New progress in sex research of higher plants, Shijie Kexue (World Science), (5): 26-28. (邵宏波, 初立业, 姜恩来, 1993, 高等植物性别研究的新进展, 世界科学, (5): 26-28.)
Sivesind T.E., Maghfour J., Rietcheck H., Kamel K., Malik A.S., and Dellavalle R.P., 2022, Cannabinoids for the Treatment of Dermatologic Conditions, JID Innov, 2(2): 100095.
?miarowska M., Bia?ecka M., and Machoy-Mokrzyńska A., 2022, Cannabis and cannabinoids: pharmacology and therapeutic potential, Neurol. Neurochir. Pol., 56(1): 4-13.
Tang H.J., Zang G.G., Cheng C.H., Tang Q., Li Y.J., and Zhao L.N., 2018, Correspondence analysis of yield and quality traits of industrial hemp, Zuowu Zazhi (Crop Journal), (2): 52-55.(唐慧娟, 臧巩固, 程超华, 唐蜻, 李育君, 赵立宁, 2018, 工业大麻 产量和品质性状的对应分析, 作物杂志, (2): 52-55.)
Wang Q.M., and Zeng G.W., 1997, Signals inducing sex differentiation in higher plants, Zhiwu Shenglixue Tongxun (Communications of Plant Physiology), (2): 147-151. (汪俏梅, 曾广文, 1997, 高等植物性别分化的诱导信号, 植物生理学 通讯, (2): 147-151.)
Wang W., and Cao Z.X., 1983, Sex differentiation of higher plants, Zhiwuxue Tongbao (Bulletin of Botany), (1): 10-14. (王纬, 曹宗 巽, 1983, 高等植物的性别分化, 植物学通报, (1): 10-14.)
Wei X.Q., Jia W.F., Ma J.H., Wang Y., Li J.Y., and Wu L., 2022, Overview of the effects of plant growth regulators on plant growth and development, Beifang Yuanyi (Northern Horticulture), (4): 118-125. (魏晓琼, 贾文飞, 马靖恒, 王颖, 李金英, 吴林, 2022, 植物生长调节剂对植株生长发育的影响概述, 北方园艺, (4): 118-125.)
Wu S., 2020, Effect of exogenous hormone on cannabinoid content in Cannabis sativa L. and transcriptome analysis, Thesis for M.S., Chinese Academy of Agricultural Sciences, Supervisor: Su J.G., pp.35. (吴姗, 2020, 外源激素对大麻中大麻素含量的影响及 转录组分析, 硕士学位论文, 中国农业科学院, 导师: 粟建光, pp.35.)
Xue H.F., Liu S.G., Kong L.Y., and Jiang Y.C., 2021, Research progress on main factors affecting the yield of industrial cannabis, Xiandai Nongye Keji (Modern Agricultural Science and Technology), (24): 34-39. (薛红芬, 刘胜贵, 孔令羽, 蒋永昌, 2021, 影响工业大麻产量的主要因素研究进展, 现代农业科技, (24): 34-39.)
Zhang S.Q., 2019, 100 Questions on Industrial Hemp, China Agricultural Science and Technology Press, China, Beijing, pp.2-3. (张 树权, 编著, 2019, 工业大麻 100 问, 中国农业科学技术出版社, 中国, 北京, pp.2-3.)
文献摘自:刘丽杰,孙玉婷,丁美云,王璐瑶,于梦迪,毕亚蕾,余源,罗培霞,王雪松.植物激素IAA和6-BA对汉麻生理代谢及性别分化的影响[J/OL].分子植物育种:1-8[2023-03-09].