摘 要:该试验旨在建立适合罗布麻保健茶总黄酮含量的检测方法。以芦丁为标准品,利用黄酮类分子在碱性溶液中显色的原理测定含量。结果显示:试验方法的线性方程为Y=0.0012X+0.0031,R2=0.9997,线性关系良好;相对标准偏差SRSD为2.05%(n=6),回收率为99.1%(n=6),最低检测线为4μg/mL。硝酸铝显色法更能代表罗布麻保健茶的品质。
关键词:罗布麻茶;总黄酮;硝酸铝显色法
罗布麻Apocynum venetum L.(红麻)是夹竹桃科罗布麻属多年生宿根草本植物,唐代《新修本草》、明代《救荒本草》称“漆泽”,近代《中国高等植物》称“茶叶花”。自20世纪50年代起,先后经过我国几十个科研院所、百余名科研人员的研究与临床实验表明,罗布麻(红麻)叶具有清血脂、降血压、解郁安神、清热消炎、利尿消肿、抗氧化等功效,尤其降血压功能比较显著。罗布麻叶中富含黄酮类、有机酸、醇类、氨基酸、微量元素等活性物质,大量试验表明黄酮类物质是罗布麻叶中的主要活性成分之一[1-4]。总黄酮包括黄酮与黄酮醇类等,是具有苯骈呋
喃环结构的一类天然化合物总称。目前,检测总黄酮的方法有多种,研究发现不同的检测方法测出罗布麻茶中的总黄酮含量不尽相同,有时还有较大差异[5-9]。试验采用硝酸铝显色对罗布麻茶中的总黄酮含量进行检测,以期为罗布麻茶的进一步开发和研究提供参考[10-11]。
1 材料与方法
1.1 材料
罗布麻茶样品来自于阿勒泰戈宝茶股份有限公司自生产的戈宝红麻®罗布麻茶。
1.2 方法
1.2.1 芦丁标准曲线的制备
精确吸取0,0.5,1.0,2.0,3.0和4.0mL芦丁标准溶液于10mL比色管中,加入30%乙醇液至5mL,各加0.3mL5%NaNO2溶液,振摇后放置5min,加入0.3mL10%Al(NO3)3溶液,摇匀后放置6min,加2mL1.0moL/LNaOH溶液,用30%乙醇定容至刻度,摇匀,同时做空白,在510nm处测定吸光度。
1.2.2 样品处理[12-14]
取约1g罗布麻茶试样粉末,准确称定,倒入锥形瓶中,准确加入25mL70%乙醇,称其质量,回流1h,冷却后,再次称其质量,用70%乙醇补足减失的质量,摇匀后过滤,取1mL滤液于蒸发皿中,加1g聚酰胺粉,水浴上待乙醇挥发后转入层析柱。依次用20mL石油醚、甲醇进行洗脱,将洗脱液浓缩,残渣加甲醇溶解,转移至10mL量瓶中,定容。
1.2.3 样品测定
准确吸取2mL供试品溶液于10mL比色管中,加30%乙醇至5mL,照1.2.1,自“0.3mL加5%NaNO2溶液”起,依法测定吸光度,并根据回归方程计算样品中总黄酮的含量。
1.2.4 显色剂质量分数选择[15-17]
1.2.4.1 NaNO2质量分数
吸取2mL150μg/mL芦丁标准品溶液,分别加入0.5mL1%,3%,5%,7%和9%NaNO2溶液,其余同1.2.3。
1.2.4.2 Al(NO3)3质量分数
吸取2mL150μg/mL芦丁标准品溶液,分别加入0.5mL2.5%,5%,7.5%,10%,12.5%和15%Al(NO3)3溶液,其余同1.2.3。
1.2.4.3 NaOH质量分数
吸取2mL150μg/mL芦丁标准品溶液,分别加入4mL1.5%,2.5%,4%,5.5%和7%NaOH溶液,其余同1.2.3。
2 结果与分析
2.1 显色剂质量分数的选择
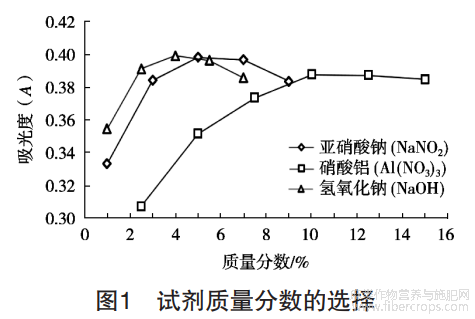
结果表明,NaNO2质量分数在1%~5%范围内吸光度逐渐增加,当质量分数>5%时,吸光度有所下降,所以将NaNO2的质量分数设为5%;Al(NO3)3质量分数在2.5%~10%范围内吸光度呈现不断上升趋势,随后随质量分数的增加,吸光度开始下降,固将质量分数设为10%;NaOH质量分数在1%~4%范围内吸光度逐渐增加,当质量分数>4%时,吸光度有所下降,故将质量分数设为4%。结果见图1。
2.2 提取溶剂质量分数比较
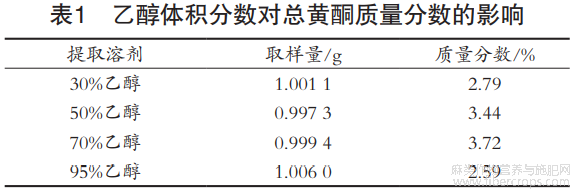
取1g供试品,分别加30%,50%,70%和95%乙醇回流提取1h。紫外分光光度法中并未明确提取乙醇体积分数,通过表1可知,70%乙醇的提取效果最佳。
2.3 提取时间比较
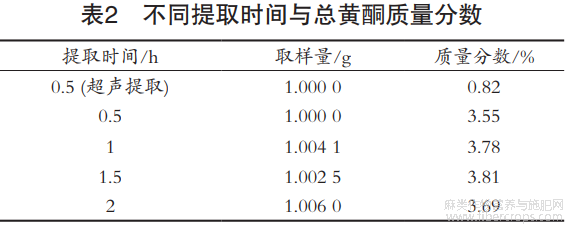
取1g供试品,分别加70%乙醇回流提取0.5,1,1.5和2h。测定结果见表2。1h提取已较完全,在相同的时间内,回流提取比超声提取率高。紫外分光光度法中采用超声提取,从表2可看出,回流提取较超声提取来说提取得更加充分。
2.4 方法学验证
2.4.1 线形关系考察
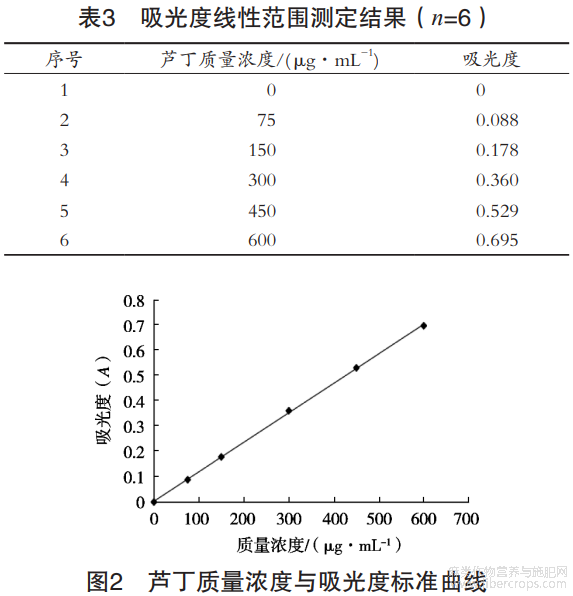
按1.2.1要求,测定结果见表3,绘制芦丁质量浓度(μg/mL)与吸光度的标准曲线如图2。结果显示,芦丁的标准曲线方程为Y=0.0012X+0.0031,R2=0.9997。
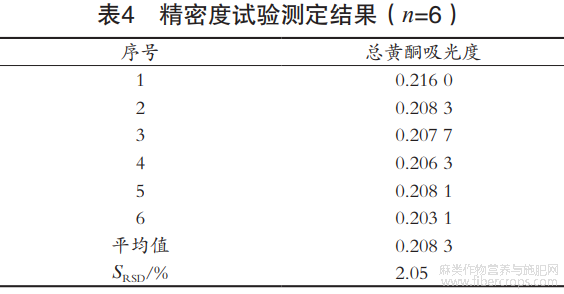
2.4.2 精密度试验
取6份同一样品,按前述方法测定总黄酮含量,计算相对标准偏差。由表4可知,总黄酮吸光度的SRSD为2.05%,显示精密度良好。
2.4.3 稳定性试验
取同一样品,按前述方法测定总黄酮含量,每隔30min进行测定,结果见表5。结果显示,显色反应后应在30min内进行测定。
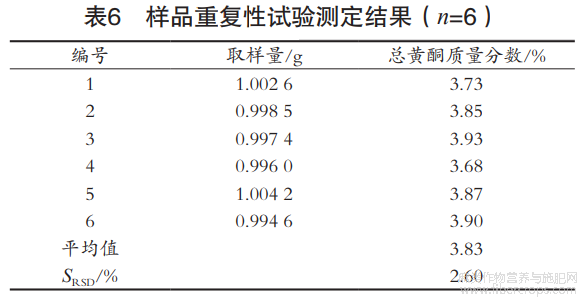
2.4.4 重复性试验
取同一样品,按前述方法分别制备6份供试品溶液,测定总黄酮质量分数。由表6可知,总黄酮平均质量分数为3.83mg/g,SRSD为2.60%,表明该测定方法的重复性良好。
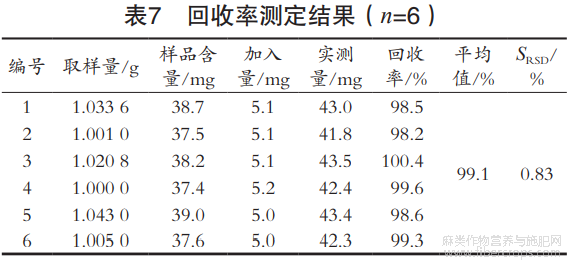
2.4.5 回收率试验
称取6份样品,每份1g左右,分别加入5.0mg芦丁标准品,按前述方法测定总黄酮质量分数,计算回收率,结果见表7,芦丁的平均回收率为99.1%。
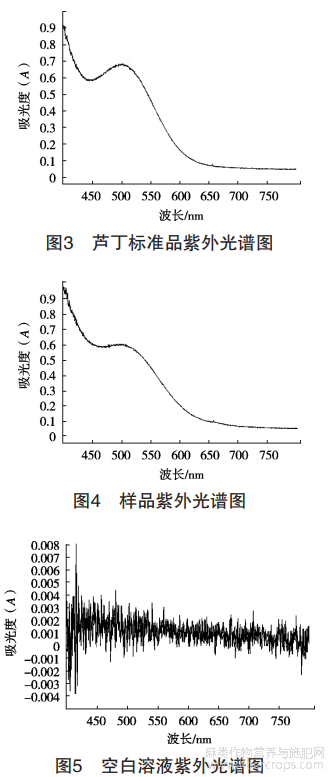
2.4.6 专属性试验
精确吸取4mL标准品溶液、样品溶液及空白样品,按照1.2.3方法要求精确添加显色剂后,分别在400~800nm波长下进行扫描,如图3、图4、图5所示,在510nm处标准品、样品溶液有相同的吸收峰,空白样品在510nm下无吸收峰,表明测定方法对罗布麻茶种的总黄酮测定具有良好的专属性。
2.4.7 耐用性试验
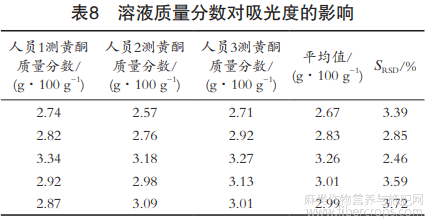
考察被测溶液的质量分数对测定结果的影响。由不同实验人员进行操作,每人均取0.6,0.8,1.0,1.2和1.4g罗布麻粉末样品,按照1.2.3方法进行操作,测得样品溶液在510nm下的吸光度。从表8可以看出,随着样品质量分数的增加,黄酮质量分数总体呈上升趋势。3组实验人员检测出的黄酮质量分数的SRSD结果表明,试验条件具有良好的适应性。
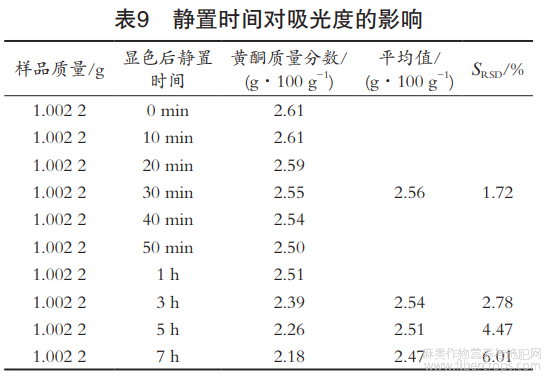
考察被测溶液的稳定性对测定结果的影响。放置0min,10min,20min,30min,40min,50min,1h,3h,5h和7h后,按1.2.3方法测吸光度。由表9可知,待测溶液加入显色剂后随着时间的延长,吸光度整体呈下降趋势,所以显色后应在1h内上机完成检测,该方法选30min内上机检测。
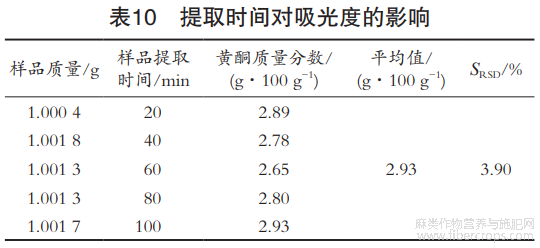
考察样品提取时间对测定结果的影响。准确称取1g罗布麻茶试样粉末,置具塞锥形瓶中,加入25mL70%乙醇,静置后称其质量,分别回流20,40,60,80和100min,冷却后,再称其,剩下步骤同1.2.3“用70%乙醇补足质量”后的方法,分别添加显色剂后在510nm下测定吸光度,结果见表10。
2.5 样品的测定
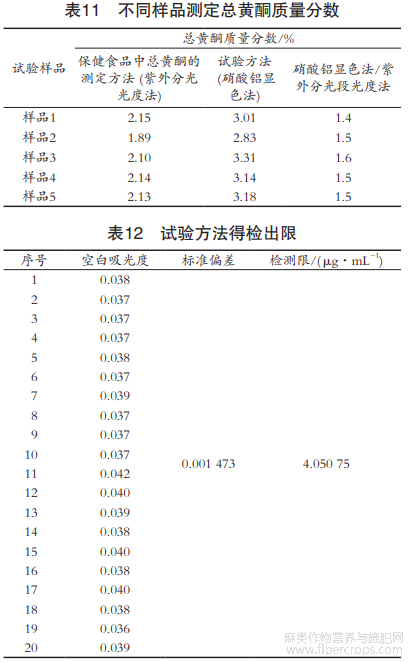
分别称取不同批次的罗布麻茶粉末,各1g,按1.2.3小节的方法和《保健食品检验与评价技术规范(2003版)》保健食品中总黄酮的测定方法分别进行测定,计算其总黄酮质量分数,结果见表11[18]。
结果显示,2个方法测定的总黄酮质量分数具有较大差异,基本在1.5倍左右。紫外分光光度法检测的是黄酮类物质特有的B环的肉桂酰基结构,这个结构是黄酮物质的主要活性部位,吸收峰在300~400nm之间,硝酸铝显色法检测的是所有具有邻二位酚羟基结构的黄酮类化合物,吸收峰在510nm左右。紫外分光光度法直接对样品进行测定,具有一定的局限性,比较适合成分单一样品的检测,不能很好地代表罗布麻茶的品质。因为罗布麻茶中具有降血压、降血脂等保健功效成分物质除黄酮类物质外,还含有大量其他物质,如羟基苯甲酸类、绿原酸等酚类,这些物质用紫外分光光度法是检测不出来的[19]。
2.6 最低检测限
按照1.2.3方法测定20次空白溶液的吸光度并计算检测限,根据“检测限(LOD)=3.3δ/S”计算。式中,δ表示被测液中黄酮质量分数的标准偏差;S表示标准曲线的斜率。由表12可知,最低检测线为4μg/mL。
3 结论及讨论
3.1 讨论
野生罗布麻(红麻)于20世纪60年代在我国北纬33°~48°的盐碱地域大量分布,由于人为破坏、环境恶化等原因,导致罗布麻(红麻)至今在全国29个历史分布区的边缘地带仅有零星残存,只有全球距海岸最远的新疆阿勒泰盐湖东戈壁尚存82041m²,是我国当今该植物最大的野生群落,罗布麻(红麻)已濒临灭绝。因此,2006年,“拯救罗布麻健康千万家”工程被发起,以原生种大规模(1453hm²)仿生种植。现已成为罗布麻(红麻)年产干叶高达1000t的产能基地,占我国罗布麻(红麻)资源的90%[20]。因此确定合适检测方法,对罗布麻(红麻)产业的发展具有重大的意义。
3.2 结论
试验方法的线性方程为Y=0.0012X+0.0031,R2=0.9997,线性关系良好;精密度试验SRSD为2.05%(n=6);稳定性试表明溶液配制好后应在30min内上机比色;重复性试验显示SRSD为2.60%(n=6);回收率试验显示回收率为99.1%(n=6);专属性试验表明该测定方法对罗布麻茶种的总黄酮测定具有良好的专属性;从被测溶液的质量分数、不同检测人员及环境、被测溶液的稳定性、样品的提取时间方面讨论了检测方法的耐用性,结果表明所设定的测定条件能够满足测定的需要,测定方法系统适用性良好,方法的检出限为4μg/mL。由此说明,用该方法测定罗布麻茶中的黄酮是可行的。
罗布麻茶用硝酸铝显色法进行总黄酮检测,该方法简便、准确、专属性好,能够更好地代表罗布麻茶的保健功效。
参考文献:
[1] 郭洁, 贾伯阳, 张蓉, 等. 国产保健食品原料与功效/标志性成分分析[J]. 食品研究与开发, 2018, 10(24): 218-224.
[2] 庞秀清, 马莹, 方灿, 等. 辅助降血脂类保健食品质量现状分析[J]. 食品安全导刊, 2017, 15(3): 146-148.
[3] FAN H J, LIANG Y, JIANG B, et al. Curcumin inhibits intracellular fatty acid synthase and induces apoptosis in human breast cancer MDA-MB-231 cells[J]. Oncology Reports, 2016, 18(35): 2651-2656.
[4] NIE F Y, LIANG Y, JIANG B, et al. Apoptotic effect of tannic acid on fatty acid synthase over-expressed human breast cancer cells[J]. Temor Biology, 2015, 27(10): 1007-1015.
[5] 张娟, 卿德刚, 孙宇, 等. 化学计量学辅助分析罗布麻中的黄酮类成分[J]. 西北药学杂志, 2020, 35(2): 173-177. [6] 徐硕, 徐文峰, 邝咏梅, 等. 一测多评法测定罗布麻叶中6个黄酮类成分的含量[J]. 药物分析杂志, 2019, 18(7): 1217-1228.
[7] 于村, 俞莎, 沈向红. 保健食品中总黄酮测定方法的研究[J]. 中国卫生检验杂志, 2002, 8(12): 401-402.
[8] 于村, 俞莎, 沈向红. 中草药总黄酮的提取和含量测定[J]. 浙江预防医学, 2002, 14(7): 61-62.
[9] 刘维, 蒲朝文, 封雷, 等. 保健食品中总黄酮含量的分光光度测定法[J]. 职业与健康, 2005, 21(6): 839-840.
[10] 范华锋, 赵士权, 查河霞. 紫外分光光度法测定保健食品中总黄酮的方法改进[J]. 中国卫生检验杂志, 2011, 21(4): 828-828.
[11] 张欣烨, 张利锋, 张洁, 等. 紫外分光光度法在保健食品检测中的应用[J]. 中国卫生工程学, 2015, 14(8): 347-349.
[12] 李艳提, 赵金凤, 张卫民, 等. 罗布麻茶总黄酮含量测定方法研究[J]. 食品科技, 2010, 35(6): 274-277.
[13] 刘东平, 周亚球, 王先荣. 罗布麻叶总黄酮的测定方法探讨[J]. 时珍国医国药, 2007, 18(6): 614-616.
[14] 范维刚, 解成喜, 李锋, 等. 罗布麻茶总黄酮含量测定方法研究[J]. 食品科技, 2010, 35(6): 274-277.
[15] 李慕春, 王苗苗, 韩非, 等. 罗布麻和白麻中主要化学成分的统计分析[J]. 中国实验方剂学杂志, 2018, 24(2): 62-68.
[16] 贺灵芝, 李俊华, 梁忠厚. 黑老虎果皮中总黄酮提取工艺研究[J]. 衡阳师范学院学报, 2020, 3(1): 82-86.
[17] 廖圆圆, 王燕新, 郭晓农, 等. 枇杷叶总黄酮提取及体外抗氧化的研究[J]. 西北民族大学学报, 2020, 21(1): 60-64.
[18] 王光亚. 保健食品功效成分检测方法[M]. 北京: 中国轻工业出版社, 2002: 29-31.
[19] 李维嘉, 黄璇莹, 蔡大川, 等. 紫外分光光度法测定保健食品中总黄酮 (以芦丁计) 的不确定度评估[J]. 食品安全导刊, 2015, 15(36): 161-165.
[20] 刘起棠, 肖正春, 张卫明. 中国罗布麻2个新变种-戈宝红麻、戈宝白麻[J]. 中国野生植物资源, 2015, 34(1): 40-42.
文章摘自:何伟,王莉,黄景凤,刘磊,杨如钢,黄升.罗布麻茶中总黄酮测定方法[J].食品工业,2021,42(08):180-184.