摘 要:麻仁中含有20%~25%的蛋白,营养丰富,富含人体所需的各种必需氨基酸,相比于大豆蛋白,麻仁蛋白不含有过敏源、更易消化且具有更好的营养结构,是一种优质的植物蛋白资源。麻仁蛋白及其水解产物具有抗氧化、降血压、降胆固醇等生物活性,可以作为生物功能蛋白和活性肽等生物活性物质的重要来源。对麻仁蛋白的提取、理化性质以及活性肽的功能研究进行综述,为麻仁蛋白及其水解产物活性肽相关的功能性食品和医药相关生物制品的研发提供参考。
关键词:汉麻;麻仁蛋白;活性肽
大麻(Cannabis sativa L.)原产于亚洲,是桑科大麻属一年生草本植物,具有悠久的历史,自史前时代起就是纤维、食物和精神药物的重要来源[1]。最初人们主要利用大麻秆中的纤维制作麻绳、渔网、衣物等纤维制品,之后人们逐渐发现了大麻有使人致幻的作用,大麻花叶中的四氢大麻酚(tetrahydrocannabinol,THC)是使人致幻和上瘾的主要成分,因此很长一段时间以来,大麻都被作为精神类药物和毒品进行严格的管控。
大麻一共可以分为3个亚种,分别为:C.sativa subsp.sativa,C.sativa subsp.indica及C.sativa subsp.ruderalis。C.sativa subsp.sativa品种的大麻植株通常较高,通常生长在室外,分枝松散,叶片长而窄,花叶中THC的含量低于0.3%,因此基本上不会产生致幻和麻醉的效果。由于THC含量较低,因此人们主要利用C.sativa subsp.sativa品种的纤维和种子,所以该品种大麻的价格也相对更加便宜,我们通常说的工业大麻就属于这一品种。毒品大麻则属于C.sativa subsp.indica品种,其植株矮小、枝密、叶宽,更适合在室内生长,该品种的THC含量较高(通常>10%),人们主要利用的是花叶中提取的THC来制作毒品,因此价格也相对较高。相比于其他2种大麻,C.sativa subsp.ruderalis则鲜为人知,它大多生长在气候恶劣的地区,植株十分矮小,但是其THC含量很低,人们大多用它来进行杂交育种。由此可见,工业大麻由于THC含量较低,根本达不到刺激神经的作用,是较为安全的作物,且有的工业大麻品种中含有高含量的大麻二酚(cannabidiol,CBD),CBD也是从大麻的花叶中提取的一类物质,虽然它与THC的结构相同,代谢途径相似,但是CBD是非神经活性物质,不会产生致幻和麻醉作用,反而具有抗惊厥、抗肿瘤和抗抑郁等其他作用,因此工业大麻也被种植用来提取CBD[2]。
近年来,人们逐步认识到汉麻种子(指工业大麻的种子)也是一种含有丰富蛋白质和油脂的优质资源,自2015年起,籽用大麻种植面积及产量呈现逐年递增的趋势,而中国是籽用大麻种植面积较大的国家之一。麻仁中含有丰富的蛋白质,根据品种和环境因素的不同,其含量在20%~25%变化,麻仁蛋白的蛋白质含量高于其他富含蛋白质的产品如藜麦(13.0%)和亚麻籽(0.9%)。蛋白质的营养品质主要是由其氨基酸组成和消化率决定的,麻仁蛋白富含联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)、世界卫生组织(World Health Organization,WHO)所要求的2~5岁儿童所需的所有必需氨基酸,其氨基酸的含量与目前的主要植物蛋白——大豆蛋白相似,麻仁蛋白的含硫氨基酸含量显著高于大豆蛋白,而含硫氨基酸的含量被证明与植物的营养性相关,而且麻仁蛋白的必需氨基酸与总氨基酸的比值显著高于大豆蛋白,因此相比于大豆蛋白,麻仁蛋白具有更好的营养价值[3-5]。研究表明,麻仁蛋白相比于其他种子蛋白具有更高的消化率[6],除此之外,麻仁蛋白不含有大豆蛋白内含有的胰蛋白酶抑制剂,因此相比于大豆蛋白更易于被人体消化吸收;麻仁蛋白及其水解产物在用不同的蛋白酶处理后,体内和体外均被证明具有抗氧化性,降胆固醇,抗疲劳等生物活性。目前在麻仁蛋白中没有检测到大麻相关的过敏原,因此麻仁蛋白作为低敏蛋白,具有作为食用植物蛋白的巨大潜力。
食物来源的活性肽可以影响一系列生理功能,包括肠道运输、营养吸收调节、排泄以及免疫调节作用。因此,活性肽作为有益于健康和营养方面的营养食品正变得越来越重要,许多食物中天然存在的活性肽可以作为疾病管理的辅助剂,或者作为一些遗传性疾病的预防措施[7-8]。来源于鱼、肉、蛋、奶的活性肽已经被广泛的研究,但是来源于水果、蔬菜、谷物等的活性肽的相关研究并不多。虽然营养学家普遍认为植物蛋白的营养价值略低于动物蛋白,但相比动物蛋白,可食用植物及其种子是更为廉价且环境可持续的可以产生活性肽的蛋白来源[9-10]。植物是一种研究生物活性组分的理想系统,植物在受到生物和非生物胁迫时会产生次生代谢产物例如酚类、萜类和活性肽。食物源的次生代谢产物被认为具有延缓疾病进展、抑制病理生理机制或抑制致病分子活性的特性[11]。蛋白和多肽在这些活性中起着至关重要的作用[12]。我国作为世界人口大国,人口众多,人均耕地面积少,将大量的粮食用于饲喂动物,转化成动物蛋白得不偿失,且动物蛋白食用过多会导致肥胖、高血压、高血脂、心脑血管病、糖尿病等疾病,这一趋势在我国发达地区也有明显表现,近年国内外开始重视低脂肪、无胆固醇的植物蛋白资源的开发,因此积极开发植物蛋白质资源势在必行。汉麻蛋白经过蛋白酶水解以后会产生许多不同生物活性的活性肽,因此是一种良好的植物活性肽来源。该研究对汉麻仁蛋白的提取条件、理化性质以及水解产物活性肽的功能研究及应用现状进行综述,为优质植物蛋白资源的开发以及麻仁蛋白及其水解产物活性肽相关的功能性食品、医药相关生物制品的研发提供参考。
1 麻仁蛋白研究进展
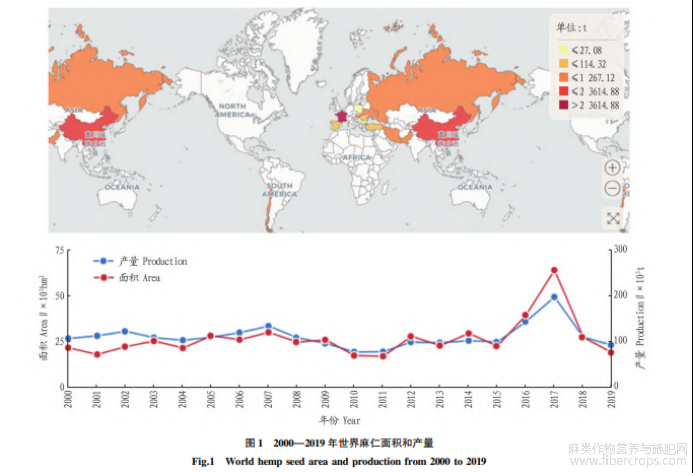
由于工业大麻具有低THC、高CBD的特征,因此,工业大麻在奥地利、澳大利亚、加拿大、智利、中国、美国等国家都可以合法种植(图1)。除此之外,人们也逐渐意识到工业大麻种子是一种丰富的蛋白质资源,因此籽用工业大麻的种植面积逐年增加,中国则是籽用大麻种植面积和产量较大的国家之一(表1,数据来自FAO开放数据库:www.fao.org)。
1.1 麻仁蛋白的组成及营养价值
高等植物种子内的贮藏蛋白(seed storage protein,SSP)按照溶解度可以分为4类:溶于水的白蛋白、溶于稀盐的球蛋白、溶于稀酸或稀碱的谷蛋白以及溶于70%~80%乙醇溶液的醇溶蛋白。研究表明,麻仁的2种主要蛋白质是球蛋白(67%~75%)和白蛋白(25%~37%),其中球蛋白又可以细分为11S球蛋白和7S豌豆球蛋白类蛋白[13]。
11S球蛋白是麻仁蛋白中最丰富的成分,约占麻仁总蛋白的60%~80%,又被称为麻仁球蛋白(edestin),Pavlovic等[14]的研究表明,edestin约占麻仁蛋白质总量的65%,这一结果与Mamone等[15]的HPLC和Ms/Ms分析结果一致,但略少于Wang等[6]的测定含量,说明不同品种的麻仁的蛋白质含量不同。尽管不同研究中麻仁球蛋白的含量有所差异,但它始终是麻仁蛋白中含量最高的蛋白。早在20世纪初,Svedberg等[16]就利用超速离心技术首次报道了麻仁球蛋白的分子质量为(211±10)kD,由大约500个氨基酸构成,具有11S球蛋白的典型结构。麻仁球蛋白是由6个相同亚基构成的六聚体结构,每个亚基由1个酸性亚单位(AS)和1个碱性亚单位(BS)通过二硫键相连接构成,AS分子量约为34.0kD,BS含有分子量约为20.0和18.0kD的2个亚基[17]。Ponzoni等[3]对Cannabis sativa L.cv.Futura自交六代后的植株进行研究发现,麻仁球蛋白根据氨基酸的组成可以分为Csede1、Csede2、Csede3 3种,这3种麻仁球蛋白均具有N端23个氨基酸残基的内质网结合信号肽序列以及4个保守的半胱氨酸残基,但相比于其他2类的麻仁球蛋白,Csede3型的麻仁球蛋白含有更丰富的半胱氨酸和甲硫氨酸残基,而含硫氨基酸的含量与作物的营养价值密切相关,因此认为Csede3型的麻仁球蛋白具有更高的营养价值。
7S豌豆球蛋白类蛋白占麻仁总蛋白含量最少,它由493个氨基酸构成,分子量约为48kD,在N端具有21个氨基酸残基组成的信号肽,目前在麻仁中只鉴定到一种编码7S豌豆球蛋白类蛋白的基因,和11S球蛋白及白蛋白不同,7S豌豆球蛋白类蛋白不含有二硫键,它具有典型的7S豌豆蛋白的结构域:4个N(X)TN-糖基化位点(X代表除脯氨酸以外的任何氨基酸)和2个保守的Cupin结构域[3,18-19]。
白蛋白占麻仁总蛋白的13%,由142个氨基酸残基构成,其N端具有1个23氨基酸残基的内质网结合信号序列以及将成熟白蛋白分为大小2个亚基的裂解位点[20]。麻仁中含有2种编码2S白蛋白的基因,二者具有98%的相似性,编码完全相同的氨基酸序列。麻仁白蛋白具有8个保守的半胱氨酸残基,在大亚基内形成2个链内二硫键,在成熟蛋白质中形成2个链间二硫键连接亚基。与成熟白蛋白相比,麻仁白蛋白存在1个由10个残基组成的连接肽(RFEEEDEIEN)和3个分别位于N端(YSR)和C端(RYY)的氨基酸[21]。
蛋白质的营养价值主要是由其氨基酸组成和消化率决定的。不同学者对麻仁蛋白的氨基酸组成进行分析,结果都一致表明麻仁蛋白包含全部9种人类所需的必需氨基酸,其中谷氨酸含量最高(占整个汉麻种子的3.74%~4.58%),其次是精氨酸(占全种子的2.28%~3.10%)[13,22],谷氨酸可以作为大脑中的一种神经递质,精氨酸虽然不是必需氨基酸,但它是合成一氧化氮(NO)的前体,因此它对心血管有益,也与免疫功能和肌肉修复相关[23]。除此之外,与酪蛋白和大豆蛋白相比,麻仁蛋白含有大量的含硫氨基酸,而含硫氨基酸被认为与蛋白营养价值相关,可以提高人体的抗氧化能力。麻仁蛋白中含有的必需氨基酸占总氨基酸的比例(E/T)为45.16%,显著高于大豆蛋白(41.72%),表明麻仁蛋白比大豆蛋白具有更优异的氨基酸营养结构[4]。麻仁蛋白不含有胰蛋白酶抑制剂,而胰蛋白酶抑制剂被认为是最重要的抗营养因子之一,在许多禾本科、十字花科和豆科植物中都存在,这使得麻仁蛋白在人体中更易被消化和吸收,因此麻仁蛋白具有更好的营养价值。研究人员对麻仁蛋白进行一系列研究也发现,麻仁蛋白的溶解度在酸性pH条件下低于大豆蛋白,这可能是由于edestin单个分子之间形成共价二硫键,导致不溶性蛋白聚集[24]。高温可以使蛋白质展开并暴露其疏水基团,有利于蛋白质与蛋白质的相互作用,而不是蛋白质与水的相互作用,从而形成不溶性蛋白质聚集体,无法被消化酶消化。麻仁蛋白具有很高的变性温度,因此更容易被消化酶消化,Wang等[6]的研究结果表明,麻仁蛋白的变性温度为92℃。这一结论与Raikos等[25]所观察到的热处理(80°C或以上)对麻仁蛋白质结构特征的影响一致,从而对它们的消化率产生影响。Tang等[26]对麻仁蛋白体外消化率的研究表明,未经处理的麻仁蛋白比大豆蛋白更易消化;对麻仁蛋白体内消化的试验表明,相比于其他植物蛋白,麻仁蛋白具有更高的体内消化率。总体上看,相比于其他植物蛋白,麻仁蛋白具有较高的消化率和良好的氨基酸组成,可以被认为是一种良好的可食用植物蛋白资源。
1.2 麻仁蛋白的提取方法
目前国内外提取汉麻贮藏蛋白的主要形式是麻仁分离蛋白(hempseed protein isolation,HPI)以及麻仁浓缩蛋白(hempseed protein concentrate,HPC)[26-27],其中HPI的提取方法为胶束提取法(盐提)及酸沉碱提法(碱提)。
胶束提取法得到的麻仁蛋白纯度较高(98.8%)[28],但是其操作较烦琐,不利于工业生产。酸沉碱提法提取得到的麻仁蛋白纯度可以达到92%[29],虽然低于胶束提取法,但由于其操作简单,易于生产,因此目前大多数采用酸沉碱提法提取麻仁分离蛋白[30]。具体操作为将新鲜的汉麻种子用液氮磨成尽可能细的粉末,精确称取汉麻粉末的质量,以1∶4(W/V)加入正己烷,室温萃取3h,随后以1∶6(W/V)加入正己烷过夜,第2天将麻仁粉末置于通风橱内吹干,使正己烷挥发完全。将脱脂后的麻仁粉末以1∶20(W/V)溶于去离子水,用1mol/L NaOH溶液调节pH至9.0~10.0,室温搅拌抽提4h,20℃ 7900r/min离心30min,弃去沉淀;将上清液用1mol/L HCl调节pH至5.0,产生大量沉淀后,室温静置10~20min,20℃ 7900 r/min离心30min收集沉淀,用去离子水清洗沉淀3次,以洗去杂质。最后用去离子水重悬沉淀,调节pH至7.0,冻干浊液即汉麻分离蛋白。不同研究提取原理相同,但在麻仁粉末与水的比值、搅拌抽提条件、离心条件以及调节pH采用的试剂、pH大小有些许差异[6]。孟妍等[31]通过单因素试验和响应面法建立以麻仁蛋白提取率为响应值,料液比、提取时间、提取温度、提取pH为因变量的麻仁蛋白提取工艺理论模型对酸沉碱提提取汉麻分离蛋白的方法进行了研究和优化,结果表明麻仁蛋白最佳提取工艺条件为料液比1∶20,提取时间70min,提取pH=8.3,提取温度为44℃,测得蛋白质实际提取率为(39.15±0.28)%。
HPC的提取方法为,将2g脱脂麻仁粉加入15mL 100mmol/L Tris-HCl/0.5mol/L NaCl缓冲液,调节pH=8.0,进行均质化处理,在4℃下分批提取过夜。在4℃下,5700r/min离心30min,去除沉淀。上清液在pH=8.0,100mmol/L Tris-HCl缓冲液中透析36h,得到HPC[32]。
2 麻仁活性肽的功能
已有研究表明,尽管汉麻籽蛋白的生物活性有限,但它们的水解产物具有更高的生物活性,包括抗氧化、抗高血压、阻止恶性细胞增殖、降胆固醇血、抗炎和神经保护等[33-34]。这是由于生物活性肽在蛋白质的天然结构中被加密,无法发挥活性,但在水解过程中活性肽会被释放,从而发挥不同的生物活性。水解时使用不同类型的蛋白酶以及不同的水解时间可以获得不同功能和活性的活性肽。这是由于水解条件会影响活性肽的大小和氨基酸结构,进而影响肽的活性和功能[13]。研究表明,影响肽生物活性的重要因素是它们的分子量和氨基酸组成,一般来说,低分子量的多肽与高分子量肽相比具有更多的生物活性,因为它们更容易在胃肠道中逃脱蛋白酶的降解,可以被人体更好地吸收并引入血液[4]。此外,与分子量较大的肽相比,小肽也更容易与特定的靶点,如酶的活性位点相互作用,因为肽的氨基酸组成是确定其结构和功能的基础,从而影响与活性肽靶点之间的互作。麻仁蛋白的消化率很好,容易被各种蛋白酶进行消化,所以更容易得到不同种类的分子量小于10kDa的高疏水性小分子肽,也因此麻仁蛋白的水解产物具有更高更丰富的生物活性[35-36]。
2.1 抗氧化活性
Wang等[6]用6种不同的蛋白酶(碱性蛋白酶、风味蛋白酶、中性蛋白酶、复合蛋白酶、胃蛋白酶和胰蛋白酶)对麻仁蛋白进行水解,发现不同的水解产物表现出不同的抗氧化性能(清除DPPH自由基、螯合Fe2+能力和还原能力),麻仁蛋白的水解度越高、疏水氨基酸数量越多、表面疏水程度越高,体外抗氧化活性也越高。Teh等[37]分别用AFP、HT等蛋白酶对麻仁分离蛋白进行水解,发现不同蛋白酶水解4h后,ORAC活性和DPPH自由基清除能力都显著提高,且活性肽的活性与底物浓度、水解时间有关。Girgih等[38]对麻仁蛋白水解产物进行鉴定和分离,结果表明在鉴定的23个短链(≤5个氨基酸)肽中,WVYY和PSLPA是活性最高的抗氧化肽,其活性抗氧化能力分别为67%和58%,金属螯合活性分别为94%和96%。Lu等[35]也发现,汉麻蛋白水解产物具有良好的DPPH自由基、超氧自由基和羟基自由基清除能力,其活性呈浓度依赖性。这些结果表明,麻仁蛋白水解产物中可能含有给电子物质,能够与自由基发生反应,使自由基转化为更稳定的产物,从而终止自由基链反应。
研究表明,由4~16个氨基酸残基组成的肽能够抑制亚油酸的自氧化,因为它们具有更强的通过肠道屏障和与自由基有效相互作用的能力,肽的强抗氧化特性是通过组氨酸残基清除自由基、质子捐赠能力和金属离子螯合作用的联合作用实现的,某些氨基酸的存在,如组氨酸、酪氨酸、甲硫氨酸、赖氨酸、色氨酸和脯氨酸,可以增加肽的抗氧化能力[39]。麻仁蛋白水解肽由于肽链较短且含有可以增强抗氧化性的氨基酸,因此具有良好的抗氧化能力。
2.2 抗癌和抗炎活性
Logarušic′等[40]发现麻仁蛋白的水解物对HeLa癌细胞具有细胞毒活性和剂量依赖性的抗增殖活性,对正常HaCaT细胞有促进增殖作用。研究表明,麻仁蛋白水解产物可以下调lps刺激的BV-2小胶质细胞TNF-α、IL-1β和IL-6mRNA的转录水平,上调抗炎细胞因子IL-10和IL-4的基因表达,此外,麻仁蛋白水解产物可以下调M1极化标记基因(CCR7和iNOS)的表达,上调M2极化标记基因(CD200R和MRC1)的表达,下调趋化基因(CCR2和CCL2)的mRNA表达,通过重编程单核细胞向M2极化表型,改善慢性炎症状态,促进再生过程,从而具有改善神经炎症和炎症状态的效果[41]。
2.3 降血压和神经保护活性
肽的生物活性与肽链长度、氨基酸组成和序列有关,之前的研究表明,目前发现的最有效的ACE抑制肽由2~20个氨基酸组成,具有良好的疏水性/亲水性平衡以及与序列相关的一些特殊结构特征[42-43]。疏水性氨基酸可以提高肽在脂质条件下的溶解度,使其发挥更大的降压作用,此外,试验证据表明,在C端具有环或芳香环的残基,如酪氨酸、苯丙氨酸、色氨酸、脯氨酸,以及在N端具有疏水氨基酸的残基,特别是在N端具有甘氨酸、异亮氨酸、亮氨酸、缬氨酸等脂肪链的残基,是典型的ACE抑制剂肽。ACE抑制肽与ACE活性位点紧密结合,与血管紧张素I竞争,使ACE失活,从而防止血压升高[44]。
麻仁蛋白含有较多的疏水性氨基酸及具有ACE抑制肽潜力的氨基酸,是开发ACE抑制肽的良好来源。经过胃蛋白酶和胰酶的顺序作用,Girgih等[45]从麻仁蛋白水解物中分离出2种具有ACE及肾素体外双重抑制活性的多肽WYT和SVYT,它们对ACE活性的体外抑制率分别为89%和79%,对肾素的体外抑制率分别为77%和86%。Orio等[32]通过用盐酸对麻仁分离蛋白进行完全水解,鉴定出GVLY、IEE、LGV和RVR4种具有潜在ACE抑制活性的多肽,其中GVLY对ACE的抑制活性最高,麻仁蛋白水解产物的降血压及抑制肾素的活性似乎与高脯氨酸和苯丙氨酸含量有关,Girgih等[46]通过用麻仁蛋白代替酪蛋白饲喂具有先天性高血压的小鼠发现,麻仁蛋白可以通过降低先天性高血压小鼠体内肾素的活性从而降低小鼠的血压。
乙酰胆碱酯酶(acetylcholinesterase enzyme,AChE)能够水解乙酰胆碱(acetylcholine,ACh),使中枢神经系统中ACh水平降低,从而导致神经冲动功能的降低和大脑信号传输的不足,最终导致记忆损伤,如阿尔茨海默病。有研究表明,麻仁蛋白水解产物可以通过抑制AChE的活性而发挥体外神经保护作用,其中带负电荷氨基酸量最高的水解产物活性最高[47-48]。精氨酸作为酶解产物中含量次高的氨基酸,对AChE也有较高的抑制作用,研究认为,这可能是因为它与AChE的外周阴离子位点(peripheral anionic site,PAS)结合,而PAS被认为是抑制剂的一个重要的酶结合位点,因此麻仁水解肽中含量较高的精氨酸也是麻仁水解肽具有AChE抑制作用的原因之一[49]。
2.4 降低胆固醇活性
Aiello等[50]用不同的蛋白酶水解麻仁蛋白,对水解产物进行肽组学分析后发现部分活性肽被证明具有3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl-glutaryl-coenzymeAreductase,HMGCoAR)的抑制活性。抑制胆固醇生物合成是降低血清胆固醇水平的最有效途径,由于细胞内胆固醇的产生是一个多步骤的途径,其中HMGCoAR是合成内源性胆固醇的关键限速酶,有效抑制HMGCoAR的活性可以显著降低胆固醇水平,说明麻仁蛋白的水解产物可以有效抑制胆固醇的升高。这些降低胆固醇的活性肽含有8~10个残基,具有较高的疏水性,有1个疏水的N端以及带负电荷的C端,这些被鉴定为与HMGCoAR互作所必需的特征。Zanoni等[51]也证明了这一观点,他们发现用胃蛋白酶水解麻仁蛋白后,水解产物在0.1~1.0 mg/mL范围内,可以有效抑制抑制HMGCoAR的催化活性,其作用机制可能与他汀类药物相似。当浓度为1.0 mg/mL时,麻仁蛋白水解产物对HMGCoAR的抑制率可以达到80%,远高于其他降胆固醇肽,例如羽扇豆肽(-17%,2.5mg/mL),证明麻仁蛋白肽具有更好的降低胆固醇活性的能力。
除此之外,也有研究表明,麻仁蛋白可以提高小鼠的抗疲劳和免疫调节能力,李永进等[52]研究发现,给小鼠饲喂麻仁蛋白后能明显延长小鼠游泳时间、降低血乳酸值、增加肝糖原含量,明显增强小鼠ConA诱导的脾淋巴细胞转化和迟发型变态反应,提高小鼠抗体生成数和半数溶血值,增强小鼠巨嗜细胞吞噬能力,增加小鼠外周血液中T淋巴细胞百分比。麻仁蛋白水解产物还有降血糖的功能,Ren等[53]研究发现,用碱性蛋白酶水解麻仁蛋白,水解度为(27.2±0.88)%时,水解产物表现出较高的α-葡萄糖苷酶抑制活性,这是由于2种新的α-葡萄糖苷酶抑制肽序列Leu-Arg(287.2D)和Pro-Leu-Met-Leu-Pro(568.4D)导致的,证明麻仁蛋白水解产物具有抗糖尿病的特性。
3 展望
人们对于食品的消费逐渐转向含有膳食营养且能够保持健康的食品,因此食源性活性肽逐渐进入了人们的视野。其中,植物来源活性肽由于资源丰富、廉价易得以及其独特的生理功能已成为食品研究开发的热点之一。汉麻仁是一种极好的营养来源,麻仁蛋白含有人体所需的各种必需氨基酸,不含色氨酸抑制因子,不影响蛋白质的吸收,也不含大豆的寡聚糖和致敏因子,因此不会造成反胃、胃涨和过敏反应,是一种十分优异的植物蛋白质来源。麻仁蛋白消化率好,易被蛋白酶消化产生小分子多肽,用不同蛋白酶经过不同处理时间产生的活性肽具有降血压、降胆固醇、抗氧化以及抗癌等生理活性,因此麻仁蛋白比其他植物蛋白在保健食品、功能性食品的开放方面有着更高的潜力和价值。目前有关于麻仁蛋白的研究主要集中在活性肽功能的制备及功能验证方面,但其发挥功能的具体机制还不是很明确,真正可以投入生产和发挥医疗作用的汉麻源活性肽为数不多。探究汉麻蛋白及其水解产物生理功能的具体机制及其对生物饮食上的医学反应,还需要作进一步的研究,从而将其运用于生产及医学实践。
参考文献
[1] 宋淑敏,刘宇峰,董艳,等.汉麻籽的营养价值及开发利用[J].农产品加工,2016(17):54-55.
[2] VASSILEVSKA?IVANOVA R.Biology and ecology of genus cannabis:Genetic origin and biodiversity.in vitro production of cannabinoids[J].Genetics and plant physiology,2019,9(1/ 2):75-98.
[3] PONZONI E,BRAMBILLA I M,GALASSO I.Genome?wide identification and organization of seed storage protein genes of Cannabis sativa[J].Biologia plantarum,2018,62(4):693-702.
[4] RUSSO R,REGGIANI R.Evaluation of protein concentration,amino acid profile and antinutritional compounds in hempseed meal from dioecious and monoecious varieties[J].American journal of plant sciences,2015,6 (1):14-22.
[5] 温林凤,刘果,宋明月,等.汉麻籽生物活性成分及其应用研究进展[J]. 中国果菜,2021,41(2):21-27.
[6] WANG X S,TANG C H,YANG X Q,et al.Characterization,amino acid composition and in vitro digestibility of hemp(Cannabis sativa L.)proteins [J].Food chemistry,2008,107(1):11-18.
[7] DALIRI E B,LEE B H,OH D H.Current trends and perspectives of bioactive peptides[J].Critical reviews in food science and nutrition,2018,58 (13):2273-2284.
[8] 王睿晗,黄永震,王周利,等.食源性生物活性肽免疫调节功能的研究 [J].基因组学与应用生物学,2019,38(1):148-152.
[9] MULTARI S,NEACSU M,SCOBBIE L,et al.Nutritional and phytochemical content of high?protein crops[J].Journal of agricultural and food chemistry,2016,64(41):7800-7811.
[10] CHAKRABARTI S,GUHA S,MAJUMDER K.Food?derived bioactive peptides in human health:Challenges and opportunities[J].Nutrients,2018, 10(11):1-17.
[11] 陈贵堂,赵霖.植物蛋白的营养生理功能及开发利用[J].食品工业科技,2004,25(9):137-140.
[12] PIHLANTO A,MATTILA P,MÄKINEN S,et al.Bioactivities of alternative protein sources and their potential health benefits[J].Food and function, 2017,8(10):3443-3458.
[13] LEONARD W,ZHANG P Z,YING D Y,et al.Hempseed in food industry: Nutritional value,health benefits,and industrial applications[J].Comprehensive reviews in food science and food safety,2020,19(1):282-308.
[14] PAVLOVIC R,PANSERI S,GIUPPONI L,et al.Phytochemical and ecological analysis of two varieties of hemp(Cannabis sativa L.)grown in a mountain environment of Italian Alps[J].Frontiers in plant science,2019, 10:1-20.
[15] MAMONE G,PICARIELLO G,RAMONDO A,et al.Production,digestibility and allergenicity of hemp(Cannabis sativa L.)protein isolates[J].Food research international,2019,115:562-571.
[16] SVEDBERG T,STAMM A J.The molecular weight of edestin[J].Journal of the American chemical society,1929,51(7):2170-2185.
[17] VAINERMAN E S,GOLOVINA T O,ROGOZHIN S V.Low?molecular? weight thiol in macromolecules of Canabis sativa 11S globulin?Edestin [J].Nahrung,1986,30(3/ 4):398-400.
[18] CERINO P,BUONERBA C,CANNAZZA G,et al.A review of hemp as food and nutritional supplement[J].Cannabis and cannabinoid research, 2021,6(1):19-27.
[19] SINGH A,MEENA M,KUMAR D,et al.Structural and functional analysis of various globulin proteins from soy seed[J].Critical reviews in food science and nutrition,2015,55(11):1491-1502.
[20] DOCIMO T,CARUSO I,PONZONI E,et al.Molecular characterization of edestin gene family in Cannabis sativa L. [J]. Plant physiology and biochemistry,2014,84:142-148.
[21] MALOMO S A,HE R,ALUKO R E.Structural and functional properties of hemp seed protein products[J].Journal of food science,2014,79(8):C1512-C1521.
[22] HOUSE J D,NEUFELD J,LESON G.Evaluating the quality of protein from hemp seed(Cannabis sativa L.)products through the use of the protein digestibility?corrected amino acid score method[J].Journal of agricultural and food chemistry,2010,58(22):11801-11807.
[23] WU G Y,BAZER F W,DAVIS T A,et al.Arginine metabolism and nutrition in growth,health and disease[J].Amino acids,2009,37(1):153-168.
[24] FARINON B,MOLINARI R,COSTANTINI L,et al.The seed of industrial hemp(Cannabis sativa L.):Nutritional quality and potential functionality for human health and nutrition[J].Nutrients,2021,12(7):1-59.
[25] RAIKOS V,DUTHIE G,RANAWANA V.Denaturation and oxidative stability of hemp seed(Cannabis sativa L.)protein isolate as affected by heat treatment[J].Plant foods for human nutrition,2015,70(3):304-309.
[26] TANG C H,TEN Z,WANG X S,et al.Physicochemical and functional properties of hemp(Cannabis sativa L.)protein isolate[J].Journal of agricultural and food chemistry,2006,54(23):8945-8950.
[27] MALOMO S A,ONUH J O,GIRGIH A T,et al.Structural and antihypertensive properties of enzymatic hemp seed protein hydrolysates[J].Nutrients,2015,7(9):7616-7632.
[28] MURRAY E D,ARNTFIELD S D,ISMOND M A H.The influence of processing parameters on food protein functionality.II.Factors affecting thermal properties as analyzed by differential scanning calorimetry[J].Canadian institute of food science & technology journal,1985,18(2):158-162.
[29] DAP C ˇ EVI C ' ?HADNA -DEV T,HADNA -DEV M,LAZARIDOU A,et al. Hempseed meal protein isolates prepared by different isolation techniques. Part II.Gelation properties at different ionic strengths[J].Food hydrocolloids,2018,81:481-489.
[30] 孟妍,曾剑华,王尚杰,等.汉麻籽蛋白研究进展[J].食品工业,2020,41 (1):268-273.
[31] 孟妍,曾剑华,李美莹,等.汉麻籽分离蛋白提取技术优化及其组成和 乳化性表征[J].中国食品学报,2021,21(5):250-262.
[32] ORIO L P,BOSCHIN G,RECCA T,et al.New ACE?inhibitory peptides from hemp seed(Cannabis sativa L.)proteins[J].Journal of agricultural and food chemisrty,2017,65(48):10482-10488.
[33] XU Y J,LI J,ZHAO J K,et al.Hempseed as a nutritious and healthy human food or animal feed source:A review[J].International journal of food science & technology,2021,56(2):530-543.
[34] LIM X Y,TAN T Y C,ROSLI S H M,et al.Cannabis sativa subsp.sativa’ s pharmacological properties and health effects:A scoping review of current evidence[J].PLoS One,2021,16(1):1-22.
[35] LU R R,QIAN P,SUN Z,et al.Hempseed protein derived antioxidative peptides:Purification,identification and protection from hydrogen peroxide?induced apoptosis in PC12 cells[J].Food chemistry,2010,123(4): 1210-1218.
[36] PIOVESANA S,CAPRIOTTI A L,CAVALIERE C,et al.Recent trends and analytical challenges in plant bioactive peptide separation,identification and validation[J].Analytical and bioanalytical chemistry,2018,410 (15):3425-3444.
[37] TEH S S,BEKHIT A E D A,CARNE A,et al.Antioxidant and ACE?inhibitory activities of hemp(Cannabis sativa L.)protein hydrolysates produced by the proteases AFP,HT,Pro?G,actinidin and zingibain[J].Food chemistry,2016,203:199-206.
[38] GIRGIH A T,ALASHI A M,HE R,et al.A novel hemp seed meal protein hydrolysate reduces oxidative stress factors in spontaneously hypertensive rats[J].Nutrients,2014,6(12):5652-5666.
[39] PENTA?RAMOS E A,XIONG Y L.Antioxidant activity of soy protein hydrolysates in a liposomal system[J].Journal of food science,2002,67(8): 2952-2956.
[40] LOGARUŠI C ' M,SLIVAC I,RADOŠEVI C ' K,et al.Hempseed protein hydrolysates’ effects on the proliferation and induced oxidative stress in normal and cancer cell lines[J].Molecular biology reports,2019,46(6): 6079-6085.
[41] RODRIGUEZ?MARTIN N M,MONTSERRAT?DE LA PAZ S,TOSCANO R,et al.Hemp(Cannabis sativa L.)protein hydrolysates promote anti?in? flammatory response in primary human monocytes[J].Biomolecules,2020, 10(5):1-12.
[42] LEE S Y,HUR S J.Antihypertensive peptides from animal products,marine organisms,and plants[J].Food chemistry,2017,228:506-517.
[43] DASKAYA?DIKMEN C,YUCETEPE A,KARBANCIOGLU?GULER F,et al.Angiotensin?I?converting enzyme(ACE)?inhibitory peptides from plants [J].Nutrients,2017,9(4):1-19.
[44] KOBAYASHI Y,YAMAUCHI T,KATSUDA T,et al.Angiotensin?I converting enzyme(ACE)inhibitory mechanism of tripeptides containing aromatic residues[J].Journal of bioscience and bioengineering,2008,106(3): 310-312.
[45] GIRGIH A T,HE R,ALUKO R E.Kinetics and molecular docking studies of the inhibitions of angiotensin converting enzyme and renin activities by hemp seed(Cannabis sativa L.)peptides[J].Journal of agricultural and food chemistry,2014,62(18):4135-4144.
[46] GIRGIH A T,ALASHI A,HE R,et al.Preventive and treatment effects of a hemp seed(Cannabis sativa L.) meal protein hydrolysate against high blood pressure in spontaneously hypertensive rats[J].European journal of nutrition,2014,53(5):1237-1246.
[47] MALOMO S A,ALUKO R E.In vitro acetylcholinesterase?inhibitory properties of enzymatic hemp seed protein hydrolysates[J].Journal of the American oil chemists’ society,2016,93(3):411-420.
[48] SAMSAMIKOR M,MACKAY D,MOLLARD R C,et al.A double?blind, randomized,crossover trial protocol of whole hemp seed protein and hemp seed protein hydrolysate consumption for hypertension[J].Trials,2020,21 (1):1-13.
[49] RODRIGUEZ?MARTIN N M,TOSCANO R,VILLANUEVA A,et al.Neuroprotective protein hydrolysates from hemp (Cannabis sativa L.) seeds [J].Food function,2019,10(10):6732-6739.
[50] AIELLO G,LAMMI C,BOSCHIN G,et al.Exploration of potentially bioactive peptides generated from the enzymatic hydrolysis of hempseed proteins[J].Journal of agricultural and food chemistry,2017,65(47):10174- 10184.
[51] ZANONI C,AIELLO G,ARNOLDI A,et al.Hempseed peptides exert hypocholesterolemic effects with a statin?like mechanism[J].Journal of agricultural and food chemistry,2017,65(40):8829-8838.
[52] 李永进,杨睿悦,扈学俸,等.火麻仁蛋白对小鼠抗疲劳和免疫调节功 能的初步研究[J].卫生研究,2008,37(2):175-178.
[53] REN Y,LIANG K,JIN Y Q,et al.Identification and characterization of two novel α?glucosidase inhibitory oligopeptides from hemp(Cannabis sativa L.)seed protein[J].Journal of functional foods,2016,26:439-450.
文献摘自:孙鑫,孙尧,李瑶,吴琼,王雷.麻仁蛋白及其水解活性肽的研究进展[J].安徽农业科学,2023,51(02):15-20.