摘 要:目的:建立罗布麻叶破壁饮片的UPLC指纹图谱及有效成分量测定方法。方法:采用ACQUITY UP-LC®HSS T3 C18(100mm×2.1mm,1.8μm)色谱柱;以乙腈-0.1%甲酸溶液为流动相,梯度洗脱;流速为0.3mL/min;检测波长为360nm;柱温为25℃。采用“中药色谱指纹图谱相似度评价系统(2012版)”进行相似度评价,并对结果进行系统聚类分析(HCA)、主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)。结果:15批破壁饮片样品指纹图谱标定了17个共有峰,指认了金丝桃苷、异槲皮苷、槲皮素3个成分;与对照图谱相似度为0.922~0.994,HCA及PCA分析将15批样品分为3类,OPLS-DA分析找到对评价罗布麻叶破壁饮片质量一致性和分类贡献较大的7个成分;罗布麻叶破壁饮片中的金丝桃苷、异槲皮苷、槲皮素含量分别为2.338~4.092mg/g、3.339~5.670mg/g、0.135~0.696mg/g。结论:该研究建立的指纹图谱及含量测定方法专属性强,准确可靠,结合化学模式识别可用于罗布麻叶破壁饮片的质量评价和控制。
关键词:罗布麻叶;破壁饮片;指纹图谱;含量测定;质量控制
罗布麻叶为夹竹桃科植物罗布麻Apocynum venetum L.的干燥叶,具有平肝安神、清热利水的功效,用于治疗肝阳眩晕、心悸失眠、浮肿尿少,分布于我国西北和华北地区的盐渍荒漠或半荒漠土壤,河北中南部、天津是其适宜生境〔1,2〕。现代研究表明罗布麻叶主要含有黄酮类、挥发油类、三萜及甾醇类等成分〔3-6〕,具有镇静催眠、降血压、降血脂、抗抑郁、抗氧化、止咳、平喘、化痰等作用〔7-11〕。
罗布麻叶破壁饮片是将其传统饮片通过现代粉碎技术加工至粒径D90<45μm的粉体,进一步通过制粒成型技术制成的可直接口服的30~100目颗粒状饮片,具有质量均一、成分高效利用、服用便捷等特点。2020年版中国药典一部罗布麻叶药材质量标准中是以对照药材、槲皮素和山柰酚对照品为薄层定性鉴别指标,以金丝桃苷作为含量测定指标,缺少可反映批间质量一致性的指标,存在一定的局限性。为了更科学、有效评价和控制罗布麻叶破壁饮片的质量,本研究建立其UPLC指纹图谱和多指标成分含量测定方法,结合聚类分析(HCA)、主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)等方法进行研究,寻找对评价罗布麻叶破壁饮片质量一致性和分类贡献较大的主要因素,以期为提高罗布麻叶破壁饮片的质量控制水平提供参考。
1仪器与材料
1.1仪器
Waters H-class型超高效液相色谱仪(美国Waters公司);KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司);ME204型万分之一电子天平(瑞士梅特勒-托利多公司)。
1.2材料
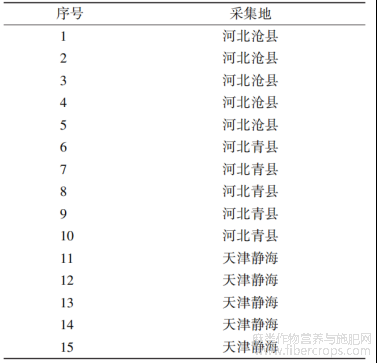
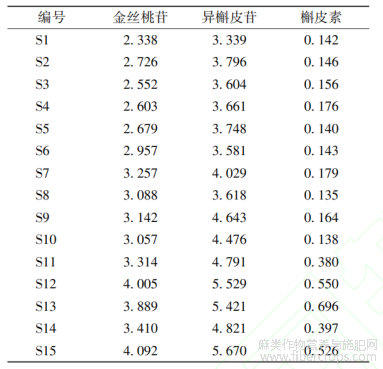
金丝桃苷(批号:111521-201809,质量分数:94.9%)、异槲皮苷(批号:250004-202011,质量分数:97.2%)、槲皮素(批号:100081-201610,质量分数:99.1%)对照品均购自中国食品药品检定研究院;乙腈、甲醇均为色谱纯,水为超纯水;其余试剂均为分析纯;2020年6月从罗布麻叶的3个主产地共采集样品15批,经中智药业集团贾世清主管中药师鉴定为夹竹桃科植物罗布麻Apocynum venetum L.的干燥叶,净制、切段成传统饮片(编号:DP1~DP15),超微粉碎制备成破壁粉体(中间体,编号:UP1~UP15),经“无添加制粒”专利技术制成罗布麻叶破壁饮片(成品不含辅料,编号:S1~S15)。破壁饮片及其原料药材的产地信息见表1。
表1 罗布麻叶样品来源信息
2方法与结果
2.1溶液的制备
2.1.1供试品溶液:
取罗布麻叶破壁饮片约0.5g,精密称定,置具塞锥形瓶中,加70%甲醇15mL,称重,超声(560W,40kHz)30min,冷却至室温,用70%甲醇补重,摇匀,用0.22μm微孔滤膜滤过,取续滤液,即得。
2.1.2对照品溶液:
精密称取金丝桃苷、异槲皮苷、槲皮素对照品适量,加甲醇制成浓度分别为1.0、1.8、0.7mg/mL的对照品储备液;取各对照品储备液适量,加甲醇制成浓度分别为150、170、20μg/mL的混合对照品溶液。
2.2色谱条件
色谱柱为ACQUITY UPLC®HSS T3 C18(100mm×2.1mm,1.8μm)柱;流动相为乙腈(A)-0.1%甲酸溶液(B),梯度洗脱(0~6min,9%A;6~8min,9~14%A;8~25min,14%~18%A;25~37min,18%~45%A;37~40min,45%~9%A);流速为0.3mL/min;检测波长为360nm;柱温为25℃;进样量为2μL。
2.3指纹图谱研
2.3.1精密度试验:
取罗布麻叶破壁饮片供试品溶液,按“2.2”项下色谱条件连续进样测定6次,以4号金丝桃苷色谱峰为参照峰(S),计算得到各共有峰相对保留时间RSD<1.00%,相对峰面积RSD<1.00%,表明仪器精密度良好。
2.3.2重复性试验:
取同一批罗布麻叶破壁饮片6份,按“2.1.1”项下方法制备供试品溶液,进样测定,以4号金丝桃苷色谱峰为参照峰(S),计算得到各共有峰相对保留时间RSD<1.00%,相对峰面积RSD<2.50%,表明该方法重复性良好。
2.3.3稳定性试验:
取罗布麻叶破壁饮片供试品溶液,分别于制备后0、2、4、8、12、24h进样测定,以4号金丝桃苷色谱峰为参照峰(S),计算得到各共有峰相对保留时间RSD<1.00%,相对峰面积RSD<4.90%,表明供试品溶液在24h内稳定性良好。
2.3.4指纹图谱建立及相似度评价:
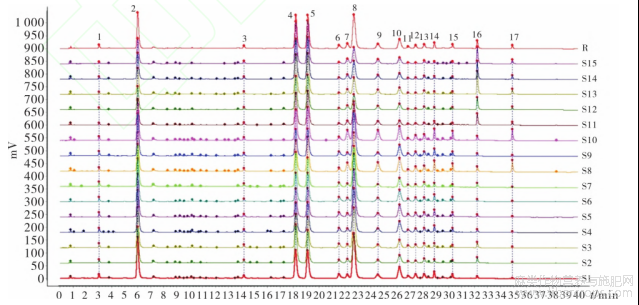
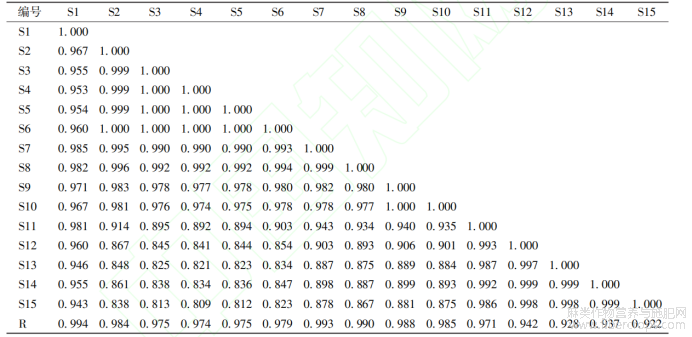
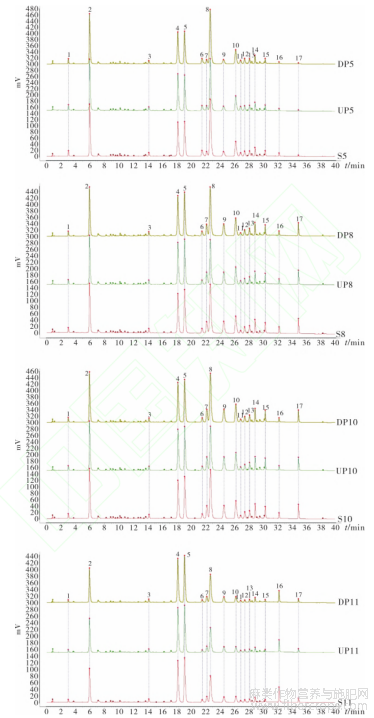
取15批罗布麻叶破壁饮片样品溶液,按“2.2”项下色谱条件进样测定,记录色谱图,将数据导入“中药色谱指纹图谱相似度评价系统(2012版)”,以S14号样品的图谱为参照图谱,多点校正后采用平均数法(时间窗0.1min)生成叠加图谱及对照图谱,见图1,确定了17个共有峰,通过与对照品(图2)比对,指认了其中3个成分,分别为金丝桃苷(4号)、异槲皮苷(5号)、槲皮素(16号)。相似度评价结果见表2。各样品图谱与对照图谱的相似度为0.922~0.994,说明15批破壁饮片样品质量较稳定。
图1 15批罗布麻叶破壁饮片UPLC叠加图谱(S1~S15)及对照图谱(R)
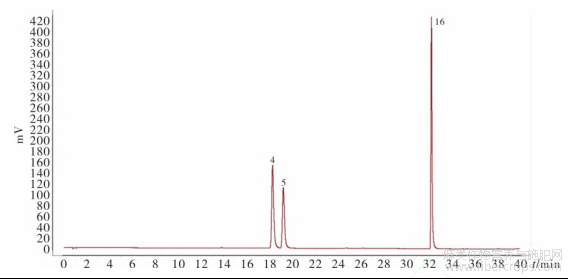
图2 混合对照品溶液的HPLC色谱图
4.金丝桃苷5.异槲皮苷16.槲皮素
表2 罗布麻叶破壁饮片指纹图谱相似度评价结果
表3 罗布麻叶中3个成分的线性关系考察结果
2.4成分含量测定
2.4.1线性关系考察:
取混合对照品储备液适量,加甲醇稀释成系列不同浓度的混合对照品溶液,按“2.2”项下色谱条件进样测定,以对照品溶液的浓度为横坐标,峰面积为纵坐标,绘制标准曲线,结果见表3。
2.4.2精密度试验:
取罗布麻叶破壁饮片供试品溶液,按“2.2”项下色谱条件连续进样测定6次,计算得到金丝桃苷、异槲皮苷、槲皮素峰面积的RSD分别为0.72%、0.78%、0.87%,表明仪器精密度良好。
2.4.3稳定性试验:
取罗布麻叶破壁饮片供试品溶液,分别于制备后0、2、4、8、12、24h进样测定,计算得到金丝桃苷、异槲皮苷、槲皮素峰面积的RSD分别为1.51%、1.18%、0.83%,表明供试品溶液在24h内稳定性良好。
2.4.4重复性试验:
取同一批罗布麻叶破壁饮片(S14)6份,按“2.1.1”项下方法制备供试品溶液,进样测定,计算得到金丝桃苷、异槲皮苷、槲皮素峰面积的RSD分别为0.72%、0.74%、0.54%,表明该方法重复性良好。
2.4.5加样回收率试验:
取已知成分含量的罗布麻叶破壁饮片(S14)9份,每份0.5g,精密称定,分别按已知成分含量50%、100%、150%的比例加入各对照品,按“2.1.1”项下方法制备供试品溶液,进样测定,计算得到金丝桃苷、异槲皮苷、槲皮素的平均加样回收率分别为97.93%、100.14%、100.21%,RSD分别为0.52%、2.26%、2.46%,表明该方法准确性良好。
2.4.6样品含量测定:
取15批罗布麻叶破壁饮片样品溶液,按“2.2”项下色谱条件进样测定,计算各成分含量,结果见表4。15批罗布麻叶破壁饮片中金丝桃苷、异槲皮苷、槲皮素含量分别为2.338~4.092mg/g、3.339~5.670mg/g、0.135~0.696mg/g;不同产地原药材所制备破壁饮片中金丝桃苷、异槲皮苷和槲皮素含量差异较大。
表4 罗布麻叶破壁饮片中3个成分的含量测定结果(mg/g)
2.5化学计量学分析
2.5.1系统聚类分析(HCA):
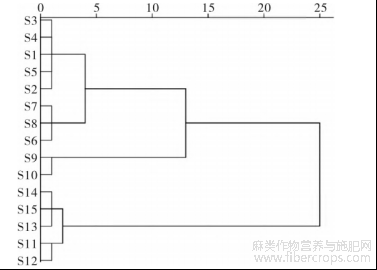
以罗布麻叶破壁饮片中17个共有峰的峰面积为变量,运用SPSS22.0软件,采用Ward连结法选用Z得分对数据进行标准化,以平方欧式距离测量进行系统聚类分析,结果见图3。当平方欧式距离为5时,样品被分为3类,图315批罗布麻叶破壁饮片HCA图其中第1类为S1~S8号样品,第2类为S9、S10号样品,第3类为S11~S15号样品。当平方欧式距离为15时,原药材产自河北青县和沧县的破壁饮片S1~S10号样品归为一类,而原药材产自天津静海的破壁饮片S11~S15号样品归为一类。15批样品的含量测定结果结合聚类分析结果初步显示,罗布麻叶破壁饮片的质量一致性评价和分类与原药材的产地具有较大相关性。
图3 15批罗布麻叶破壁饮片HCA图
2.5.2主成分分析(PCA):
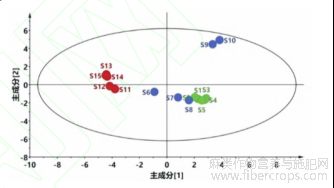
采用SIMCA-P14.1软件,以17个共有峰的峰面积为变量进行PCA,模型解释率参数R2X为0.989,预测能力参数Q2为0.956,表明该模型稳定、可靠;PCA得分图结果与HCA结果一致,见图4。15批破壁饮片按原药材的产地被分为2类样本点;原药材产自天津静海的破壁饮片样品能与河北的样品显著分开,原药材产自河北青县和沧县的破壁饮片样品(S1~S8)无法区分。
图4 15批罗布麻叶破壁饮片PCA得分图
2.5.3正交偏最小二乘判别分析(OPLS-DA):
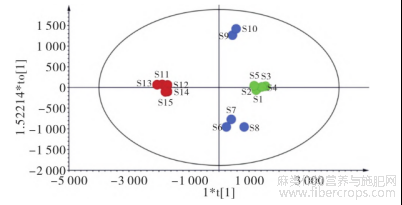
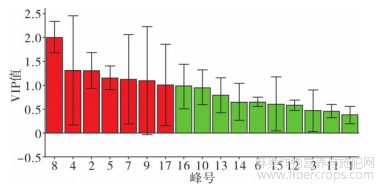
采用SIMCA-P14.1软件,在PCA分析的基础上,以17个共有峰面积为变量进行OPLS-DA分析,得分矩阵图见图5,变量重要性投影(VIP值)图见图6。模型累积解释能力参数R2X和R2Y分别为0.996和0.984,预测能力参数Q2为0.948,说明具有较好的稳定性和预测能力,可用于分析不同质量的样品;由OPLS-DA得分矩阵图可知,15批样品可分为4类,产自天津静海的药材所制备破壁饮片聚为1类,与河北药材所制样品显著分开;产自河北沧县药材所制备破壁饮片聚为1类;产自河北青县药材所制备破壁饮片分为2类,具有较大的质量差异性;以VIP>1.0为标准,筛选出对OPLS-DA模型分类贡献度大的变量,依次为色谱峰8、4、2、5、7、9、17号。
图5 15批罗布麻叶破壁饮片OPLS-DA得分图
图6 罗布麻叶破壁饮片OPLS-DAVIP值图
2.6基于量质传递分析制备工艺对破壁饮片质量的影响
2.6.1破壁饮片及其中间体、原药材的指纹图谱测定:
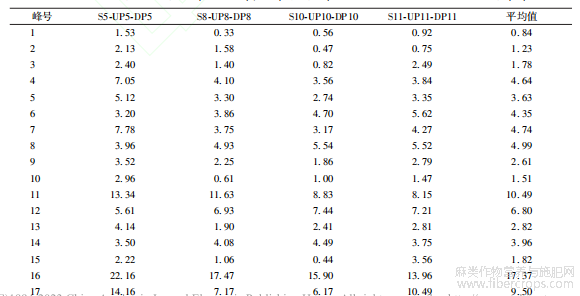
从OPLS-DA分析后的4类破壁饮片中各取1批破壁饮片样品(S5、S8、S10、S11)及其对应的中间体(UP5、UP8、UP10、UP11)和原药材饮片(DP5、DP8、DP10、DP11),按“2.1.1”项下方法制备样品溶液,按“2.2”项下色谱条件进样测定,记录色谱图,见图7。
2.6.2破壁饮片—中间体—原药材的量质传递分析:
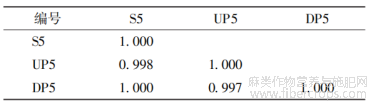
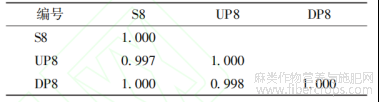
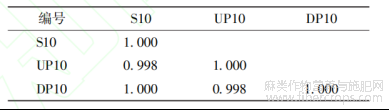
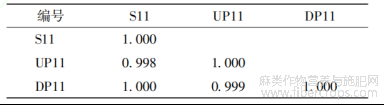
将来源于同批药材的破壁饮片及其中间体(破壁粉体)和原药材(传统饮片)的UPLC指纹图谱导入“中药色谱指纹图谱相似度评价系统(2012版)”进行单组数据分析。由传统饮片依次制备成破壁粉体和破壁饮片成品,指纹图谱的全谱相似度均≥0.997,见表5~8;除11、12、16、17号共有峰外,其它13个共有峰的破壁饮片-中间体-原料之间的峰面积RSD平均值均<5.00%,而峰面积RSD平均值>5.00%的4个峰均不属于对OPLS-DA分类贡献度较大的共有峰,见表9。表明破壁饮片—中间体—原药材的化学相关性高,量质传递效果好,破壁饮片的制备工艺技术及过程控制未造成显著的成分流失、新成分生成或成分含量降低、升高。
表5 罗布麻叶破壁饮片(S5)及其中间体(UP5)、原料(DP5)的相似度
表6 罗布麻叶破壁饮片(S8)及其中间体(UP8)、原料(DP8)的相似度
表7 罗布麻叶破壁饮片(S10)及其中间体(UP10)、原料(DP10)的相似度
表8 罗布麻叶破壁饮片(S11)及其中间体(UP11)、原料(DP11)的相似度
表9 罗布麻叶破壁饮片及其中间体(破壁粉体)、原料(传统饮片)的UPLC指纹图谱共有峰面积RSD值(%)
图7 罗布麻叶破壁饮片及其中间体(破壁粉体)、原料(传统饮片)的 UPLC 叠加图谱比较
3讨论
3.1色谱条件的确定
试验前期对色谱条件进行了系统考察,包括不同的流动相系统(乙腈-0.1%醋酸溶液、0.1%甲酸溶液-甲醇、0.1%磷酸溶液-乙腈、甲醇-水、乙腈-0.1%甲酸溶液、乙腈-水)、柱温(20、25、30、35、40℃)、流速(0.2、0.25、0.3、0.35、0.4mL/min)、进样量(1、2、3、4、5μL)、波长,最终确定了罗布麻叶破壁饮片指纹图谱分析和含量测定的最佳色谱条件。
3.2中药破壁饮片批间质量一致性的控制
通过对15批罗布麻叶破壁饮片UPLC指纹图谱数据进行HCA、PCA和OPLS-DA分析,发现不同产地原药材所制备的破壁饮片质量具有显著性差异;金丝桃苷和异槲皮苷的含量测定结果也表现出显著的地域性差异;对破壁饮片及其中间体、原药材饮片的指纹图谱进行了全谱相似度分析和共有峰峰面积比较,发现制备工艺过程的量质传递高效,通过工艺技术的先进性和标准化的过程控制实现破壁饮片与其传统饮片的同质性。综合分析,原药材质量是影响罗布麻叶破壁饮片成品质量一致性的主要因素之一,在产业化过程中,除需关注固定原药材产地外,还需进一步统一控制生长年限、采收时间、产地加工方法等,实施全产业链质量控制,必要时进行均一化处理,提高批间质量一致性。通过OPLS-DA分析,找出对不同批次罗布麻叶破壁饮片分类贡献较大的7个成分,也是鉴别批间质量一致性的主要标志性成分,在该品种后续的质量控制方法优化研究中应重点关注,特别是具有药理活性且含量可达定量限度要求的标志性成分应建立含量测定质量控制项,提高该品种的质量标准。
参考文献
[1]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2020:220-221.
[2]杨会枫,郑江华,贾晓光,等.气候变化下罗布麻潜在地理分布区预测[J].中国中药杂志,2017,42(6):1129-1124.
[3]李慕春,王苗苗,韩飞,等.罗布麻和白麻叶中主要化学成分的统计分析[J].中国实验方剂学杂志,2018,24(2):62-68.
[4]周春玲,孔令锋.GC-MS分析罗布麻叶挥发油的化学成分[J].中成药,2011,33(2):338-340.
[5]侯晋军,韩利文,杨官娥,等.罗布麻叶化学成分和药理活性研究进展[J].中草药,2006,37(10):1603-1605.
[6]孔娜娜,方圣涛,刘莺,等.罗布麻叶中非黄酮类化学成分研究[J].中草药,2013,44(22):3114-3118.
[7]何伟,王莉,黄景凤,等.罗布麻叶水提物镇静催眠作用研究[J].药物评价研究,2022,45(2):274-280.
[8]许泽恭,白荣钰,严雪梅,等.罗布麻叶总黄酮对高脂血症大鼠的降脂作用研究[J].中药新药与临床药理,2021,32(2):208-213.
[9]王佳,谢健,陈岳明,等.罗布麻叶总黄酮提取物对抑郁模型大鼠抗抑郁作用的研究[J].浙江医学,2016,38(1):14-16,21.
[10]Wang WQ,Liang XY,Fu D,etal.Apocynum venetum leaf attenuates myocardial ischemia/reperfusion injury by inhibiting oxidative stress[J].American Journal of Chinese Medicine, 2015,43(1):71-85.
[11]付剑江,王曦聆,吕红,等.罗布麻叶提取物的抗高血压作用及其机制研究[J].中国实验方剂学杂志,2013,19(7):159-164.
文章摘自:乔卫林,黄丽桃,彭丽华,陈炜璇,史军杰,陈金梅.罗布麻叶破壁饮片的指纹图谱和多成分定量质量控制研究[J/OL].中药材,2023(01):137-143[2023-03-19].DOI:10.13863/j.issn1001-4454.2023.01.024.