摘 要:目的:优化提取罗布麻黄酮成分最佳工艺条件。方法:选用乙醇回流提取法对罗布麻中黄酮化合物的提取工艺进行研究,通过单因素试验、正交试验和响应面试验优化得到最佳的提取工艺参数。结果:最佳提取工艺为乙醇浓度70%,提取温度70℃,提取回流时间60min,液料比30ml/g。结论:乙醇回流提取法工艺简单、准确、重复性好,由试验得出的罗布麻黄酮最佳提取率可达到24.6%,对植物黄酮的提取分离工艺具有参考价值。
关键词:罗布麻;黄酮;响应面法;正交法
罗布麻(Apocynumvenetum),在我国新疆、青海和甘肃等省区均有分布,有清热利湿、降血脂、平抑旰阳、安神等作用。现代药理研究表明,罗布麻叶中起主要作用的是黄酮类化合物成分,具有抗氧化、保肝、抗神经衰弱等多种生物活性[1,,2]。《中国药典》记载其性味淡、微苦、性平,有清热平肝、益心利水之效,主治头痛、尿少、水肿、失眠等症[3]。实现其药用价值的关键环节为黄酮类化合物的有效提取,当前有很多黄酮类化合物的提取方法,其中包括回流提取法、碱提酸沉法、微波提取法、酶辅助提取法、超临界流体萃取法等。其中乙醇回流提取法工艺简单、成本低,在中药制药、植物天然产物提取中发挥着不可或缺的重要作用。
黄酮类化合物是一类具有多酚结构的植物次生代谢产物,较广泛分布于双子叶植物中,在治疗癌症、阿海茨默病(AD)、动脉粥样硬化等多种疾病中均有应用,且具显著提高免疫机能作用[4]。为实现自然资源的合理运用,减少有效成分的流失,其分离纯化尤为重要。该试验通过乙醇回流法提取罗布麻黄酮,采用正交法和响应面法进行工艺设计,通过对优化结果的分析比较,明确提取的最佳条件,为罗布麻黄酮新产品的开发提供实践依据[5,,6]。
1材料与方法
1.1材料
取罗布麻叶为材料磨粉,过100目筛,密封保管备用;芦丁标准品;蒸馏水;95%乙醇;无水乙醇、硝酸铝、氢氧化钠等均为分析纯。
1.2仪器
DK-S26型水浴锅;旋转蒸发仪RE-2000A,郑州市亚荣仪器有限公司;FA2004N电子分析天平;V-5000可见分光光度计,METASH上海元仪器有限公司;UV-1800型紫外可见光分光光度计;多功能粉碎机;立式高压蒸汽灭菌锅;电热鼓风干燥箱。
1.3试验方法
1.3.1单因素试验
采取控制变量法对提取罗布麻黄酮的工艺进行单因素试验设计,分别考察液料比、提取温度、提取时间、乙醇浓度对罗布麻黄酮提取率的影响[7]。即控制乙醇浓度为70%,提取温度为70℃,提取时间为60min,在液料比为10ml/g、20ml/g、30ml/g、40ml/g、50ml/g的条件下测定黄酮提取率;控制乙醇浓度为70%,液料比为30ml/g,提取时间为60min,在提取温度为50℃、60℃、70℃、80℃、90℃的条件下测定黄酮提取率;控制乙醇浓度为70%,液料比为30ml/g,提取温度为70℃,在提取时间为40min、50min、60min、70min、80min的条件下测定黄酮提取率;控制液料比为30ml/g,提取温度为70℃,提取时间为60min,在乙醇浓度为50%、60%、70%、80%、90%条件下测定黄酮提取率。
1.3.2正交试验设计
通过L9(34)正交试验设计明确液料比,提取时间,乙醇浓度,提取温度等因素的最佳影响条件,优化罗布麻叶中黄酮的提取工艺[8]。
1.3.3响应面试验设计
在单因素试验基础上,依据Design-Expert8.0.6.1软件中的设计原理,选取提取时间(A)、提取温度(B)、乙醇浓度(C)、液料比(D)为四个考察因素,黄酮提取率(Y)为响应值,进行四因素三水平的响应面分析法分析得出罗布麻黄酮的最佳提取工艺条件[9]。
1.3.4.标准曲线的绘制
向50mL容量瓶中加入芦丁标准品5mg,加入几滴无水乙醇使其溶解,加入60%乙醇稀释至刻度得到0.1mg/ml的芦丁标准品溶液。取6支10mL的容量管,分别加入0、1.0、2.0、3.0、4.0、5.0ml上述0.1mg/mL的芦丁标准品溶液,每管再加入0.3mL的5%NaNO3溶液,摇匀后放置5min;加入0.3mL的10%A(lNO3)3溶液,摇匀后放置6min;再加入4mL4%NaOH溶液,蒸馏水稀释至10mL,摇匀静置15min。以第一管样品溶液为空白对照,在510nm波长处测吸光度,以吸光度对芦丁标准品溶液浓度作图,绘制芦丁标准曲线[10]。
2结果与分析
2.1罗布麻黄酮类化合物的粗提
将20.00g罗布麻粉末、600mL70%乙醇溶液加入到1000mL回流瓶中,即液料比选择30ml/g,乙醇回流提取1h后过滤杂质,同法进行提取3次[11],然后使用旋转蒸发仪合并提取液,得到浓缩液,将浓缩液水浴加热90℃直至叶绿素完全析出,过滤去除叶绿素沉淀,接着进行醇沉,即加入3倍体积的95%乙醇静置48h,过滤去除杂蛋白,再用旋转蒸发仪浓缩至浸膏,可得到4.86g黄酮类化合物粗提物,提取率为24.3%。
2.2标准曲线的绘制
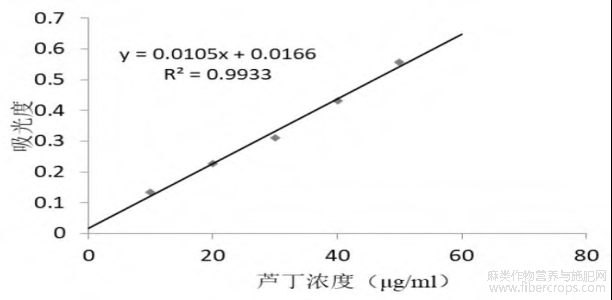
将芦丁标准曲线用最小二乘法作线性回归,回归方程为y=0.0105x+0.0166(R2=0.9933),经检验P<0.01。因此,该回归方程可适用于定量测定检验。
图1 芦丁标准曲线
2.3罗布麻粗提物黄酮的测定
向10mL的刻度试管中加入1.00mL过滤后的提取液。测定提取液吸光度为1.47,代入芦丁标准曲线中,得到提取液黄酮的浓度0.138mg/ml[12]。黄酮提取率=([提取液总黄酮质量浓度×样品提取液总体积)(/测定用提取液体积×原料质量×1000)]×100%。经计算后的浓度算出样品溶液中黄酮化合物的含量为67mg/g[13]。
2.4单因素试验分析
2.4.1乙醇浓度
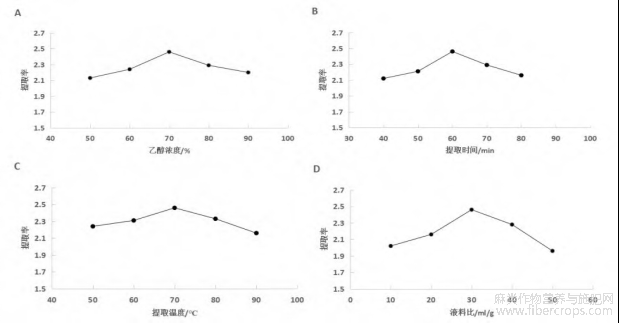
称取5份10g的罗布麻粉末,分别加入300ml不同浓度乙醇于回流装置内,70℃反应60min,结果如图2。由图2可知,当乙醇浓度高于70%后,黄酮提取率随乙醇浓度的升高而降低。因此本试验选取乙醇浓度为70%。
2.4.2提取时间
称取5份10g的罗布麻粉末,加入300ml70%的乙醇,在提取温度为70℃的条件下,提取不同时间,结果由图2。由图2可知,当提取时间超过60min后,黄酮提取率逐渐降低。因此本试验选取提取时间为60min。
2.4.3提取温度
称取5份10g的罗布麻粉末,加入300ml70%乙醇于回流装置中,在不同温度下提取60min,结果如图2。由图2可知,当提取温度高于70℃时,黄酮提取率呈现下降趋势。因此本试验选取提取温度为70℃。
2.4.4液料比
称取5份10g的罗布麻粉末,按不同料液比加入70%的乙醇于回流装置中,70℃下反应60min,结果如图2。由图2可知,当液料比超过30ml/g时,黄酮的提取率随液料比的增大而下降。因此本试验选取液料比为30ml/g。
A.不同乙醇浓度下的黄酮提取率;B.不同提取时间下的黄酮提取率;C.不同提取温度下的黄酮提取率;D.不同料液比下的黄酮提取率
图2 单因素实验结果
2.5正交试验设计结果
在单因素试验结果基础上,每个因素选择3个水平进行四因素三水平的L(934)正交试验,试验结果如表1。结果表明,各因素对试验结果的重要次序依次为液料比,乙醇浓度,提取温度,提取时间[14]。
表1 正交实验设计结果
|
处理 |
因素 |
黄酮提取率/% |
|||
|
提取时间 |
乙醇浓度 |
提取温度 |
液料比 |
||
|
1 |
1 |
1 |
1 |
1 |
20.83 |
|
2 |
2 |
2 |
2 |
1 |
20.38 |
|
3 |
3 |
3 |
3 |
1 |
18.17 |
|
4 |
3 |
2 |
1 |
2 |
23.35 |
|
5 |
1 |
3 |
2 |
2 |
20.85 |
|
6 |
2 |
1 |
3 |
2 |
23.31 |
|
7 |
2 |
3 |
1 |
3 |
19.12 |
|
8 |
3 |
1 |
2 |
3 |
18.44 |
|
9 |
1 |
2 |
3 |
3 |
18.97 |
|
K1 |
60.65 |
62.58 |
63.3 |
59.38 |
|
|
K2 |
62.66 |
62.7 |
59.67 |
67.51 |
|
|
K3 |
59.96 |
58.14 |
60.45 |
56.53 |
|
|
R |
2.7 |
4.44 |
3.66 |
10.98 |
|
2.6响应面试验设计结果
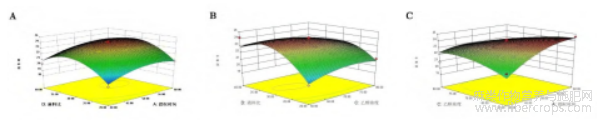
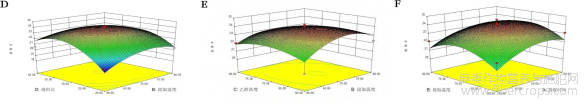
响应面实验设计结果如图3所示。由图3可看出,本试验中液料比对应的响应面图坡度较陡,对试验结果影响较大,因而可知在四个因素中液料比对黄酮提取率最显著[15]。各因素对罗布麻黄酮提取率的影响最大的是液料比,乙醇浓度次之,接着为提取温度,提取时间影响最小。由Design-Expert8.0.6.1软件预测的最佳提取条件为:提取时间60min,提取温度70℃,液料比30ml/g,乙醇浓度70%,此时罗布麻黄酮提取率为24.6%。
图3 两因素交互作用对黄酮提取率影响的响应面图
图3中,A为提取时间和液料比对黄酮提取率影响的响应面图;B为乙醇浓度和液料比对黄酮提取率影响的响应面图;C为提取时间和乙醇浓度对黄酮提取率影响的响应面图;D为提取温度和液料比对黄酮提取率影响的响应面图;E为乙醇浓度和提取温度对黄酮提取率影响响应面图;F为提取时间和提取温度对黄酮提取率影响的响应面图。
由以上结果可知,正交实验和响应面法优化的提取条件一致,按照工艺优化条件,进行重复性验证实验,测得总黄酮的最高提取率为24.6%,和相关研究结果相近[16],表明正交试验所得工艺条件可靠,所建立的回归模型具有良好的预测性,通过响应面得到的罗布麻黄酮成分提取最佳条件准确可靠[17]。
3结论
采用乙醇回流法提取罗布麻黄酮,在单因素试验基础上进行正交试验设计、响应面试验设计,对影响罗布麻黄酮提取率的四个因素即乙醇浓度、提取温度、提取时间、液料比进行对比研究,优化罗布麻黄酮提取工艺。综合以上因素得到的罗布麻黄酮最佳提取条件为:乙醇浓度70%,提取时间60min,提取温度70℃,液料比30ml/g,在此条件下罗布麻黄酮的提取率为24.6%。
参考文献
[1]周金辉.罗布麻叶多糖提取及其生物活性的研究[D].青岛大学,2020.
[2]杨永涛.罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D].华南理工大学,2018.
[3]陈超,王丹丹,程磊,等《.中华人民共和国药典》2020年版和国外药典的药包材标准体系概述[J].中国医药工业杂志,2021,52(2):267-271.
[4]Li X, Chen G, Zhang X, et al. A new class of flavonol-based anti-prostate cancer agents: Design,synthesis,andevaluationincellmodels[J].Bioorganic&MedicinalChemistryLetters,2016,26(17).
[5]ChaoHC,TsaiPF,LeeSC,etal.EffectsofMyricetin?ContainingEthanolSolutiononHigh?FatDietInducedObese Rats[J]. Journal of Food Science,2017,82(8).
[6]ToshiyukiN,MasanoriI,KazunoriO,etal.Improve?mentofmemoryrecallbyquercetininrodentcontextualfearconditioningandhumanearly-stageAlzheimer'sdis?easepatients.[J].Neuroreport,2016,27(9).
[7]戴富才,何新生,王刚,等.罗布麻中芦丁的分离纯化及表征[J].离子交换与吸附,2017,33(2):160-167.
[8]戴富才,赵娣,商文雨,等.正交法优化大孔树脂提纯罗布麻中总黄酮的工艺[J].离子交换与吸附,2016,32(2):174-184.
[9]郑思睿,杨婷,依木然·马瑞士,等.响应面法优化罗布麻多糖提取工艺及抗氧化活性研究[J].食品研究与开发,2018,39(16):93-97.
[10]张琳,陈雅思.紫花地丁总黄酮的抗氧化作用研究[J].粮食与食品工业,2021,28(1):55-58.
[11]王慧竹,王肃樊,邓博文,等.罗布麻生物活性成分及产品开发研究进展[J].吉林化工学院学报,2018,35(11):4-7.
[12]郑永红,韦晓瑜,龙继红.罗布麻叶中黄酮类成分研究进展[J].今日药学,2010,20(8):5-7.
[13]苏伟,万聆,简素平,等.桑叶总黄酮提取纯化工艺及抗氧化性研究[J].食品工业科技,2020,41(10):151-156.
[14]张意笠,胡培豪,黄真,等.小构树总黄酮提取工艺优化及其抗氧化、美白活性[J].中成药,2020,42(4):842-848.
[15]张意笠,程汝滨,黄真,等.响应面法优化结香花总黄酮提取工艺及其抗氧化活性[J].食品工业科技,2020,41(19):192-197.
[16]杨志,李文义,高云涛,等.响应面法优化针叶樱桃总黄酮的提取工艺及其抗氧化活性研究[J].浙江农业学报,2020,32(10):1866-1872.
[17]张意笠,程汝滨,黄真,等.响应面法优化结香花总黄酮提取工艺及其抗氧化活性[J].食品工业科技,2020,41(19):192-197.
文章摘自:周永萍,郑芝琳,朱月滢,王亚玲,郭晓农.响应面法和正交法优化罗布麻黄酮提取工艺[J].轻工科技2022年第38卷第3期。