摘 要:为了解析HcPGK基因的功能,本研究以红麻保持系花药为材料,克隆HcPGK基因,利用生物信息学对基因序列进行理化性质分析,并对该基因的表达模式进行检测。结果表明,HcPGK基因最大开放阅读框(ORF)为1203bp,编码400个氨基酸。生物信息学结果表明,PGK蛋白属于磷酸甘油激酶家族,其等电点为6.06,主要定位在叶绿体上;通过系统进化分析发现红麻和木槿的PGK蛋白序列在进化分支中关系密切。组织特异性表达结果表明,HcPGK基因在叶片中表达量最高,且显著高于根和叶,而该基因在红麻的根和茎中的表达量无显著差异。自激活实验分析表明,该基因不存在自激活现象,可用于酵母双杂交实验。本研究为解析HcPGK基因的功能提供一定的参考。
关键词:红麻;HcPGK基因;基因克隆;生物信息学分析
红麻(Hibiscus cannabinus L.)是锦葵科木槿属的一年生纤维作物,具有耐盐、抗旱和耐重金属等特性。红麻的茎秆和韧皮部纤维主要用于制作纸制品、建筑材料、牲畜饲料、吸附剂以及生物质能源等(Chen et al.,2019;Fan et al.,2019)。由于红麻具有巨大的发展潜力,全球的红麻纤维需求量巨大且每年在持续增长(刘正初,2007;孙进昌等,2010)。种植红麻不仅能充分利用劣地,在改善土壤和环境,减少水土流失,具有深远的环保意义,而且能够有效解决我国优质纤维原料的不足的问题(陈安国等,2011)。
磷酸甘油酸激酶(Phosphoglycerate kinase,PGK)是糖酵解途径(EMP)中的限速酶,对于生物体代谢具有重要作用(郭楠,2014)。在高等植物中主要有两类PGK,一种被定位于细胞溶质(cPGK),另一种定位于质体中(pPGK)。在糖酵解中,cPGK的主要功能是催化底物水平磷酸化产生ATP产生,而pPGK主要参与光合碳还原过程和叶绿体糖酵解过程(郭楠,2014)。无论是糖酵解糖异生还是光合作用(碳固定),磷酸甘油酸激酶催化的糖酵解反应都是将一个磷酸基从1,3-二磷酸甘油酸的酰基磷酸转移到ADP上,从而形成ATP和3-磷酸甘油酸(3-PGA)(Matsubara et al.,2011)。糖酵解过程中ATP的产生需要已糖激酶和磷酸甘油酸激酶的催化,PGK作为所需的两种酶之一,是一种典型的铰链弯曲酶(Szabo et al.,2008),具有与己糖激酶(HK)、磷酸果糖激酶(PFK)等代谢激酶类似的底物辅助结构域闭合机(Massange-Sanchez et al.,2020)。每个区域均由一个中心β层组成,中间夹着两个由一个灵活的螺旋铰接在一起的α螺旋层,它们闭合以实现催化作用(Zerrad et al.,2011;Zheng et al.,2012)。
PGK基因在不同植物中已被广泛研究,它们的功能差异很大。PGKc对维持拟南芥根内细胞的pH稳态至关重要(王晓国等,2021)。在拟南芥中发现了3个PGK基因,分别为At3g12780(AtPGK1)、At1g56190 (AtPGK2)、At1g79550(AtPGK3)(Massange et al.,2020)。AtPGK1仅在于光合组织的叶绿体中表达,AtPGK2在光合和非光合细胞的叶绿体/质体中表达,AtPGK3在胞质中表达。其中,高盐度可显著诱导AtPGK2,且AtPGK2的过表达转基因拟南芥增强了对盐胁迫的耐受性(Liu et al.,2015),AtPGK2突变体中会出现程序化细胞死亡(programmed cell death,PCD)的表型,并且随着植株的生长表现得越来越明显,最终无法开花结果(黄小贞等,2017)。植物 PGK可能参与蔗糖和淀粉间碳分配的调节等过程,也可参与日葵胚胎发育阶段的脂质合成进而导致含油量增加(Adrian Troncoso-Ponce et al.,2009)。PGK转基因油菜发育种子中含油量也显著提高(Tan et al.,2011)。PGK基因还可以调节植物生理代谢(Rosa et al.,2018)。在红麻中,目前只发现了一种PGK基因,其功能还未被研究过,有待深入研究。
本课题组前期对红麻细胞质雄性不育系P3A和及其保持系P3B的花药进行了转录组和蛋白质组学分析,发现HcPGK基因的相对表达量及其蛋白的乙酰化修饰水平在P3B中都显著高于P3A(Chen et al.,2019),推测HcPGK基因能在红麻细胞质雄性不育的发生过程中发生重要作用。为了解析HcPGK基因的功能,本研究克隆了红麻HcPGK基因的,并对其进行生物信息学分析,检测其在红麻各组织的表达量,旨在为研究红麻HcPGK基因的功能提供一定的参考。
1结果与分析
1.1红麻HcPGK基因的克隆
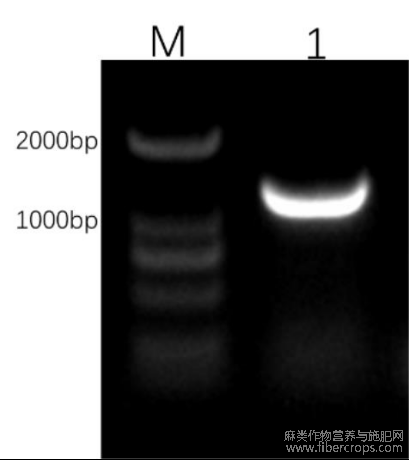
提取红麻保持系P3B花药中的总RNA,经反转录得到cDNA。以此为模板,HcPGK-F和HcPGK-R为上下游引物,进行PCR扩增,利用1%琼脂糖凝胶电泳检测扩增产物(图1)。测序结果显示HcPGK基因大小为1203bp,与预测分子量大小一致。红麻HcPGK基因号为Hc.13G000800.t1,最大开放阅读框(ORF)编码400个氨基酸(图2),该蛋白的结构域为最长ORF全长。
图1 红麻HcPGK基因扩增检测
图2 红麻HcPGK基因的预测蛋白序列分析
1.2红麻HcPGK基因的生物信息学分析
1.2.1红麻HcPGK蛋白理化性质分析及功能域预测
HcPGK蛋白含有400个氨基酸,预测相对分子量为42.35kDa,等电点为6.06。HcPGK蛋白的功能域预测结果如图3所示,HcPGK蛋白属于磷酸甘油激酶家族,其功能域预测结果如图3所示。利用网站对HcPGK蛋白进行预测,预测结果显示该蛋白定位在叶绿体上。
图3 红麻HcPGK蛋白功能域分析
1.2.2红麻HcPGK高级蛋白结构预测
利用sopma(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和expasys WISS模型(https://www.swissmodel.expasy.org/)预测了HcPGK蛋白质的二级(图4)和三级(图5)结构,结果表明,HcPGK蛋白多肽链中含有47.88%的α-螺旋,15.71%的延伸链,8.98%的β转角,27.43%的无规则卷曲。由于α-螺旋占比比较多,有利于PGK蛋白稳定发挥作用。
图4 红麻HcPGK蛋白的二级结构分析
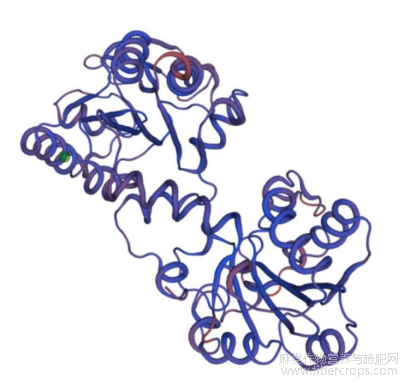
红麻HcPGK蛋白的三级结构预测如图5所示,同源建模的模板来自嗜热脂肪芽孢杆菌的3-磷酸甘油酸激酶ADP复合物的3-磷酸甘油酸激酶,序列标识度为60.57%,置信度为0.85,因此,预测结果比较可信。
图5 红麻HcPGK蛋白的三级结构分析
1.2.3红麻HcPGK氨基酸同源性分析及进化树构建
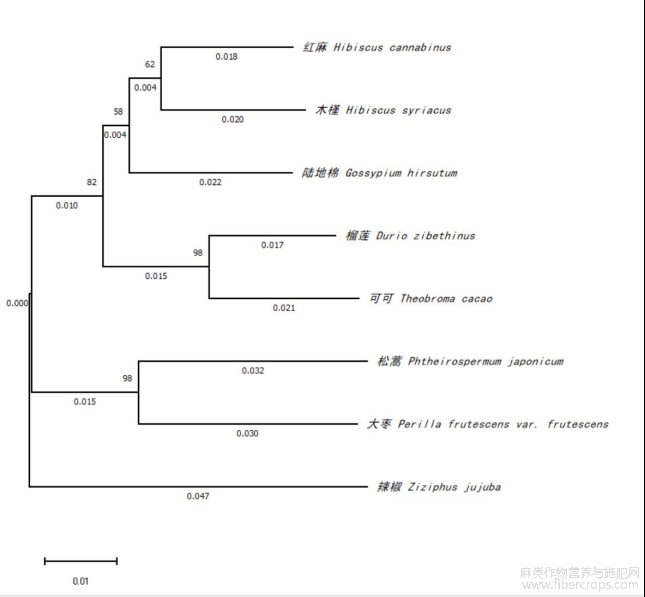
利用BlastP对HcPGK的氨基酸序列进行比较,筛选出同源性较高的序列(图6)。经过DNAMAN比对后,采用MEGA7.0软件构建进化树。结果表明,红麻和木槿的PGK蛋白序列在进化分支中关系密切(图7)。
图6 红麻与其他植物的HcPGK氨基酸序列多重比对
图7 不同植物中PGK的系统进化树
1.3红麻HcPGK基因基因组织特异性表达分析
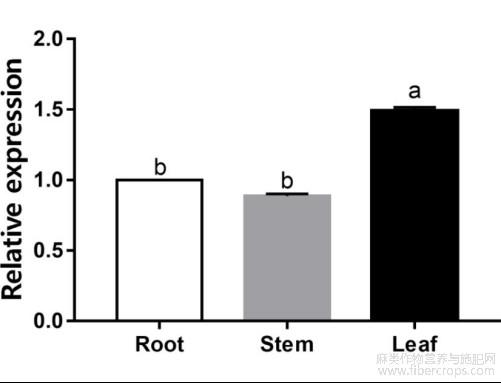
对红麻幼苗时期的根、茎、叶部位进行荧光定量PCR分析,结果表明,HcPGK在根和茎的的表达量几乎一致,在叶中的表达量最高,显著高于根和茎(图8)。
图8 红麻各组织中HcPGK相对表达水平定量分析
注:不同小写字母表示之间差异显著(P<0.05)
1.4重组质粒pGBKT7-HcPGK的自激活效应检测
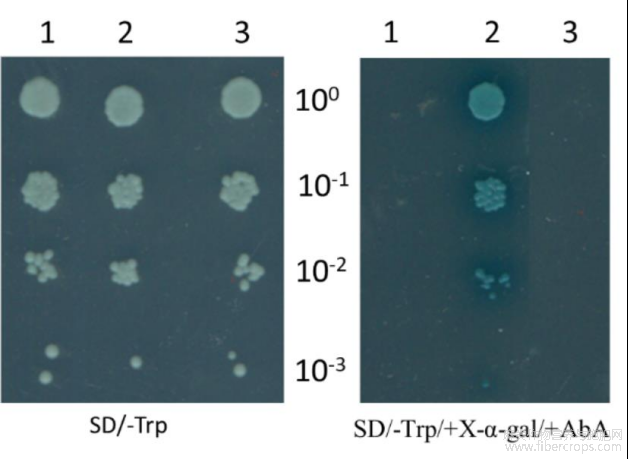
将重组质粒pGBKT7-HcPGK、PGBKT7空载质粒以及PGBKT7-53和PGADT7-T(阳性对照)转化酵母Y2HGold感受细胞点板后发现,它们均能在SD/-Trp板上生长,但是只有阳性对照PGBKT7-53和PGADT7-T能在SD/-Trp/+X-α-gal/+AbA平板上生长,且菌落为蓝色,因此,重组质粒pGBKT7-HcPGK不存在自激活效应(图9)。后续可用酵母双杂技术筛选与HcPGK蛋白互作的蛋白。
图9 HcPGK的转录自激活检测
注:1:PGBKT7;2:阳性对照PGBKT7-53和PGADT7-T;3:pGBKT7-HcPGK
2讨论
PGK都包含有Phosphoglycerate kinase结构域(郭楠,2014),本研究克隆了HcPGK基因,并通过生物信息学分析对其进行分析和预测。HcPGK基因cDNA全长为1203bp,编码400个氨基酸,其编码蛋白的分子量为42.35kD,等电点为6.06,属于磷酸甘油激酶家族,与其他物种的PGK蛋白的氨基酸序列高度相似。
在高等植物中,PGK基因主要参与光合碳还原和叶绿体糖酵解过程(郭楠,2014)。在烟草、甘蓝型油菜和拟南芥中,PGK基因在不同组织中存在差异表达(郭楠,2014;Huang et al.,2017)。本研究发现HcPGK基因在根和茎中的表达量较低且无显著差异,但是在叶中的表达量较高,说明HcPGK在红麻中的表达也具有一定的组织特异性。此外,亚细胞定位预测HcPGK蛋白表达位置于叶绿体中,这与ZmPgk4蛋白在玉米中的定位位置一致(Massange et al.,2020),而PGK蛋白能催化ATP的产生,故推测这与HcPGK基因在叶绿体基质中参与的光合碳循环的原因有关(郭楠,2014;Massange et al.,2020)。HcPGK基因不会发生转录自激活现象,因而在红麻体内只有特定条件下才能发挥作用,符合酶的特性。
蛋白质乙酰化修饰是在乙酰基转移酶的作用下发生的一种可逆的蛋白翻译后修饰,可以通过改变蛋白的理化性质和构象,从而调控蛋白的结合能力与功能(Choudhary et al.,2009;Kahn,1995)。本课题组前期发现花药中HcPGK基因的相对表达量及其蛋白的乙酰化修饰水平在保持系P3B中都显著高于不育系P3A,说明PGK蛋白乙酰化修饰可能影响了红麻雄性不育的发生。据报道甘蓝型油菜中,BnPGK在保持系中花蕾的表达量显著高于不育系,这可能与雄性不育系花蕾败育有关(郭楠,2014)。因此推测在红麻中蛋白乙酰化修饰对研究HcPGK基因的表达调控以及调控PGK酶活性导致细胞质雄性不育的形成具有重要作用。本研究发现HcPGK没有自激活效应,为利用酵母双杂技术等技术寻找与HcPGK相互作用蛋白并进行较为深入的分子实验研究奠定了基础。
本研究仅做了HcPGK基因在红麻不育系P3B的根茎叶的特异性表达分析,为了研究蛋白乙酰化修饰是否对PGK蛋白功能产生影响以及是否与细胞质雄性不育有关,下一步将收集红麻不育系P3A和保持系p3B的败育期花药,并检测HcPGK基因在这两系中的表达情况,再对其进行不育机理的研究,这些后续的研究具有重要的意义。
3材料与方法
3.1材料
本试验所用红麻材料为红麻保持系P3B,红麻植株种植于广西大学试验田,种植期间进行常规的田间管理。
3.2红麻总RNA提取与第一链cDNA的合成
使用RNA提取试剂盒(Vazyme,RC101)提取P3B的总RNA。用1.0%琼脂糖凝胶电泳检测RNA的完整性,并用NanoDrop ND-100(凯乐博(北京)科技发展有限公司)检测RNA的浓度和纯度。使用诺唯赞反转录试剂盒(R312-01)合成第一链cDNA,并置于-20℃保存备用。
3.3红麻HcPGK基因的扩增
根据红麻转录组的序列,利用Primer Premier5.0软件设计扩增HcPGK全长的特异性引物(表1),以P3B花药cDNA为模板,采用高保真Mix(Vazyme,P520)进行扩增,反应体系参照P520说明书,退火温度为58度,扩增产物电泳后切胶回收。
3.4红麻HcPGK基因的克隆载体构建
将PCR胶回收产物连接到pEASY-Blunt克隆载体上,体系为5μL,25℃反应10min,之后将连接产物转化大肠杆菌DH5α,37℃培养14h,挑取单克隆在液体LB中扩繁,6h后进行PCR鉴定,使用引物为载体上的引物M13F/R(表1),将有目的条带的菌液送往华大公司进行测序,使用DNAMA比对测序结果,将结果正确的菌液加50%甘油,于-20℃保存。
3.5红麻HcPGK基因的生物信息学分析
把目的基因序列提交到NCBI网站进行基因结构预测,进行DNAMAN软序列比对,利用Mega7软件邻居连接(neighbor joining,NJ)构建进化树。利用ExPASY在线工具分析蛋白的分子量和等电点。利用在线网站对蛋白质的跨膜结构、信号和亲水性多肽进行分析。利用sopma网站和expasys WISS模型预测蛋白质的二级和三级结构结果。在http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/网站对HcPGK进行亚细胞定位预测。
3.6红麻HcPGK基因不同组织表达模式分析
分别取红麻幼苗时期的根、茎、叶,用试剂盒提取总RNA,反转录获得cDNA。根据基因的全长ORF序列设计引物荧光定量PCR引物(表1),以红麻Histone3为内参基因,利用2-ΔΔCT 法(Li et al.,2021)计算目的基因的相对表达量。
3.7pGBKT7-HcPGK的构建
根据HcPGK编码序列设计带有pGBKT7载体序列信息引物HcPGK- pGBKT7 (表1),以重组质粒HcPGK-blunt载体为模板,PCR扩增得到含有pGBKT7载体同源臂的目的序列,用限制性内切酶EcoRⅠ单酶切pGBKT7空载体,胶回收目的序列和线性化载体,用同源重组法将其连接,转化大肠杆菌DH5α,挑选单克隆,进行PCR鉴定,将有条带的菌液送往华大公司测序,将测序正确的菌液扩繁,提质粒,-20℃保存。
3.8重组质粒pGBKT7-HcPGK自激活效应检测
将重组质粒pGBKT7-HcPGK、PGBKT7空载质粒以及PGBKT7-53和PGADT7-T(阳性对照)转化酵母Y2HGold感受细胞。将转化得到的单克隆酵母进行菌液PCR鉴定,将正确的菌液分别稀释1、100、1000倍,取2μL点样在SD/-Trp/+X-α-gal/+AbA平板上,30℃培养3~5d。
表1 实验所用引物
|
引物名称 Primer name |
引物序列(5'-3') Primer sequence(5'-3') |
功能 Function |
|
HcPGK-F |
ATGGCTACAAAGAAGAGCGTCG |
基因克隆 Gene clone |
|
|
TGCGTCATCAAGAGCAAGGAC |
|
|
PGK-qPCR-F |
TGTGGCAAATCCCAAGAAGC |
荧光定量 qPCR |
|
PGK-qPCR-R |
GGCAGCAAGAGAGAGACCCCT |
|
|
HcPGK- pGBKT7-F HcPGK- pGBKT7-R M13F M13R H3 (Histone3)-F H3 (Histone3)-R |
ATATGGCCATGGAGGCCGAATTCATGGCTACAAAGAAGAGCGTCG GTCGACGGATCCCCGGGAATTCTGCGTCATCAAGAGCAAGGAC GAGCGGATAACAATTTCACACAGG CGCCAGGGTTTTCCCAGTCACGAC GTGGAGTCAAGAAGCCTCACAG ATGGCTCTGGAAACGCAAA |
载体构建 vector construction PCR检测 PCR test 荧光定量 qPCR |
参考文献
[1]Adrian Troncoso-Ponce M.,Kruger N J.,Ratcliffe G.,Garces R,and Martinez-Force E.,2009,Characterization of glycolytic initial metabolites and enzyme activities in developing sunflower(Helianthus annuus L.)seeds,Phytochemistry.,70(9):1117-1122.
[2]Bringloe D H.,Rao S K.,Dyer T A.,Raines C A,and Bradbeer J W.,1996,Differential gene expression of chloroplast and cytosolic phosphoglycerate kinase in tobacco.,Plant Molecular Biology,30(3):637-640.
[3]Chen A.G.,Li D.F.,Li J.J.,and Tang H.J.,2011,To Develop “Low-Carbon Economy”,Kenaf is Highly Promising.,Zhongguo Maye Kexue(Plant Fiber Sciences in China),33(1):5.(陈安国,李德芳,李建军,唐慧娟,2011,发展"低碳经济",红麻大有可为,中国麻业科学,33(1):5.)
[4]Chen P.,Wei F.,Li R.,Li Z Q.,Kashif M H,and Zhou R Y.,2019,Comparative acetylomic analysis reveals differentially acetylated proteins regulating anther and pollen development in kenaf cytoplasmic male sterility line.,Physiologia Plantarum,166(4):960-978.
[5]Choudhary C.,Kumar C.,Gnad F.,Nielsen M L.,Rehman M.,Walther T C.,Olsen J V,and Mann M.,2009,Lysine Acetylation Targets Protein Complexes and Co-Regulates Major Cellular Functions.,Science,325(5942):834-840.
[6]Fan W.,Danfeng T.,Zengqiang L.,Haneef K M.,Aziz K.,Hai L.,Ruixing J,and Peng C.,2019,Molecular cloning and subcellular localization of six HDACs and their roles in response to salt and drought stress in kenaf (Hibiscus cannabinus L.).,Biological research,52(1).
[7]Guo N.,Zhao J.,Gao T.,Bai R.,Huang X.,Lu J.,and Zhang T.,2014,Cloning and Expression Analysis of PGK Gene in Brassica napus.,Xibei Zhiwu Xuebao (Acta Botanica Boreali-Occidentalia Sinica),34(11):2188-2193.(郭楠,赵敬会,高天姝,白瑞英,黄兴琳,陆俊杏,张涛,2014,甘蓝型油菜PGK基因的克隆与表达分析,西北植物学报,34(11):6)
[8]Huang X.Z.,Zhao D.C.,2017,Functional analysis of PGK gene family in Arabidopsis.,Shandi Nongye Shengwu Xuebao(Journal of Mountain Agriculture and Biology)36(1):7.(黄小贞,赵懿琛,2017,拟南芥PGK基因家族功能的初步分析,山地农业生物学报,36(1):7.)
[9]Kahn P.,1995,Molecular Biology:From Genome to Proteome:Looking at a Cell's Proteins.,Science,270 (5235) ,pp.369-370
[10]Liu D.,Li W.,Cheng J,and Hou L.,2015,AtPGK2,a member of PGKs gene family in Arabidopsis,has a positive role in salt stress tolerance.,Plant Cell Tissue & Organ Culture,120(1):251-262.
[11]Li Z.,Hu Y.,Chang M.,Kashif M.H.,Tang M.,Luo D.,Cao S.,Lu H.,Zhang W.,Huang Z.,Yue J.,and Chen P.,2021,5-azacytidine pre-treatment alters DNA methylation levels and induces genes responsive to salt stress in kenaf (Hibiscus cannabinus L.).,Chemosphere,271.
[12]Liu Z.C.,2007.,Foreground Analysis of Herbaceous Fiber Industry with Scientific Development View in China.,Zhongguo Maye Kexue (Plant Fiber Sciences in China),29(2):4.(刘正初,2007,用科学发展观看我国草本纤维产业前景,中国麻业科学,29(2):4.)
[13]Massange-Sanchez J A.,Casados-Vazquez L E.,Juarez-Colunga S.,Sawers R J H,and Tiessen A.,2020,The Phosphoglycerate Kinase (PGK) Gene Family of Maize (Zea mays var.B73).,Plants-Basel,9(12).
[14]Matsubara K.,Yokooji Y.,Atomi H,and Imanaka T.,2011,Biochemical and genetic characterization of the three metabolic routes in Thermococcus kodakarensis linking glyceraldehyde 3-phosphate and 3-phosphoglycerate.,Molecular Microbiology,81(5):1300-1312.
[15]Rosa-Tellez S.,Djoro Anoman A.,Flores-Tornero M.,Toujani W.,Alseek S.,Fernie A R.,Nebauer S G.,Munoz-Bertomeu J.,Segura J,and Ros R.,2018,Phosphoglycerate Kinases Are Co-Regulated to Adjust Metabolism and to Optimize Growth.,Plant Physiology,176(2):1182-1198.
[16]Sun J.C.,Peng Y..D.,and Pi S.,2010,Study on the Use and Development Prospect of Bast Fiber Crops.,Nongchanpin Jiagong ·Xuekan (Academic Periodical of Farm Products Processing),(3):3.(孙进昌,彭源德,皮珊,2010,麻类作物的用途及发展前景,农产品加工学刊,(3):3)
[17]Szabo J.,Varga A.,Flachner B.,Konarev P V.,Svergun D I.,Zavodszky P,and Vas M.,2008,Communication between the nucleotide site and the main molecular hinge of 3-phosphoglycerate kinase.,Biochemistry,47(26):6735-6744.
[18]Tan H.,Yang X.,Zhang F.,Zheng X.,Qu C.,Mu J.,Fu F.,Li J.,Guan R.,Zhang H.,Wang G,and Zuo J.,2011,Enhanced Seed Oil Production in Canola by Conditional Expression of Brassica napus LEAFY COTYLEDON1 and LEC1-LIKE in Developing Seeds.,Plant Physiology,156(3):1577-1588.
[19]Wang X,G.,Gong P,P.,Li S ,N.,Chen W.,Li R ,Z.,Bian J,H.,Wang W,F.,Guan Y,F.,2021,Cytosolic phosphoglycerate kinase (PGKc) plays a role in regulating intracellular pH homeostasis in Arabidopsis thaliana.,Zhiwu Shengli Xuebao(Plant Physiology Journal),57(10):8.(王晓国,龚萍萍,厉苏宁,陈伟,李瑞姿,卞江虎,王文斐,关跃峰,2021,拟南芥胞质磷酸甘油酸激酶(PGKc)对细胞pH稳态平衡的影响,植物生理学报,57(10):8.)
[20]Zerrad L.,Merli A.,Schroeder G F.,Varga A.,Graczer E.,Pernot P.,Round A.,Vas M,and Bowler M.W.,2011,A Spring-loaded Release Mechanism Regulates Domain Movement and Catalysis in Phosphoglycerate Kinase.,Journal of Biological Chemistry,286(16):14040-14048.
[21]Zheng H.,Filippova E V.,Tkaczuk K L.,Dworzynski P.,Chruszcz M.,Porebski P J.,Wawrzak Z.,Onopriyenko O.,Kudritska M.,Grimshaw S.,Savchenko A.,Anderson W F.,and Minor W.,2012,Crystal structures of putative phosphoglycerate kinases fromB.Anthracis and C.jejuni.,Journal of structural and functional genomics,13(1):15-26.
文章摘自:黄震,吴启境,陈灿妮,罗登杰,潘姣,廖长君,李赟,陈鹏.红麻磷酸甘油激酶基因(HcPGK)的克隆及生物信息学分析[J/OL].分子植物育种:1-14[2022-07-11].