摘 要:建立了测定橄榄油?猪肉?面包等食品中包括合成大麻在内的9种大麻素的气相色谱-质谱(GC-MS)分析方法?样品经甲醇和乙腈提取,固相萃取净化,以毛细管色谱柱HP-5MS(30m×0.25mm×0.25µm)分离,使用电子轰击电离(EI)源检测,SIM模式质谱监测,外标法定量?结果表明,该方法在0~500.0μg/L浓度范围内有良好的线性关系,相关系数(r2)均大于0.9992?方法的检出限(LOD,S/N=3)和定量限(LOQ,S/N=10)分别为1μg/kg~15μg/kg和2.5μg/kg~50μg/kg?对不同样品基质进行1?2和10倍定量限3个水平的加标回收试验,9种大麻素化合物的回收率为65.2%~117.9%,相对标准偏差(RSD,n=6)为2.0%~12.7%?该方法灵敏度高?检测速度快?适用性强,对发现和控制我国食品中大麻素类物质的残留?制定检测标准和采取相应的管理措施具有理论和现实意义?
关键词:大麻素;合成大麻;食品;气相色谱-质谱(GC-MS)
大麻素是大麻植物中天然含有的一类萜酚类化合物[1],其中的Δ9-四氢大麻酚(Δ9-Tetrahydrocannabinol,Δ9-THC)具有较强的精神活性和致幻成瘾作用,被《麻醉品单一公约》[2]?《精神药物公约》[3]和《联合国禁止非法贩运麻醉药品和精神药物公约》[4]等国际公约列为国际管制的毒品?合成大麻素(SyntheticCannabinoids,SCs)是一类药理?生理作用与Δ9-THC相似的化合物,最初由科学家以治疗疾病的目的发明出来,但最终因其具有精神活性而被滥用[5],因其在实验室内就能够人工合成,因此也被称为“策划药”或“实验室毒品”,吸食成瘾的效果是天然大麻的4~5倍[6],现已成为使用量最大的新精神活性物质种类[7]?近年来,国际上对大麻管控的态度有所变化,大麻合法化运动在部分国家迅速蔓延,澳大利来?新西兰?智利?哥伦比亚?德国等12个国家和美国的32个州(特区)对医用大麻合法化,乌拉圭?加拿大和美国的12个州(特区)还对娱乐性大麻全面合法化[8],世界卫生组织也在2018年向联合国麻醉药品委员会提出解除对低THC含量的大麻及产品的列管的建议[9]?但我国和世界上其他国家对大麻制品,特别是合成大麻素都采取严格管控的措施,我国《麻醉药品品种目录》?《精神药品品种目录》[10]?《非药用麻醉药品和精神药品管制品种增补目录》[11]和历次增补公告[12-13]中,先后将48种合成大麻素和7种合成大麻素化学结构通式列为管制品?但不法分子为逃避打击,不断修改化合物的结构从而开发出新种类的合成大麻素,目前已从第一代的萘甲酰基吲哚类发展至第八代的吲哚酰胺类[14-15]?不仅如此,不法分子还将大麻素喷洒在香料或药草上晾干,以减少被识别的概率,甚至还伪装成奶茶?咖啡?饼干?开心果?饮料?酒或糖果等各种食品[16-19],具有极强的隐蔽性和社会危害性?
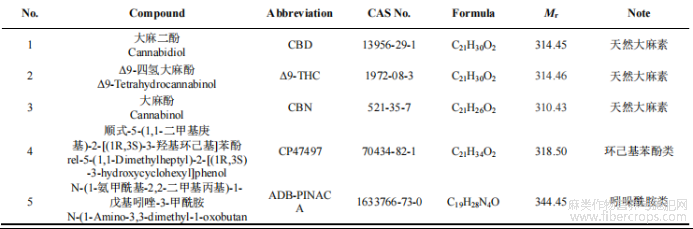
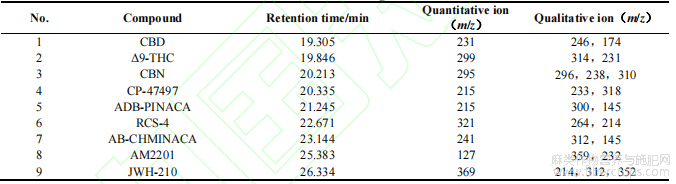
当前检测大麻素方法的大多针对毛发[20-21]?血液[22-23]?尿液[24-25]和疑似毒品[26-27]等基体,涉及食品基质的研究往往集中在四氢大麻酚?大麻二酚和大麻酚等天然大麻素上[28-30],或是对少数特定食品中的合成大麻素[31-32],研究的结构种类也较少,无法满足当前已出现在多种食品中非法添加合成大麻素的现状?本研究结合已公布的非法添加报道,选择猪肉?牛奶?橄榄油?蜂蜜?面包?茶叶?大豆?可乐饮料和啤酒等有代表性的食品基质,以9种常见的大麻素为分析对象,结构上涵盖了天然大麻素和萘甲酰基吲哚?环己基苯酚?苯酰基吲哚和吲哚酰胺类等多种类型的合成大麻素(详见表1),优化了操作条件,建立了适用于多种食品基质中大麻素的固相萃取-气相色谱质谱分析方法?
表1 9种大麻素英文全称?简称?分子式?相对分子质量及CAS号
1材料与方法
1.1材料与试剂
Δ9-THC?CBN?CBD?JWH-210?CP47497?AM-2201?RCS-4?AB-CHMINACA和ADB-PINACA标准溶液(含量均为1mg/mL)天津阿尔塔公司;甲醇?乙腈(色谱纯)德国Merck公司;CaptivaEMR-Lipid固相萃取柱(100mg,3mL)美国Agilent公司;HLB固相萃取柱(60mg,3mL)美国Waters公司;其他试剂均为国产分析纯或优级纯;实验用水符合GB/T6682-2008《分析实验室用水规格和试验方法》中规定的一级水?
橄榄油?猪肉?牛奶?蜂蜜?面包?茶叶?大豆?可乐和啤酒均购自超市?火麻仁?火麻籽?火麻茶?火麻糊?火麻油?火麻膏和火麻粉均购自广西火麻食品专卖店?
1.2仪器与设备
Trace1300/ISQ7000 型气相色谱质谱联用仪美国Thermo 公司;3-18K 高速离心机德国Sigma公司?
1.3标准溶液的配制
混合标准溶液:移取适量9种大麻素标准溶液,用甲醇稀释配制成1.0μg/mL的混合标准工作液,于-20℃避光保存?
基质标准曲线:选择与被测样品性质相同或相似的空白样品按照1.4进行前处理,得到空白基质溶液?精确吸取一定量的混合标准溶液,用空白基质溶液逐级稀释成质量浓度为0.002 mg/L?0.005 mg/L?0.01 mg/L?0.02 mg/L?0.05 mg/L?0.1 mg/L?0.2 mg/L和0.5 mg/L的基质标准曲线?
1.4样品前处理
1.4.1样品提取
橄榄油:称样1.00g(精确至0.01g)于50mL离心管中,加入10mL乙腈,涡旋混匀30s,50℃下超声提取15min,10000r/min离心5min,取5mL上清液待净化?
大豆?猪肉?面包?蜂蜜?茶叶:称样1.00g(精确至0.01g)于50mL离心管中,加入10mL甲醇,涡旋混匀30s,50℃下超声提取15min,10000r/min离心5min,取5mL上清液,加5mL水稀释后涡旋混匀,10000r/min离心5min,取全部上清液待净化?
牛奶:称样1.00g(精确至0.01g)于50mL离心管中,加入5g氯化钠和10mL甲醇,涡旋混匀30s,50℃下超声提取15min,再加入1g三氯乙酸,静置15min~20min沉淀蛋白质后,10000r/min离心5min,取5mL上清液,加5mL水稀释后涡旋混匀,10000r/min离心5min,取全部上清液待净化?
可乐?啤酒:称样1.00g(精确至0.01g)于50mL离心管中,加入5g氯化钠和10mL甲醇,涡旋混匀30s,50℃下超声提取15min,10000r/min离心5min,取5mL上清液,加5mL水稀释后涡旋混匀后待净化?
1.4.2样品净化
橄榄油:将待净化液转移至事先用2mL乙腈活化过的EMR固相萃取小柱中,待其自然重力流出后,用5mL乙腈淋洗小柱,减压抽干30s?上样和洗脱流速均应小于1mL/min?收集全部流出液,在40℃下氮吹至干,加入1mL甲醇溶液,涡旋混匀30s,超声3min,过0.22μm滤膜后待测定?
其他试样:将待净化液转移至事先用5mL甲醇和5mL水活化过的HLB固相萃取小柱中,待其自然重力流出后,用5mL50%甲醇水溶液淋洗小柱,弃去全部淋洗液并减压抽干30s,用5mL乙腈洗脱小柱?上样和洗脱流速均应小于1mL/min?收集全部洗脱液,在40℃下氮吹至干,加入1mL甲醇溶液,涡旋混匀30s,超声3min,过0.22μm滤膜后待测定?
1.5分析方法
1.5.1色谱条件
色谱柱:HP-5MS毛细管柱(30m×0.25mm×0.25µm);进样口温度290℃;进样量1.0μL;进样方式:不分流进样;载气:高纯氦气(99.999%);流速:恒定流量1.5mL/min;升温程序:初始70℃,保持2min,以10℃/min升至180℃,再以15℃/min升至300℃,保持9min?
1.5.2质谱条件
电子轰击电离(electronionization,EI源);电离能量:70eV;离子源温度:310℃;传输线温度:290℃;溶剂延迟时间:7.5min;检测方式:选择离子监测(SIM)?
2结果与分析
2.1色谱条件优化
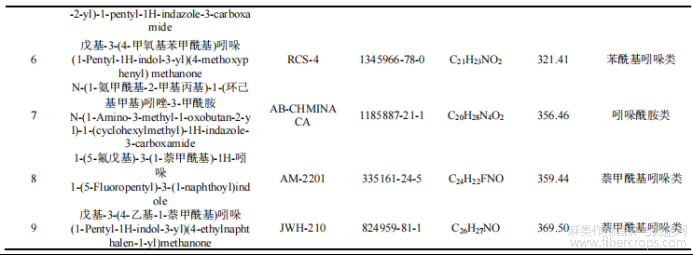
大麻素主要为非极性和弱极性化合物,本试验比较了中等极性的DB-17MS色谱柱和非极性的HP-5MS色谱柱测定9种大麻化合物的效果?结果表明,两种色谱柱均可实现9种大麻的全部分离,但除JWH-210外,使用HP-5MS色谱柱测定的峰面积均高于DB-17MS,平均峰面积为后者的1.8倍?这可能HP-5MS色谱柱固定相对分离的目标物具有选择宽泛的特点,对非极性和弱极性化合物的分离效果更佳?考虑到同时分析多种目标物的需要,本实验使用HP-5MS色谱柱进行测定,选择离子流色谱图见图1?
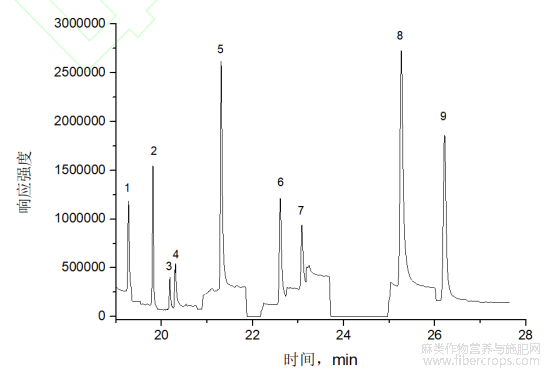
本实验考察了250℃~310℃进样口温度下9种大麻化合物峰面积情况,结果见图2?从图中可以看出,随着进样口温度的升高,9种大麻化合物的峰面积呈现整体上升,在290℃~300℃达到最高?为进一步明确最佳的进样口温度,在290℃和300℃的进样口温度下分别连续进样6次,比较进样精密度的影响,结果显示,290℃进样口温度下的峰面积RSD在2.5%~5.8%,300℃进样口温度下的峰面积RSD为1.8%~11.2%,为此,本实验选择290℃的进样口温度作为实验条件?
图1 9种大麻标准品的选择离子流色谱图(20倍定量限浓度)
图2 不同进样口温度下的峰面积
2.2质谱条件优化
比较了GC-MS的全扫描(SCAN)和选择离子监测(SIM)模式同时分析9种大麻素的情况?先用单级质谱的SCAN方式获得9种目标物的总离子流色谱图,确定每种化合物的保留时间,再用SIM方式建立5组多通道时间段,每个时间段内扫描1~3个化合物,每种化合物选择定量离子1个,定性离子2~3个,得到9种大麻化合物的离子信息,详见表2?
表2 9种大麻素的保留时间和监测离子
2.3提取条件的优化
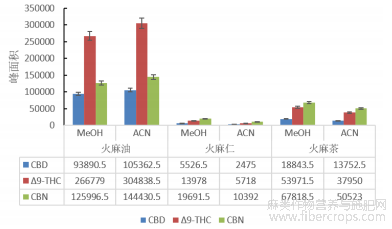
本试验考察了甲醇和乙腈这两种文献中[22-28]检测大麻最常用的提取溶剂,使用空白样品加标的方式比较两种溶剂对大麻素的提取效果,结果表明,两种溶液均有较好的提取效果,橄榄油基质中乙腈对各种大麻素的平均提取回收率为93.7%,高于甲醇提取时的85.0%,而其他基质中甲醇对各目标物的提取回收率均大于90%,高于乙腈的74.3%?为验证这一结论,本实验还使用天然含有Δ9-THC?CBD?CBN的火麻油?火麻仁和火麻茶样品,用峰面积比较两种溶剂的提取效果,详见图3?从图中可以看中,实际样品中的提取效果与试验时的一致,因此本试验选用乙腈作为油脂类样品的提取溶剂,用甲醇作为其他样品的提取溶剂?
图3 不同提取溶剂对火麻油、火麻仁和火麻茶的提取效果比较
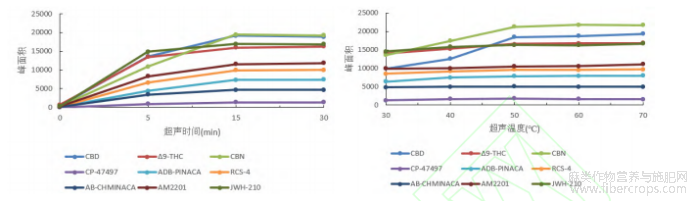
本试验还比较了涡旋提取、均质提取和超声提取等方式的提取效率,图4结果表明,在相同的提取时间下,超声方式对各种大麻素的提取效率均高于90%,优于涡旋振荡和均质提取的效率。继续对超声提取的时间和温度进行优化的结果表明,超声温度对各大麻素的影响差别不大,整体上当超声温度高于50℃时,峰面积趋于稳定,当超声时间大于15min时,目标物的峰面积基本不再增加。因此,本试验使用乙腈作为油脂类样品的提取溶剂,用甲醇作为其他类别样品的提取溶剂,并在50℃下超声提取15min进行提取。
图4 不同超声时间和超声温度对提取效果的影响
2.4净化方法的优化
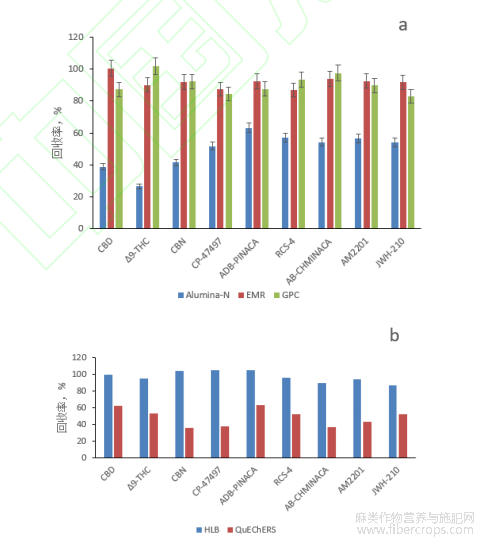
根据基质的特点和目标物的结构特性,参考相关文献,本实验使用空白样品加标的方式,对橄榄油样品比较了中性氧化铝小柱(Alumina-A)[34]、CaptiveEMR-Lipid小柱和凝胶渗透色谱(GPC)[35]净化方法。对其他基质样品比较了二乙烯苯-N-乙烯基吡咯烷酮(HLB)固相萃取和QuEChERS(PSA+C18+柠檬酸钠+柠檬酸二钠)基质分散萃取净化方法[29-32],平均回收率的结果见图5。
图5 不同净化方式对橄榄油样品(a)和其他基质样品(b)的净化效果
从图5可以看出,对于油类基质样品,中性氧化铝小柱回收率一般,EMR小柱和GPC净化方法都能取得较好的回收率,但GPC净化操作繁琐,耗时长,且需额外增加凝胶渗透色谱仪设备,故选择EMR固相萃取小柱净化方法。其他基质的样品中,HLB小柱的回收率优于QuEChERS方法,因此,本试验选择EMR、HLB小柱分别作为油类和其他基质样品的净化小柱。在此基础上,本试验进一步比较了BIOSIL、RayCure、Agela、BESEP等多个不同品牌小柱和10%、20%、50%甲醇水/乙腈水作为淋洗液和洗脱液时的情况,并结合基质效应影响的评估方法,试验了3mL~7mL不同淋洗液体积的效果,实验结果表明,使用5mL乙腈淋洗CaptivaEMR-Lipid小柱和使用5mL50%甲醇水溶液洗脱OasisHLB小柱时,能达到较好的回收率和净化效果。
2.5内外标法选择
本试验比较了外标法和内标法在定量上的差别。当使用外标法定量时,在各目标物1、2、10倍定量限三个添加浓度水平的平均回收率为65.2%~117.9%。当使用Δ9-THC-d3(C21H27d3O2,天津阿尔塔公司)作为内标定量时,各目标物的平均回收率为80.1%~142.7%,回收率普遍偏高。这可能是由于各种大麻素在结构和性质上存在差别,而只使用一种Δ9-THC的同位素内标时,无法同时对多种大麻素进行结果校正所致。由于很难获得每种大麻素的同位素内标,外标法回收率的结果效果令人满意,因此本试验最终采用外标法定量分析。
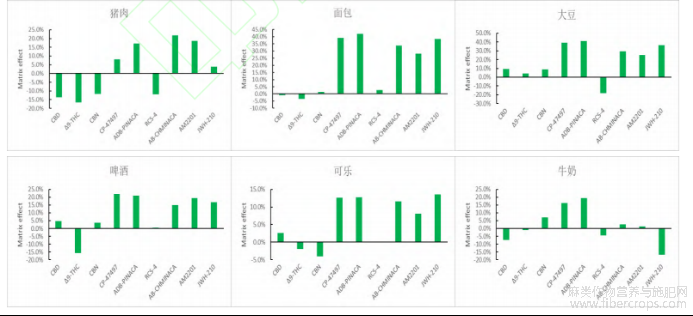
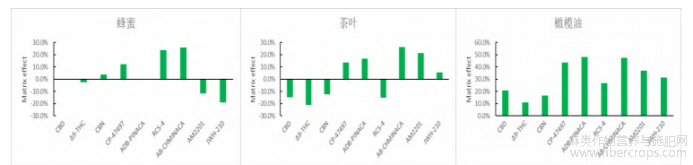
2.6基质效应考察
GC-MS分析时,由于待测成分的离子化效应被改变,从而导致目标化合物发生离子增强或抑制现象。本试验涉及的食品基质较多,不同基质对目标物会产生不同的基质效应(ME),本文参考GonzalezO等人[35]的方法,使用甲醇配制的标准曲线斜率(SlopeA)和用空白基质配制的相同浓度标准曲线斜率(SlopeB)进行比较,按基质效应(ME)=(SlopeB-SlopeA)/SlopeA×100%的公式计算各种样品的基质效应,且当|ME|<20%时为弱基质效应,当20%<|ME|<50%时为中等强度基质效应,|ME|>50%时为强基质效应。结果表明,各种基质食品中9种大麻素整体呈现出基质增加,且面包、大豆、橄榄油样品的基质效应相对较高,这可能与其油脂含量高有关,对此,本试验根据降低基质效应的方法[36],采取优化净化条件、改善稀释过程和使用空白基质配制标准曲线等方法减少和校正基质效应的影响,结果见图6。从图中可以看出,各种基质的ME值在-21.3%~48.0%之间,均处在中等强度或弱基质效应范围里,可以满足检测方法的要求。
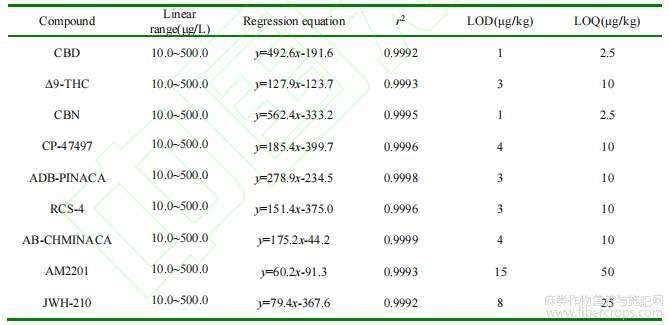
2.7 标准曲线、检出限和定量限
精密吸取9种大麻素混合标准工作液,用甲醇稀释成质量浓度为10.0μg/L、20.0μg/L、50.0μg/L、100μg/L、200.0μg/L和500.0μg/L的系列混合标准工作溶液,实验按浓度由低到高的顺序进样分析。以9种大麻素化合物的峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,从而获得线性方程和相关系数(r2)。结果表明,9种大麻素在10~500μg/L的范围内呈现良好的线性,相关系数均在0.9992以上,能满足测试工作的需求。在各阴性基质的样品中分别添加1.0~100.0μg/L的9种大麻素标准溶液,按优化后前处理方法和仪器条件测定,以定量离子信噪比(S/N)为3和10时的响应定义方法的检出限(LOD)和定量限(LOQ)。根据信噪比的结果,部分种类基质样品的检出限和定量限可以更低,但考虑到操作上的便捷和使用时的方便,基于最不灵敏化合物的检出限和定量限进行了统一,各种基质中大麻素的检出限和定量限分别为1μg/kg~15μg/kg和2.5μg/kg~50μg/kg,详见表3。
表3 9种大麻的回归方程、相关系数、检出限和定量限
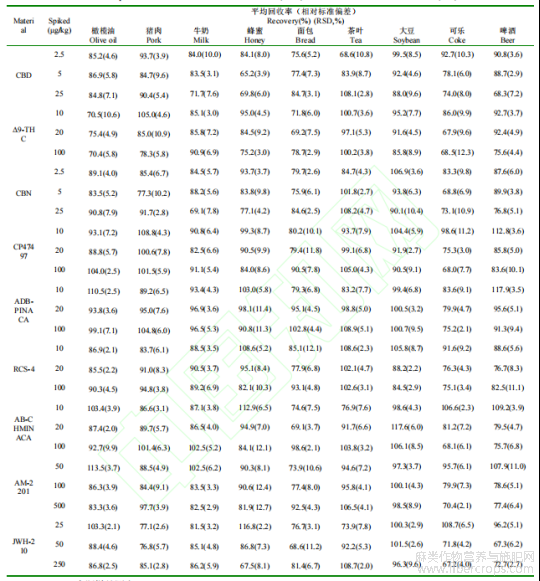
2.8 准确度和精密度
为验证方法的准确度和精密度,在空白的橄榄油?大豆等9种食品进行加标回收试验,分别添加相当于1?2?10倍定量限浓度的9种大麻标准品,每个水平测定6次,计算方法的回收率和精密度,结果见表4?结果表明,9种大麻素在各种食品基质中的平均回收率为65.2%~117.9%,相对标准偏差为2.0%~12.7%,说明该方法准确度高,重复性好,能够满足多种食品基质中9种大麻化合物的定量分析要求?
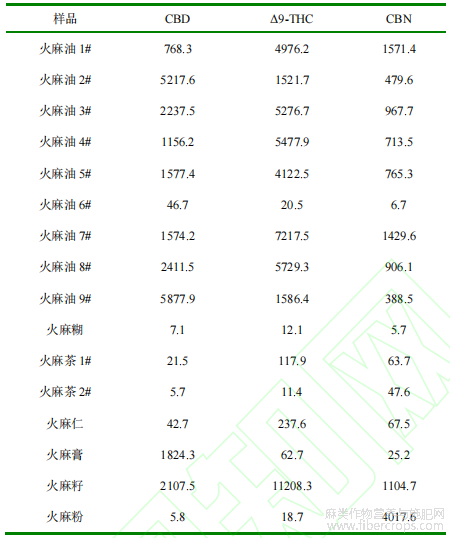
2.9实际样品测定
应用本试验建立的方法对市场购买的16种火麻食品进行测定,包括火麻茶?火麻油?火麻膏?火麻糊?火麻粉?火麻仁和火麻籽等,结果见表5?结果表明,所有火麻食品均未检出合成大麻素,但均不同程度的检出了CBD?Δ9-THC和CBN等天然大麻素,其中火麻油中大麻素的整体含量最高?不同品牌火麻油或火麻茶中三种大麻素含量差别较大,这可能与原料?产地?大麻籽用量等有关?
表5 实际样品中大麻素类化合物的检测结果
3结论
本实验通过优化色谱?质谱条件,建立了固相萃取-气相色谱质谱联用法测定多种食品基质中9种大麻素的检测方法?该方法操作简单?快速,针对的大麻素种类包括了多种类型的合成大麻素,具有较好的实用性和适用性,为监控食品中非法添加的大麻素提取技术支持和监测手段?
参考文献
[1]MANUELA PELLEGRINI, EMILIA MARCHEI, ROBERTA PACIFICI, et al. A rapid and simple procedure for the determination of cannabinoids in hemp food products by gas chromatography-mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2005, 36:939-946.
[2]经《修正1961年麻醉品单一公约的议定书》修正的1961年麻醉品单一公约[EB/OL].(2019-1-30)[2022-3-1].
[3]精神药物公约[EB/OL].(1971-2-21)[2022-3-1].
[4]联合国禁止非法贩运麻醉药品和精神药物公约[EB/OL].(1988-12-20)[2022-3-1].
[5]MULET, ANAMARY TARIFA, ANTHONY P. DECAPRIO. Comprehensive analysis of synthetic cannabinoids and metabolites in oral fluid by online solid-phase extraction coupled to liquid chromatography-triple quadrupole-mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2020, 412:7937-7953.
[6]EMCDDA. Thematic papers: understanding the “Spice” phenomenon[M]. Lisbon: European Monitoring Centre for Drugs and Drug Addiction (EMCDDA), 2009.
[7]AXEL KLEIN, BLAINE STOTHARD. Suggested future directions for the European Monitoring Centre on Drugs and Drug Addiction[J]. Drugs and Alcohol Today. 2015, 15(3).
[8]李岚林.大麻合法化的欧洲逻辑:价值博弈与法律平衡[J].上海对外经贸大学学报,2020,27(4):66-76.
[9]World Health Organization, Cannabis and cannabis resin[R]. Geneva: WHO, 2018.
[10]食品药品监管总局 公安部 国家卫生计生委关于公布麻醉药品和精神药品品种目录的通知[EB/OL].
[11]非药用类麻醉药品和精神药品列管办法[EB/OL].(2021-10-28)[2022-3-1].
[12]关于将4-氯乙卡西酮等32种物质列入非药用类麻醉药品和精神药品管制品种增补目录的公告[EB/OL].
[13]关于将合成大麻素类物质和氟胺酮等18种物质列入《非药用类麻醉药品和精神药品管制品种增补目录》的公告[EB/OL].(2021-05-12)[2022-3-1].
[14]DOWLING G, REGAN L. A method for CP 47, 497 a synthetic non-traditional cannabinoid in human urine using liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B. 2011,879(3-4):253-259.
[15]王冠翔,王继芬,黑海. 吲哚/吲唑酰胺类合成大麻素检验方法研究进展[J]. 化学通报, 2021, 84(120:1345-1350.
[16]小熊软糖?饮料?都是毒品!紧急提醒:陌生人给的东西别乱吃[EB/OL].(2020-06-25)
[17]防范新精神活性物质,警惕伪装毒品陷阱[EB/OL].(2022-01-17)[2022-03-01).
[18]新型毒品竟然伪装成保健品,新精神活性物质一定要警惕[EB/OL].
[19]警惕!这类毒品易伪装!极易对青少年造成诱惑和危害[EB/OL].
[20]ZHOU LIYING, SHEN MIN, SHEN BAOHUA, et al. Application of UPLC-MS/MS method for quantitative analysis of 29 synthetic cannabinoids and their metabolites, such as ADB-BUTINACA and MDMB-4en-PINACA in human hair in real cases[J]. Forensic Science International, 2022, 331:111139.
[21]BYUNGSUK CHO, HAN SOO CHO, JUNGHYUN KIM, et al. Simultaneous determination of synthetic cannabinoids and their metabolites in human hair using LC-MS/MS and application to human hair[J]. Forensic Science International, 2020, 306:110058.
[22]GILBERT MERCIECA,SARA ODOARDI,SERENA MESTRIA, et al. Application of ultrasound-assisted liquid–liquid microextraction coupled with gas chromatography and mass spectrometry for the rapid determination of synthetic cannabinoids and metabolites in biological samples[J]. Journal of separation science, 2020, 43(14):2858-2868.
[23]CORNELIUS HESS, LYNN KRUEGER, MICHAEL UNGER, et al. Freeze-thaw stability and long-term stability of 84 synthetic cannabinoids in serum[J]. Drug Test Analysis, 2017, 9:1506-1511.
[24]MANUELA PELLEGRINI, EMILIA MARCHEI, ESTHER PAPASEIT, et al. UHPLC-HRMS and GC-MS sereening of a selection of Synthetic Cannabinoids and Metabolites in urine of consumers[J]. Medicina, 2020, 56:408.
[25]ALEX J. KROTULSKI, AMANDA L.A. MOHR ,BARRY K LOGAN. Emerging Synthetic Cannabinoids: Development and Validation of a Novel Liquid Chromatography Quadrupole Time-of-Flight Mass Spectrometry Assay for Real-Time Detection[J].Journal of Analytical Toxicology, 2020, 44:207-217.
[26]GARNET MCRAE, JEREMY E.MELANSON. Quantitative determination and validation of 17 cannabinoids in cannabis and hemp using liquid chromatogrphy-tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2020, 412:7381-7393.
[27]KRISTIANE DE CASSIA MARIOTTI, MARCELO CAETANO ALEXANDRE MARCELO, RAFAEL S. ORTIZ, et al. Seized cannabis seeds cultivated in greenhouse:A chemical study by gas chromatography-mass spectrometry and chemometric analysis[J]. Science and Justice, 2016, 56:35-41.
[28]NICOLAS CHRISTINAT, MARIE-CLAUDE SAVOY, PASCAL MOTTIER. Development, validation and application of a LC-MS/MS method for quantification of 15 cannabinoids in food[J]. Food Chemistry, 2020, 318:126469.
[29]URSULA E, MARIA J A-C, VICENTE A, et al. Analysis of cannabinoids by liquid chromatography–mass spectrometry in milk, liver and hemp seed to ensure food safety[J]. Food chemistry. 2017, 228:177-185.
[30]QINGFANG MENG, BETH BUCHANAN, JONATHAN ZUCCOLO, ET AL,. A reliable and vailidated LC-MS/MS method for the simultaneous quantification of 4 cannabinoids in 40 consumer products[J]. Plos ONE. 2018, 13(5):e0196396.
[31]SEOK HEO, GEUM JOO YOO, JI YEON CHOI, et al. Simultaneous Analysis of Cannabinoid and Synthetic Cannabinoids in Dietary Supplements Using UPLC with UV and UPLC–MS-MS[J]. Journal of Analytical Toxicology, 2016, 40:350-359.
[32]Carmen T. Mulet ,Anamary Tarifa, Anthony P. Decaprio. Comprehensive analysis of synthetic cannabinoids and metabolites in oral fluid by online solid-phase extraction coupled to liquid chromatography-triple quadrupole-mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2020, 412:7937-7953.
[33]张受芝,王全林.超高效液相色谱-串联质谱法分析测定食用植物油中痕量Δ9-四氯大麻酚[J].食品科学.2011,32(10):194-198.
[34]吴丽琳,唐庆强,陈迪,等.凝胶渗透色谱-高效液相色谱法测定火麻仁油中Δ9-四氯大麻酚含量[J].中国食品卫生杂志.2021,22(1):35-39.
[35]GONZALEZ O, BLANCO M E, IRIARTE G, et al. Bioanalytical chromatographic method validation according to current regulations, with a special focus on the non-well defined parameters limit of quantification, robustness and matrix effect[J]. Journal of Chromatography A, 2014, 1353:10-27.
[36]CIOLINO L A, RANIERI T L, TAYLOR A M. Commercial Cannabis consumer products part 1: GC-MS qualitative analysis of Cannabis cannabinoids [J]. Forensic Science International, 2018, 289: 429-437.
文章摘自:唐庆强,夏林兵,曹丹,杨方,吴春灯,薛昆鹏.固相萃取-气相色谱质谱法测定食品中9种大麻素[J/OL].食品科学:1-12[2022-06-30].