摘 要:工业大麻是重要的药用和纤维作物,含有的次生代谢物如大麻二酚、四氢大麻酚等大麻素具有特殊药用性能,是目前重要的医药原料。腺毛参与植物的防御反应,也是重要的分泌器官,合成与储存某些次生代谢物,大麻素类生物活性物质的合成和积累均与腺毛相关。重点阐述了工业大麻腺毛的形态结构以及3种分泌型腺毛的特征及特性,腺毛内主要次生代谢物质合成途径和大麻素调控机制。同时,对今后工业大麻腺毛的研究方向提出建议及展望,为推动药用工业大麻定向选育、低毒甚至无毒高药用价值工业大麻品种培育提供参考。
关键词:工业大麻;腺毛;形态特征;大麻素;合成和积累;调控
大麻(Cannabis sativa L.)为大麻科大麻属一年生草本植物,是重要的药用和纤维作物,也是现存最古老的作物之一[1]。传统上,大麻的主要功能是提取韧皮纤维作为纺织原料以及种子榨油食用。近年来,对大麻活性成分的大量研究表明,大麻中含有多种生物活性物质,部分生物活性物质具有较高药用价值,如大麻素[2]。目前,研究最多的大麻素为四氢大麻酚(THC)和大麻二酚(CBD),二者均属于萜类化合物,且互为同分异构体[3],是大麻中含量较高、药用性能研究较成熟的活性物质。THC有较强的致幻作用和成瘾性,过量摄入会对神经系统和身体造成损伤[4],因此大麻栽培和利用等环节均受到严格管控,适合大面积种植的工业大麻品种要求THC含量低于0.3%[5]。CBD是非成瘾性大麻素,已有研究证实,CBD能够阻断某些多酚对人体神经系统的影响,对癫痫、癌症、抑郁症等精神性疾病具有很好的药效[6]。工业大麻中CBD药用性能的开发,不仅丰富了医学原料,同时对工业大麻育种提出了新的要求,选育高CBD低THC含量的工业大麻品种成为大麻育种的首要目标[7]。
腺毛主要参与植物的防御反应、合成并储存某些次生代谢物[8]。按有无分泌功能可将腺毛分为分泌型腺毛和非分泌型腺毛,大麻、黄花蒿、烟草和部分茄科植物等均有分泌型和非分泌型腺毛的相关研究报道。非分泌型腺毛是进行植物分类的一项重要依据,也是植物抵御某些非生物胁迫和生物胁迫的有力屏障[9,10,11];分泌型腺毛被誉为“植物化工厂”,主要分泌和储存某些次生代谢物,其分泌物主要包括部分香料作物的香气物质和某些特定的酚类、醛类等物质[12]。研究发现,大麻素类物质一般是在腺毛中合成与积累[13],大麻素含量与分泌型腺毛相关。
工业大麻腺毛单位面积数量一般表现为雌株比雄株丰富,雌株中又以种子苞片、花、幼叶等部位腺毛最密集。腺毛分泌物与大麻的药用价值密切相关,大麻腺毛的种类及密度对大麻素含量具有较大影响[13]。目前,国内高CBD含量工业大麻品种资源匮乏,为推动药用工业大麻定向选育,培育出高药用价值工业大麻品种,系统阐述工业大麻腺毛的形态结构以及3种分泌型腺毛的特征及特性、腺毛内主要次生代谢物质合成途径、大麻素调控机制。
1大麻腺毛的形态与功能
大麻腺毛观察早在20世纪已经开展,不同腺毛的形状、大小差别较大且组成细胞数量不同[14],有分泌型腺毛和非分泌型腺毛之分,大麻雌雄植株均分布有分泌型腺毛和非分泌型腺毛,其中雄性植株分泌型腺毛的数量和种类均明显少于雌性[15]。笔者通过Leica立体显微镜观察大麻雌株叶片和雌花发现,雌株叶片及雌花表面腺毛分布较为密集,在显微镜下观察到的腺毛大部分呈透明状,由球形的头部和长柄组成(图1),同时也尝试用扫描电镜观察生长中期的大麻叶表皮,发现大麻叶片表皮腺毛中非分泌型腺毛分布最为广泛,且密度最高(图2),推断叶片表面密布的非分泌型腺毛可能与植物自我防御有关。
图1 雌性工业大麻叶片(A)和雌花(B)表面腺毛观察
图2 大麻叶表皮扫描电镜图
20世纪70年代,研究人员通过扫描电镜观察发现,大麻嫩叶和花萼表面存在3种不同类型的分泌型腺毛,分别为头状有柄腺毛(Capitate-stalked glandular trichome)、头状无柄腺毛(Capitate-sessile glandular trichome)和球状腺毛(Bulbous glandular trichome)[3,14](图3),且3种分泌腺毛的分泌细胞数量不相同[14,16],但均有用于储存和分泌代谢物的分泌腔。
图3 大麻嫩叶和花萼表面3种分泌型腺毛
A.头状有柄腺毛,B.头状无柄腺毛,C.球状腺毛,比例尺为20μm[14]A.Capitate-stalked glandular trichome; B.Capitate-sessile glandular trichome; C.Bulbous glandular trichome;Scale bars 20 μm[14]
研究者[15]通过观察大麻花萼发育进程发现,不同发育时期分泌型腺毛的种类和密度不同,推测此现象可能与植株所处的生长时期有关,其中,有柄腺毛通过一个由多细胞组成的长柄将球形的分泌腔与植物表面连接(图3A);球状腺毛由球状的头部和短柄状的基座组成(图3C)[14],且已有研究结果显示,球状腺毛只能生产有限的特定代谢产物;无柄腺毛是由一个直径约50~70µm的球形分泌腔直接着生在大麻组织表面[14,15](图3B)。研究表明,有柄腺毛的分泌能力最强,分泌的大麻素种类最多[13,17],荧光染色试验[14]同样证实,有柄腺毛能合成的大麻素种类最多,分泌能力较无柄腺毛更强,可能与有柄腺毛和无柄腺毛头部大小差异有关[13]。研究者在观察大麻花萼发育进程时发现,不同发育时期分泌型腺毛的种类和密度不同,推测此现象可能与植株所处的生长时期有关;在观察大麻苞片表面腺毛发育进程时发现,有柄腺毛较无柄腺毛和球状腺毛出现时期滞后,且随着植株发育进程不断推进,有柄腺毛占总腺毛比例不断上升[15]。LIVINGSTON等[14]推测,无柄腺毛可能是有柄腺毛发育的早期阶段,有柄腺毛可能由无柄腺毛进化形成。
2腺毛内主要次生代谢物质的合成途径
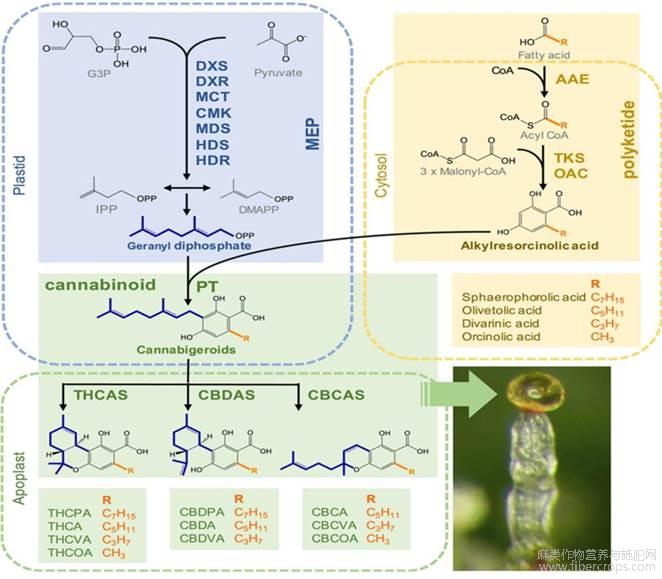
植物次生代谢物质是指通过植物次生代谢途径合成的一类生物小分子[18],是植物适应环境和应对不良环境的重要防护屏障,植物次生代谢物主要包括黄酮类、萜类等。腺毛是植物重要的分泌器官,大量次生代谢物的合成以及储存在此进行,大麻素是大麻腺毛的主要次生代谢物,研究报道,大麻素主要由大麻分泌型腺毛合成和储存,大麻素的合成过程较为复杂,包括己酸途径、2-甲基赤藓醇磷酸(MEP)途径、焦磷酸香叶酯(GPP)途径和以这3个途经合成产物为底物的Cannabinoid途径4个环节共同完成[19,20,21,22](图4)。其中,MEP途径为大麻素与青蒿素合成中共有的环节,也是植物进行萜类物质合成的重要步骤[23],通过MEP途径合成的异戊烯基二磷酸(IPP)和二甲烯丙基二磷酸(DMAPP)同为大麻素和青蒿素合成的重要底物之一。大麻素合成过程中,己酸途径产物乙酰辅酶A通过聚酮合酶(OLS)催化形成戊基二羟基苯酸(OLA),与GPP途径产生的GPP在异戊烯基转移酶催化下形成产物大麻萜酚酸(CBGA)[20,24],这一步骤被认为是大麻素合成途径中最为关键的一步,通过此次催化反应生成大麻素合成途径中的第一类大麻素[25],也为后续多种大麻素的合成提供底物。此外,大麻素合成过程中OLA也可以和GPP的异构体焦磷酸橙花酯(NPP)同样通过异戊烯基转移酶催化生成大麻酚酸(CBNRA)[26,27],但由于CBNRA合成量较少,此路径研究报道较少。CBGA经腺毛中特异性表达的四氢大麻酚酸合成酶(THCAS)、大麻二酚酸合成酶(CBDAS)、大麻环萜酚酸合成酶(CBCAS)催化形成四氢大麻酚酸(THCA)、大麻二酚酸(CBDA)、大麻环萜酚酸(CBCA)[28,29],最后经过非酶促反应脱羧形成THC、CBD和大麻环萜酚(CBC)[30]。
图4 大麻素合成途径[22]
3大麻素调控机制
大麻素是大麻腺毛合成的重要药用活性物质,目前关于大麻素的研究热点主要集中在降低精神活性物质THC含量及提高药用价值成分CBD含量方面[7]。CBDA和THCA是由共同的前体物质CBGA转化而来,且互为同分异构体,调控机制较为复杂[31],易受环境和品种本身因素影响。大麻中CBD和THC含量波动较大,但CBD与THC比值在作物的生命周期中变化较小,推测CBD/THC易受位于同一个基因座上的2个共显性基因影响,当BT基因纯合时以THC的合成为主,当BD基因纯合时则主要合成CBD,BD和BT同时出现THC和CBD均合成[32]。
陈璇等[20]筛选了16个与大麻素合成相关的基因,通过荧光定量PCR发现,4-磷酸胞苷-2-甲基赤藓糖激酶(CMK)基因、2-C-甲基-D-赤藓糖醇-2,4-环焦磷酸合成酶(MDS)基因、4-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶(HDS)基因、4-羟基-2-甲基-2-E-丁烯基-4-焦磷酸还原酶(HDR)基因、GPP基因的表达量与大麻素合成量呈正相关。研究还发现,在以大麻萜酚酸为底物的下游生物合成过程中,单一CBDAS可以催化CBGA合成CBDA和少量THCA,同样,单一THCAS也可以催化合成少量CBDA[20,33]。
THCAS与CBDAS基因位点位于6号染色体[33],CBDAS/THCAS相关的13个基因拷贝集中分布在9号染色体25~33Mb的3段区间内,1个单拷贝CBDAS相关基因位于30Mb,其余基因分别位于25Mb和29Mb2个串联重复簇内,每个重复单元由基因序列和两侧的LTR序列构成[5]。目前,THCAS基因是大麻素调控基因中功能研究最深入的基因。1995年,TAURA等[34]发现,THCA合成酶是74ku的单体脱氢酶,催化由戊基间苯二酚酸到THCA的氧化环化反应。2004年,科学家成功克隆四氢大麻酚合成酶基因,进一步证明THCA基因调控将CBGA转换为THCA[35]。研究发现,高THC含量大麻中THCAS基因表达量高[36],而CBDAS基因在工业大麻中表达偏高[37]。不同pH值同样影响着THCAS及CBDAS的催化活性,当pH值为4.5时,CBDAS催化能力最强,分泌CBD含量相对较高[33]。THCA和CBDA的合成是由2个碱基序列相似度较高且联系较为密切的不同基因控制[38,39],且THC和CBD在不同类型大麻中以相似的路径合成[40]。随着测序技术的发展,在2011年第1个大麻品种‘Purple Kush’参考基因组发布后,研究人员发现,该品种的基因序列中存在一个THCAS基因和多个CBDAS基因,由此推测CBD合成由多位点控制[41],然而,其多个CBDAS基因能否行使功能还未完全验证。进一步研究大麻品种‘Finola’基因组和转录组发现,CBDAS基因也能合成THC[39,41]。THCAS和CBDAS同为大麻素合成途径末端最重要的2种酶,这2种酶的催化作用显著影响大麻重要药用成分和毒性物质含量,调整THCAS基因的表达能够有效抑制THC的合成,通过RNA干扰THCAS基因降低THC合成量是一个有效途经[42]。
4讨论及展望
非分泌型腺毛是植物抵御某些非生物胁迫和生物胁迫的有力屏障,分泌型腺毛是分泌和储存某些次生代谢物的植物化工厂。据报道,植物腺毛生长除受自身因素影响外,还受如光、水、肥、激素等环境因素影响。不同的光照强度可以改变烟叶表面腺毛的类型、密度以及内容物含量,影响烟叶的化学品质[43],也可影响薄荷次生代谢物的分泌[44],蓝光诱导茶树可合成更多次生代谢类物质[45]。干旱胁迫可改变荆芥表面腺毛数量及分泌的次生代谢物的种类和比例[46],显著影响烟草香气物质西柏烷类化合物含量[47]。缺少Fe、B、Ca、Mg等元素都会对烟草腺毛的生长不利[48],而增施腐殖酸类有机肥料能够显著提高烟草腺毛密度,提升烟草香气物质合成量[49]。植物激素茉莉酸甲酯能使番茄[50]、向日葵[51]和黄花蒿[52,53]腺毛数目增加,次生代谢物质和防御蛋白含量上升;喷施水杨酸能够缓解非生物胁迫对青蒿的影响,同时刺激其腺毛发育,提高青蒿素的合成量[54];喷施赤霉素烟草叶表面腺毛密度增加了近1/3,增加腺毛分泌物含量,提升烤烟香气[55],促进番茄表面腺毛生长[56]。工业大麻腺毛生长影响因子的报道较少,除吴姗[57]报道激动素(KT)影响其代谢物质分泌外,光、水、肥及其他激素对腺毛生长的影响鲜有研究报道,因此,今后工业大麻研究可侧重于深入研究光、水、肥、激素等非生物因素对工业大麻腺毛分泌能力的影响。
大麻腺毛的观察研究历时近50a,其功能和结构已得到清晰展示,其分泌的重要次生代谢物质CBD及THC的合成途径和调控机理研究也已进行了颇多报道。但是,大麻腺毛分泌的代谢物质除CBD及THC外还有很多其他物质,其中,酚类物质就有60多种,如大麻酚(CBN)、次大麻二酚(CBDV)及CBC等,这些物质大部分具有特殊药用功效[58],然而,这些酚类物质在腺毛中分泌、合成及调控的途径研究少见报道,故更多的大麻腺毛分泌次生代谢产物功能及其调控机制尚待挖掘,以有助于工业大麻药用物质的开发与利用。
大麻腺毛中分泌代谢物质THC具较强的致幻作用和成瘾性,致使大麻种植一直受限。分子设计育种和分子聚合辅助育种是遗传改良的有效途经,也是未来的育种方向。若能采用敲除或者沉默等方法,消除与THC分泌相关联基因的影响,或者通过分子设计育种和分子聚合辅助育种,选育出零THC含量的工业大麻品种,将促进工业大麻各领域的蓬勃发展。然而,目前与工业大麻腺毛生长发育及次生代谢分泌调控关联基因的报道较少,研究深度较浅,加上工业大麻遗传转化系统不成熟,关联基因功能尚未有充分验证。因此,有必要加大与腺毛分泌代谢物质关联基因尤其是与THC关联关键基因的挖掘研究,优异等位基因的挖掘及功能验证将为大麻腺毛分泌特性改良、药用工业大麻定向选育、低毒甚至无毒高药用价值工业大麻品种培育提供基础。
参考文献
[1]白云俊,周新郢,袁媛,等.药用大麻起源及其早期传播[J].中草药,2019,50(20):5071-5079.
[2]ELSOHLY M A,RADWAN M M,GUL W,et al.Phytochemistry ofCannabis sativaL.[J].Progress in the Chemistry of Organic Natural Products,2017,103:1-36.
[3]NIZAR H,SARA A,REMCO M,et al.Analysis of cannabinoids in laser-microdissected trichomes of medicinalCannabis sativausing LCMS and cryogenic NMR[J].Phytochemistry,2013,87:51-59.
[4]WHITLOW C T,FREEDLAND C S,PORRINO L J.Functional consequences of the repeated administration of Δ9-tetrahydrocannabinol in the rat[J].Drug and Alcohol Dependence,2003,71(2):169-77.
[5]李秋实,孟莹,陈士林.药用大麻种质资源分类与研究策略[J].中国中药杂志,2019,44(20):4309-4316.
[6]弓佩含,杨洋,刘玉婷,等.大麻化学成分及药理作用的研究进展[J].中国实验方剂学杂志,2017,23(13):212-219.
[7]张际庆,陈士林,尉广飞,等.高大麻二酚(CBD)含量药用大麻的新品种选育及生产[J].中国中药杂志,2019,44(21):4772-4780.
[8]蒋征,王红,吴啟南,等.药用植物腺毛研究进展[J].中草药,2016,47(22):4118-4126.
[9]植汉成,郭宝林,葛菲,等.非腺毛形态在(药用)植物分类和植物类药材鉴别方面的研究进展[J].中国现代中药,2018,20(4):489-494.
[10]刘艳霞,马亚丽,兰海燕.植物非腺毛形态发生及其功能研究进展[J].植物生理学报,2018,54(10):1527-1534.
[11]ZHANG Y,SONG H H,WANG X Y,et al.The roles of different types of trichomes in tomato resistance to cold,drought,whiteflies,andBotrytis[J].Agronomy,2020,10(3):411.
[12]HUCHELMANN A,BOUTRY M,HACHEZ C.Plant glandular trichomes:natural cell factories of high biotechnological interest[J].Plant Physiology,2017 ,175(1):6-22.
[13]TURNER J C,HEMPHILL J K,MAHLBERG P G.Quantitative determination of cannabinoids in individual glandular trichomes ofCannabis sativaL.(Cannabaceae)[J].American Journal of Botany,1978,65(10):1103-1106.
[14]LIVINGSTON S J,QUILICHINI T D,BOOTH J K,et al.Cannabisglandular trichomes alter morphology and metabolite content during flower maturation[J].The Plant Journal,2020,101(1):37-56.
[15]HAMMOND C T,MAHLBERG P G.Morphology of glandular hairs ofCannabis sativafrom scanning electron microscopy[J].American Journal of Botany,1973,60(6):524-528.
[16]EBERSBACH P,STEHLE F,KAYSER O,et al.Chemical fingerprinting of single glandular trichomes ofCannabis sativaby coherent anti-stokes raman scattering(CARS) microscopy[J].BMC Plant Biology,2018,18(1):275.
[18]王景顺,吴秋芳,路志芳.植物次生代谢物与林木抗虫性研究进展[J].江苏农业科学,2015,43(8):4-7.
[19]GAO S,WANG B S,XIE S S,et al.A high-quality reference genome of wildCannabis sativa[J].Horticulture Research,2020,7(1):73.
[20]陈璇,张庆滢,郭蓉,等.不同发育时期大麻素合成相关酶基因表达特征与大麻素含量的相关分析[J].分子植物育种,2018,16(2):583-590.
[21]MCGARVEY P,HUANG J H,MCCOY M,et al.De novo assembly and annotation of transcriptomes from two cultivars ofCannabis sativawith different cannabinoid profiles[J].Gene,2020,762:145026.
[22]HURGOBIN B,TAMIRU-OLI M,WELLING M T,et al.Recent advances inCannabis sativagenomics research[J].The New phytologist,2021 ,230(1):73-89.
[23]张松涛,陈红丽,崔红,等.植物MEP途径的代谢调控机制[J].西北植物学报,2012,32(7):1500-1504.
[24]GUELCK T,BOOTH J,CARVALHO Â,et al.Synthetic biology of cannabinoids and cannabinoid glucosides inNicotianabenthamianaandSaccharomyces cerevisiae[J].Journal of Natural Products,2020,83(10):2877-2893.
[25]FELLERMEIER M,ZENK M H.Prenylation of olivetolate by a hemp transferase yields cannabigerolic acid,the precursor of tetrahydrocannabinol[J].Febs Letters,1998,427(2):283-285.
[26]TAURA F,MORIMOTO S,SHOYAMA Y.Cannabinerolic acid,a cannabinoid fromCannabis sativa[J].Phytochemistry,1995,39(2):457-458.
[27]陈璇,杨明,郭鸿彦.大麻植物中大麻素成分研究进展[J].植物学报,2011,46(2):197-205.
[28]MARKS M D,TIAN L,WENGER J P,et al.Identification of candidate genes affecting Δ9-tetrahydrocannabinol biosynthesis inCannabis sativa[J].Journal of Experimental Botany,2009 ,60(13):3715–3726.
[29]SIRIKANTARAMAS S,TAURA F,TANAKA Y,et al.Tetrahydrocannabinolic acid synthase,the enzyme controlling marijuana psychoactivity,is secreted into the storage cavity of the glandular trichomes[J].Plant & Cell Physiology,2005,46(9):1578–1582.
[30]MILAYILAY L,BERMAN P,SHAPIRA A,et al.Metabolic profiling ofCannabissecondary metabolites for evaluation of optimal postharvest storage conditions[J].Frontiers in plant science,2020,11:583605.
[31]WEIBLEN G D,WENGER J P,CRAFT K J,et al.Gene duplication and divergence affecting drug content inCannabis sativa[J].New Phytologist,2015,208(4):1241-50.
[32]STAGINNUS C,ZÖRNTLEIN S,MEIJER D E.A PCR marker linked to a THCA synthase polymorphism is a reliable tool to discriminate potentially THC-rich plants ofCannabis sativaL.[J].Journal of Forensic Sciences,2014 ,59(4):919-26.
[33]ZIRPEL B,KAYSER O,STEHLEtehle F.Elucidation of structure-function relationship of THCA and CBDA synthase fromCannabis sativaL.[J].Journal of Biotechnology,2018,284:17-26.
[34]TAURA F,MORIMITO S,SHOYAMA Y,et al.First direct evidence for the mechanism of Δ1-tetrahydrocannabinolic acid biosynthesis[J].Journal of the American Chemical Society,1995,117(38):9766-9767.
[35]SIRIKANTARAMA S,MORIMOTO S,SHOYAMA Y,et al.The gene controlling marijuana psychoactivity[J].Journal of Biological Chemistry,2004,279(38):39767-39774.
[36]TAURA F,SIRIKANTARAMA S,SHOYAMA Y,et al.Cannabidiolic-acid synthase,the chemotype-determining enzyme in the fiber-typeCannabis sativa[J].Febs Letters.2007,581(16):2929-2934.
[37]TAURA F,MORIMOTO S,SHOYAMA Y.Purification and characterization of cannabidiolic-acid synthase fromCannabis sativaL.[J].Journal of Biological Chemistry,1996,271(29):17411-17416.
[38]HILLIG KW,MAHLBERG P G.A chemotaxonomic analysis of cannabinoid variation inCannabis(Cannabaceae)[J].American Journal Botany,2004 ,91(6):966-75.
[39]ROMERO P,PERIS A,VERGARA K,et al.Comprehending and improvingCannabisspecialized metabolism in the systems biology era[J].Plant Science,2020,298:110571.
[40]KOJOMA M,SEKI H,YOSHIDA S,et al.DNA polymorphisms in the tetrahydrocannabinolic acid (THCA) synthase gene in "drug-type" and "fiber-type"Cannabis sativaL.[J].Forensic Science International,2006,159(2/3):132-40.
[41]BAKEL H V,STOUTT J M,COTE A G,et al.The draft genome and transcriptome ofCannabis sativa[J].Genome Biology,2011,12(10):R102.
[42]姜颖,孙宇峰,韩喜财,等.大麻THCA合成酶基因(CsTHCA)RNA干扰载体的构建及遗传转化[J].植物遗传资源学报,2019,20(1):207-214.
[43]武东玲,冯琦,王霄龙,等.光照度对烟草腺毛发育及其物质代谢的影响[J].河南农业大学学报,2013,47(6):659-662,682.
[44]SOUZA M A A D, SANTOS L A D,BRITO D M C D et al.Influence of light intensity on glandular trichome density,gene expression and essential oil of menthol mint (Mentha arvensisL.)[J].Journal of Essential Oil Research,2016,28(2):138-145.
[45]ZHENG C,MA J Q,MA C L,et al.Regulation of growth and flavonoids formation of tea plant(Camelliasinensis) by blue and green light[J].Journal of Agricultural and Food Chemistry,2019,67:2408-2419.
[46]李柯,李四菊,周庄煜,等.干旱胁迫对荆芥腺毛与气孔密度及腺毛分泌物的影响[J].中国中药杂志,2019,44(21):4573-4580.
[47]李鹏飞,周冀衡,张建平,等.烤烟成熟期土壤水分状况对烟叶挥发性香气物质及主要化学成分的影响[J].中国烟草学报,2009,15(3):44-48.
[48]张钊.镁对烤烟主要营养元素分配及腺毛发育的影响[D].长沙:湖南农业大学,2007.
[49]时向东,刘国顺,韩锦峰,等.不同类型肥料对烤烟叶片腺毛密度、种类及分布规律的影响[J].中国烟草学报,1999(2):22-25.
[50]张晓霞,洪波,景亮亮,等.外源茉莉酸甲酯诱导番茄对烟粉虱的抗虫性[J].生态学杂志,2020,39(11):3651-3657.
[51]ROWE H C,RO D K,RIESEBERG L H.Response of sunflower (HelianthusannuusL.) leaf surface defenses to exogenousMethylJasmonate[J].Plos One,2012,7(5):e37191.
[52]颜廷祥.茉莉酸调控青蒿分泌型腺毛发育相关转录因子的克隆及功能分析[D].上海:上海交通大学,2017.
[53]MAES L,VAN NIEUWERBURGB F,ZHANG Y S,et al.Dissection of the phytohormonal regulation of trichome formation and biosynthesis of the antimalarial compound artemisinin inArtemisiaannuaplants[J].New Phytologist,2011,189(1):176-189.
[54]KUMARI A,PANDEY N,PANDEY-RAI S.Exogenous salicylic acid-mediated modulation of arsenic stress tolerance with enhanced accumulation of secondary metabolites and improved size of glandular trichomes inArtemisiaannuaL.[J].Protoplasma,2018,255(1):139-152.
[55]贺凌霄,薛刚,孙聚涛.外源赤霉素对烤烟叶面腺毛和香气物质的影响[J].河南农业科学2021,50(1),52-59.
[56]刘金秋,陈凯,张珍珠,等.外施GA、MeJA、IAA、SA和KT对番茄表皮毛发生的作用[J].园艺学报,2016,43(11):2151-2160.
[57]吴姗.外源激素对大麻中大麻素含量的影响及转录组分析[D].北京:中国农业科学院,2020.
[58]ZAMBERLETTI E,RUBINO T,PAROLARO D.Therapeutic potential of cannabidivarin for epilepsy and autism spectrum disorder[J].Pharmacology&Therapeutics,2021,226:107878.
文章摘自:张静,粟建光,唐蜻,戴志刚,陈小军,许英.工业大麻腺毛研究进展[J/OL].河南农业科学:1-11[2022-04-05].