摘 要:采集种植1、2a和3a的胡麻土壤,利用高通量测序技术对不同胡麻连作年限土壤细菌群落进行测定,旨在揭示不同连作年限对胡麻土壤细菌群落结构和多样性的影响。结果表明:连作3a土壤样本细菌OTU数目最多,为1773条,细菌群落丰度指数(Chao指数1759.07和Ace指数1741.89)最高,而细菌群落多样性(Shannon指数T1(6.45)>T2(6.41)>T3(6.33),Simpson指数T1(0.0034)<T2(0.0037)<T3(0.0074))随着连作年限增长而降低;不同连作年限胡麻土壤内共获得36门的细菌,且优势菌门(丰度占比>0.01)都为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和绿湾菌门(Chloroflexi)等12个菌门,但各优势菌门在各样本中所占的丰度不同;随着连作年限增加,变形菌门丰度(T1(31.74%)>T2(27.69%)>T3(25.21%))逐渐降低,酸杆菌门丰度(T119.39%,T221.99%,T314.28%)和拟杆菌门丰度(Bacteroidetes,T17.29%,T28.72%,T32.59%)先增加后降低,放线菌门丰度(T1(12.16%)<T2(15.38%)<T3(24.12%))和绿湾菌门丰度(T1(9.58%)<T2(10.99%)<T3(11.82%))逐渐增加。土壤细菌群落β多样性分析显示,连作显著改变土壤细菌的群落结构,其影响随连作年限增长而增强。研究表明胡麻连作降低土壤细菌多样性,影响细菌群落结构组成。
关键词:胡麻;连作;高通量测序;土壤细菌群落
连作障碍作为困扰农业生产的一个复杂问题,其形成机制是农业发展研究的热点,备受国内外学者关注。连作障碍是土壤内部诸多因素综合作用的外在表现,目前研究主要认为土壤理化性质、自毒作用及土壤微生物群落是引起连作障碍发生的主要因素[1-3]。土壤微生物在土壤中一直扮演着重要角色,对土壤养分的吸收转化及作物生长发育具有显著影响[4-5]。研究表明,连作障碍程度受到种植作物、种植模式、土壤类型及连作年限等因素的影响,连作会对土壤微生物群落结构与物种多样性造成破坏,抑制有益微生物的生长,促进病原微生物积累与生长,造成土壤微生态系统失衡,从而导致作物产量降低[6-13]。细菌是土壤微生物群落中的重要类群,在土壤微生物群落中起着重要作用。大豆、硒砂瓜及烟草等研究发现,土壤细菌群落结构与连作障碍关系密切,受连作年限和作物种类的影响[6-7,14]。因此,对不同作物连作中的细菌群落变化进行研究,将对破解其连作障碍有重要意义。
胡麻是我国西北和华北黄土高原地区重要的油料作物。在实际农业生产中,尤其干旱和半旱区的种植户发现,胡麻连作2~3a后其产量就显著降低,而利用间作或轮作模式,可使其状况得到明显改善。经研究发现,胡麻连作3a会导致土壤水提液自毒作用明显加强,降低种子萌发、抑制植株生长,降低产量,并对土壤酶活性造成不利影响,表现出明显的连作障碍现象[15-18]。目前,关于胡麻连作障碍的研究虽然已经取得部分成果,但胡麻连作对土壤细菌群落多样性及群落结构影响的研究少有报道,因此,本试验通过高通量测序技术对胡麻连作土壤内细菌群落进行测定,研究胡麻连作条件下土壤细菌群落变化,以期从细菌群落变化角度解析胡麻连作障碍机制,从而为消减胡麻连作障碍提供理论依据,为胡麻产业的良性发展提供技术支撑。
1材料与方法
1.1试验材料及试验地概况
试验所用胡麻品种为陇亚10号,由甘肃省农业科学院作物所提供。试验地点为甘肃省榆中县试验地(E104°06'35″、N35°50'36″),海拔1600m,属于黄土高原丘陵沟壑半干旱高寒区,年均降水量450mm,年蒸发量1400~1450mm,样地区域土壤类型为黄绵土,有机质18.5g·kg-1,全氮1.15g·kg-1,全磷1.5g·kg-1,有效氮49.4mg·kg-1,有效磷38.9mg·kg-1,速效钾104.1mg·kg-1,pH8.13。试验地为浇灌地,3月底胡麻种植,整个生长期实行规范化管理,胡麻生育期充分浇灌2次。
1.2田间试验处理
田间试验设置胡麻种植1a(T1)、连作2a(T2)和连作3a(T3),每个处理设置3个重复,随机区组排列,每小区面积30m2(6m×5m)。为防止小区间相互影响,小区间用宽60cm、高50cm土埂分隔。
1.3土样采集
在收获后分别采集胡麻种植1a、连作2a和连作3a的根际土壤,土壤样品采集采用“S”型布点,保证6~8个采样点,采样土壤充分混合,剔除枯叶、腐叶等,每小区获得2份土样。每种处理的3个重复土样充分混合,最终每种处理获得2个土壤样本,用四分法取适量土样放入自封袋,迅速置于干冰上保存,带回实验室进行后续分析。
1.4样品DNA提取及高通量测序
准确称取0.1g土样,按照土壤微生物DNA提取试剂盒说明书步骤,分别提取各土样的总DNA,Drop2000测定浓度和纯度,1.0%琼脂糖凝胶电泳检测DNA完整性。设计带有barcode的融合引物,针对细菌16SrRNA的V3~V4区进行PCR扩增,扩增特异性引物序列为338F:ACTCCTACGGGAGGCAG-CA,806R:GGACTACHVGGGTWTCTAAT。对扩增产物进行2%琼脂糖凝胶电泳后切胶回收PCR产物,并用Quanti FluorTM-ST蓝色荧光定量系统进行定量检测,按照每个样本测序量要求,进行相应比例的混合,合格样品交由美吉生物医药科技公司进行Miseq文库构建及高通量测序,测序平台为PE300。
1.5数据处理与分析
测序后,对原始数据进行拼接、过滤处理,得到优化序列,进行OTU(Operational taxonomic uniits)聚类分析、Alpha多样性分析、物种组成分析、Beta多样性分析及物种差异分析。其中,序列拼接利用FLASH、序列过滤利用QIME,聚类利用UPARSEpipeline软件。
2结果与分析
2.1胡麻不同连作年限下土壤细菌OTU分布
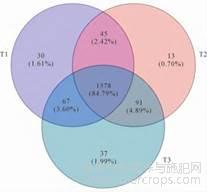
测序结果优化后共获得193836条有效序列,按97%相似度归并后通过OTU聚类分析得到1861条OTU。对各土样测序得到的OTU进行分类,结果表明三类样品中共有的OTU为1578条,T1、T2和T3分别具有特异OTU为30、13和37条,仅T1和T2共有的OTU为45条,T1与T3共有而T2没有的OTU为67条,T1不具有而T2和T3共有的OTU为91条(图1)。
2.2胡麻不同连作年限下土壤细菌物种多样性分析
采用Chao指数、Ace指数、Shannon指数和Simpson指数对不同连作年限的胡麻根际土壤细菌群落Alpha多样性进行分析,从而反映细菌群落的丰度和多样性。由表1可知各样本文库覆盖率均大于99.4%,说明测定结果能够真实反映各样本的细菌群落组成。不同处理样本根际细菌多样性指数Shannon指数表现为T1>T2>T3,Simpson指数表现为T3>T2>T1,细菌群落丰度(Chao指数和Ace指数)
图1 不同种植年限土壤细菌OTU分布venn图
表1 不同连作年限土壤中细菌的Alpha多样性分析
注:T1—连作1a,T2—连作2a,T3—连作3a,下同。
则表现T3>T1>T2,说明细菌多样性随着连作年限增加而降低,而细菌丰度先降低后再升高,且连作3a的细菌丰度高于连作1a。
2.3胡麻不同连作年限下土壤细菌物种丰富度
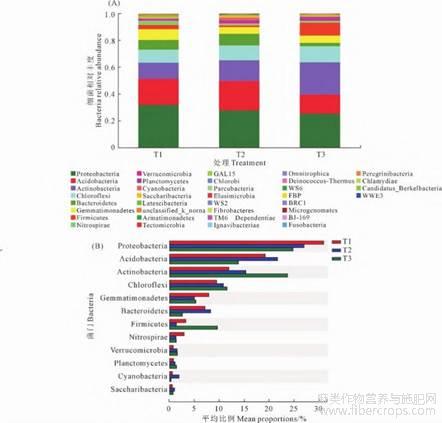
分析样本检测出的细菌主要分布在36个门,77个纲,144个目,259个科,428个属,804个种。在门分类水平对土壤细菌分析发现,T1、T2和T3土壤具有的细菌门数分别为33、32个和35个,其中有31个细菌门三者所共有,T1和T2土壤内的WWE3菌门在T3土壤内未检测到,T2土壤内未检测到T1和T3土壤内的Peregrinibacteria菌门,衣原体门(Chlamydiae)、梭杆菌门(Fusobacteria)和BJ-169菌门只有在T3土壤内检测到(图2A)。对土壤细菌优势菌门(丰度占比>0.01)分析表明,3种土壤内的优势菌门均为相同的12个菌门,但不同土壤内各优势细菌门的相对丰度存在差异,相对丰度前四的优势菌门分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和绿湾菌门(Chloroflexi)(图2B)。相对丰度第一的变形菌门随着种植年限增长相对丰度逐年降低,其相对丰度分别为31.74%、27.69%和25.21%。酸杆菌门表现出先升高再降低,T3中的相对丰度比T1降低了35.76%。放线菌门相对丰度变化与变形菌门相反,表现出随着种植年限增长相对丰度逐年升高,相对丰度分别为12.16%、15.38%和24.12%。绿湾菌门的相对丰度分别为9.58%、10.99%和11.82%,与放线菌门一样,都是随着种植年限增长而升高。T3土壤中拟杆菌门(Bacteroidetes)的相对丰度明显低于T1和T2,仅是T1和T2的29.82%和35.62%。芽单胞菌门(Gemmatimonadetes)在T2和T3土壤内的相对丰度接近,分别为4.98%和5.35%,但T1土壤内相对丰度为8.02%,明显高于T1和T2。后壁菌门(Firmicutes)在各土壤内的相对丰度为T3(9.67%)>T1(3.29%)>T2(1.32%)。硝化螺旋菌门(Nitro-spirae)在T1土壤内相对丰度为2.99%,高于T2和T3土壤内的相对丰度1.28%和1.33%。疣微菌门(Verrucomicrobiae)和浮霉菌门(Planctomycetes)也随着连作年限增长相对丰度逐渐增加,T3土壤内其相对丰度分别达到1.57%和1.41%。另外蓝藻菌门(Cyanobacteria)和Saccharibacteria菌门在T2土壤内的相对丰度较高,分别为2.06%和1.02%(图2B)。
2.4胡麻连作对土壤细菌群落结构影响
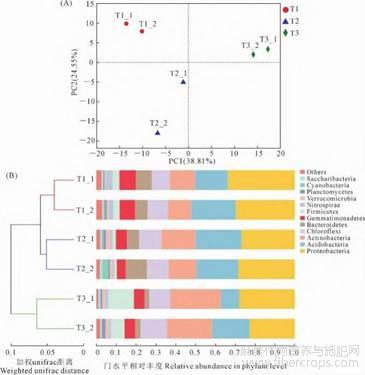
对测序结果的主成分分析(Principalcomponentanalysis,PCA)发现,胡麻不同种植年限土壤细菌群落丰度差异比较明显。如图3A所示,土壤PC1贡献率为38.81%,PC2的贡献率为24.55%,T1分布在PC1的负值区域和PC2的正值区域,且分布集中,而T2分布于PC1和PC2的负值区域,分布相对较远,T3聚集到PC1和PC2的正值区域,样本集中。基于WeightedUnifrac距离矩阵进行聚类分析,如图3B所示,T1和T2土壤聚为一类,T3土壤单独分为一类,说明T1和T2土壤细菌群落差异相对小,随着连作年限增长土壤细菌群落差异变大。
图2 门分类水平上不同连作年限土壤细菌物种相对丰度(A)及主要菌门(B)
图3 不同连作年限土壤中细菌群落β多样性分析
3讨论与结论
土壤内细菌群落多样性往往会伴随连作障碍发生而改变。岳思君等[6]对不同连作年限硒砂瓜土壤群落研究发现,随着连作年限增长,细菌菌群多样性指数和丰富度指数都逐渐增加。林震等[19]也研究证明连作4a苜蓿根际土壤细菌群落多样性指数高于0a苜蓿。而高林等[7]对烟草连作土壤微生物群落分析发现,细菌的Shannon指数和Chao指数都随着连作年限增长而下降。纳小凡等[20]对枸杞种植研究表明,与对照样地相比,连作地种植枸杞根际细菌群落α多样性降低。大豆中也有证据表明,连作2a根际土壤中细菌丰富度和多样性指数低于连作0a[14]。这种随连作种植年限增长而细菌多样性指数降低的现象也在黑胡椒、黄瓜、草莓和花生等作物中得到证实[21-24]。这些研究成果显示,连作土壤根际中细菌群落多样性的变化与栽培作物及连作年限相关,在特定的连作年限内,有的随连作年限而升高,有的随连作年限而降低。本研究中胡麻连作土壤根际细菌群落的多样性随着连作年限而逐渐降低,但细菌丰度并未保持持续降低趋势,而在连作3a根际土壤内丰富度指数最大,这与以上所示的研究成果都有所差异。
种植连作年限增加,土壤内细菌群落差异也随之改变,但不同作物连作对细菌群落影响也存在差别。烟草不同连作年限土壤细菌中变形菌门占比最高,放线菌门和泉古菌门的丰富度则随着增加,细菌群落差异变大[7]。硒砂瓜连作土壤内的优势菌门为放线菌门、变形菌门、绿湾菌门和酸杆菌门,放线菌门和酸杆菌门丰度随着连作时间先增后降,变形菌门丰度随着连作年限增长逐渐降低,而绿湾菌门丰度先降后增[6]。在大豆连作根际土壤细菌群落测定中发现,变形菌门和放线菌门丰度在连作2a土壤中低于对照,而酸杆菌门和绿弯菌门丰度表现相反的趋势[14]。这些已有的报道说明,不同作物种植土壤中各菌门的丰度存在差异,但放线菌门、变形菌门、酸杆菌门和绿湾菌门等一般都包含在优势菌门内。番茄根际土壤细菌优势菌门中也包含变形菌门和酸杆菌门[25]。本研究也得到相似的结果,发现在胡麻不同连作年限根际土壤内的优势菌门数量和种类是相同的,但不同土壤中各菌门丰度不同。变形菌门和放线菌门在土壤中是有益的菌门,参与有机碳氮循环,在胡麻连作中,变形菌门丰度随连作年限增长而降低,表现出与大豆、硒砂瓜等连作中相似的趋势,不利于作物的生长,但放线菌门丰度却表现出持续增高的趋势,这与大豆连作中的趋势相反,却与烟草、硒砂瓜等连作中的早期趋势相一致,说明随着连作年限进一步增长,胡麻根际土壤内的放线菌门丰度很可能会表现出下降的趋势,从而进一步加剧连作障碍的危害。因此,今后继续深入开展胡麻更长连作时间对细菌群落结构影响研究,将对有效解决胡麻连作障碍十分必要。主成分分析表明,在胡麻不同种植年限的根际土壤内,代表细菌群落分布的距离较远,说明群落结构存在较显著差异。进一步的聚类分析显示,相同连作年限的样品聚集在一个分支,且随连作年限增长样品间聚类水平降低,说明连作改变细菌菌门所占比例,影响菌群结构组成,这与烟草和黄花蒿连作土壤的研究结果一致[7,26]。本研究通过高通量测序分析了胡麻连作条件下根际土壤细菌群落的丰度及其变化规律,这些成果对改良胡麻种植技术及缓解连作障碍提供了理论基础。
参考文献
[1]LIU W X,WANG Q L,WANG B Z,et al. Changes in the abundance and structure of bacterial communities under long-term fertilization treatments in a peanut monocropping system[J]. Plant and Soil,2015, 395( 1/ 2) : 415-427.
[2]侯乾,王万兴,李广存,等.马铃薯连作障碍研究进展[J].作物杂志,2019,( 6) : 1-7.
[3]马玲,马琨,杨桂丽,等.马铃薯连作栽培对土壤微生物多样性的影响[J].中国生态农业学报,2015,23( 5) : 589-596.
[4]SUN L,GAO J S,HUANG T,et al. Parental material and cultivation determine soil bacterial community structure and fertility[J]. FEMS Microbiology Ecology,2015,91( 1) : 1-10.
[5]ALAMI M M,XUE J Q,MA Y T,et al. Structure,function,diversi- ty,and composition of fungal communities in rhizospheric Soil of Cop-tischinensisFranchunder a successive cropping system[J]. Plants, 2020,9( 2) : 244.
[6]岳思君,冯翠娥,杨彦研,等.不同连作年限硒砂瓜土壤细菌群落结构特征[J].干旱地区农业研究,2020,38( 1) : 230-236.
[7]高林,王新伟,申国明,等.不同连作年限植烟土壤细菌和真菌群落结构差异[J].中国农业科技导报,2019,21( 8) : 147-152.
[8]马少兰,马彩霞,徐鹏鑫,等.再植枸杞根际真菌群落对长期连作的响应研究[J].土壤学报,2019,56( 6) : 1493-1503.
[9]陈冬梅,柯文辉,陈兰兰,等.连作对白肋烟根际土壤细菌群落多样性的影响[J].应用生态学报,2010,21( 7) : 1751-1758.
[10]DONG L L,XU J,FENG G Q,et al. Soil bacterial and fungal com- munity dynamics in relation to Panax notoginseng death rate in a con- tinuous cropping system[J]. Scientific Reports,2016,6: 31802.
[11]LING N,DENG K Y,SONG Y,et al. Variation of rhizosphere bacte-rial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer[J]. MicrobiologicalResearch,2014,169( 7/ 8) : 570-578.
[12]BERENDSEN R L,PIETERSE C M J,BAKKER P A H M. The rhi-zosphere microbiome and plant health[J]. Trends in Plant Science, 2012,17( 8) : 478-486.
[13]NIU J J,CHAO J,XIAO Y H,et al. Insight into the effects of differ- ent cropping systems on soil bacterial community and tobacco bacterial wilt rate[J]. Journal of Basic Microbiology,2017,57( 1) : 3-11.
[14]殷继忠,李亮,接伟光,等.连作对大豆根际土壤细菌菌群结构的影响[J].生物技术通报,2018,34( 1) : 230-238.
[15]陈军,王立光,叶春雷,等.耕作制度对胡麻土壤酶活性的影响[J]干旱地区农业研究,2019,37( 3) : 177-184,214
[16]陈军,王立光,叶春雷,等.栽培模式对甘肃旱区胡麻地土壤酶活性及胡麻产量的影响[J].甘肃农业科技,2018,( 5) : 42-46.
[17]罗影,王立光,陈军,等.不同种植模式对甘肃中部高寒区胡麻田土壤酶活性及土壤养分的影响[J].核农学报,2017,31( 6) : 1185-1191.
[18]陈军,罗影,王立光,等.不同种植模式土壤水浸提液对胡麻的化感效应[J].中国土壤与肥料,2017,( 3) : 125-130.
[19]刘震,徐玉鹏,赵忠祥,等.不同年限苜蓿根际土壤细菌群落的多样性[J].江苏农业科学,2020,48( 8) : 184-188.
[20]纳小凡,郑国旗,邢正操,等.连作对再植枸杞根际细菌群落多样性和群落结构的影响[J].土壤学报,2017,54( 5) : 1280-1292.
[21]LI Y,CHI J L,AO J,et al. Effects of different continuous cropping years on bacterial community and diversity of cucumber rhizosphere soil in solar-greenhouse[J]. Current Microbiology,2021,78 ( 6) : 2380-2390.
[22]HUANG Y,XIAO X,HUANG H Y,et al. Contrasting beneficial and pathogenic microbial communities across consecutive cropping fields of greenhouse strawberry [ J ]. Applied Microbiology and Biotechnology,2018,102( 13) : 5717-5729.
[23]CHEN M N,LI X,YANG Q L,et al. Soil eukaryotic microorganism succession as affected by continuous cropping of peanut-pathogenic and beneficial fungi were selected [J]. Plos One, 2012, 7( 7) : e40659.
[24]LI Z G,ZU C,WANG C,et al. Different responses of rhizosphere and non-rhizosphere soil microbial communities to consecutive Piper nigrum L. monoculture[J]. Scientific Reports,2016,6: 35825.
[25]CHENG Z Q,LEI S N,LI Y,et al. Revealing the variation and sta-bility of bacterial communities in tomato rhizosphere microbiota[J]. Microorganisms,2020,8(2) : 170.
[26]李倩,袁玲,杨水平,等.连作对黄花蒿生长及土壤细菌群落结构的影响[J].中国中药杂志,2016,41( 10) : 1803-1810.
文献摘自:王立光,叶春雷,陈军,李进京,罗俊杰.胡麻连作对土壤细菌群落的影响[J].干旱地区农业研究,2022,40(01):70-75.