摘 要:为了应对黑龙江省工业大麻的快速发展所带来的工业大麻花、叶、茎秆、种子等的大量检测需求,本文建立了工业大麻花、叶、茎秆和种子中大麻二酚酸(CBDA)、大麻二酚(CBD)、四氢大麻酚酸(THCA-A)和四氢大麻酚(THC)同时测定的高效液相色谱法。工业大麻花、叶、茎秆和种子中的4种大麻素经20mL的90∶10(V∶V)甲醇-正己烷溶液分两次振荡提取后离心,收集全部上清液混合后,过滤。提取液采用C18色谱柱分离,可变波长紫外检测器检测,基质加标法定量。结果表明:大麻二酚、大麻二酚酸、四氢大麻酚和四氢大麻酚酸4种大麻素在0.5~25.0mg·L-1之间线性关系良好,相关系数R2均大于0.9994,4种大麻素的提取回收率为89.6%~99.7%,相对标准偏差为1.5%~4.8%,检出限为0.1mg·kg-1。该方法具有快速、操作简单、灵敏度高等优点,可满足工业大麻中大麻二酚、大麻二酚酸、四氢大麻酚和四氢大麻酚酸的检测要求。
关键词:大麻素;高效液相色谱;工业大麻;大麻二酚;四氢大麻酚
我国乃至全球对大麻的研究由来已久,目前从大麻中已鉴定出约500种化合物[1]。在这500余种化合物中最受研究者关注的就是大麻素。大麻素是特有的萜烯酚化合物,浓缩在植物毛状体产生的树脂分泌物中,这些毛状体主要集中在雌花序的特定部位。大麻素是一组化学结构类似化合物,已知约100种[2]。在植物组织中,大麻素以酸性(羧化)形式生物合成。发现的最常见的酚酸类大麻素有四氢大麻酚酸A(THCA-A),大麻二酚酸(CBDA)和大麻萜酚酸(CBGA)[3,4]。四氢大麻酚酸以THCA-A和THCA-B两种形式存在[5],THCA-A是四氢大麻酚酸的主要形式,且在大麻样品中只能检测到THCA-A,故将其称为THCA。THCA和CBDA在经过高温干燥的条件下脱羧成为四氢大麻酚(THC)和大麻二酚(CBD)。大麻二酚(CBD)和四氢大麻酚(THC)是工业大麻中研究最广泛使用率最高的2种大麻素[6],两者在医学上的地位逐渐增强,四氢大麻酚(THC)通常被认为是具有精神活性的化合物容易致瘾[7],是我国严格管控的毒品[8,9,10]。为了量化新鲜植物材料中曾经存在的总THC含量和总CBD含量,其中总THC含量为THCA和THC二者的总含量,同理总CBD含量为CBDA和CBD的总含量。
工业大麻是指花叶干物质中总四氢大麻酚含量低于0.3%的大麻品种[11,12,13]。目前工业大麻在纺织、化妆品、食品以及医药等行业均有较大的发展[14,15,16]。随着黑龙江省工业大麻产业的快速发展[17,18],工业大麻的种植面积逐年增加[19,20],目前却缺乏与之相应的能够同时检测工业大麻花、叶、茎秆和种子中大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸测定含量的检测方法。建立能够同时测定工业大麻中4种主要大麻素的高效液相色谱检测技术标准,能有效提升我国工业大麻检测能力和水平,可有效促进黑龙江省工业大麻产业的发展。本方法基于高效液相色谱技术,通过对工业大麻花、叶、茎秆和种子中大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸提取方式、提取溶剂、色谱条件的优化,建立了同时测定工业大麻中4种大麻素含量的高效检测方法,以期满足其快速检测需求。
1材料与方法
1.1材料与仪器
标准品大麻二酚酸(CBDA)、大麻二酚(CBD)、四氢大麻酚酸(THCA-A)和四氢大麻酚(THCA)(1mg·mL-1,1mL)购自美国Cerilliant公司。色谱纯乙腈、正己烷、甲醇、甲酸和乙醇均购自北京迪马欧泰科技发展中心(中国)。分析纯的磷酸购自北京益利精细化学品有限公司(中国北京)。有机系滤膜(尼龙,0.22μm)购自北京迪马欧泰科技发展中心(中国)。
高效液相色谱,配有可变波长紫外检测器(UVD)日本岛津公司;BT 2202 S电子天平德国赛多利公司;CF15RX高速离心机日本日立公司;HS501振荡器德国IKA 公司;VORTEX2 涡旋仪德国IKA公司。
1.2方法
1.2.1试材制备
大麻花、叶、茎秆和种子来自黑龙江省农业科学院经济作物研究所于哈尔滨市道外区民主镇种植的龙麻五号。
大麻花、叶和大麻茎秆于避光通风处阴干,风干后的大麻茎秆用铡刀切成1cm左右的小段,大麻种子混匀。四分法取样,放入食品加工机粉碎,过40目筛,制成试样,放入试样瓶中密封,做上标记,并置于-20℃条件下保存,待测。
1.2.2色谱条件
液相色谱柱:ZORBAX SB-C18(粒径5μm,250mm×4.6mm);柱温:35℃;流速:1.0mL·min-1;进样量:10μL;流动相:0.1%甲酸水溶液+乙腈(25+75),保持25min;检测波长:250nm。
1.2.3标准储备液
分别精密量取1.00mL大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸标准溶液于10mL棕色容量瓶中,用色谱甲醇稀释至刻度,分别配制成浓度为100mg·L-1的标准储备溶液,-20℃以下避光保存。
混合大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸标准储备液:分别精密量取100mg·L-1的4种大麻素标准储备溶液1.0mL,于10mL容量瓶中用色谱甲醇稀释至刻度,配制成大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸浓度为10mg·L-1的混合标准工作溶液,-20℃以下避光保存。
1.2.4提取方法
分别称取粉碎后的大麻花、叶、茎秆或种子约1.0g(精确至0.01g)试样至50mL离心管中。向离心管中加入20mL90∶10(V∶V)的甲醇-正己烷溶液,振荡提取60min,3500r·min-1离心3min。将上清液全部转移至新的50mL离心管中,再次向残渣中加入20mL90∶10(V∶V)的甲醇-正己烷溶液,振荡提取60min,3500r·min-1离心3min,合并提取液,10000r·min-1涡旋混合1min,取2mL混合液经0.22μm有机系滤膜过滤,待测。
1.2.5方法学考察
本研究方法学考察包括检测限(LOD)和定量限(LOQ)。其中LOD拟设定为信噪比为3时的样品添加浓度,LOQ拟设定为信噪比为10时且回收率结果和相对标准偏差符合要求的样品添加浓度。本研究设2个添加浓度进行回收率测定,浓度分别为方法4倍定量限浓度和40倍定量限浓度。定量限以上添加浓度的回收率范围应该在70%~120%之间,结果的变异系数应在20%以内。对大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸的峰面积y和浓度x(mg·L-1)制作工作曲线,设置5个点进行测定。
取混合标准工作液与试样交替进样,采用单点或多点校准,外标法定量。当样品的上机液浓度超过线性范围时,需根据测定浓度,稀释后进行重新测定。
1.2.6试验设计
分别对仪器条件、提取溶剂、提取方法进行优化,通过回收率确定最高效便捷的检测方法。
仪器条件的优化:分别选用了ZORBAX SB-C8(4.6mm×250mm,2.5μm)、ZORBAXSB-C8(4.6mm×150mm,2.5μm)、ZORBAXSB-C18(4.6mm×250mm,2.5μm)和ZORBAXSB-C18(4.6mm×150mm,2.5μm)4种不同的常见色谱柱来确定对大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸的分离度以及峰形;由于大麻二酚酸和四氢大麻酚酸中含有羧酸基,因此选用了甲醇+水,甲醇+0.1%甲酸水,甲醇+0.1%磷酸水,乙腈+0.1%甲酸水4种组合进行分离。
提取溶剂的优化:用混合标准溶液加标大麻花、叶、大麻茎秆和大麻种子,以使上述3种介质中4种大麻素含量均为40mg·kg-1,使用乙腈、乙醇、甲醇和甲醇正己烷90∶10(V∶V)对上述4种大麻素的提取溶剂进行优化。
提取方法的优化:比较振荡(60min)、超声(10,20,30和60min)和均质3种提取方式对添加水平为4mg·kg-1的4种大麻素的提取效果。
1.2.7数据分析
采用Excel 2017处理数据及制作图表。
2结果与分析
2.1HPLC条件优化
2.1.1色谱柱的优化
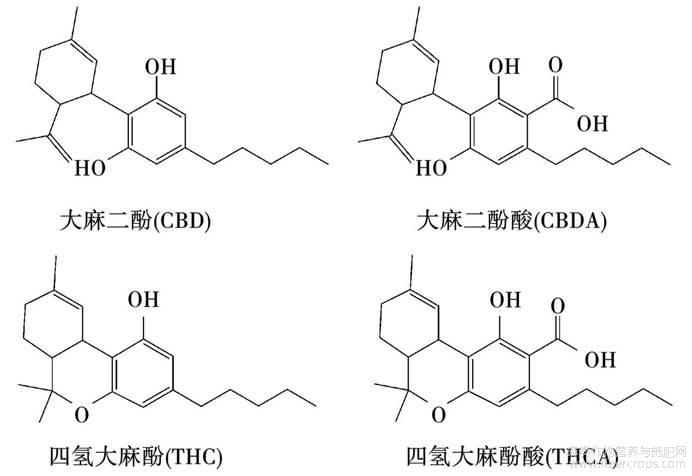
由于大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸在甲醇、乙醇等有机溶液中是非极性化合物(图1),因此选用在反相色谱柱对4种大麻素进行保留和分离。研究发现ZORBAX SB-C18(4.6mm×150mm,2.5μm)色谱柱对4种大麻素的保留最好,分离度高且峰形好。
图1 4种大麻素的结构式
2.1.2分离溶液的优化
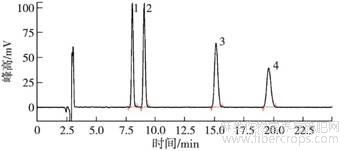
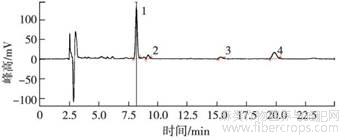
4种提取溶剂中乙腈+0.1%甲酸水对大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸4种大麻素的分离效果和响应最好,因此最终确定流动相采用乙腈—水(0.1%甲酸)系统进行洗脱,流动相比例为75∶25(V∶V),流速为1.0mL·min-1,在25min内4种大麻素得到很好的色谱保留与分离。图2和图3分别为标准品和大麻花叶提取物在ZORBAX SB-C18色谱柱,75∶25(V∶V)乙腈—0.1%甲酸水系统下的色谱图。
1.大麻二酚酸(CBDA);2.大麻二酚(CBD);3.四氢大麻酚(THC);4.四氢大麻酚酸(THCA-A)。
图2 4种大麻素标准品的色谱图(0.01mg·L-1)
2.2提取溶剂的优化
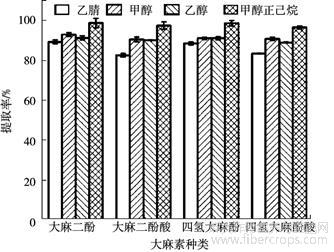
如图4所示,使用乙腈对4种大麻素的提取率为87.2%~89.4%,甲醇对4种大麻素的提取率为90.7%~93.1%,乙醇对4种大麻素的提取率为89.1%~91.4%,90∶10(V∶V)的甲醇正己烷的提取率为96.7%~98.9%。因此,90∶10(V∶V)的甲醇正己烷是提取大麻花、叶、茎秆和种子中4种大麻素的最佳溶剂。
1.大麻二酚酸(CBDA);2.大麻二酚(CBD);3.四氢大麻酚(THC);4.四氢大麻酚酸(THCA-A)。
图3 大麻花、叶提取物的色谱图
图4 提取溶剂对4种大麻素提取率的影响
2.3提取方法的优化
由表1可知,超声提取随着时间的增加,大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸的提取率也逐渐提高,平均提取率由75.4%~78.5%提高至94.3%~96.1%,但仍低于振荡60min的平均提取率。振荡提取操作简便,适合大批量样品,因此本研究选择振荡60min作为4种大麻素的提取方式。
表1 提取方法对4种大麻素提取率的影响
2.4 标准曲线和检出限
本研究选用外标法定量,在确定的最佳条件下,按响应值将大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸配制成含0.5,1.0,5.0,10.0和25.0mg·L-1的混合标准工作溶液,对4种大麻素的峰面积y和浓度x(mg·L-1)制作工作曲线,其标准曲线如下:y大麻二酚酸=44352x大麻二酚酸-15664,R2=0.9995;y大麻二酚=48952x大麻二酚-15047,R2=0.9997;y四氢大麻酚=50863x四氢大麻酚-16623,R2=0.9994;y四氢大麻酚酸=39140x四氢大麻酚酸-9479.2,R2=0.9995。按照噪音理论确定该方法检测4种大麻素的最低检出限LOD(3倍信噪比)均为0.03mg·kg-1,最低定量限LOQ(10倍信噪比,同时符合回收率和变异系数要求)均为0.1mg·kg-1。
2.5 回收率和精密度
在不含有大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸的工业大麻花、叶、茎秆和种子中分别加入4和40mg·kg-1的4种大麻素,每个浓度的样本平行制备5份。回收率结果详见表2,可见4种大麻素的提取回收率为89.6%~99.7%,RSD值均小于5%,表明本方法对4种大麻素的提取效率良好,可以满足工业大麻中4种大麻素的检测分析。
表2 4种大麻素的添加回收率
2.6方法的重复性
在同一实验室,由同一操作者使用相同的仪器设备,按相同测试方法,并在短时间内对同一水平加标样品进行了6次测定,4种大麻素的加标浓度及平行性测定结果可以看出,大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸在4和40mg·kg-1两个水平的平行性测定结果中,其相对标准偏差(RSD)为1.5%~4.8%,表明方法重复性好,能够满足工业大麻中大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸高效液相色谱定量检测重复性的要求。
3讨论
本研究利用高效液相色谱建立了工业大麻中同时提取、分离大麻二酚、大麻二酚酸、四氢大麻酚、四氢大麻酚酸的分析方法。该方法能同时测定工业大麻中4种大麻素,且操作简单、灵敏度高,同时该方法能够与国外测定的目标物一致,与国际工业大麻数据一致,能够满足出口需求[21]。此外,通过规定测试所用的试剂材料、仪器、取样、分析步骤等关键测试要素,使得该方法在选择性、精密度、准确性、检测限和分析效率上有很大的提高。结合黑龙江省仪器配置和测试水平,并考虑黑龙江省工业大麻体系的实际情况,在查阅、收集国内外标准资料的基础上来确定本标准的各项指标及操作步骤,使本方法具有较强的适用性,可推动我国工业大麻的检测工作,最终促进我国工业大麻的快速健康发展。
4结论
参考文献
本文建立了一种基于高效液相色谱法的同时检测工业大麻花、叶、茎秆和种子中4种大麻素的分析方法。本方法的色谱条件为液相色谱柱:ZORBAXSB-C18(粒径5μm,250mm×4.6mm);柱温:35℃;流速:1.0mL·min-1;进样量:10μL;流动相:0.1%甲酸水溶液+乙腈(25+75),保持25min;检测波长:250nm。前处理方法为分别称取粉碎后的大麻花、叶、茎秆或种子约1.0g(精确至0.01g)试样至50mL离心管中。向离心管中加入20mL90∶10(V∶V)的甲醇-正己烷溶液,振荡提取60min,3500r·min-1离心3min。将上清液全部转移至新的50mL离心管中,再次向残渣中加入20mL90∶10(V∶V)的甲醇-正己烷溶液,振荡提取60min,3500r·min-1离心3min,合并提取液,10000r·min-1涡旋混合1min,取2mL混合液经0.22μm有机系滤膜过滤,经高效液相色谱测定。该方法的检出限、定量限、精密度、回收率等结果均较好,可用于实际样品的分析检测。
参考文献
[1]张景,孙武兴,王曙宾,等.工业大麻提取物中四氢大麻酚定量检测方法研究[J].绿色科技,2020(12):216-218,220.
[2]胡赠彬.实验室检测工业大麻及相关产品的安全管理[J].食品安全质量检测学报,2020,11(18):6311-6317.
[3]孙冬梅,兰韬,云振宇,等.火麻油中五种大麻素的HPLC同时检测[J].食品工业科技,2021,42(22):263-269.
[4]吴鹏,杨丽君,刘东麟,等.云南、黑龙江两省工业大麻种植加工的合法化对吉林省的启示[J].中国麻业科学,2021,43(2):88-96.
[5]刘胜贵,马海悦,李智高,等.HPLC法测定工业大麻花叶中的CBD和THC的含量[J].云南化工,2020,47(5):62-64.
[6]张晓艳,王晓楠,曹焜,等.碱性盐胁迫对3个国外引进工业大麻品种萌发特性的影响及评价[J].种子,2021,40(6):58-63.
[7]严江涛,常丽,张江江,等.工业大麻中大麻二酚提取工艺优化和生物活性分析[J].中国麻业科学,2020,42(2):61-69.
[8]孙孔春,陈兴龙,杨璨瑜,等.不同条件下工业大麻中大麻二酚含量变化[J].昆明医科大学学报,2020,41(5):23-28.
[9]唐慧娟,臧巩固,程超华,等.工业大麻产量和品质性状的对应分析[J].作物杂志,2018(2):20-24.
[10]周莹,陈念念,韩丽,等.国内外工业大麻食品法律法规及大麻素检测方法研究进展[J].食品安全质量检测学报,2019,10(23):7959-7966.
[12]张庆滢,郭蓉,许艳萍,等.不同类型地膜覆盖对工业大麻生长和产量的影响[J].中国麻业科学,2020,42(5):239-243.
[13]孙哲,王金娥,乔永刚.工业大麻发育早期雌雄株鉴定方法的研究[J].农业与技术,2021,41(14):70-71.
[14]许艳萍,杨明,郭鸿彦,等.5个工业大麻品种对5种重金属污染土壤的修复潜力[J].作物学报,2020,46(12):1970-1978.
[15]孟沛鑫,赵毅,贾明宏.ICP-MS法测定不同品种工业大麻秆中5种重金属元素[J].安徽农业科学,2021,49(9):177-179.
[16]解国庆,董清山,范书华,等.八个不同基因型工业大麻(药用)在黑龙江省东南部的适应性评价[J].黑龙江农业科学,2021(6):9-12.
[17]黄峰华.黑龙江省麻类产业现状及发展建议[J].辽宁农业科学,2017(5):70-71.
[18]张明,张利国,房郁妍,等.黑龙江省工业大麻产业现状及未来发展建议[J].黑龙江农业科学,2020(12):123-125.
[19]赵越,王晓楠,孙宇峰,等.工业大麻纤维产量、品质影响因素及纤维发育相关基因研究进展[J].中国麻业科学,2021,43(3):155-160.
[20]王明明,景尚友,李彩华,等.浅析黑龙江省药用大麻品种选育策略[J].现代化农业,2020(8):36-37.
文章摘自:陈国峰,尤宏梅,王贵江,张晓波,刘峰,董见南,黄文功,任红波.高效液相色谱法同时测定工业大麻中四种大麻素的方法研究[J].黑龙江农业科学,2021(11):60-64.