摘 要:MADS-box是植物重要的转录调控因子,参与种子休眠和萌发、根系生长、花器官发育、果实成熟等营养生长和生殖生长过程。我们前期研究结果表明AhMADS8937可能参与调控剑麻株芽的发育。鉴于MADS-box蛋白能以复合体的形式调控植物发育,因此为筛选剑麻(Agave hybrid No.11648)中与AhMADS8937蛋白相互作用的蛋白,本研究构建了pGBKT7-AhMADS8937诱饵表达载体,酶切验证和测序结果表明载体构建成功。将重组载体转化Y2HGold酵母感受态,检测其对酵母菌株是否有毒性,以及是否存在自激活。结果表明pGBKT7-AhMADS8937诱饵载体对Y2HGold酵母菌无毒性但存在自激活,5mmol/L的3-氨基1,2,4-三唑(3-Amino-1,2,4-triazole,3-AT)可抑制其自激活。本研究成功构建AhMADS8937酵母双杂交诱饵载体,为筛选与AhMADS8937相互作用的蛋白,解析剑麻株芽发育的分子调控网络打下基础。
剑麻(Agave sisalana Perr.)是天门冬科龙舌兰属单子叶、单次开花的多年生植物,是热带亚热带地区的重要经济作物,主要被用来提取纤维、皂素和酿酒(Davis et al.,2019)。剑麻可以通过有性和无性方式进行繁殖,其中吸芽和株芽是剑麻无性繁殖的材料。花脱落后,株芽逐渐在花的脱落口附近开始发育,直到形成完整的根茎叶结构,从母体脱落后遇土即可生长。单株剑麻可产生500-3000多颗株芽(Szarek and Holmesley,1996)。通过这种方式,剑麻提高了繁殖成功率和子代的成活率,以应对极端干旱和高温环境。株芽繁殖方式在自然界较少见,对其发育机制知之甚少。“假胎生”理论认为花发育被终止后,转而发育成新的叶或者株芽,发育过程受到外部环境和内部因子的调控(Diggle.,1997)。一种假设认为株芽是由保持分裂能力的无活力细胞在诱导后重启动发育而来;另一种假设认为株芽是在花梗的特定区域从头发育形成(Kerstetter and Hake.,1997;Tooke et al.,2019)。由这两种假说可以发现,株芽的发育与花的发育、脱落和新的分生组织形成密切相关。
MADS-box(MCMl、AGAMOUS、DEFICIENS、SRF4) 是调节植物花器官形成和脱落的重要调控基因 (Bey et al.,2004;Rijpkema et al.,2006; Cheng et al.,2021;Noor et al.,2014;Mao et al.,2000)。在剑麻研究中,Zhou(2012)等在Agave hybrid No.11648中发现了4个Ⅱ型MADS-box基因,其中AhMADS-box1/2/6在花芽发育初期表达量最高,随着花的形成其表达量降低。Sandoval(2012)从Agave tequilana(龙舌兰)中发现AtqMADS1/2/4/6/7在株芽发育过程中的转录水平逐渐降低,而AtqMADS3的转录水平先增加后降低。我们以AhKNOX2(Agave hybrid Knotted1-like homeobox 2)为诱饵蛋白,通过酵母双杂交系统,在Agave hybrid No.11648的cDNA表达文库中筛选到一个MADS-box基因—AhMADS8937(杨子平等,2020)。AhKNOX2调控剑麻株芽的发育(Abraham-Juárez et al.,2010),而MADS-box能以复合体的形式调控其他植物的器官发育及脱落(Seok et al.,2010 Cseke et al.,2003;Sun et al.,2017;Nakano et al.,2012;Liu et al.,2014)。所以我们认为剑麻AhMADS8937可能通过复合体的形式调控剑麻株芽的发育。为了获得与AhMADS8937相互作用的蛋白,构建AhMADS8937蛋白的调控网络,本研究构建了AhMADS8937的酵母双杂交诱饵载体,并检测其毒性和自激活性。结果表明诱饵载体对Y2HGold酵母菌无毒性但存在自激活性,5mmol/L的3-氨基-1,2,4-三唑(3-Amino-1,2,4- triazole,3-AT)能抑制自激活性,该结果为下一步通过酵母双杂交筛选剑麻中与其互作的蛋白奠定基础。
1结果与分析
1.1剑麻AhMADS8937基因诱饵载体的构建
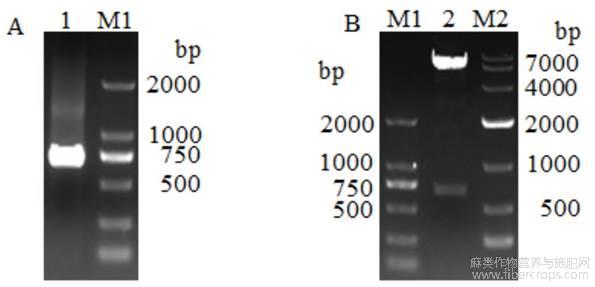
以携带剑麻AhMADS8937基因的质粒为模板,上下游带EcoR Ⅰ酶切位点的特异引物进行PCR扩增,获得695bp长的条带 (图1A)。利用限制性内切酶EcoR Ⅰ对重组载体pGBKT7-AhMADS8937质粒单酶切。琼脂糖电泳结果显示,出现一条7000bp左右的载体条带和一条750bp左右的目的条带(图1B),说明载体构建成功。测序结果表明插入片段序列没有发生突变,可以用于下一步试验。
图1 AhMADS8937基因的扩增及pGBKT7-AhMADS8937诱饵载体构建
注:A:AhMADS8937基因扩增电泳检测;B:pGBKT7-AhMADS8937诱饵载体酶切检测;M1:DL2000 DNA Marker;M2:DL 10000 DNA marker;1:AhMADS8937扩增产物;2:pGBKT7-AhMADS8937质粒酶切产物Note:A:Amplification and electrophoresis detection of AhMADS8937 gene;B:Restriction detection of pGBKT7-AhMADS8937 bait vector;M1: DL2000 DNA Marker;M2:DL 10000 DNA marker;1:AhMADS8937 amplification products;2:pGBKT7-AhMADS8937 plasmid enzyme digestion products
1.2诱饵载体毒性检测
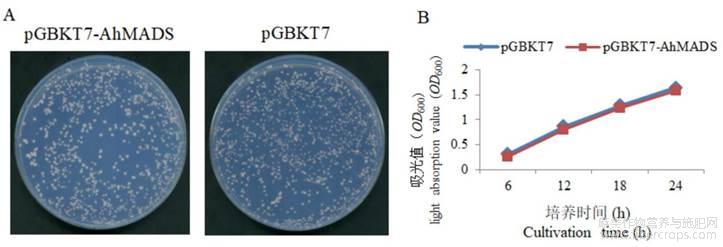
为检测诱饵载体对Y2HGold酵母菌是否有毒性作用,将分别含诱饵载体pGBKT7-AhMADS8937和空载体pGBKT7的Y2HGold酵母菌株涂布于SD/-Trp(不含色氨酸)固体培养基上。SD/-Trp固体培养基上,生长的酵母单菌落直径大于2mm(图2A);挑取单克隆接种于SD/-Trp液体培养基后,携带诱饵载体的Y2HGold酵母菌与含空载体的酵母菌在SD/-Trp液体培养基中的生长趋势接近,接种14h之后,培养液的OD600值大于0.8,接种24h之后,培养液的OD600值为1.5(图2B)。两个结果说明pGBKT7-AhMADS8937对酵母Y2HGold菌株没有毒性作用。
图2 诱饵pGBKT7-AhMADS8937载体毒性检测
注:A:含空载体pGBKT7和诱饵载体pGBKT7-AhMADS8937的酵母菌在SD/-Trp培养基的生长状况;B:含空载体pGBKT7和诱饵载体pGBKT7-AhMADS8937的酵母菌生长曲线Note:A:Growth of yeast containing empty vector pGBKT7 and bait vector pGBKT7-AhMADS8937 in SD/-Trp medium;B:The growth curve of yeast containing vector pGBKT7 and bait vector pGBKT7-AhMADS8937
1.3诱饵载体自激活检测
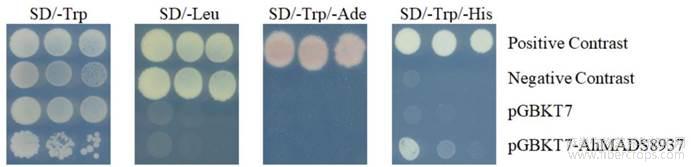
诱饵载体自激活试验结果显示(图3),含阳性对照载体的酵母在4种培养基上均能生长;阴性对照只在SD/-Trp和SD/-Leu(不含亮氨酸) 两种培养基生长,含pGBKT7空载体的酵母菌只能在SD/-Trp培养基上生长,在其他4种培养基上无菌落生长;含pGBKT7-AhMADS8937的酵母菌在SD/-Trp和SD/-Trp/-His(不含色氨酸和组氨酸)培养基上生长,在SD/-Leu和 SD/-Trp/-Ade (不含色氨酸和腺嘌呤)上无菌落生长。实验结果表明pGBKT7-AhMADS8937对ADE2报告基因没有激活作用但能激活HIS3报告基因的表达,说明该诱饵载体存在自激活性。
图3 pGBKT7-AhMADS8937自激活检测
1.4 3-AT抑制浓度的筛选
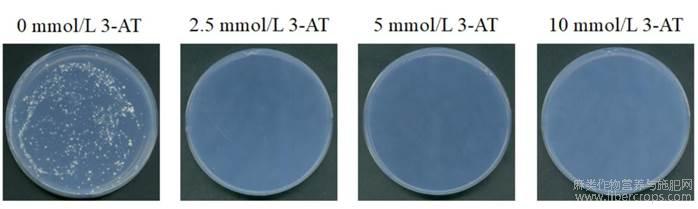
由于pGBKT7-AhMADS8937存在自激活,能够在缺组氨酸的培养基上生长,需要筛选抑制诱饵载体激活的背景生长。我们分析了含0、2.5、5、10mmol/L3-AT的SD/-Trp/-His培养基上酵母菌的生长情况,结果显示Y2HGold酵母在含0mmol/L3-AT的SD/-Trp/-His培养基上能生长;在含2.5、5、10mmol/L3-AT及以上浓度的SD/-Trp/-His培养基上不能生长(图4)。说明5mmol/L的3-AT可以抑制pGBKT7-AhMADS8937的自激活性背景。
图4不同浓度3-AT下酵母菌生长状况
2讨论
酵母双杂交是在酵母细胞体内研究蛋白质相互作用的技术,能够以特定蛋白作为诱饵,从指定的cDNA文库中筛选出与之相互作用的蛋白(Vojtek et al.,1993;Wang et al.,2020)。酵母双杂交凭借其独特的优势成为研究蛋白质互作的有力工具。首先,蛋白质互作发生在酵母细胞内,保证了蛋白质结构不被破坏;其次,酵母双杂交系统敏感度高,能检测到较弱的蛋白质互作;另外,可以直接获得互作蛋白的核酸序列,省略了蛋白质提取纯化等繁琐步骤。然而,由于典型的转录因子具备DNA结合域和转录激活域(Keegan et al.,1986; Ma and Ptashne.,1987),在利用酵母双杂交筛选互作蛋白之前,必须检测其自激活性并筛选抑制自激活的最佳抑制剂浓度,以减少酵母双杂交中的假阳性。3-氨基-1,2,4-三氮唑(3-AT)是组氨酸合成酶的竞争性抑制剂,能够抑制组氨酸的合成 (Durfee et al.,1993)。本实验中pGBKT7-AhMADS8937可以在缺乏色氨酸(SD/-Trp) 和双缺色氨酸、组氨酸 (SD/-Trp/-His) 的培养基上生长,说明该基因可激活HIS3报告基因的表达,存在自激活性。经筛选,SD/-Trp/-His培养基中添加5mmol/L 3-AT能抑制pGBKT7-AhMADS8937的自激活。
Sandoval等(2012)发现MADS-box调控剑麻的开花以及花器官的发育,同时发现MADS-box在株芽发育的不同阶段表达量发生改变,暗示MADS-box可能参与剑麻株芽的发育。Abraham-Juárez等(2010)发现龙舌兰中AtqKNOX1/2的表达量随着株芽的发育逐渐升高,原位杂交结果表明AtqKNOX2在株芽形成的早期和后期均发挥作用,而AtqKNOX1仅在株芽形成后期发挥作用(Abraham-Juárez et al.,2010),表明KNOX调控了株芽的发育。我们以AhKNOX2为诱饵载体筛选获得一个MADS-box蛋白,这一结果不仅暗示MADS-box参与了剑麻的株芽发育,同时表明MADS-box可能以复合体的形式参与株芽发育的调控。在其他植物中,MADS-box通过复合体的形式调控了多个发育事件。例如,水稻OsMADS1与OsMADS4形成二聚体后,可进一步与OsMADS6、OsMADS7、OsMADS8等蛋白形成多聚复合物调控花柱发育(Seok et al.,2010);杨树MADS-box蛋白PTM5与肌动蛋白解聚因子(PtADF) 和富含亮氨酸重复序列蛋白(PtLRR)互作,调控木质部发育(Cseke et al.,2003)。Nakano报道番茄中两个调控离区发育的MADS-box蛋白MACROCALYX(MC)和JOINTLESS蛋白之间存在相互作用(Nakano et al.,2012)。Liu报道MC、JOINTLESS和SEPALLATA(SEP)3个MADS-box蛋白形成三元复合体,调控番茄离区的发育(Liu et al.,2014)。我们的研究表明AhMADS8937与AhKNOX2存在直接相互作用关系,但是AhMADS8937与AhKNOX2相互作用调控株芽发育的机制尚不明确。同时,有必要筛选其他与AhMADS8937相互作用的蛋白,以完善AhMADS8937调控株芽发育的分子网络。
3方法与材料
3.1材料
携带AhMADS8937基因的pGADT7质粒为本实验室保存。PCR产物纯化试剂盒、普通质粒小提试剂盒购自北京中科瑞泰生物公司。限制性内切酶EcoR Ⅰ、Hi-Fushion连接酶、KOD高保真酶购自江苏愚公生物技术公司。扩增引物由广东省艾基生物公司合成。
3.2剑麻AhMADS8937基因的扩增
设计上下游带EcoR Ⅰ酶切位点的引物(表1),以携带AhMADS8937基因的质粒为模板、使用KOD高保真酶进行PCR扩增,反应体系如下:2×KOD EZ Buffer 25μL,10mmol/L的dNTPs 1μL,cDNA模板2μL,pGBKT7-AhMADS8937-F和pGBKT7-AhMADS8937-R引物各1μL,用NF Water补齐至50μL。PCR程序扩增为:94℃ 2min;98℃ 30s,58℃ 30s,68℃ 1min,35循环;68℃ 5min。扩增产物用1%琼脂糖凝胶电泳检测。
表1 AhMADS8937扩增引物
|
引物名称 |
引物序列 (5'-3') |
用途 |
酶切位点 |
|
Primer name |
Primer sequence(5'-3') |
Using |
Restriction sites |
|
BK-AhMADS8937-F |
ATGGCCATGGAGGCCGAATTCATGGCGAGGGAGAAGATTCAA |
诱饵载体构建 Bait vector construction |
EcoR Ⅰ |
|
BK-AhMADS8937-R |
TCGACGGATCCCCGGGAATTCCTTCCATGGCAGACCTAACTTGA |
3.3pGBKT7-AhMADS8937诱饵载体的构建
利用PCR产物纯化试剂盒,对扩增获得的剑麻AhMADS8937片段进行纯化。pGBKT7载体质粒用EcoR Ⅰ单酶切,切胶回收线性化载体。将目的条带和线性化载体用Hi-Fushion连接酶连接,50℃,30min;采用热激法将连接液转化大肠杆菌DH5α菌株,转化液涂于含Kan抗生素的LB平板上,37℃倒置培养12h。挑取单克隆进行菌落PCR鉴定。将阳性克隆扩大培养并提取质粒,并对质粒进行PCR扩增和酶切验证,验证正确的质粒由广东艾基生物科技有限公司进行测序。酶切验证和测序正确的质粒用于下一步实验。
3.4酵母Y2HGold感受态的制备及重组质粒转化
进行酵母感受态制备时,将保存的Y2HGold甘油菌解冻后划线于YPDA固体培养基上,28℃倒置培养4d。将活化的Y2HGold酵母菌接种于5mL YPDA培养基中,28℃,200r/min振荡培养过夜。吸取1mL菌液接种至100mL YPDA培养基中,振荡培养至OD600=0.60。将菌液分装至2个灭菌50mL离心管中,9000r/min离心5min收集菌体。弃上清,菌体沉淀用30mL灭菌水重悬,9000r/min离心5min,弃上清。菌体沉淀用1.5mL 1.1×TE/LiAC重悬,12000r/min离心15 s后弃上清。菌体用600μL 1.1×TE/LiAC悬浮,置于冰上待用。
将重组质粒转化酵母感受态时,10μL carrier DNA于96℃变性5min,冰浴2min。将10μL变性的 carrier DNA与待转化质粒混匀,加入50μL新鲜制备的Y2HGold酵母感受态和500μL PEG/LiAC混合后混匀,30℃孵育30min,每10min上下颠倒混匀。加入20μL DMSO吸打混匀,42℃孵育15min,颠倒混匀。12000r/min离心15s后弃掉上清液,加1mL YPDA培养基,28℃,200r/min振荡培养90min。12000r/min离心15s收集菌体,弃掉上清液加1mL生理盐水,吸取100μL菌体涂布于SD/-Trp平板,30℃静置培养3d。
3.5 pGBKT7-AhMADS8937诱饵载体毒性及自激活检测
将pGBKT7-AhMADS8937和pGBKT7质粒分别转化Y2Hgold酵母菌,转化产物涂布在SD/-Trp培养基上,从SD/-Trp培养基上挑取单克隆接种于SD/-Trp液体培养基中,28℃,200r/min振荡培养。测定培养后的第6、12、18、24h的OD600的吸光值,分析pGBKT7-AhMADS8937诱饵载体对Y2HGold酵母菌是否有毒性。
将pGBKT7-AhMADS8937和pGBKT7质粒分别转化Y2HGold酵母菌,转化产物分别涂布在SD/-Leu、SD/-Trp/-Ade、SD/-Trp/-His培养基上,28℃培养4d,观察各培养基上菌落生长状况,分析pGBKT7-AhMADS8937诱饵载体是否具有自激活性。
3.6 3-AT抑制浓度的筛选
将含重组质粒的pGBKT7-AhMADS8937的Y2HGold酵母菌涂布于含0、2.5、5、10mmol/L 3-AT (3-氨基1,2,4-三唑) 的SD/-Trp/-His培养基上,28 ℃倒置培养8d,观察不同抑制浓度下酵母菌的生长情况,分析最佳3-AT抑制浓度。
参考文献
[1]Abraham-Juárez M.J.,Martínez-Hernández A.,Leyva-González M.A.,Herrera-Estrella L.,and Simpson J.,2010,Class IKNOX genes are associated with organogenesis during bulbil formation in Agave tequilana,J.Exp.Bot.,61(14):4055-4067.
[2]Bey M.,Stuber K.,Fellenberg K.,Schwarz-Sommer Z.,Sommer H.,Saedler H.,and Zachgo S.,2004,Characterization of Antirrhinum petal development and identification of target genes of the class B MADS-box gene DEFICIENS,Plant Cell,16(12):3197-3215.
[3]Cheng X.Q.,Wang H.T.,Wei H.L.,Gu L.J.,Hao P.B.,Sun H.R.,Wu A.M.,Cheng S.S.,and Yu S.X.,2021,The MADS transcription factorGhAP1.7 coordinates the flowering regulatory pathway in upland cotton(Gossypium hirsutum L.),Gene,769:145235.
[4]Cseke L.J.,Zheng J.,and Podila G.K.,2003,Characterization ofPTM5 in aspen trees: a MADS-box gene expressed during woody vascular development,Gene,318(30):55-67.
[5]Davis S.C.,Simpson J.,Gil-Vega K.D.C.,Niechayev N.A.,Tongerlo E.V.,Castano N.H.,Dever L.V.,and Búrquez A.,2019,Undervalued potential of crassulacean acid metabolism for current and future agricultural production,J.Exp.Bot.,70(22):6521-6537.
[6]Diggle P.K.,1997,Extreme preformation in alpinePolygonum viviparum:an architectural and developmental analysis,Am.J.Bot.,84(2):154-169.
[7]Durfee T.,Becherer K.,Chen P.L.,Yeh S.S.,Yang Y.,Kilburn A.E.,Lee W.H.,and Elledge S.J.,1993,The retinoblastoma protein associates with the protein phosphatase typeⅠ catalytic subunit,Genes Dev.,7(4):555-569.
[8]Keegan L.,Gill G.,and Ptashne M.,1986,Separation of DNA bind from the transcription-activating function of eukaryotic regulatory protein,Science,231(4739): 699-704.
[9]Kerstetter R.A.,and Hake S.,1997,Shoot meristem formation in vegetative development,Plant Cell,9(7):1001-1010.
[10]Liu D.M.,Wang D.,Qin Z.R.,Zhang D.D.,Yin L.J.,Wu L.,Colasanti J.,Li A.,and Mao L.,2014,The SEPALLATA MADS-box protein SLMBP21 forms protein complexes with JOINTLESS and MACROCALYX as a transcription activator for development of the tomato ?ower abscission zone,Plant J.,77(2):284-296.
[11]Ma J.,and Ptashne M.,1987,A new class of yeast transcriptional activators,Cell,51(1):113-119.
[12]Mao L.,Begum D.,Chuang H.W.,Budiman M.A.,Szymkowiak E.L.,Irish E.E.,and Wing R.A.,2000,JOINTLESS is a MADS-box gene controlling tomato ?ower abscission zone development,Nature,406(6798):910-913.
[13]Nakano T.,Kimbara J.,Fujisawa M.,Kitagawa M.,Ihashi N.,Maeda H.,Kasumi Y.,and Ito Y.,2012,MACROCALYX and JOINTLESS interact in the transcriptional regulation of tomato fruit abscission zone development,Plant Physiol.,158(1): 439-450.
[14]Noor S.H.,Ushijima K.,Murata A.,Yoshida K.,Tanabe M.,Tanigawa T.,Kubo Y.,and Nakano R.,2014,Double flower formation induced by silencing of C class MADS-box genes and its variation amongPetunia cultivars,Sci.Hortic.,178:1-7.
[15]Rijpkema A.S.,Royaert S.,Zethof J.,Weerden G.,Gerats T.,and Vandenbussche T.,2006,Analysis of thePetunia TM6 MADS-box gene reveals functional divergence within the DEF/AP3 lineage,Plant Cell,18(8):1819-1832.
[16]Sandoval S.D.C.D.,Juárez M.J.A.,and Simpson J.,2012,Agave tequilana MADS genes show novel expression patterns in meristems,developing bulbils and floral organs,Sex. Plant Reprod.,25(1):11-26.
[17]Seok H.Y.,Park H.Y.,Park J.I.,Lee Y.M.,Lee S.Y.,An G.,and Moon Y.H.,2010,Rice ternary MADS protein complexes containing class B MADS heterodimer,Biochem. Bioph. Res. Co.,401(4):598-604.
[18]Sun C.H.,Yu J.Q.,Wen L.Z.,Guo Y.H.,Sun X.,Hao Y.J.,Hu D.G.,and Zheng C.S.,2018,Chrysanthemum MADS-box transcription factor CmANR1 modulates lateral root development via homo-/heterodimerization to influence auxin accumulation in Arabidopsis,Plant Sci.,266:27-36.
[19]Szarek S.R.,and Holmesley G.E.,1996,Physiological activity in persistent bulbils ofAgave vilmoriniana (Agavaceae),Am. J. Bot.,83(7):903-909.
[20] Vojtek A.B.,Hollen-berg S.M.,and Cooper J.A.,1993,Mammalian ras interacts directlywith these rine threonine kinase raf,Cell,74(1):205-230.
[21]Wang C.,Zhang L.,Li Y.,Ali Buttar Z.,Wang N.,Xie Y.,and Wang C.,2020,Single nucleotide mutagenesis of theTaCHLI gene suppressed chlorophyll and fatty acid biosynthesis in common wheat seedlings,Front. Plant Sci.,11:97.
[22]Yang Z.P.,Sun Y.H.,Yang Q.,Lu Z.W.,Zhang Y.M.,Li J.F.,and Zhou W.Z.,2020,Construction of yeast two-hybrid library ofAgave Hybrid No.11648 and screening of proteins interacting with AhKNOX2,Redai Zuowu Xuebao (Chinese Journal of Tropical Crops),41(9):1748-1755.(杨子平,孙艺桓,杨倩,鹿志伟,张燕梅,李俊峰,周文钊,2020,剑麻酵母双杂交cDNA表达文库的构建及与AhKNOX2相互作用蛋白的筛选,热带作物学报,41(9):1748-1755.)
[23]Zhou W.Z.,Zhang Y.M.,Lu J.Y.,and Li J.F.,2012,Construction and evaluation of normalized cDNA libraries enriched with full-length sequences for rapid discovery of new genes from sisal(Agave sisalana Perr.)different developmental stages,Int.J.Mol.Sci.,13(10):13150-13168
文章摘自:杨茜,徐蕾,汪询,杨子平,周文钊.剑麻AhMADS8937基因酵母双杂交诱饵载体的构建、毒性和自激活检测[J/OL].分子植物育种:1-11[2021-12-22].