摘 要:本发明提供一种红麻HcPDS基因VIGS沉默体系,属于基因工程技术领域。通过构建含有HcPDS基因特异性片段的pTRV2病毒沉默表达载体,该载体经农杆菌介导转化红麻,诱导红麻内源HcPDS基因发生沉默,有效降低了红麻HcPDS基因的表达水平,导致白化表型。包括如下步骤:构建重组病毒质粒pTRV2-HcPDS;制备侵染液;农杆菌介导法侵染红麻,并后续检测基因沉默效率。本发明的有益效果是首次在红麻中应用VIGS技术体系,为VIGS技术体系在红麻上的大规模应用奠定了基础。
技术要点
1.一种红麻八氢番茄红素脱氢酶基因HcPDS,其特征在于:其全长基因的核苷酸序列如SEQ ID NO.1所示。
2.一种用于沉默红麻八氢番茄红素脱氢酶基因HcPDS的HcPDS基因特异性片段,其特征在于:所述HcPDS基因特异性片段的核苷酸序列如SEQ ID NO.4所示。
3.一种沉默红麻八氢番茄红素脱氢酶基因HcPDS的VIGS载体,其特征在于:利用gateway重组克隆技术将HcPDS基因特异性片段连接至VIGS病毒骨架载体pTRV2中,构建获得重组病毒载体pTRV2-HcPDS。
4.一种红麻八氢番茄红素脱氢酶基因HcPDS的VIGS沉默体系,其特征在于,其构建方法包括以下步骤:
(1)通过冻融法将重组病毒载体pTRV2- HcPDS转化到农杆菌GV3101感受态细胞,PCR鉴定阳性;
(2)将转化后的阳性农杆菌菌液与pTRV1菌液按菌液体积比1:1混合制成混合菌液;
(3)通过侵泡法将红麻种子在步骤(2)的混合菌液中侵泡24h;
(4)检测:将侵泡后的种子播种后置于培养温度为22℃,光照/黑暗=14h/10h的条件下生长,观察新长出的红麻叶片的表型变化,并检测叶片中八氢番茄红素脱氢酶基因HcPDS的表达情况,即构建得到红麻八氢番茄红素脱氢酶基因HcPDS沉默体系。
5.如权利要求2所述的HcPDS 基因特异性片段在沉默红麻八氢番茄红素脱氢酶基因HcPDS中的应用。
6.如权利要求3所述的一种沉默红麻八氢番茄红素脱氢酶HcPDS基因的VIGS载体在沉默红麻八氢番茄红素脱氢酶基因HcPDS中的应用。
7.如权利要求4所述的一种红麻八氢番茄红素脱氢酶基因HcPDS的VIGS沉默体系在沉默红麻八氢番茄红素脱氢酶基因HcPDS中的应用。
技术领域
本发明属于植物基因工程技术领域,具体为一种红麻HcPDS基因VIGS沉默体系。
背景技术
病毒诱导的基因沉默(virus-induced gene silencing,VIGS)是通过插入目的基因片段的重组病毒来抑制植物内源基因表达的遗传技术,主要用于基因的功能分析,是植物体内普遍存在的一种遗传免疫机制,属于转录后沉默。与基因敲除和突变体筛选等转基因技术相比,VIGS技术无需构建转基因植株,具有周期短、操作简便和成本低等优点,是目前功能基因组学研究领域常用的技术手段之一。广泛应用于植物的生长发育、抗虫病和代谢调控等相关基因功能研究。到目前为止。TRV-VIGS已在茄属的番茄、烟草、辣椒、拟南芥、麻风树、矮牵牛、罂粟等植物上成功应用。
红麻(Hibiscus spp.)是继棉花和黄麻之后的世界上第三大天然纤维作物,广泛在亚热带和热带地区种植,主要分布在中国、印度、泰国、孟加拉国、越南、印度尼西亚、巴西、古巴、伊朗与埃及等。由于红麻韧皮部纤维具有抑菌、透气、吸湿性好和可降解等特点,被视为21世纪潜在的优势作物。
发明内容
本发明的目的在于提供一种红麻HcPDS基因VIGS沉默体系。该体系实现简单、快速、高通量分析鉴定红麻HcPDS基因功能。
为实现上述目的,本发明采用以下技术方案:
一种红麻八氢番茄红素脱氢酶基因HcPDS(Phytoene desaturase),其全长基因序列如SEQ ID NO.1所示。
一种用于沉默红麻八氢番茄红素脱氢酶基因HcPDS的HcPDS基因特异性片段,其核苷酸序列如SEQ ID NO.4所示。
一种沉默红麻八氢番茄红素脱氢酶基因HcPDS的VIGS病毒载体,利用gateway重组克隆技术将HcPDS基因特异性片段连接至VIGS病毒骨架载体pTRV2中,构建获得重组病毒载体pTRV2-HcPDS。
一种红麻八氢番茄红素脱氢酶基因HcPDS的VIGS沉默体系,其建立方法包括以下步骤:
(1)通过冻融法将重组病毒载体pTRV2-HcPDS转化到农杆菌GV3101感受态细胞,PCR鉴定阳性;
(2)将转化后的阳性农杆菌菌液与pTRV1菌液按菌液体积比1:1混合制成混合菌液;
(3)通过侵泡法将红麻种子在步骤(2)的混合菌液中侵泡24h;
(4)将侵泡后的种子播种后置于培养条件为22℃,光照/黑暗=14h/10h的条件下生长,观察新长出的红麻叶片的表型变化,并检测叶片中HcPDS的表达情况,即构建得到红麻HcPDS基因序列沉默体系。
上述HcPDS基因特异性片段在沉默红麻八氢番茄红素脱氢酶基因HcPDS中的应用。
上述一种沉默红麻八氢番茄红素脱氢酶HcPDS基因的VIGS载体在沉默红麻HcPDS基因中的应用。
上述的一种红麻HcPDS基因VIGS沉默体系在沉默红麻八氢番茄红素脱氢酶基因HcPDS中的应用。
上述红麻八氢番茄红素脱氢酶基因(HcPDS,Phytoene desaturase),全长基因序列的获得:在TAIR网站(https://www .arabidopsis.org/)获得拟南芥AtPDS(AT4G14210)基因蛋白质序列。然后,在NCBI网站(https://www.ncbi.nlm.nih.gov/, Sequence Read Archive(SRA)登录号PRJNA596386),利用红麻优良品种福红952的参考基因组(Zhang et al.,2020, Plant Biotechnology Journal,DOI:10.1111/pbi.13341),通过BLASTP查找红麻同源基因,获得八氢番茄红素脱氢酶基因HcPDS的全长基因序列,其核苷酸序列如SEQ ID NO.1所示。
上述HcPDS基因特异性片段的获得:以八氢番茄红素脱氢酶基因HcPDS的全长基因序列为模板,设计用于扩增HcPDS基因CDS结构域上的250bp特异性片段的引物HcPDS-F和HcPDS-R;其核苷酸序列分别为:
HcPDS-F:SEQ ID NO.2:5’-GGGGACAAGTTTGTACAAAAAAGCAGGCTTCCGTTAATTTTTTGGAGGCTGCT-3’
HcPDS-R:SEQ ID NO.3:5’-GGGGACCACTTTGTACAAGAAAGCTGGGTCGTAGGCCCCGAAGAATATGTGT-3’
取红麻的幼嫩叶片,用OMEGA试剂盒操作步骤提取RNA,按照TaKaRa反转录试剂盒操作步骤合成cDNA第一链,于-20℃保存。以cDNA为模板利用设计的特异性引物HcPDS-F和HcPDS-R PCR扩增HcPDS 基因特异性片段,其大小为250bp,核苷酸序列如SEQ ID NO.4所示。
本发明的有益效果为:
(1)本发明首次构建了红麻HcPDS基因VIGS沉默体系,获得了具有能够使红麻基因沉默的体系。
(2)本发明通过,并采用烟草脆裂病毒构建红麻HcPDS基因沉默体系,能够在红麻植株内进行系统扩散传播。
(3)本发明所述沉默体系能够有效降低红麻HcPDS基因的表达水平,叶绿素被漂白。
附图说明
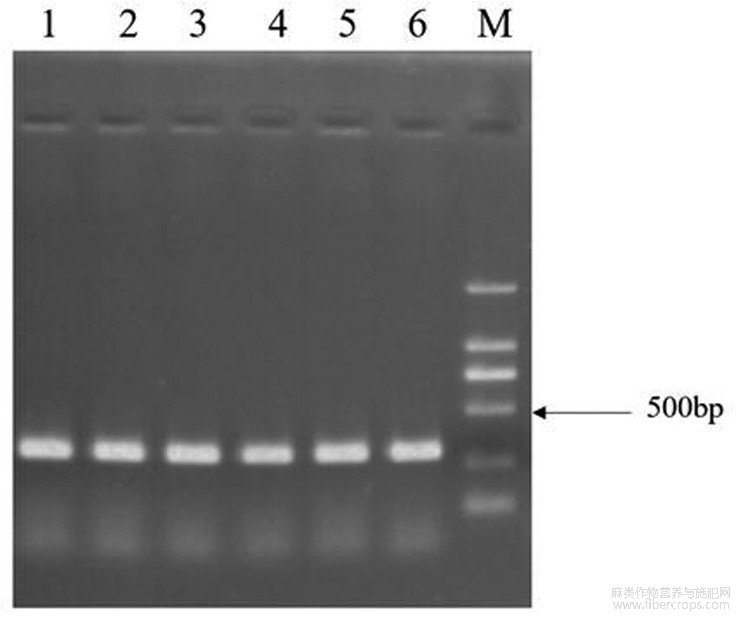
图1构建重组病毒载体pTRV2-HcPDS农杆菌菌液PCR的琼脂糖凝胶电泳图。M:DNA ladder DL2000;1-6:农杆菌克隆。
图2沉默载体侵染红麻幼苗后出现的新叶的白化表型形状。
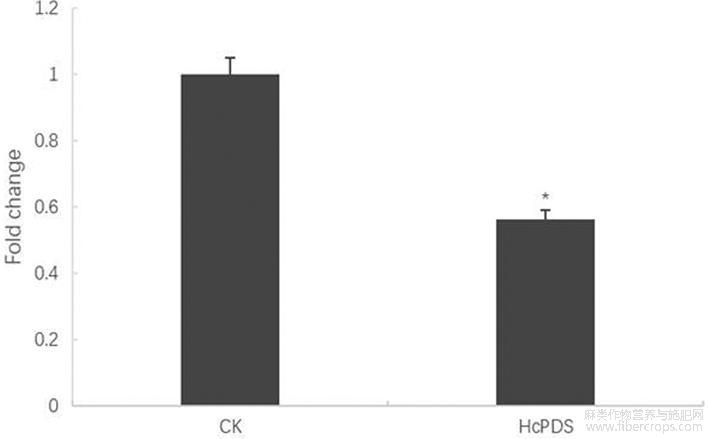
图3实时荧光定量PCR(qRT-PCR)检测红麻HcPDS的沉默效果。CK:空载体pTRV2侵染的红麻苗;HcPDS:重组病毒载体pTRV2-HcPDS侵染的红麻苗。
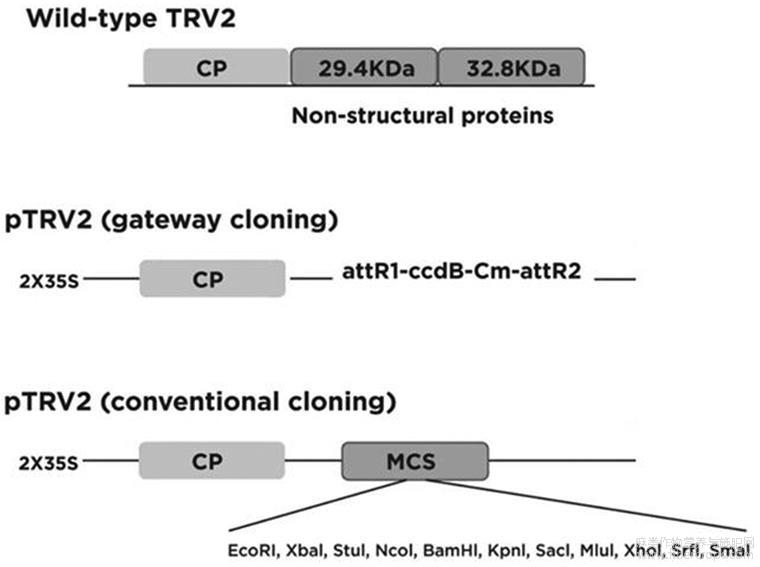
图4质粒pTRV2-HcPDS结构图。本发明采用gateway cloning的方法构建载体质粒pTRV2-HcPDS。其中,ccdB为致死基因,Cm为目标基因HcPDS。
具体实施方式
下面通过实施例对本发明作进一步的说明,其目的仅在于更好理解本发明的内容而非限制本发明的保护范围。
实施例1
红麻HcPDS基因特异性的克隆
HcPDS全长基因序列的获得
首先,在TAIR网站(https://www .arabidopsis.org/)获得拟南芥AtPDS(AT4G14210)基因蛋白质序列。然后,在NCBI网站(https://www.ncbi.nlm.nih.gov/,Sequence Read Archive (SRA)登录号 PRJNA596386),利用红麻优良品种福红952的参考基因组(Zhang et al.,2020,Plant Biotechnology Journal,DOI:10.1111/pbi.13341),通过BLASTP查找红麻同源基因,获得八氢番茄红素脱氢酶基因HcPDS的全长基因序列,其核苷酸序列如SEQ ID NO.1所示。
HcPDS基因特异性片段的克隆
以八氢番茄红素脱氢酶基因HcPDS 全长基因序列为模板,设计用于扩增HcPDS基因CDS结构域上的250bp特异性片段的引物HcPDS-F和HcPDS-R;其核苷酸序列分别为:
HcPDS-F:SEQ ID NO.2:5’-GGGGACAAGTTTGTACAAAAAAGCAGGCTTCCGTTAATTTTTTGGAGGCTGCT-3’
HcPDS-R:SEQ ID NO.3:5’-GGGGACCACTTTGTACAAGAAAGCTGGGTCGTAGGCCCCGAAGAATATGTGT-3’
取红麻的幼嫩叶片,在研钵中用液氮冷冻并研磨成粉状,然后用OMEGA试剂盒操作步骤提取RNA,-80℃冻存备用。取出-80℃冻存的RNA,按照TaKaRa反转录试剂盒操作步骤合成cDNA第一链,于-20℃保存。以cDNA为模板利用设计的特异性引物HcPDS-F和HcPDS-R PCR扩增HcPDS基因特异性片段,其大小为250bp,核苷酸序列如SEQ ID NO.4所示。
PCR反应体系为:cDNA模板2μL、上下特异性游引物各1.5μL、dNTP(2mM)5μL、10×KOD PCR buffer 5μL、MgSO4(25mM)2μL、KOD Plus 1μL,补ddH2O至50μL。扩增条件为:94℃变性3min、55℃30s、68℃2min 32个循环、72℃延伸10min。
实施例2
重组病毒载体pTRV2-HcPDS的构建采用Gateway技术构建载体。其操作步骤如下:
将实施例扩增所得的HcPDS基因特异性片段、载体pDONR207和BP酶按体系混匀后,置于25℃的PCR仪中进行过夜连接。再将得到的连接产物热激转化到DB3.1感受态细胞中,然后涂布在含有50μg/mL-1的庆大霉素的LB平板上,37℃过夜培养,挑取阳性单克隆扩大培养。提取质粒pDONR207-HcPDS后,用pDONR207的通用引物pDONR207-F(SEQ ID NO.5)和pDONR207-R(SEQ ID NO.6) PCR扩增检测。再将质粒pDONR207-HcPDS、载体pTRV2和LR酶按体系混匀后,置于25℃的PCR仪中进行过夜连接。再将得到的连接产物热激转化到TOP10感受态细胞中,然后涂布在含有50μg/mL-1的卡那霉素的LB平板上,37℃过夜培养,挑取阳性单克隆扩大培养。提取质粒pTRV2-HcPDS,用HcPDS-F(SEQ ID NO.2)和HcPDS-R(SEQ ID NO.3)进行PCR扩增检测,测序验证序列为HcPDS的特异性片段,即HcPDS基因CDS结构域上的250bp大小的片段(SEQ ID NO.4)。将质粒pTRV2-HcPDS(其结果如图4所示)通过冻融法转入GV3101感受态细胞中,经过含有50μg/mL-1的卡那霉素、50μg/mL-1的庆大霉素和50μg/mL-1的利福平的筛选,获得含目标基因片段的农杆菌菌株。
实施例3
红麻HcPDS基因的功能鉴定
(1)重组病毒载体转化农杆菌
以pTRV1 质粒、pTRV2 质粒和pTRV2-HcPDS重组病毒载体分别转化农杆菌GV3101,挑取新鲜培养转化子单菌落(图1),分别接种到1mLLB液体培养基(Kan,50μg、mL-1;Gen,50μg/mL-1;Rif,50μg/mL-1)中,28℃ 180转min-1培养24 h;然后转入150mLLB液体培养基(Kan,50μg/mL–1;Gen,50μg/mL–1;Rif,50μg/mL–1)中,28℃ 180转min-1培养12h;28℃ 5000rpm离心10 min 收集菌体细胞,以适当体积的重悬液(10mmol/L-1 MgCl2,10mmol/L-1MES以及200μmol/L-1乙酰丁香酮) 重悬至终浓度为OD600=1.5;将重悬液于室温下静置3h,将携带有pTRV1载体的农杆菌GV3101菌液分别与携带pTRV2的农杆菌GV3101菌液和携带pTRV2-HcPDS重组病毒载体的农杆菌GV3101菌液的重悬液按体积比1:1混匀制成2种混合菌液,用于侵染红麻种子。红麻种子在混合菌液中侵泡24h,将红麻种子实验材料置于温度22℃,光/暗周期14h/10 h的条件下生长。
侵染后红麻HcPDS基因表达量测定
播种后3周,观察新长出的红麻叶片的表型变化,叶片表型为白色时(图2),取其叶片,用RNA试剂盒提取叶片总RNA,以Actin为内参基因,通过RT-PCR检测被沉默后目标基因的表达量。所用引物为:HcPDS-RT-F(SEQ ID NO.7);HcPDS-RT-R(SEQ ID NO.8);Actin-RT-F(SEQ ID NO.9);Actin-RT-R(SEQ ID NO.10)。红麻叶片中HcPDS基因表达量测定结果见图3,图3结果表明:与对照CK相比,受到携带pTRV2-HcPDS重组病毒载体农杆菌侵染的红麻叶片中HcPDS基因表达量显著降低。
|
图1 |
|
图2 |
|
图3 |
|
图4 |
摘自国家发明专利,发明人:张立武,徐益,张力岚,祁建民,张列梅,徐建堂,申请号202010073462.1,申请日2020.01.22