摘 要:剑麻是我国乃至世界热带地区最重要的麻类经济作物,用途广泛,综合利用价值高。而斑马纹病是剑麻生产上最为严重的病害之一,严重制约着剑麻产业的持续稳定发展。本研究通过农杆菌介导将抗病的Hevein基因导入,获得37株剑麻抗性植株,阳性率约为24.7%。经PCR检测,证明外源基因Hevein已成功整合到该剑麻植株的基因组中。并通过体外抑菌和抗病性检测,说明转基因剑麻植株中表达出一定的活性,而且还提高了对剑麻斑马纹病的抗性。研究结果为培育抗病高产转基因剑麻新品种奠定了坚实基础。
关键词:剑麻;斑马纹病;转基因;Hevein;抗病
剑麻是热带地区最重要的纤维作物,用途广泛,纤维具有坚韧耐磨、质地刚柔、富有弹性、低温下不会硬化脆断、不霉变、耐腐蚀、无毒、无过敏、无污染、防静电等特点,可广泛应用于纺织、航运、电梯、工矿、物流运输、新型材料等多种领域,而剑麻渣、麻渣水等副产物则作为生物质资源和生物制药原料,应用前景广阔[1]。此外,在全球性剑麻种植规模缩减的背景下,剑麻原料及其制品的需求呈增长趋势,因而市场前景可期。然而,我国剑麻主栽品种单一,60多年来仅有品种‘H.11648’,品种单一的种植风险逐渐凸显出来,早衰退化并面临新一轮剑麻病虫害的威胁,每年因病虫害死亡的剑麻面积达千亩,经济损失严重,因此培育抗病品种成为生产上的当务之急,而斑马纹病是目前剑麻生产上最严重的病害之一,该病由烟草疫霉菌引起,可造成植麻区的麻田早期发生大量缺株,产量出现大幅降低甚至绝收,严重制约着剑麻产业的持续稳定发展。
随着分子生物学的发展,作物转基因育种技术为剑麻育种开辟了新的途径。通过外源抗病基因的遗传转化可克服剑麻种间杂交的不育性,显著缩短育种周期,提高育种效率。同时与其他作物相比,剑麻作为纤维作物在应用转基因育种技术上独具优势,在转基因安全性方面更易控制和被人们所接受。Hevein基因来源于橡胶树,编码一类能结合几丁质的小分子蛋白,编码蛋白不但在体外表现出广谱的抗菌性,在转基因植物体内也表现出很好的广谱抗菌性,不仅能抗细菌、真菌,对烟草疫霉等卵菌类也表现出很好的抗性[2-5]。因此,本研究将外源抗病Hevein基因导入剑麻中,创制剑麻新种质,缩短育种周期,提高育种效率,为培育抗病高产剑麻新品种奠定基础。
1材料与方法
1.1材料
大肠杆菌菌株DH5α,根癌农杆菌菌株EHA105,质粒载体pCAMBIA3301和含有目的基因片段的载体pUC57-Hevein均由本实验室保存,抑菌试验中接种用的剑麻斑马纹病病原菌烟草疫霉由本实验室分离、纯化、鉴定并保存。常用培养基配制如下:
LB培养基:氯化钠(10g/L)+蛋白胨(10g/L)+酵母提取物(5g/L);若是固体培养基加琼脂粉(15g/L),pH7.0。于121℃,高压灭菌20min。
YEP培养基:氯化钠(5g/L)+蛋白胨(10g/L)+酵母提取物(10g/L);若是固体培养基加琼脂粉(15g/L),pH7.0。于121℃,高压灭菌20min。
PDA培养基:马铃薯(300g/L)+葡萄糖(20g/L)+琼脂粉(15g/L),自然pH。于121℃,高压灭菌20min。
愈伤诱导培养基:SH+6-BA(3.0mg/L)+NAA(0.5mg/L)+2,4-D(0.1mg/L)+蔗糖(30g/L)+卡拉胶(6.5g/L),pH5.8。于121℃,高压灭菌20min。
愈伤继代培养基:SH+6-BA(1.0mg/L)+NAA(0.1mg/L)+蔗糖(30g/L)+卡拉胶(6.5g/L),pH5.8。于121℃,高压灭菌20min。
出芽诱导及增殖培养基:SH+6-BA(1.5mg/L)+NAA(0.5mg/L)+蔗糖(30g/L)+卡拉胶(6.5g/L),pH5.8。于121℃,高压灭菌20min。
生根诱导培养基:SH+IAA(0.1mg/L)+蔗糖(30g/L)+卡拉胶(6.5g/L),pH5.8。于121℃,高压灭菌20min。
转化用基本培养基:SH+6-BA(2.0mg/L)+NAA(0.1mg/L)+蔗糖(30g/L)+卡拉胶(6.5g/L),pH5.8。于121℃,高压灭菌20min。
1.2方法
1.2.1植物表达载体pCAMBIA3301-Hevein的构建
pCAMBIA3301和pUC57-Hevein质粒的提取与纯化按试剂盒说明书进行操作,即分别用HindIII和SacⅠ进行双酶切,并通过试剂盒(OMEGA)进行胶回收,连接后转化DH5α,涂板后进行菌落PCR验证。以P1、P2为引物,进行目的基因Hevein的PCR扩增,鉴定筛选重组子,通过验证即可完成构建(图1)。P1:5¢-CTGCAGATGAAATACTGTACTATGTTTAT-3¢(29bp);P2:5¢-TCTAGATCAGTTGGCACCGC-3¢(20bp)。
1.2.2剑麻对bar基因筛选剂PPT的敏感性
经过预试验,脱菌抗生素Timentin浓度为200mg/L时的最佳使用组合:剑麻叶片在农杆菌浓度为OD600=0.8、侵染时间为15min、As浓度为200μmol/L、预培养时间为2d,剑麻愈伤组织在OD600=0.6、染时间为10min、As浓度为200μmol/L、预培养时间为3d时,β-葡糖苷酸酶(β-glucuronidase,GUS)瞬时表达率达到最高。采用bar基因筛选剂中膦丝菌素(phosphinothricin,PPT)作为后续试验的筛选剂,为确定其使用浓度,首先将剑麻叶片及愈伤组织切小在预培养基上恢复培养2d,再转入含不同浓度PPT(0、0.5、1.0、1.5、2.0、2.5mg/L)的培养基上进行培养,每处理接种30块叶片及愈伤组织,设置3次重复。30d后观察各处理的外植体变化情况,调查统计外植体的分化率和死亡率。
图1 pCAMBIA3301-Hevein载体的构建过程
1.2.3 Hevein基因转化剑麻
按照优化后的剑麻遗传转化体系,用已得到的农杆菌重组质粒pCAMBIA3301-Hevein菌液侵染剑麻幼叶及愈伤组织,得到分化出的剑麻小苗。当分化出的小苗长到1~2cm高时,在出芽诱导及增殖培养基中添加全致死的PPT量进行3次筛选,每次筛选时间间隔15d。
1.2.4剑麻转化植株的PCR检测
PCR检测是一种非常简单、快速和直接的转基因苗检测方法,本试验用此方法对转化植株进行检测,统计阳性转化率。
1.2.5转基因剑麻植株对斑马纹病的抗病性鉴定
(1)转基因剑麻植株叶片粗蛋白对斑马纹病原疫霉菌的抑制试验。取1个锥形瓶的PDA固体培养基溶解,待降温后(手能握住同时未凝固),加入250μL转Hevein基因剑麻植株叶片粗蛋白液,然后迅速摇动锥形瓶使其分散,并在培养皿上倒一薄层,待其凝固后,挑取已活化培养好的斑马纹病原疫霉菌菌丝转接至培养基中心。以同样操作方法,分别加入250μL未转基因剑麻植株叶片粗蛋白液和250μL已配置好的10mg/L烯酰吗啉,前者作为阴性对照,后者作为阳性对照。每个处理设3个重复,置于28℃培养箱中培养7d后,观察剑麻斑马纹病原菌烟草疫霉的生长情况,并测量菌圈直径的大小,挑取菌圈边缘菌丝,于电镜下观察其形态的变化。
(2)转基因剑麻植株人工接种斑马纹病菌的抗病性检测。用灭菌打孔器在已活化培养的斑马纹病原疫霉菌培养基上,从中心向外取菌饼。用小型注射器以菌饼大小为模板,在剑麻叶片上集中打上小孔,每片叶打3处小孔,再将带有菌丝的菌饼紧贴在打有小孔的叶片上,立即用湿润的纸巾将其迅速包起来,于25℃温室放置2d,期间每4h浇1次水,保持剑麻的叶片处于一定的湿度中。2d后,去掉纸巾,观测记录剑麻叶片发病情况。每个处理重复3次。
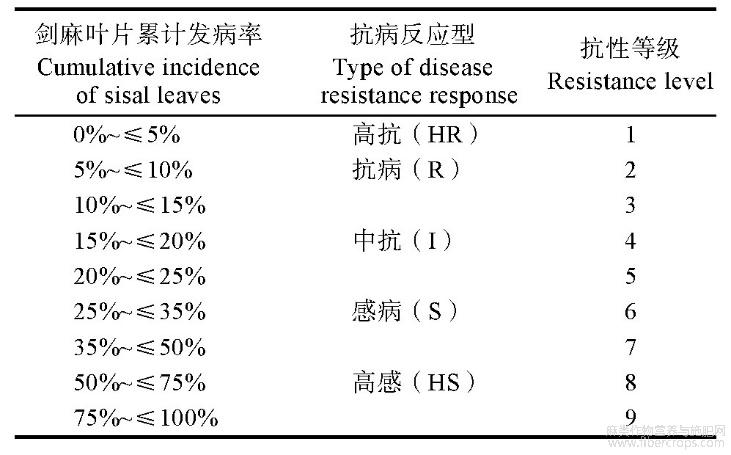
按照Chao[7]的分级标准(表1),根据最终累计叶片感染率确定剑麻株系的抗性等级和抗病反应型,累计发病叶片数占总叶片数的百分数。
2结果与分析
2.1植物表达载体pCAMBIA3301-Hevein的构建
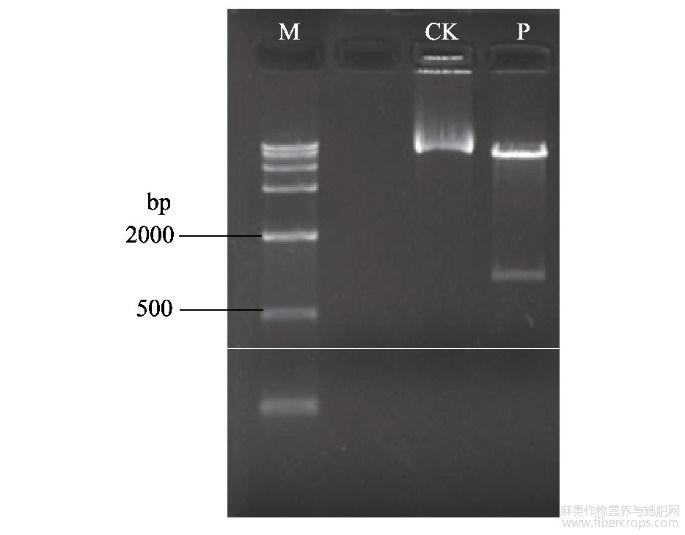
质粒pCAMBIA3301和质粒pUC57-Hevein分别用HindIII和SacI的双酶切,分别回收大片段和小片段,连接构建植物表达载体pCAMBIA3301-Hevein。对构建的植物表达载体pCAMBIA3301-Hevein进行HindIII和SacI的双酶切鉴定(图2)。由图可知,同对照的质粒pCAMBIA3301(CK)相比较,表达载体pCAMBIA3301-Hevein(P)酶切获得1条1000bp左右的条带,与预期的1070bp相符,表明包含35S启动子、Hevein基因和Nos终止子的片段已成功连接到载体pCAMBIA3301上,成功获得Hevein基因的植物表达载体,将其命名为pCAMBIA3301-Hevein。然后利用“冻融法”将植物表达载体pCAMBIA3301-Hevein导入根癌农杆菌EHA105的感受态细胞中(图3),随机挑选5个重组质粒进行目的基因Hevein的PCR鉴定,均能扩增得到与目的片段大小(276bp)相符的片段(图4),表明植物表达载体pCAMBIA3301-Hevein已成功导入农杆菌EHA105中。
表1 剑麻抗斑马纹病的分级标准
图2 pCAMBIA3301-Hevein的双酶切鉴定(HindIII、SacI)
图3 pCAMBIA3301-Hevein表达载体转入农杆菌EHA105
图4 重组农杆菌的PCR检测
2.2剑麻对bar基因筛选剂PPT的敏感性
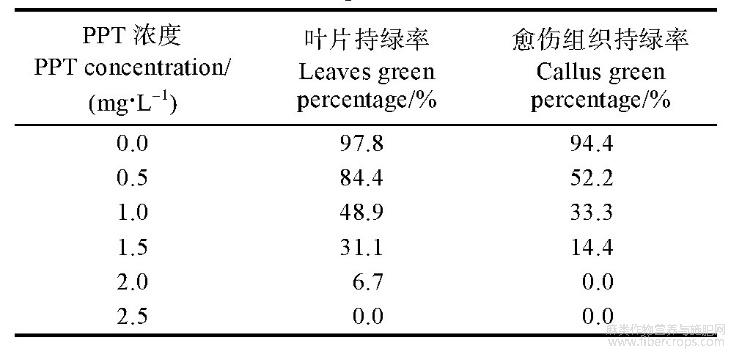
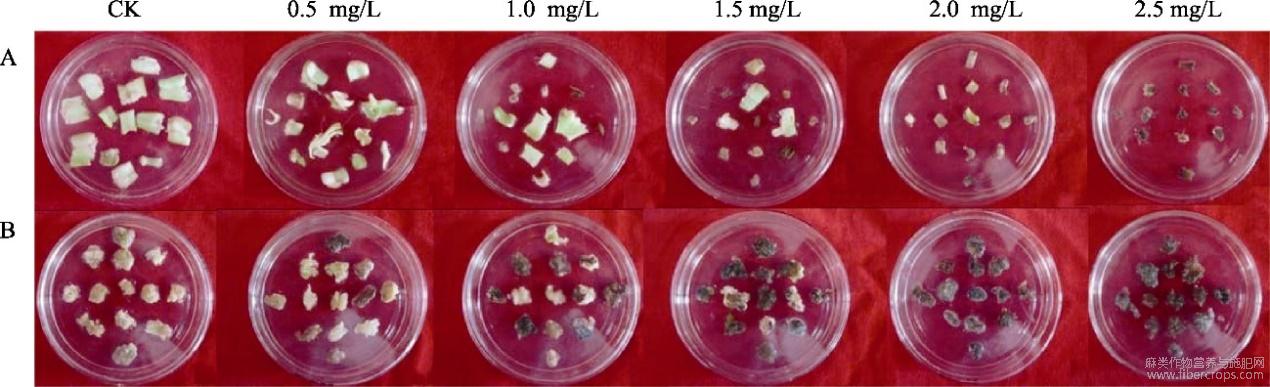
采用bar基因筛选剂PPT作为后续试验的筛选剂,调查统计外植体的分化率和死亡率,其中剑麻叶片在PPT浓度达到2.5mg/L时出现全致死,而剑麻愈伤组织在PPT浓度达到2.0mg/L时出现了全致死(表2,图5)。
表2 不同浓度PPT对剑麻叶片及愈伤组织生长状况的影响
图5 不同浓度PPT对剑麻叶片及愈伤组织生长状况的影响
A:叶片;B:愈伤组织。
2.3农杆菌介导的剑麻转化
根据剑麻遗传转化的优化体系结果,作为农杆菌介导Hevein基因转入剑麻愈伤组织的实验条件参数。当分化出的小苗长到约1cm高时,往分化增殖培养基中添加PPT(1.0mg/L)进行第一次筛选,筛选的效果非常明显(图6A),经统计,幼苗存活率约25%。此时幼苗比较弱,对筛选压力很敏感,有一些转化苗也会抵挡不住选择压力而被误杀,因此第一次筛选的效果会很明显。15d后,挑选生长良好的小苗分成单株接种到含1.3mg/LPPT的分化增殖培养基中,进行第二次筛选,幼苗存活率约65%(图6B)。15d后,再一次挑选生长良好的小苗接种到含1.5mg/LPPT的分化增殖培养基中,进行第三次筛选,幼苗存活率约95%(图6C)。然后对抗性苗进行组培快繁(图7)。当抗性苗在生根培养基上长到超过8cm时(如图8A),将根系发达、叶色浓绿的抗性苗组培瓶打开,进行室内炼苗,待植株长出大量的新根,将小苗移植于配置好的混合沙土中进行炼苗(图8B)。
A:第一次PPT筛选;B:第二次PPT筛选;C:第三次PPT筛选。
图6 剑麻幼苗的PPT筛选
A:组培箱中的抗性组培苗;B:组培室中的抗性组培苗。
图7 抗性植株的组培快繁
A:抗性植株在生根培养基中;B:抗性植株的沙土炼苗。
图8 抗性植株的炼苗
2.4转基因植株的PCR检测
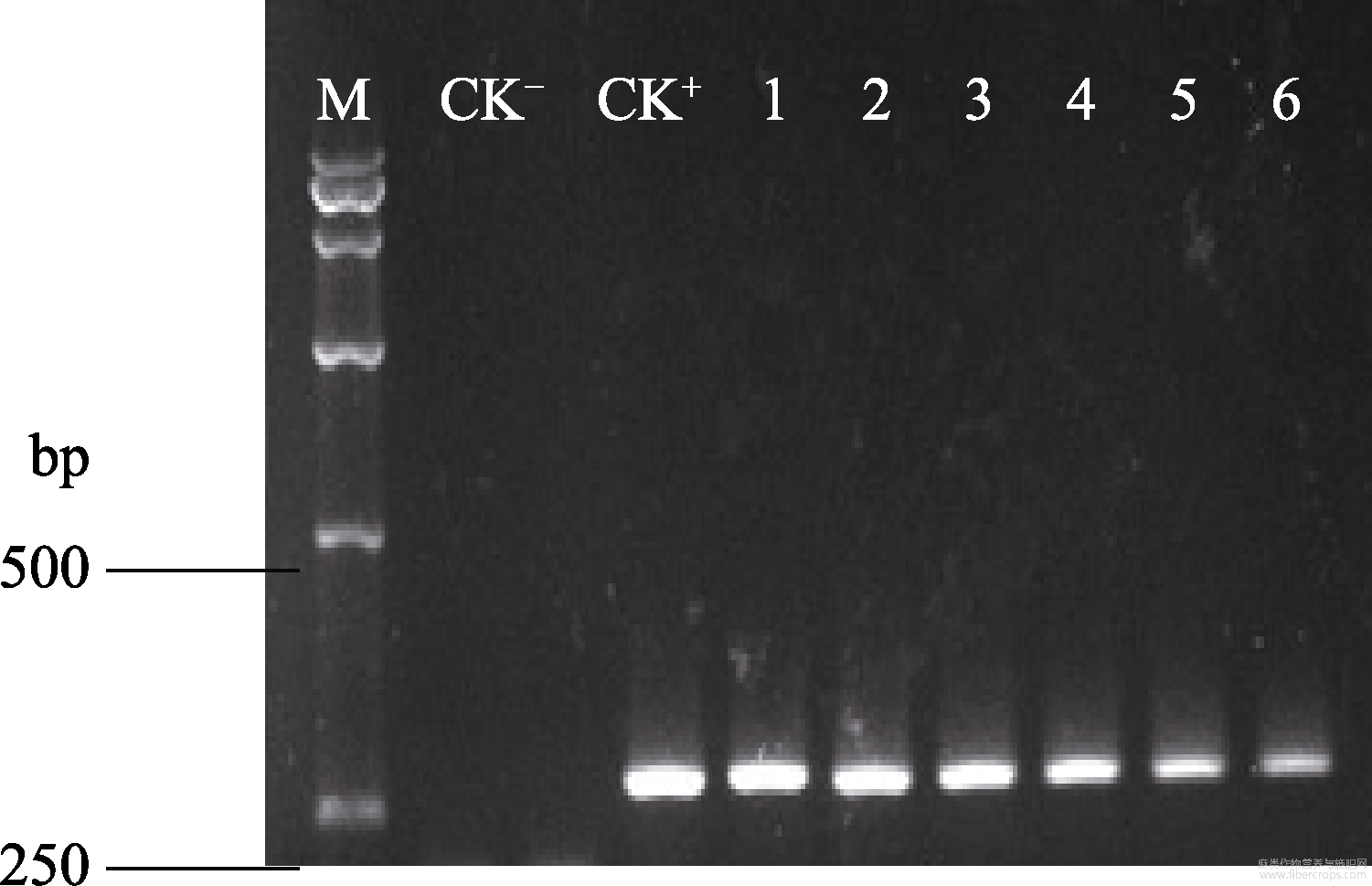
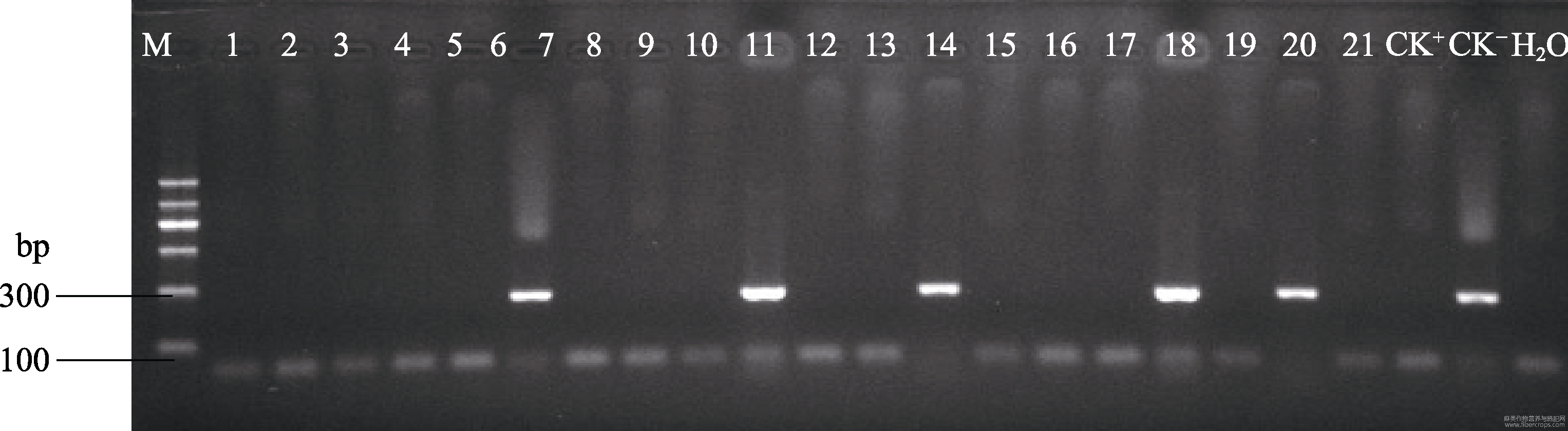
以CTAB法小量提取的剑麻总DNA为模板,通过引物P1和P2对转化植株进行目的基因Hevein(GenBank:L41873.1)的PCR扩增检测。其中用pCAMBIA3301-Hevein质粒作为阳性对照,用未转化剑麻的DNA作为阴性对照。共提取了37株Hevein基因转化植株的DNA,其中有10株能扩增到与预期片段大小一致的条带(276bp),部分电泳结果如图9,初步证明Hevein基因已经整合到了剑麻基因组中。
2.5转基因剑麻植株对斑马纹病的抗病性鉴定
2.5.1转基因剑麻植株叶片粗蛋白的体外抑菌检测
用含有10mg/L烯酰吗啉的PDA培养基接种剑麻斑马纹病原菌烟草疫霉作为阳性对照[8],用未转基因剑麻叶片提取的粗蛋白作为阴性对照,发现转Hevein基因剑麻植株叶片提取的粗蛋白对剑麻斑马纹病原菌烟草疫霉均有一定的抑菌作用(图10)。再分别挑取菌落边缘的菌丝经行电镜扫描,发现从烯酰吗啉和转基因剑麻叶片粗蛋白处理的菌丝中均有出现瘪平或断裂的情况,而未转基因的对照组却完好无损,且菌丝数量和密度明显多于其余2个处理(图11)。说明转Hevein基因剑麻叶片提取的粗蛋白有一定的抑菌作用。同时在抑菌试验中发现,7株转基因剑麻植株中有5株具有较强的抑制烟草疫霉的作用
2.5.2转基因剑麻植株人工接种斑马纹病菌的抗病性检测
将叶片粗蛋白对斑马纹病菌有强烈抑制作用的5株剑麻转基因株系(T4、T5、T6、T8和T9)进行人工接种斑马纹病菌,同样方法接种未转基因的剑麻植株作为对照,7d后统计其发病情况(图12),计算发病率。按照Chao[7]的分级标准方法,根据最终累计叶感染率确定剑麻株系的抗病反应型和抗性等级。统计结果表明:T8和T6表现为抗病(R),抗病等级分别为2和3;T5和T9表现为中抗(I),抗病等级均为5级;T4表现为感病(S),抗病等级为7;非转化植株CK表现为高感病(HS),抗病等级为8。
图9 抗性植株目的基因Hevein的PCR检测
A:农药阳性对照;B:转基因剑麻;C:未转基因剑麻阴性对照。
图10 转基因剑麻植株叶片粗蛋白的体外抑菌检测
3讨论
剑麻愈伤组织的分化能力非常强,因此剑麻愈伤组织在农杆菌浸染后,很容易出现假阳性和嵌合体植株,所以需要对分化出来的幼苗进行筛选,尽可能地剔除假阳性和嵌合体植株。剑麻对PPT敏感,临界致死浓度较低(2mg/L),因此PPT可用于剑麻转化植株的筛选。bar基因是抗除草剂基因,将其导入剑麻后,剑麻转化植株对PPT具有抗性。
A:农药阳性对照;B:转基因剑麻;C;未转基因剑麻阴性对照。
图11 抑菌试验后剑麻斑马纹病原烟草疫霉菌的电镜观测
图12 人工接种剑麻斑马纹病原烟草疫霉菌后的发病情况(水培组培苗)
当幼苗生长至1~2cm时,此时苗较弱,对筛选压力很敏感,因此筛选效果明显,但有些转化苗也会抵挡不住选择压力而被误杀,且过早地施加选择压力不利于苗的后期生长。当幼苗已分化成单株、长至4cm以上,此时苗比较健壮,不易造成误杀,但其对筛选物质的抗性能力也有所增强,因此需要提高PPT的筛选浓度。本研究进行连续多次筛选,筛选过程中PPT的浓度递增,尽量剔除假阳性和嵌合体植株。第一次筛选(PPT1.0mg/L),其幼苗存活率约25%,第二次筛选(PPT1.3mg/L)幼苗存活率约65%,第三次筛选(PPT1.5mg/L)幼苗存活率约95%。经过连续3次PPT筛选获得的抗性幼苗进行PCR检测,阳性植株的所占比例可达到70%。表明进行连续多次筛选,且筛选过程中PPT的浓度递增,可剔除大部分假阳性和嵌合体植株。
目前,剑麻材料的斑马纹病抗性鉴定的评价指标通常为累计丛感率(IPmax)、累计叶感率(Ymax)和病害进展曲线下的面积(AUDPC)。累计丛感率是在整个种植期中,累计发病丛数占总丛数的百分数。累计丛感率主要是反映剑麻材料抗初浸染的能力,不反映剑麻材料抗再浸染的能力,不包含病原菌对孽芽和侧芽的浸染情况。由于再浸染是斑马纹病造成危害不可缺少的部分。因此累计丛感率作为评价指标存在一定的缺陷。病害进展曲线下的面积是指一定时间内叶感染率与时间的乘积之和,涉及病害在整个作物季中发生的全过程,病害最短潜伏期(LP)、发病持续期(SDD)以及从发病开始到病害结束整个过程中叶感染率的动态大小都对它有影响,且其计算较为复杂,因此病害进展曲线下的面积作为评价指标应用得不多。累计叶感率是在整个种植期中,累计发病叶数占总叶数的百分数,是病害在整个种植期中的累计量,统计比较全面,较为常用。因此,本研究用累计叶感率作为剑麻转基因株系的斑马纹病抗性鉴定的评价指标是合理可靠的。
此外,剑麻存在基因转化率较低,基因型依赖性强,再生细胞部位与转化感受态细胞部位不一致等亟待解决的问题。只有解决这些问题才能使基因工程技术在剑麻品种改良上得到广泛应用。为此,本研究进行了剑麻抗除草剂基因转移及其农杆菌转化系统的研究,旨在建立高效、稳定的剑麻遗传转化受体系统,获得抗草丁膦的转基因剑麻,为改良剑麻对草丁膦的抗性研究奠定基础;另外本研究以bar基因作为筛选标记基因来验证该遗传转化体系,克服了抗生素筛选的局限性,为今后除草剂PPT筛选转基因剑麻提供了有效参考。
由于剑麻生长期长达十年以上,又主要是通过吸芽、地下走茎、组培快繁等无性繁殖方式进行繁殖,因此培育出来的新种质抗病性可以稳定表达。而且剑麻是纤维用经济作物,在应用转基因技术中,容易被人们接受和推广,不易引起转基因安全问题。同时本研究的成功,预示着在未来可将晚花、高纤维率等基因导入剑麻‘H.11648’中,快速提高剑麻的抗性、产量和品质,促进我国剑麻产业的健康持续发展。
参考文献
[1]陈河龙,高建明,张世清,等.剑麻ISSR反应体系的建立及其优化[J].贵州农业科学,2015,43(2):20-23.
[2]Lee H I,Broekaert W F,Raikhel N V.Co-and post-translational processing of the hevein preproprotein of latex of the rubber tree (Hevea brasiliensis)[J].Journal of Biological Chemistry, 1991, 266(24):15944-15948.
[3]Gidrol X Chrestin H, Tan H L, et al. Hevein, a lectin-like protein from Hevea brasiliensis (rubber tree) is involved in- the coagulation of latex[J].Journal of Biological Chemistry, 1994,269(12):9278-9283.
[4]Gao A G,Hakimi S M,Mittanck C A, et al. C M.Fungal pathogen protection in potato by expression of a plant defen- sin peptide[J].Nature Biotechnology,2000,18(12):1307-1310.
[5]Koo J C,Chun H J,Park H C,et al.Over-expression of a seed specific hevein-like antimicrobial peptide from Phar-bitis nil enhances resistance to a fungal pathogen in trans-genictobacco plants[J].Plant Molecular Biology,2002, 50(3):441-452.
[6]钟坤,谭德冠,孙雪飘,等.一株木薯生淀粉糖化酶菌株的分离及酶学性质研究[J].热带作物学报,2012,33(7):1239-1244.
[7]Chao C P.Heritability of resistance and repeatability of clone reactions to sugarcane smut in Louisiana[J].Sugarcane&Canesugar,1990,80(7):622-626.
[8]刘巧莲,郑金龙,张世清,等.13种药剂对剑麻斑马纹病病原菌的室内毒力测定[J].热带作物学报, 2010, 31(11):2010-2014.