摘 要:为提高工业大麻的经济价值,本研究以工业大麻叶为原料,利用离子液体辅助超声法提取具有药用价值的活性成分大麻二酚(CBD),并对提取工艺进行优化。本研究以CBD得率为指标,先从16种咪唑类离子液体中筛选出[C8mim]NTF2为最佳提取溶剂。再对影响离子液体辅助超声法提取CBD得率的6个因素(超声功率、超声温度、超声时间、乙醇溶液浓度、离子液体的摩尔浓度和液料比),进行单因素实验,并确定乙醇浓度为65%,离子液体摩尔浓度为0.3mol/L(65%乙醇溶液配制)。在此结果基础上,利用Plackett-Burman试验设计筛选出4个显著因素(超声功率、超声温度、超声时间和液料比)。并利用响应面Box-Behnken试验设计进一步优化提取工艺。确定CBD显著因素的最佳提取工艺条件为:超声功率280W,超声温度50℃,超声时间62.5min,液料比25mL/g。在上述条件下,离子液体[C8mim]NTF2提取CBD得率为7.66%±0.2%、甲醇的CBD得率为6.42%±0.3%,65%乙醇溶液的CBD得率为5.81%±0.2%。即CBD的提取能力,离子液体[C8mim]NTF2>甲醇>65%乙醇溶液。通过CBD降解实验,表明离子液体[C8mim]NTF2的CBD降解率16.40%±0.3%,小于甲醇的24.65%±0.6%和65%乙醇溶液的32.88%±0.5%,表明65%乙醇溶液加入离子液体[C8mim]NTF2后,既可以降低CBD的降解率,又可提高CBD的得率。本研究证明了离子液体既是CBD的保护剂,也是CBD的优良提取溶剂,研发了离子液体辅助超声法提取CBD工艺,为工业大麻的开发利用提供数据支持。
关键词:工业大麻叶;大麻二酚(CBD);离子液体;超声提取;Plackett-Burman 设计;响应面
工业大麻(Cannabis sativa L.)因其广泛应用于纺织、油料、营养食品、化妆品和生物燃料领域,而被广泛种植[1,2]。近期,工业大麻中大麻素的药用价值成为研究热点。现今,已有80多种大麻素被鉴定出来,主要有是大麻二酚、四氢大麻酚、大麻酚,大麻萜酚、大麻环醇、大麻色原烯和大麻三醇等[3]。研究表明大麻素对人体生理和精神上具有治疗作用,因此具有潜在的药用价值[4]。但四氢大麻酚可用作麻醉品,所以多国规定工业大麻中THC 的含量必须低于0.3%[5]。其中,大麻二酚(Cannabidiol,CBD)是最重要的大麻素,是一种淡黄色晶体,几乎不溶于水,见光受热易分解,无致幻作用[6]。近年来,随着国内外对CBD研究的深入,发现CBD具有很高的药用价值。Wang Y等[7]发现CBD能保护酒精性肝损伤。Wirth P W等[8]发现CBD具有抗炎、抗氧化等作用。在化妆品方面,Huber S等[9]发现CBD是天然的化妆品原料,可以舒缓、滋润皮肤,并具有镇痛功效。李焰梅等[10]发现CBD对皮肤发炎、发红,皮肤敏感等症状具有疗效,还有一定治疗痤疮的效果。刘凯等[11] 和Boehnke K F等[12] 均发现CBD具有缓解肌肉疼痛。Moltke J等[13]发现CBD具有改善焦虑和失眠的功效。但CBD不稳定,是光敏,热敏感物质,易在提取过程中分解[14]。因此,如何提高CBD得率,且保证CBD在提取过程中的稳定性,成为研究热点。
以前,普遍通过甲醇、乙醇、氯仿和丙酮等有机溶剂热回流提取CBD[15]。该方法成本低廉,操作简单,但污染严重,存在易燃易爆等安全隐患。为了解决这些问题,一些新的提取方法被采用。微波辅助提取法和超声辅助提取法,具有提取速度快、提取率高和操作简单等优点,但依然需要有机溶剂进行提取[16,17]。CO2超临界流体提取法,是利用CO2超临界流体替代有机溶剂进行提取的方法,具有绿色、环保、无污染和提取率高等优点,但存在能耗大、操作复杂和设备成本高等问题[18]。近期,一种新型提取溶剂离子液体成为研究热点。离子液体是由对称且体积较大的有机阳离子,及体积相对较小的无机阴离子组成,在室温或近室温下呈液态的盐[19]。离子液体拥有,几乎可忽略的蒸汽压、不挥发、不易燃、较好的化学稳定性、无毒无污染和可设计性等特点[20]。离子液体出现在20世纪70年代,作为电池的电解质[21]。由于,离子液体具有通过改变阴阳离子组成,调控其的物理化学性质的可设计性[22]。因此,离子液体得到了快速发展,被广泛应用于化工、医药和食品等领域[23]。离子液体可以作为活性物质提取的催化剂和萃取剂,能加速有机溶剂的提取效率或代替有机溶剂进行提取。Hao Xu等[24]阐明了基于咪唑类离子液体作为二苯并噻吩氧化脱硫的催化剂和萃取剂。Mazid[25]等发现离子液体可增强生物活性物质的活性和稳定性。Stefan等[26]研究发现离子液体阳离子为咪唑基团时,极易在微生物作用下水解,而吡啶基团则很难被分解,阐明了咪唑类离子液体对环境和人体安全,吡啶类离子液体具有毒性。
鉴于此,本研究以工业大麻叶为原料,采用咪唑类离子液体作为一定浓度乙醇水溶液的催化剂,在提高乙醇水溶液的提取能力基础上,降低有机溶剂的使用量,并保证CBD在提取过程中的稳定性。再辅助超声法进一步提高CBD的得率。并通过单因素实验、Plackett-Burman试验设计和响应面Box-Behnken试验设计,对工业大麻叶中CBD的提取工艺进行优化,建立一个高效、安全的提取方法,为CBD的提取工艺提供实验依据。
1 材料与方法
1.1 材料及仪器
工业大麻叶,高CBD品种,黑龙江省哈尔滨市民主镇大麻种植基地;大麻二酚(CBD)标准品,99.5%,西安元贝贝生物科技;无水乙醇,分析纯,沈阳迈科麦科技有限公司;甲醇,分析纯,沈阳迈科麦科技有限公司;甲醇,色谱纯,沈阳迈科麦科技有限公司;乙腈,色谱纯,沈阳迈科麦科技有限公司;[C4mim]PF6,99%,沈阳赛登科技;[C4mim]BF4,99%,沈阳赛登科技;[C4mim]Br,99%,沈阳赛登科技;[C4mim]NTF2,99%,沈阳赛登科技;[C6mim]PF6,99%,沈阳赛登科技;[C6mim]BF4,99%,沈阳赛登科技;[C6mim]Br,99%,沈阳赛登科技;[C6mim]NTF2,99%,沈阳赛登科技;[C8mim]PF6,99%,沈阳赛登科技;[C8mim]BF4,99%,沈阳赛登科技;[C8mim]Br,99%,沈阳赛登科技;[C8mim]NTF2,99%,沈阳赛登科技;[C10mim]PF6,99%,沈阳赛登科技;[C10mim]BF4,99%,沈阳赛登科技;[C10mim]Br,99%,沈阳赛登科技;[C10mim]NTF2,99%,沈阳赛登科技;实验用去离子水,娃哈哈集团。
KQ-400KDE型高功率超声波清洗器,济宁亨达超声波有限公司;CARY100型紫外分光光度计,上海精科有限公司;XS204型分析天平,瑞士METTLER TOLEDO公司;3-18K型冷冻离心机,德国SIGMA公司;U3000型高效液相色谱仪,美国Thermo Fisher公司;SHB-III型循环水式真空泵,无锡市长庆化工防腐设备有限公司;DYF-500型万能粉碎机,浙江瑞昊机械制造有限公司;DHG-9240A型电热恒温鼓风干燥箱,苏州德沃斯烘箱制造有限公司;DK-98-IIA电热恒温水浴锅(天津市泰斯特仪器有限公司);QT-1旋涡混合器(上海琪特分析仪器有限公司)。
1.2 实验方法
1.2.1 工艺流程
工业大麻叶→除杂→180℃高温处理→粉碎成粉→过80目筛→定量称取→与离子液体提取溶液混合→超声提取→离心→取上清液→沉淀物复溶→离心→取上清液→两次上清液合并→定容→液相色谱检测
操作要点:工业大麻叶除杂后,在鼓风干燥箱中180℃高温处理4h,使大麻叶中的大麻二酚酸(CBDA)受热充分降解为CBD[20]。再利用万能粉碎机将烘干后的大麻叶磨成粉,过80目筛。用一定浓度乙醇溶液溶解离子液体,配制成离子液体提取液,并按一定液料比与大麻粉混匀,制成混合液,并放入超声波清洗器中提取。利用高速离心机使混合液固液分离,取上清,沉淀物再次用离子液体提取液二次提取,离心取上清,两次上清液合并,定容,针入高效液相色谱检测,按下面公式计算CBD得率:

式中:W1表示CBD得率,%;c表示根据峰面积计算出的溶液质量浓度,g/mL;V表示供试品溶液体积,mL;D表示溶液稀释倍数;m表示取样量,g。
1.2.2 CBD液相色谱条件
CBD在波长220 nm有稳定的特征吸收峰,因此CBD的色谱条件为:色谱柱(Agilent Eclipse XDB-C18 250mm×4.6mm,5μm);流动相:0.1%甲酸水溶液-乙腈(25:75);检测波长:220nm;流速:1.0mL/min-l,柱温:30℃[27]。
1.2.3 离子液体的筛选
选取咪唑类离子液体[C4mim]PF6、[C4mim]BF4、[C4mim]Br、[C4mim]NTF2、[C6mim]PF6、[C6mim]BF4、[C6mim]Br、[C6mim]NTF2、[C8mim]PF6、[C8mim]BF4、[C8mim]Br、[C8mim]NTF2、[C10mim]PF6、[C10mim]BF4、[C10mim]Br、[C10mim]NTF2进行筛选。由于离子液体是粘稠的液体,而有些咪唑类离子液体难溶于水,因此需要一定浓度的乙醇水溶液溶解。因此,本实验,用70%乙醇溶液配制摩尔浓度为0.2mol/L的离子液体。称取大麻粉末1.0g,将其置于离心管中,按液料比20mL/g的比例,加入摩尔浓度为0.2mol/L的离子液体,在功率280W、温度40℃的条件下,进行超声提取40min。而后进行离心15min,取上清液1mL于10mL容量瓶中,用甲醇定容,过0.22μm有机膜,针入高效液相色谱中检测,筛选出CBD得率最高的离子液体。
1.2.4 单因素实验
根据上述提取方法,固定初始条件超声温度为50 ℃、超声时间40min、乙醇溶液浓度70%、超离子液体摩尔浓度0.2mol/L和液料比20mL/g,研究不同超声功率(200、240、280、320、360和400W)对CBD得率的影响;固定条件超声功率为280W、超声时间40min、乙醇溶液浓度70%、超离子液体摩尔浓度0.2mol/L和液料比20mL/g,研究不同超声温度(20、30、40、50、60和70℃)对CBD得率的影响;固定条件超声功率为280W、超声温度50℃、乙醇溶液浓度70%、超离子液体摩尔浓度0.2mol/L和液料比20mL/g,研究不同超声时间(20、30、40、50、60和70min)对CBD得率的影响;固定条件超声功率为280 W、超声温度50℃、超声时间60min、离子液体摩尔浓度0.2mol/L和液料比20mL/g,研究不同乙醇溶液浓度(55%、60%、65%、70%、75%和80%)对CBD得率的影响;固定条件超声功率为280W、超声温度50℃、超声时间60min、乙醇溶液浓度65%和液料比20mL/g,研究不同离子液体摩尔浓度(0.1、0.2、0.3、0.4、0.5和0.6mol/L)对CBD得率的影响;固定条件超声功率为280W、超声温度50℃、超声时间60min、乙醇溶液浓度65%和离子液体摩尔浓度0.3mol/L,研究不同液料比(10、15、20、25、30和35mL/g)对CBD得率的影响。
1.2.5 Plackett-Burman 试验设计
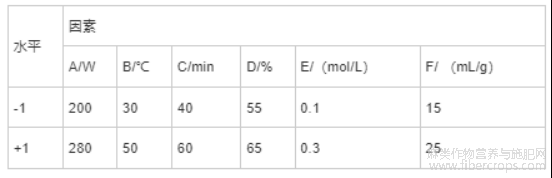
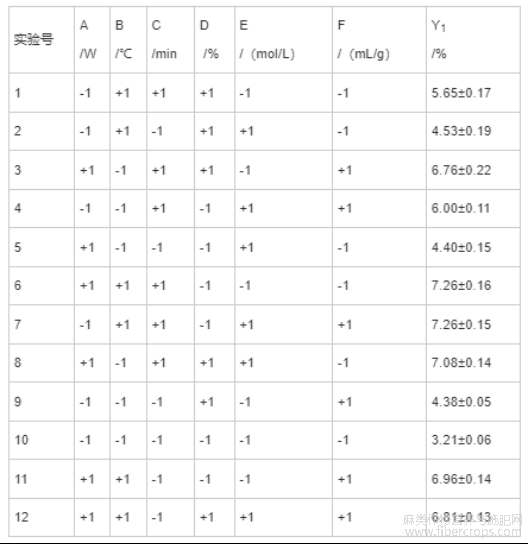
Plackett-Burman试验设计是一种析因实验设计,可根据单因素试验结果,选取各因素的高、低两水平最佳实验条件区间,评估各因素的显著性,进而从大量因素中筛选出关键因素[28]。本实验利用响应面软件Design-expert8.0,对CBD得率(Y1)的6个因素(A为超声功率、B为超声温度、C为超声时间、D为乙醇溶液浓度、E为离子液体摩尔浓度、F为液料比)进行Plackett-Burman试验评估,共12次独立实验。因素和水平编码见表1。
表1 因素与水平编码表
1.2.6 响应面优化试验
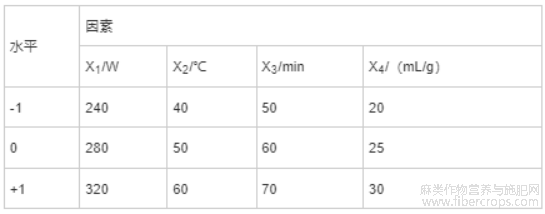
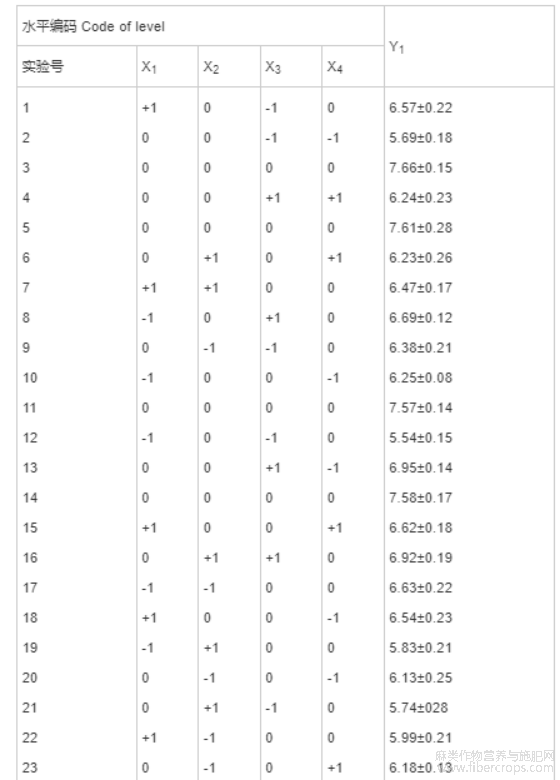
在Plackett-Burman试验结果的基础上,采用响应面软件Design-expert 8.0的Box-Benhnken试验设计[29],建立以超声功率(X1)、超声温度(X2)、超声时间(X3)和液料比为自变量(X4),CBD得率为响应值的4因素3水平Box-Benhnken试验模型[26]。因素水平和编码见表2。
表2 因素水平编码表
1.2.7 不同溶剂提取对CBD得率的影响
分别精密称取1.0g预处理后的药用大麻叶粉末,于50mL离心管中。在响应面优化后的CBD的最佳工艺条件下,分别用甲醇和65%乙醇溶液,进行超声提取。超声结束后离心15min,取上清液1mL,用甲醇定容到10mL,得到供试品溶液,过0.22μm有机滤膜,针入高效液相色谱检测。甲醇和65%乙醇溶液分别提取的CBD得率与离子液体超声提取工艺优化得到的最优结果进行比较。
1.2.8 不同溶剂提取对CBD降解的影响
分别精密称取10.0mgCBD标准品,于1mL离心管中。在响应面优化后的CBD的最佳工艺条件下,分别用甲醇、65%乙醇溶液和离子液体溶液进行超声提取。超声结束后离心15min,取上清液0.1mL,用甲醇定容到10mL,得到供试品溶液,过0.22μm有机滤膜,针入高效液相色谱检测。按下面公式计算CBD降解率:

式中:W2表示CBD降解率,%;c表示根据峰面积计算出的溶液质量浓度,mg/mL;V表示供试品溶液体积,mL;D表示溶液稀释倍数;m表示取样量,mg。
2 结果与分析
2.1 CBD得率的测定
CBD的线性回归程为y =529.7x+49.442,相关系数R2 =0.9992,在0.38~1.5mg/mL范围内线性关系良好。
2.2 离子液体筛选结果
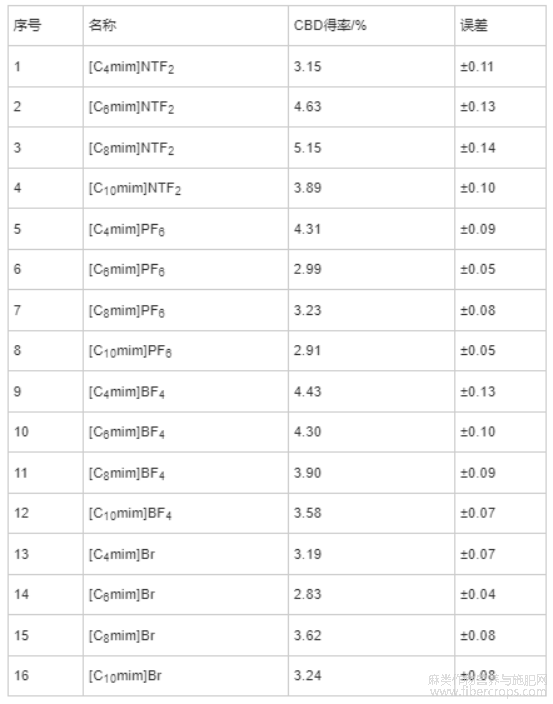
如表3所示,16种离子液体对CBD的得率各不同,在离子液体摩尔浓度为0.2mol/L(70%乙醇配制)时,[C8mim]NTF2提取CBD的得率最高。这是因为咪唑类离子液体的亲脂性是由离子液体的阴离子种类和阳离子碳链长度决定的[30]。其中的阴离子亲脂性NTF2->BF4->PF6->Br-,并且随着阳离子碳链的增长,离子液体的亲脂性也随之增加[31]。CBD属于亲脂性化合物,根据相似相溶规律,CBD更容易溶解到亲脂性强的离子液体中。而由于[C10mim]NTF2分子量过大,在同等摩尔浓度下,较[C6mim]NTF2和[C8mim]NTF2过于黏稠,不利于细胞内有效物质的溶出。因此,选取[C8mim]NTF2为最佳的提取剂,进行下一步CBD提取工艺研究。
表3 离子液体的筛选
2.3 单因素试验结果
2.3.1 超声功率对CBD得率的影响
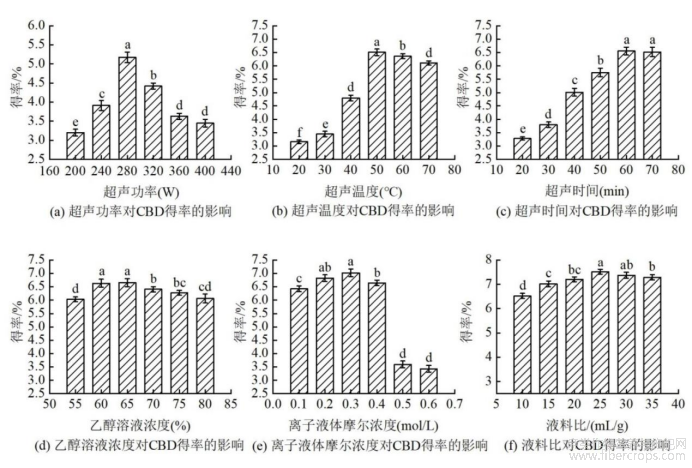
如图1a所示,当超声功率在200~280W时,随着功率的增大,超声波的空化能力也逐渐增强[32],当超声功率达到280W时CBD的得率最高,达5.17%±0.4%;当超声功率高于280W时,超声波的空化能力过强,会破坏CBD结构,得率下降。故将超声功率定为280W。
2.3.2 超声温度对CBD得率的影响
如图1b所示,当超声温度升高时,CBD得率快速增长,在50℃时,达到最高点。此时CBD得率为6.58%±0.3%。这是由于,随着温度上升,提取溶液溶解能力增强,提升提取效率。而后,CBD得率随着温度继续上升而缓慢下降。这是由于,随着温度超过50℃,继续上升,热敏性物质CBD逐渐分解。故将超声温度定位在50℃。
2.3.3 超声时间对CBD得率的影响
如图1c所示,随着超声时间的增加,CBD得率呈上升趋势,这是因为超声产生的能量随时间的增加逐渐增强[33];当超声时间在60min时得率最高,达6.55%±0.3%;当超声时间大于60min时,CBD得率的走势平缓。这是因为CBD基本从细胞中进入溶液中。为节约时间及成本,将超声时间定为60min。
2.3.4 乙醇溶液浓度对CBD得率的影响
如图1d所示,随着乙醇溶液浓度的增加,CBD得率总体呈先上升后下降趋势,当乙醇浓度在65% 时得率最高,达6.65%±0.3%。这是因为过高浓度的乙醇溶液会破坏离子液体的结构[34],影响其对CBD的提取效果。因此,选择浓度为65%的乙醇与离子液体混合使用。
2.3.5 离子液体摩尔浓度对CBD得率的影响
如图1e所示,随着的[C8mim]NTF2摩尔浓度的增加,CBD得率呈先升高后快速下降的趋势。这是因为,离子液体摩尔浓度低时,无法将大麻叶中的CBD提取完全。离子液体摩尔浓度在0.3mol/L时得率最高,得率达7.02%±0.3%;当摩尔浓度大于0.3mol/L时,离子液体粘度过大,将大麻粉末包裹起来,影响CBD得率,故将摩尔浓度定为0.3mol/L。
2.3.6 液料比对CBD得率的影响
实验参数按超声功率280W,超声温度50℃,超声时间为60min,[C8mim]NTF2摩尔浓度0.3mol/L(65%乙醇配制),液料比分别为10、15、20、25、30、35mL/g的条件下进行实验。结果如图1f所示,随着液料比的增加,CBD得率呈现逐渐升高后下降的趋势,当液料比小于25mL/g时,大麻粉末不能充分溶解在提取液中,并且提取液对CBD的溶解度以达到饱和,使得CBD提取能力降低。当液料比为25mL/g时,得率最高为7.52%±0.3%;液料比大于25mL/g,过多的提取液占比会破坏CBD结构,同时也会溶出大麻叶中的杂质,使得率下降,故将液料比定为25mL/g。
图1 各单因素对CBD得率的影响
2.4 Plackett-Burman 试验设计筛选关键因素
在单因素试验结果基础上,采用Plackett-Burman试验设计法,筛选影响的CBD得率(Y1)的关键因素。Plackett-Burman试验设计及响应值见表4。并利用响应面软件Design-expert 8.0对试验结果进行方差分析,结果见表5。
表4 Plackett-Burman试验设计及响应值
表5 Plackett-Burman试验设计方差分析
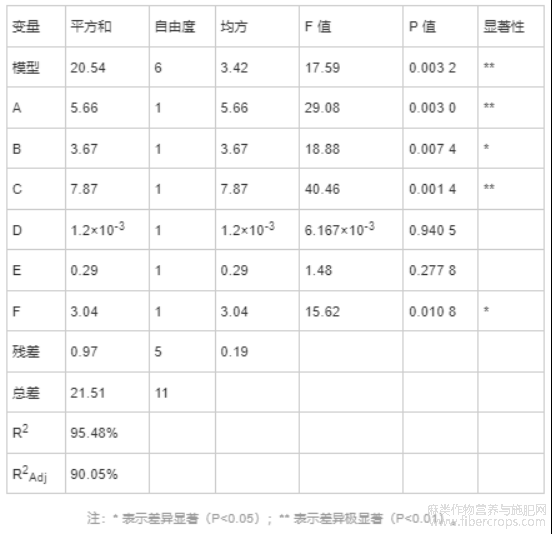
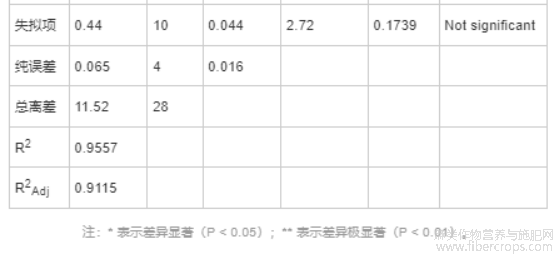
由表5可知,CBD得率的回归模型均为极显著(P<0.01),说明回归方程的因变量与自变量具有显著的线性关系,说明回归有效,实验设计可靠[35]。而且,CBD得率的模型决定系数R2值为95.48%,调整决定系数R2Adj值为90.05%,均在90.0%以上,说明CBD得率的响应值变化90.05%来源于所选因素,表明模型拟合良好[36]。另外,变量因素A和C对CBD得率影响极显著,变量因素B和F影响显著,因此将这4个因素作为CBD得率下一步响应面分析的关键因素[37]。其他不显著因素,采用单因素最佳条件,即乙醇浓度为65%,离子液体摩尔浓度为0.3mol/L。
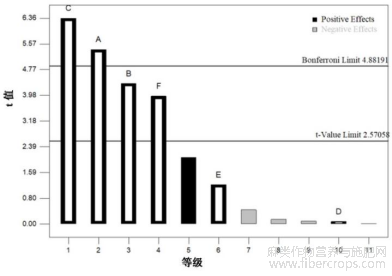
图2为6种单因素对CBD得率影响的帕累托图,能直观表现出自变量因素对目标响应值的影响,并统计展示自变量因素的显著性。帕累托图有两条t值限位线,分别为t-value限位线(2.78)和Bonferroni限位线(5.75),用于确定因素的显著性。当因素的t值高于t-value限位线数值时,则表明它的置信水平超过95%,可以认为其是显著的。当因素的t值高于Bonferroni限位线数值时,则可以认为其是极显著的[38]。由图2可知,变量因素A和C对CBD得率影响极显著,变量因素B和F对CBD得率影响显著。这与表5的结果一致,说明帕累托图是准确可靠的。再次明确将因素A(超声功率)、B(超声温度)、C(超声时间)和F(液料比)作为CBD得率下一步响应面分析的关键因素。
图2 六因素对CBD得率影响的帕累托图
2.5 响应面优化CBD提取工艺
2.5.1 Box-Behnken试验设计
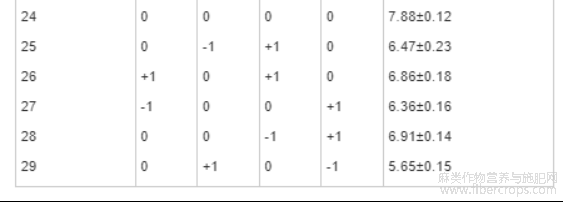
根据Plackett-Burman试验结果,利用响应面Box-Behnken法以超声功率(X1)、超声温度(X2)、超声时间(X3)以及液料比(X4),4个因素为自变量,以CBD得率(Y1)为响应值,设计4因素3水平试验模型。设计方案及试验结果见表6。
表6 Box-Behnken设计方案及结果
通过Design-Expert 8.06软件对表4中的试验数据进行多元二次多项式回归拟合,得到CBD得率(Y1)回归方程:
Y1=7.66+0.15X1-0.078X2+0.28X3+0.11X4+0.32X1X2-0.22X1X3-7.5×10-3X1X4+0.27X2X3+0.13X2X4-0.48X3X4-0.61X12-0.83X22-0.54X32-0.69X42
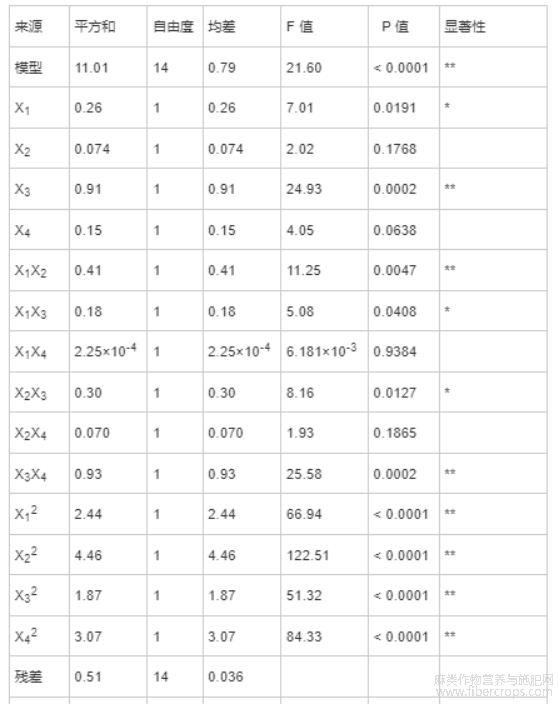
由表7可知,CBD得率(Y1)回归模型的P值<0.01,极显著,说明这两个二次回归方程模型可靠。并且,Y1模型的失拟项不显著(P>0.05),说明Y1模型未失拟,拟合可信。Y1模型决定系数R2=95.57%,调整决定系数R2Adj=91.15%,说明95.57%的响应值的可变性可以被该模型解释,该模型拟合良好。上述方差结果表明,Y1模型可以准确描述各因素与CBD得率的关系。Y1模型中因素X3、X1X2、X3X4、X12、X22、X32和X42对CBD得率影响极显著(P<0.01),因素X1、X1X3和X2X3对CBD得率的影响显著(P<0.05),其余因素不显著。通过F 值大小可知,各因素对CBD得率影响强弱的顺序为X3>X1>X4>X2,即超声时间>超声功率>液料比>超声温度。
表7 方差分析结果
2.5.2 各因素交互作用分析
如图3到图6所示,超声功率与超声温度、超声功率与超声时间、超声温度与超声时间、超声时间与液料比的交互作用等高线图均呈现椭圆状,表明各组交互作用对CBD得率影响显著,与Y1模型方差结果一致。而且深色部分主要集中在7.5%范围内,说明模型拟合出的最佳CBD得率大于7.5%。图3超声功率与超声温度交互作用3D图中,直观展现出超声功率和超声温度对CBD得率的响应曲线,均呈先上升后下降的趋势。CBD得率最高点在280W和50℃附近。图4展示,超声功率和超声温度对CBD得率的响应曲线,均呈快速上升,而后缓慢下降的趋势。CBD得率最高点在280W和60min附近。图5展示,超声温度和超声时间对CBD得率的响应曲线,均呈先上升后下降的趋势。CBD得率最高点在50℃和60min附近。图6展示,超声温度和超声时间对CBD得率的响应曲线,均呈快速上升,而后缓慢下降的趋势。CBD得率最高点在60min和25mL/g附近。

图3 超声功率与超声温度交互作用对CBD得率的影响

图4 超声功率和超声时间交互作用对CBD得率的影响

图5 超声温度和超声时间交互作用对CBD得率的影响

2.5.3 模型验证结果
根据二次回归方程,拟合提取CBD最佳工艺条件及结果。预测最佳工艺条件为,超声功率283.11W,超声温度50.08℃,超声时间62.45min,液料比24.98mL/g,CBD得率为7.70%±0.3%。根据实际操作需要,现实最佳工艺条件为,超声功率280W,超声温度50℃,超声时间62.5min,液料比25.0mL/g,CBD得率为7.66%±0.2%。误差在2.0%之内,说明响应面拟合的工艺模型准确可靠。
2.5.4 不同溶剂对CBD提取效果对比
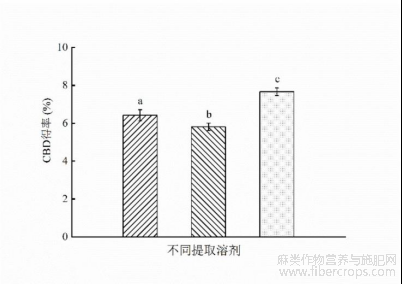
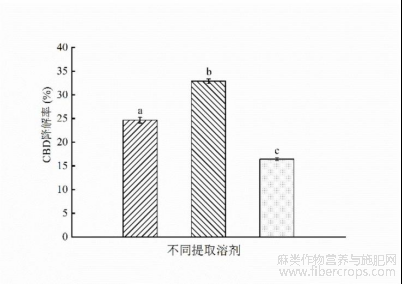
如图7所示,在响应面优化后的CBD的最佳工艺条件下,即液料比25mL/g,超声时间62.5min,功率280 W,温度50℃的条件下,甲醇提取CBD得率为6.42%±0.3%,65%乙醇溶液提取CBD得率为5.81%±0.2%。由2.5.3结果知0.3 mol/L离子液体(65%乙醇配制)提取CBD的得率为7.66%±0.2%。即CBD得率0.3mol/L离子液体>甲醇>65%乙醇溶液。这表明65%乙醇溶液加入离子液体后,提高了CBD得率。根据Mazid等的研究结果,离子液体可以保护CBD分子稳定,防止其提取过程中降解[25]。从而达到提高CBD得率的效果。而且,咪唑类离子液体的亲脂疏水性是由离子液体的阴离子种类和阳离子碳链长度决定的。根据Fan Y等的研究结果表明[39],[C6mim]PF6的疏水性大于乙腈。而[C8mim]NTF2的疏水性大于[C8mim]PF6[40]。所以疏水性由强到弱排序为,[C8mim]NTF2>[C8mim]PF6>[C6mim]PF6>乙腈>甲醇>乙醇。CBD是亲脂疏水性物质,根据相似相溶原理,对CBD的提取能力由强到弱为[C8mim]NTF2>甲醇>乙醇。所以,65%乙醇溶液加入离子液体[C8mim]NTF2后,CBD得率有了较大提升。
图7 不同溶剂提取对CBD得率的影响
(a为甲醇;b为65%乙醇溶剂;c为0.3mol/L离子液体)
2.5.5不同溶剂对CBD降解效果对比
CBD是光敏和热敏性物质,在提取过程中易降解。如图8所示,在响应面优化后的CBD的最佳工艺条件下,即液料比25mL/g,超声时间62.5min,功率280W,温度50℃的条件下,甲醇的CBD降解率为24.65%±0.6%,65%乙醇溶液的CBD降解率为32.88%±0.5%,0.3mol/L离子液体(65%乙醇配制)的CBD降解率为16.40%±0.3%。即CBD的降解率,65%乙醇溶液>甲醇>0.3mol/L离子液体。这是由于CBD在乙醇水溶液中,水呈H+和羟基(OH-)离子状态,溶液活动高,使CBD易降解。而在CBD甲醇溶液中,CBD分子与甲醇和乙醇相互作用的是范德华力,溶液相对稳定。所以,CBD在甲醇溶液中的降解率小于乙醇水溶液的。而65%乙醇溶液加入离子液体[C8mim]NTF2后,CBD的降解率不但降低了,而且小于甲醇的降解率。这是由于,CBD分子与离子液体的阴离子氢键相互作用,形成弱相互作用,弱相互作用力要强于范德华力[41]。因此,CBD分子在离子液体中稳定性更好,更不易被降解,离子液体对CBD具有保护作用。
图8 不同溶剂提取对CBD降解率的影响
(a为甲醇;b为65%乙醇溶剂;c为0.3mol/L离子液体)
3 结论
CBD是工业大麻叶中重要的活性物质,并具有药用价值。对CBD的提取方法进行优化从而提高CBD得率具有很高的应用价值。本研究先从16种咪唑类离子液体中筛选出最佳提取溶剂[C8mim]NTF2。再通过单因素实验,对影响离子液体超声法提取CBD得率的6个因素(超声功率、超声温度、超声时间、乙醇溶液浓度、离子液体的摩尔浓度和液料比)进行优化。并在此结果基础上,利用Plackett-Burman试验设计筛选出4个显著因素(超声功率、超声温度、超声时间和液料比)。并利用响应面Box-Behnken实验优化显著因素。确定提取CBD的最佳工艺条件为:超声功率280W,超声温度50℃,超声时间62.5min,液料比25mL/g。在此最佳提取工艺条件下,CBD得率为7.66%±0.2%,高于同条件下甲醇CBD得率6.42%±0.3%和65%乙醇溶液的CBD得率5.81%±0.2%。这是由于亲脂疏水性[C8mim]NTF2>甲醇>乙醇>65%乙醇,而CBD疏水性强,根据相似相溶原理,对CBD提取能力为[C8mim]NTF2>甲醇>乙醇>65%乙醇。因此65%乙醇加入离子液体后,对CBD提取能力增强,CBD得率提升。通过CBD降解实验,表明0.3mol/L离子液体(65%乙醇配制)的CBD降解率16.40%±0.3%小于甲醇的24.65%±0.6%和65%乙醇溶液的32.88%±0.5%。这说明了65%乙醇溶液加入离子液体后,降低了CBD的降解率,离子液体对CBD具有保护作用。这主要是由于离子液体能与CBD分子形成弱相互作用力,大于甲醇和乙醇与CBD分子形成的范德华力,离子液体CBD溶液更稳定,从而提高CBD的得率。因此,咪唑类离子液体[C8mim]NTF2不但是CBD的保护剂,还是CBD的优良萃取剂。离子液体在本实验中的应用,降低了乙醇的使用量,替代了有毒的甲醇,并提高了CBD的得率。因此,离子液体辅助超声法提取CBD工艺,具备绿色生产的潜力,为CBD的提取工艺研究提供数据支持,为进一步离子液体水溶液完全取代有机溶剂的提取工艺研发,提供参考依据。
参考文献
[1]Das L,Li W,Dodge L A,et al.Comparative Evaluation of Industrial Hemp Cultivars:Agronomical Practices,Feedstock Characterization and Potential for Biofuels and Bioproducts[J].ACS Sustainable Chemistry & Engineering,2020,8(16):6200–6210.
[2]Gunnarsson I B,Kuglarz M,Karakashev D,et al. Thermochemical pretreatments for enhancing succinic acid production from industrial hemp(Cannabis sativa L.)[J].Bioresource Technology,2015,182:58-66.
[3]Hartsel J A,Eades J,Hickory B, et al.Cannabis sativa and Hemp[J].Nutraceuticals,2016:735-754.
[4]Burkhard H,Robert R.Anti-tumour actions of cannabinoids[J].British journal of pharmacology,2019,176(10):1384-1394.
[5]Marcus S D.Tetrahydrocannabinol levels in hemp (cannabis sativa) germplasm resources[J].Economic Botany,2003,57(4):545-558.
[6]Grassa C J,Weiblen G D,Wenger J P,et al.A new Cannabis genome assembly associates elevated cannabidiol (CBD)with hemp introgressed into marijuana[J].New Phytologist,2021,230(4):1665-1679.
[7]Wang Y,Mukhopadhyay P,Cao Z,et al.201 - Cannabidiol Protects againstChronic Plus Binge Alcohol Induced Liver Injury by Modulating Neutrophil Infiltration,E Selectin,Inflammation and Oxidative/Nitrative Stress[J].Free Radical Biology and Medicine,2014,76:S88.
[8]Wirth P W,Watson E S,Elsohly M,et al. Anti-inflammatory properties of cannabichromene[J].Life Sciences,980,26(23):1991-1995.
[9]Huber S,Harder M,Funck K,et al.Novel Room Temperature Ionic Liquid for Liquid-Phase Microextraction of Cannabidiol from Natural Cosmetics[J].Separations,2020,7(3):45.
[10]李焰梅,郝丹,蒋献.大麻二酚在皮肤科的研究进展[J].中国皮肤性病学杂志,2019,33(10):1202-1205.
[11]刘凯,张静,何媛,等.大麻二酚临床疗效及递送系统研究进展[J].沈阳医科大学学报,2021,38(12):1361-1372.
[12]Boehnke K F,Gagnier J J,Matallana L,et al.Substituting Cannabidiol for Opioids and Pain Medications Among Individuals with Fibromyalgia: a Large Online Survey[J].The journal of pain,2021,22(11):1418-1428.
[13]Moltke J,Hindocha C.Reasons for cannabidiol use: a cross-sectional study of CBD users, focusing on self-perceived stress, anxiety,and sleep problems[J].Journal of Cannabis Research,2021,3(1):5.
[14]Hartsel J A,Eades J,Hickory B,et al.Cannabis sativa and Hemp[J].Nutraceuticals,2016:735-754.
[15]高哲,张志军,李晓君,等.火麻叶中大麻二酚的热回流法提取工艺研究[J].中国油脂,2019,44(03):107-111.
[17]Drini Z,Vladi J,Koren A,et al.Microwave-assisted extraction of cannabinoids and antioxidants from Cannabis sativa aerial parts and process modeling[J].Journal of Chemical Technology & Biotechnology, 2020, 95(3):831-839.
[19]Han G,Zhang D,Kong C,et al.Flexible,thermostable and flame-resistant epoxy-based thermally conductive layered films with aligned ionic liquid-wrapped boron nitride nanosheets via cyclic layer-by-layer blade-casting[J].Chemical Engineering Journal,2022,437:135482.
[20]Alayoubi R,Mehmood N,Husson E,et al.Low temperature ionic liquid pretreatment of lignocellulosic biomass to enhance bioethanol yield[J].Renewable energy,2020,145:1808-1816.
[22]Fan C,Li N,Cao X,et al.Ionic liquid-modified countercurrent chromatographic isolation of high-purity delphinidin-3-rutinoside from eggplant peel[J].Journal of Food Science,2020,85(4):1132-1139.
[23]曾理.化学溶剂离子液体研究进展[J].广州化工,2016,44(1):56-58
[25]Mazid R R,Divisekera U,Yang W,et al.Biological stability and activity of siRNA in ionic liquids[J].Chemical Communications,2014,50(88):13457-13460.
[26]Stolte S,Abdulkarim S,Arning J,et al.Primary biodegradation of ionic liquid cations, identification of degradation products of 1-methyl-3-octylimidazolium chloride and electrochemical wastewater treatment of poorly biodegradable compounds[J].Green Chemistry,2008,10(2):214-224.
[27]次仁曲宗,罗禹,屈晓宇,等.黑龙江汉麻叶中化学成分研究与大麻二酚(CBD)含量测定[J].四川大学学报(自然科学版),2019,56(05):957-962.
[28]廖钦洪,李会合,刘奕清,等.碳酸钾活化剂法制备稻壳活性炭的工艺优化[J].农业工程学报,2015,31(11):256-261.
[29]Wu X,Zhang L,Sui A,et al.Optimization of Fermentation Process Parameters for Ginsenoside Re Bioconversion by Plackett-Burman and Box–Benhnken Design[J].Matec Web of Conferences,2018,238(4):04001.
[30]Cai C,Yu W,Wang C,et al.Green extraction of cannabidiol from industrial hemp (Cannabis sativa L.) using deep eutectic solvents coupled with further enrichment and recovery by macroporous resin[J].Journal of Molecular Liquids,2019,287:110957.
[32]Ahmed FE.Analysis of polychlorinated biphenyls in food products[J].TrAC Trends in Analytical Chemistry,2003,22(3):170-185.
[33]邓永,刘东红.超声处理对石榴皮多酚提取效果的影响[J].食品科学技术学报,2021,39(01):65-69+77.
[34]Seoud O,Silva V, Possidonio S ,et al.Microwave-Assisted Derivatization of Cellulose, 2 – The Surprising Effect of the Structure of Ionic Liquids on the Dissolution and Acylation of the Biopolymer[J].Macromolecular Chemistry & Physics, 2011,212(23):2541-2550.
[35]王崑仑,李家磊,谢学军,等.纤维素酶辅助超声法提取葛根多糖及其DPPH自由基清除能力[J].食品工业科技,2019,40(20):174-179,187.
[36]于殿宇,王彤,唐洪琳,等.挤压法制备富钙强化重组大米的工艺优化及其结构表征[J].农业工程学报,2018,34(22):291-298.
[37]Sha R,D Wu,Wang W,et al.Application of Plackett-Burman Design in Screening the Significant Parameters in Extraction of Phytic Acid from Defatted Rice Bran by Acetic Acid[J].Waste & Biomass Valorization,2019,10(4):1003-1011.
[38]Chen F,Qiang Z,Fei S,et al.Optimization of ultrasonic circulating extraction of samara oil from Acer saccharum using combination of Plackett-Burman design and Box-Behnken design[J].Ultrasonics Sonochemistry,2017,35(Pt A):161-175.
[39]Fan Y,Chen M,Shentu C,et al.Ionic liquids extraction of Para Red and Sudan dyes from chilli powder, chilli oil and food additive combined with high performance liquid chromatography[J].Analytica Chimica Acta,2009,650(1):65-69.
[40]刘师师.喜树碱和盐酸小檗碱在离子液体中的溶解性能及应用研究[D].广西大学,2015.
[41]Cai C,Wang Y,Yi Y,et al.Ionic liquids simultaneously used as accelerants, stabilizers and extractants for improving the cannabidiol extraction from industrial hemp[J].Industrial Crops & Products,2020,155:112796.
文章摘自:王崑仑,管立军,高扬,严松,李家磊,李波,周野.离子液体辅助超声法提取工业大麻叶中大麻二酚的工艺优化[J/OL].食品工业科技:1-14[2022-09-29].DOI:10.13386/j.issn1002-0306.2022050272.