摘 要:为明确长期干旱条件下火麻花粉育性、萌发特性及组织结构变化,本研究以长期干旱胁迫和正常培育条件下的火麻花粉为试验材料,观察花粉组织结构,经响应面分析优化葡萄糖、硼酸、培养温度三个因素及最优条件下氯化钙、聚乙二醇PEG对花粉萌发特性的影响,并与TCC染色法、I2-KI染色法进行比较,探究干旱胁迫下花粉活力变化。结果表明:干旱胁迫可导致花粉囊壁增厚,绒毡层空泡化、降解时间延长、保护酶CAT、SOD和ACP的活力显著降低,葡萄糖浓度对火麻花粉萌发的影响大于硼酸、温度。此外,火麻花粉离体萌发最适宜的培养基组分为:葡萄糖质量浓度为9.52%、硼酸浓度为0.06mg/mL、培养温度为24℃、氯化钙浓度为0.40mg/mL以及PEG浓度为10%;TCC染色法和固体萌发法优于I2-KI染色法。长期干旱胁迫下花粉活力下降,可能与保护酶活性降低,绒毡层结构空泡化、降解异常有关。结果可为火麻引种、驯化和培育优良品种提供理论依据。
关键词:火麻(Cannabis sativa L.);绒毡层;花粉活力;离体萌发
火麻(Cannabis sativa L.),是大麻科大麻属一年生草本植物,又称大麻、串麻、寒麻、露麻等,纤维含量高,被广泛用于工业纺织、造纸等(粟建光和戴志刚,2006;李秋实等,2019)。因其生物活性成分四氢大麻酚(THC)、大麻二酚(CBD)等,在治疗癫痫、焦虑、抑郁、肿瘤、癌症、阿尔茨海默病、帕金森病等疾病方面具有广阔的医疗前景,而被广泛种植于欧美亚非等地区(Pattnaiketal.,2022;Li et al.,2020)。
但由于近年来火麻种植地的干旱程度和频率增加,对火麻花粉造成不可逆的影响,威胁着火麻产业发展(Gill et al.,2022),花粉活力是作物育种和繁殖的关键指标之一,直接影响到作物的结籽率和产量,干旱对花粉的生长发育产生负面影响。干旱会使花药开裂率、柱头上的花粉数、花粉活力以及花药淀粉含量等显著降低(Rao et al.,2019),引起的雄性不育,降低坐果率(Lamin-Samuetal.,2021)。在繁殖过程中,花药的减数分裂期和有丝分裂期都极易缺水,在这一阶段,干旱通过影响花药的性质和结构,包括一些减数分裂的细胞退化、小孢子迷失方向、中间层扩大和绒毡层的形成受阻、降解异常,导致花粉不育(Yu et al.,2019)。此外,花粉败育可能与氧化应激(活性氧ROS)、花药的可溶性糖含量有关(Fu et al.,2011)。国内外在其他作物花药萌发的特性,如湿度、光照、氧气浓度和适宜的营养物质等方面做了大量的研究(周瑾等,2022;Mondo et al.,2021;陈霞,2022),但在关于干旱对火麻的花粉活力的影响及萌发特性的研究方面未见报道。为研究干旱胁迫对火麻花粉的影响,本研究探索长期干旱胁迫条件下火麻花粉育性、组织结构变化、保护酶活力以花粉萌发特性,帮助育种者提高育种效率,了解火麻对干旱环境的适应性策略和抗逆性,为引种、培育优良品种和种质资源保存提供理论依据,对于筛选耐旱品种以及指导农作物的管理具有重要的意义。
1 结果与分析
1.1 干旱胁迫下火麻花粉组织结构及生理变化
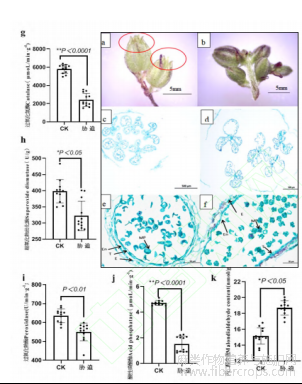
干旱胁迫下,雄株的花蕾变小,花梗变细,数量明显降低,花瓣变薄变短,花粉囊未在花朵开放前提前露出(图1a),正常花蕾形态花瓣包住花粉囊,无该现象(图1b)。对发育期一致的花粉切片观察发现:胁迫下的花粉囊壁增厚(图1c;图1e),细胞体积变大,绒毡层结构依然明显,出现空泡;而正常供水的火麻花粉,随着孢子的成熟,花粉囊壁变薄,绒毡层结构已逐渐消失,着色程度加深(图1d;图1f)。干旱胁迫下雄花的保护酶CAT、SOD和ACP的活力显著降低,POD也出现降低,而膜质过氧化产物MDA含量显著升高(图1g~图1k)。说明:在干旱胁迫下,火麻的保护系统活性氧清除能力降低,花粉发育可能受阻,绒毡层消失实间延长,不能及时释放成熟花粉,导致花粉活力降低。
图1 干旱胁迫下花粉的发育状态及生理变化
注:a:干旱胁迫下雄株花蕾形态,红圈标记为花粉囊;b:正常供水下雄株花蕾形态;c/e:干旱胁迫下花粉形态;d/f:正常供水下雄株花粉形态;g~k:干旱胁迫下花粉的生理变化;E:表皮;En:内表皮;T:绒毡层;MP:成熟花粉
1.2 干旱胁迫下的花粉发育状态及活力差异
1.2.1 TTC染色法鉴定花粉活力
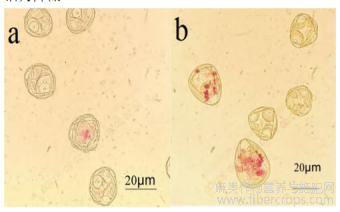
TTC渗入活细胞,与辅酶发生还原反应而显色,由图2可知,染色24h后,重度干旱胁迫下的火麻花粉染色不明显,大多呈无色和黄色;正常花粉染色后则多呈现玫瑰红。以上结果表明:干旱降低了花粉的呼吸作用,活力降低。
图2 TCC染色及显微观察
注:a:干旱胁迫花粉TTC活力鉴定;b:正常花粉TTC活力鉴定
1.2.2 I2-KI染色法
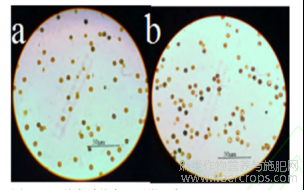
淀粉可吸附碘分子形成蓝紫色复合物,经I2-KI染色后(图3),有部分花粉粒被染成了黑蓝色,且颜色程度深浅不一,不易辨别;总体上干旱胁迫花粉被染成蓝色的粒数少于对照处理下的花粉粒数量。以上结果表明:干旱降低了花粉中的淀粉含量,导致染色不明显。
图3 I2-KI染色法染色及显微观察
注:a:重度干旱胁迫花粉I2-KI染色活力鉴定;b:正常花粉
1.2.3 固体培养基萌发法
1.2.3.1 基于响应面培养基组分优化及模型方差分析
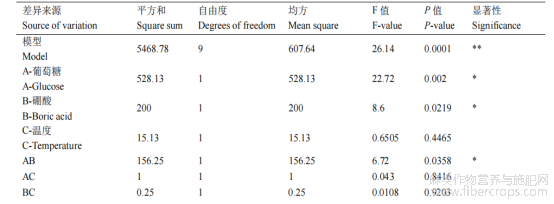
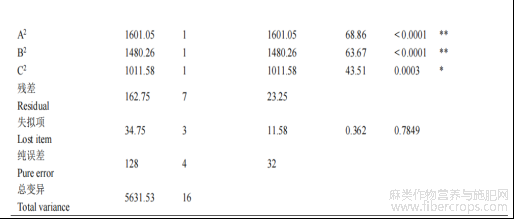
拟合得到回归方程,萌发率=72-8.13×A+5×B-1.37×C-6.25×AB+0.5×AC+0.25BC-19.5×A2-18.75×B2-15.50×C2,方差分析见(表1)可知,失拟项不显著(P=0.789>0.05),而模型的极显著(P<0.0001),因素间交互响应曲面变化趋势正常(图4),说明所选因素范围合理。此外,因素A、B和二次项(A2、B2)对结果有显著影响,而一次项C、交互项(AC、BC)对结果影响不明显(P>0.05)。且在所选取的因素水平范围内,葡萄糖浓度对火麻花粉萌发的影响大于硼酸大于温度。可能是在所选取的因素水平内,葡萄糖的浓度变化对花粉影响效应较大,表现出促进作用。
表1 方差分析
注:P≤0.0001为极显著,用**表示;P≤0.05为显著,用*表示
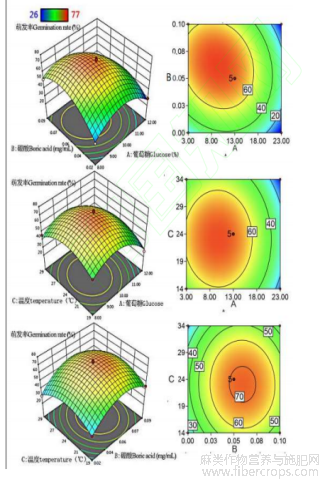
图4 葡萄糖, 硼酸和温度交互对花粉萌发的响应曲面及等高线分布
1.2.3.2 最优条件预测及验证
为探究花粉最优离体萌发最优条件,本研究利用Design-Expert 13.0.1软件对培养组分进行优化,结果表明:火麻花粉离体萌发最适宜的培养基组分为葡萄糖质量浓度为9.52%、硼酸质量浓度为0.061mg/mL以及培养温度为24℃时,火麻花粉离体萌发率为73.42%。经过扩大水平范围重复验证试验(图5a;图5b)得出火麻花粉平均萌发率为72.75%、80.50%,与Design-Expert模型预测值误差仅为2.64%和5.11%,验证结果与预测值偏差仅占0.67%、7.35%,说明:Design-Expert优化得到的火麻花粉离体萌发的培养基具有良好的复现效果,为离体萌发的最优培养条件。
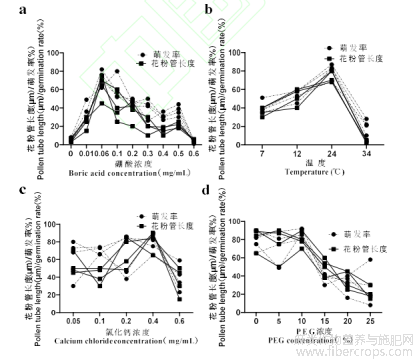
对响应分析结果进行重复验证(图5a、b),发现葡萄糖质量浓度为9.52%时,温度为24℃时,在硼酸浓度为0-0.06mg/mL范围内随浓度增加,花粉萌发率和花粉管长度呈现上升趋势;在0.06mg/mL时,花粉萌发率和花粉管长度达到了72.75%和63.75μm,0、0.60mg/mL时降至最低。在葡萄糖质量浓度为9.36%、硼酸浓度为0.06mg/mL时,随温度的增加,花粉萌发率和花粉管长度也相应地增加;在24℃时,花粉萌发率和花粉管长度达到最大值,分别为:80.50%和74.50μm;在34℃时,花粉萌发率仅为20.25%,而花粉管长度为4.00μm。说明高温导致火麻花粉败育的可能性极高。
1.2.3.3 最优条件下氯化钙对花粉萌发的影响
在Design-Expert优化得到的火麻花粉离体萌发的培养基中加入0.05~0.60mg/mL的氯化钙时,随氯化钙浓度的增加,花粉萌发率和花粉管长度表现出先上升-后下降的趋势(如图5c)。浓度为0.40mg/mL时花粉萌发率和花粉管长度达到78.00%和72.00μm,比最优培养条件下花粉管长度增长近10%,而花粉萌发率无增加趋势,说明:氯化钙可能对花粉管的伸长具有一定的促进作用,并且这种促进作用受浓度调节。
1.2.3.4 最优条件下 PEG 对花粉萌发的影响
由图5d可以看出,当培养基中葡萄糖质量浓度为9.52%、硼酸质量浓度为0.06mg/mL、氯化钙浓度为0.40mg/mL以及培养温度为24℃时,随PEG浓度的增加,花粉萌发率和花粉管长度呈单向下降趋势;在PEG浓度为10%时,花粉萌发率和花粉管长度分别为86%和79.00μm;当PEG浓度超过10%时,花粉萌发率和花粉管长度明显下降,而当PEG浓度超过15%后,固体培养基出现不凝固现象。
图5 响应分析验证及培养条件再优化
1.2.3.5 固体萌发最优培养组分下花粉活力鉴定结果
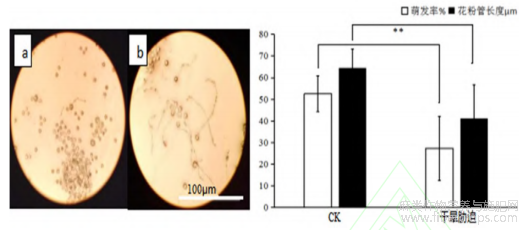
在最优培养条件下,加入0.40mg/mL氯化钙以及10%的PEG作为固体萌发鉴定培养组分,发现正常供水的火麻花粉萌发率为52.50%,花粉管长度达64.50μm;而干旱胁迫处理下的火麻花粉萌发率仅为27.33%,花粉管长降至41.25μm(图6),说明胁迫对花粉管的发育影响较大。
图6 重度干旱胁迫和CK下的花粉萌发
注:a为重度干旱胁迫,b为正常供水CK;**表示极显著,P≤0.0001
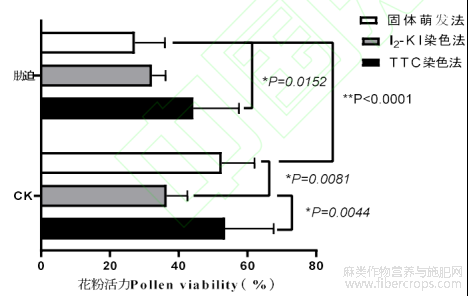
1.3 三种花粉活力鉴定比较
经TTC染色所鉴定的花粉活力的结果高于固体萌发和I2-KI染色(图7),干旱胁迫下的花粉活力均低于正常状态CK的,差异极显著。
图7 花粉活力鉴定比较
2 讨论
花粉作为将雄配子运送到胚珠,在受精过程中起着重要作用,作物的高产通常取决于活花粉活力,而在花粉萌发的过程中,糖、温度、硼和钙扮演着重要角色。糖为花粉管生长提供碳源,维持渗透压,防止花粉破裂。而硼以硼酸的形式促进花粉分化、萌发和花粉管生长,特别是在维管植物的生长发育中起着重要作用(Patel and Mankad,2014);Ca2+在花粉管生长中,控制细胞生长、囊泡运输和通过第二信使在局部梯度进行细胞内信号转导(Steinhorst and Kudla,2013)。在本研究对这些条件进行研究发现:当培养基中葡萄糖质量浓度为9.52%、硼酸浓度为0.06mg/mL以及培养温度为24℃时,火麻花粉离体萌发率为72.75%。而美蔷薇花粉最佳萌发培养基为蔗糖100.00g/L、硼酸0.10g/L萌发率可达40.26%,花粉管平均长度为166.77μm(宋华等,2021);百香果花粉萌发率的影响因素中硝酸钙大于蔗糖大于硼酸,花粉离体萌发的最适培养基为100.00g/L蔗糖、0.02g/L硼酸和0.40g/L硝酸钙,花粉的萌发率为85.55%(刘洁云等,2021);大量的研究表明糖为100.00g/L左右、温度23~30℃和硼酸为0.01~0.3g/L时,花粉适合萌发,不同植物花粉萌发所需浓度表现出一定差异,对不同营养物质的需求强度也不一致(董立国和董立军,2020;苗阳等,2018),花粉形态特征作为物种鉴别的重要指标依据之一(张淑钧等,2023),花粉对元素浓度响应的差异可能与其表面纹饰、形态结构等有关,导致对硼酸等的敏感性不同,这也从侧面也说明了深入花粉形态纹饰的研究可能是花粉营养研究的重要手段。
例如,氯化钙在促进花粉管伸长方面具有明显作用,较高浓度反而被抑制,本研究在最优条件下,氯化钙浓度为0.40mg/mL时,火麻花粉萌发率和花粉管长度达78.00%和72.00μm;而五味子在氯化钙浓度为40.00mg/L时,花粉管长度最长,达161.29μm,花粉萌发率却降低(范三鹏等,2021)。说明0.40mg/mL氯化钙可以促进火麻、五味子等植物的花粉管伸长,但并不是花粉的萌发的最佳浓度。
此外,选择不同的钙源,以葡萄糖酸钙为钙源的花粉萌发的效果优于硝酸钙(戴雨沁等,2020)。PEG是高分子渗透调节物质,可调节植物细胞内的水势变化(张加利等,2022),PEG浓度达10%时,花粉萌发率和花粉管长度最佳,当超过10%后,花粉萌发率和花粉管长度下降幅度变大。10%的PEG可能在火麻花粉萌发过程中起着保湿、维持渗透压的作用,梁露(2022)对不同荷花资源的花粉活力及花粉储藏技术探究中也发现10%的PEG对维持花粉形态和萌发效果较好。
干旱胁迫还会影响开花吐丝间隔期和雄穗的长度,降低花粉活力,导致花丝柱头接受花粉量不足(孙未伟,2022),使细胞体积变大,植株出现表皮细胞、栅栏组织和海绵组织增厚(Qiu et al.,2016)。本研究通过TTC染色发现火麻花粉活力大于固体萌发和I2-KI染色,且干旱胁迫下的花粉活力均低于正常状态CK的,干旱胁迫下植株的花蕾出现花瓣变薄,花粉囊壁增厚,细胞体积变大,绒毡层染色明显,保护酶系统中CAT、SOD和POD活性出现降低,而膜质过氧化产物MDA含量显著升高,说明:在干旱下保护酶系统失衡,花蕾积累了大量活性氧物质对花粉细胞膜系统等产生了损害(Yu et al.,2019),降低了花粉活力,此外可能是绒毡层不能及时消失、花粉囊壁增厚,不能提供营养供花粉母细胞发育和及时释放成熟的花粉,进而限制了火麻花粉小孢子的发育,因为在花药发育早期,绒毡层细胞分泌营养物质、蛋白质、脂质和酶,用于小孢子细胞和小孢子发育,同时启动程序性细胞死亡,为后期花粉壁形成提供材料(Wei and Ma,2023)。酸性磷酸酶(ACP)将有机磷酸盐去磷酸化并转化为无机磷酸盐,提高磷的利用率,并参与植株磷代谢。干旱胁迫下玉米和紫花苜蓿的ACP活性都有所增加,并且高度依赖于基因型(Ehsanpour and Amini,2003;Cunhua et al.,2010),本研究中发现胁迫下ACP在火麻花蕾和花粉中显著降低,可能是长期胁迫降低植株的营养分配,ACP的降低可能影响到花粉发育磷元素的供给,此外不同作物在胁迫下酸性磷酸酶的变化可能与作物的种类、基因型、生长环境以及胁迫程度等因素有关(夏静等,2023;EhsanpourandAmini,2003),这可能也是未来花粉特性方面研究的焦点。
在所选取的因素水平范围内,火麻花粉离体培养最佳条件为:温度为24℃、葡萄糖质量浓度为9.52%、硼酸浓度为0.06mg/mL、氯化钙浓度为0.40mg/mL及10%PEG;干旱胁迫会降低火麻花粉的淀粉含量及细胞呼吸作用,导致保护酶活性降低、膜质氧化程度加剧,积累有害物质(活性氧、丙二醛等)对花粉细胞产生损害;绒毡层不能及时消失、引起花粉囊壁增厚限制了小孢子的发育,最终导致花粉活力降低。
3 材料与方法
3.1 材料
本试验采用盆栽方法进行,选取大小均一的火麻种子(由杨永红教授2021年收集于大理宾川乌龙坝,并鉴定为大麻科,大麻属)播种到圆形塑花盆中,每个处理100盆,每盆1粒种子,移除种子未萌发的花盆,待出植株长出第3对真叶。土壤条件:碱解氮83.7mg/kg,有效磷19.4mg/kg,速效钾297.42mg/kg,有机质21.0g/kg,pH6.8。
3.2 方法
选取长势一致的火麻苗,分为2组,每组100盆。矫正温湿度仪器和土壤相对含水量实际对应数值,联合称重法,利用土壤温湿度仪(传感器型号:RS-WS-NO1-TR-1,建大仁科)监测土壤水分情况。对照组CK:保持每盆中土壤湿润程度为田间土壤最大持水能力的60%±5%(Control);处理组:土壤相对含水量维持在田间持水能力20%±5%的干旱胁迫处理(植株易出现缺水,及时补水控水),直至可以收集花粉为止。
于实验前1d采集试验正常供水和干旱胁迫处理下开使散落花粉的雄株花序,将漏出花粉囊的花蕾用剪下,收集花蕾于试管内(试管底部塞一团浸水的脱脂棉花),于7℃和-80℃冰箱保存,用于测定花粉活力和相关生理指标过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、超氧化物歧化酶(Superoxide dismutase,SOD)、酸性磷酸酶(Acid phosphatase,ACP)和丙二醛含量(Malondialdehyde content,MDA),相关试剂由苏州格锐思生物科技有限公司提供。同时,将收集的发育期相同的花蕾置于2ml离心管中,75%FAA固定液固定保存于7℃冰箱,石蜡包埋、切片、番红固绿染色、树胶封片后在显微镜下观察(相关技术及试剂由武汉赛维尔生物公司提供)。采用TCC染色法、I2-KI染色法和固体培养基萌发法对花粉活力鉴定及萌发特性进行研究。
3.2.1 TCC染色法
用尖嘴镊子夹住花托,轻轻拍打镊子将花粉抖落于载玻片上后,加1滴TTC溶液(TTC染色液:称取0.5gTTC溶于100mL磷酸盐缓冲液)盖上盖玻片,24h后取出进行显微观察,以花粉粒变红色认定有活力。
3.2.2 I2-KI 染色法
将少量花粉均匀置于载玻片后加1滴I2-KI溶液,染色10min后观察,花粉粒为蓝紫色认定其有活力。
3.2.3 固体培养基萌发法
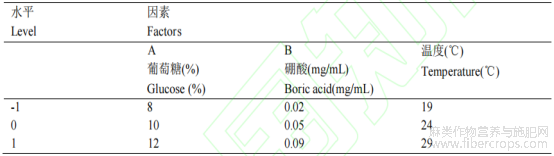
采用Design-Expert 13.0.1中心组合试验和响应面分析法设计3因素3水平的试验方案,因子和编码水平见表2。以响应面分析推荐的最优葡萄糖、硼酸和培养温度为营养基质,进行氯化钙和PEG浓度探索最佳鉴定方法和萌发特性。将不同组分的培养基加热融化后,用移液枪吸取培养基滴涂于载玻片上,每片涂3个区域,每个区域吸取150μL,冷却后将花粉抖落于培养基表面,每片用2~3个花蕾,3次重复,然后将玻片置于垫有湿润滤纸的培养皿之中,25℃条件下培养24h后在光学显微镜下观察花粉萌发情况,以花粉管长度超过花粉粒直径作为萌发计数标准。每处理统计约100粒花粉,重复4次。
花粉萌发率=萌发花粉数/观察花粉总数×100%。
表 2 响应面分析因素及水平
注:所选因素水平范围基于前期单因素实验和文献报道
3.3 数据统计与分析
采用Excel 2019软件处理数据及制作图表,运用Graphpad prism 9.3.0和SPSS 18.0软件对各参数进行单因素方差分析和Tukey多重比较(P<0.05和P<0.001,根据P值大小、显著用*表示,极显著标**)。
作者贡献
郑其向是本研究的实验设计者和实验研究的执行人,完成数据分析,论文初稿的写作;罗欢、许锦、和燕、陆银香、杨昆林和杨昆彬参与实验设计和试验结果分析;杨永红教授是项目的构思者及负责人,指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由宾川瑞林克林业科技有限公司资助,感谢杨昆林和杨昆彬为试验提供材料让研究得以顺利开展;感谢杨永红教授对研究的耐心指导。
参考文献
[1]Cunhua S., Wei D., Xiangling C., Xinna X., Yahong Z., Dong S., and Jianjie S., 2010, The effects of drought stress on the activity of acid phosphatase and its protective enzymes in pigweed leaves, African Journal of Biotechnology, 9(6): 825-833.
[2]Dong B., Zheng X., Liu H., Able J. A., Yang H., Zhao H., Zhang M., Qiao Y., Wang Y., and Liu M., 2017, Effects of drought stress on pollen sterility, grain yield, abscisic acid and protective enzymes in two winter wheat cultivars, Frontiers in Plant Science, 8: 1008.
[3]Ehsanpour A.A., and Amini F., 2003, Effect of salt and drought stress on acid phosphatase activities in alfalfa (Medicago sativa L.) explants under in vitro culture, African Journal of Biotechnology, 2(5): 133-135.
[4]Fu G.F., Song J., Xiong J., LI Y.R., Cheng H.Z., Le M.K., and Tao L.X., 2011, Changes of oxidative stress and soluble sugar in anthers involve in rice pollen abortion under drought stress, Agricultural Sciences in China, 10(7): 1016-1025.
[5]Gill A.R., Loveys B.R., Cowley J.M., Hall T., Cavagnaro T.R., and Burton R.A., 2022, Physiological and morphological responses of industrial hemp (Cannabis sativa L.) to water deficit, Industrial Crops and Products, 187: 115331.
[6]Lamin-Samu A. T., Farghal M., Ali M., and Lu G., 2021, Morpho-physiological and transcriptome changes in tomato anthers of different developmental stages under drought stress, Cells, 10(7): 1809.
[7]Li H., Liu Y., Tian D., Tian L., Ju X., Qi L., Wang Y., and Liang C.,2020, Overview of cannabidiol (CBD) and its analogues: Structures, biological activities, and neuroprotective mechanisms in epilepsy and Alzheimer’s disease, European Journal of Medicinal Chemistry, 192: 112163.
[8]Mondo J.M., Agre P.A., Asiedu R., Akoroda M.O., and Asfaw A., 2021, Optimized protocol for in vitro pollen germination in yam (Dioscorea spp.), Plants, 10(4): 795.
[9]Patel R. G., and Mankad A. U., 2014, In vitro pollen germination-areview, international journal of Science and Research, 3(5): 304-307.
[10]Pattnaik F., Nanda S., Mohanty S., Dalai A.K., Kumar V., Ponnusamy S.K., and Naik S., 2022, Cannabis: Chemistry, extraction and therapeutic applications, Chemosphere, 289: 133012.
[11]Qiu L.I.U., Zhihui L.I., and Jiyou W.U., 2016, Research progress on leaf anatomical structures of plants under drought stress, Agricultural Science and Technology, 17(1).
[12]Rao G.S., Ashraf U., Kong L.L., Mo Z.W., Xiao L.Z., Zhong K.Y., Rasul F., and Tang X.R., 2019, Low soil temperature and drought stress conditions at flowering stage affect physiology and pollen traits of rice, Journal of Integrative Agriculture, 18(8): 1859-1870.
[13]Steinhorst L., and Kudla J., 2013, Calcium-a central regulator of pollen germination and tube growth, Biochimica et Biophysica Acta (BBA)- Molecular Cell Research, 1833(7): 1573-1581.
[14]Wei S., and Ma L., 2023, Comprehensive insight into tapetum-mediated pollen development in Arabidopsis thaliana. Cells, 12(2): 247.
[15]Yu J., Jiang M., and Guo C., 2019, Crop pollen development under drought: from the phenotype to the mechanism, International journal of molecular sciences, 20(7): 1550.
[16]陈霞,王思宇,王志彬,王春荣,2022,不同培养基和贮藏方法对柳树花粉萌发的影响,河北林业科技,(2):1-3.
[17]戴雨沁,程梦雨,顾佩乾,薄雨心,陈佳豪,齐开杰,吴巨友,张绍铃,王鹏,2020,钙源对梨花粉萌发及花粉管生长的影响,江苏农业科学,48(19):142-144+155.
[18]董立国,董立军,2020,培养基类型及贮藏温度对文冠果花粉离体培养萌发效果的影响分析,湖北林业科技,49(5):28-30.
[19]范三鹏,陈巍,范志强,王东东,杨用成,胡高升,贾景明,2021,五味子成花特性及花粉离体萌发培养基优化,黑龙江农业科学,(10):117-122.
[20]李秋实,孟莹,陈士林,2019,药用大麻种质资源分类与研究策略,中国中药杂志,44(20):4309-4316.
[21]梁露,2022,不同荷花资源的花粉活力比较分析及花粉储藏技术探究,硕士学位论文,河南农业大学,导师:孔德政.
[22]刘洁云,吴艳艳,牟海飞,温放,田青兰,韦毅刚,张英俊,符龙飞,彭嘉宇,黄伟华,2021,黄百香果花粉离体培养基筛选及贮藏试验,西南农业学报,34(8):1699-1704.
苗阳,董胜君,吴月亮,刘明国,李欢,陈建华,2018,野杏花粉离体培养条件筛选及花粉生活力研究,北方园艺,(4):26-33.
[23]宋华,朱莹,邓莲,杜莹,刘娜,2021,美蔷薇花粉离体萌发条件及贮藏特性研究,种子,40(6):122-126.
粟建光,戴志刚,主编,2006,大麻种质资源描述规范和数据标准,北京:中国农业出版社.
[24]孙未伟,2022,非生物逆境胁迫下夏玉米花粉形态与生理特征研究,硕士学位论文,安徽农业大学,导师:宋有洪,pp.3.
[25]夏静,南丽丽,陈洁,马彪,何海鹏姚宇恒,张泽龙,2023,低磷胁迫下不同根型苜蓿形态及生理响应,中国草地学报,45(10):58-67.
[26]张加利,张雨欣,王宁,王思雨,曹晗,牟洪香,2022,PEG预处理对文冠果种子萌发和幼苗生长的影响,林业与生态科学,37(4):384-389.
[27]张淑钧,杨欣欣,罗建,2023,西藏色季拉山区风毛菊属植物花粉形态特征及其分类学意义,植物研究,43(5):741-755.
[28]周瑾,柏永清,曾妍,谢佳雯,齐鑫,魏冬梅,2022,含笑花花粉萌发和花粉管生长的离体培养研究,湖北农业科学,61(19):72-77.
文章摘自:郑其向,杨永红,罗欢,许锦,和燕,陆银香,杨昆林,杨昆彬.长期干旱胁迫对火麻(Cannabis sativa L.)花粉生理组织结构及萌发特性的影响[J].分子植物育种.https://link.cnki.net/urlid/46.1068.s.20250603.1322.002。