摘 要: 为研究苎麻织物整理用生物酶菌株,构建表达载体将嗜松篮状菌(Talaromyces pinophilus)膨胀因子基因进行同源表达,测定了重组嗜松篮状菌发酵72h时的纤维素酶酶活,通过X射线衍射测试了酶解前后苎麻织物的结晶度,并将酶液用于苎麻织物整理,测试了整理后苎麻织物的刺痒感降低率、失重率和断裂强力。试验结果表明:嗜松篮状菌转化子表达的膨胀因子大小约33kD;重组嗜松篮状菌发酵72h时其纤维二糖水解酶(CBH)和滤纸酶的活力分别为2.85U/mL和20.68U/mL,较出发菌株都有显著增加;酶解苎麻织物的结晶度由未酶解的75.1%降至69.6%,刺痒感降低率为42.2%,显著降低了苎麻织物的刺痒感,并保持较好的织物强力。
关键词:苎麻;纤维素酶;膨胀因子;嗜松篮状菌;刺痒感;舒适整理
麻纤维是从苎麻、黄麻和亚麻等麻类中获取的天然植物纤维。麻纤维从麻类植物中提取出来,需经过脱胶、打麻、给油和烘干等处理获得纺织用的精干麻纤维[1]。与其他纺织纤维相比,麻纤维散湿功能强,透气性好,抗拉强力大,散热性好,防霉抗蛀,静电低,其织物面料质地轻,穿着凉爽,挺括不贴身,是制作夏季服装的优良面料[2]。但麻纤维结晶度高,纤维粗糙,弹性较差,抱合力弱,容易起皱,织物不够柔软,纤维硬挺产生刺痒感,导致麻织物附加值降低,应用受到限制[3]。
针对苎麻织物产品需要提高柔软度的问题,目前常用的技术主要有化学法、物理法和酶法[4-6]。纤维素酶是通过水解纤维素的β-1,4-葡萄糖苷键产生葡萄糖的一组复合酶系,包括纤维二糖水解酶、内切-β-葡聚糖酶和β-葡萄糖苷酶,纤维素酶系的各组分协同作用将纤维素最终水解为葡萄糖[7-9]。纤维素酶能降解苎麻纤维,减少纤维素的结晶区,从而改善苎麻织物的柔软性,并且具有作用专一和低碳环保的优点[10]。
膨胀因子是一类促进纤维素晶体膨胀和降解的辅助蛋白,通过协同作用提高纤维素酶降解纤维素晶体的效率[11]。本研究将来源于Talaromyces pinophilus(嗜松篮状菌)的膨胀因子基因在T.pinophilus中进行同源表达,将表达产物用于苎麻织物的整理,为膨胀因子在苎麻织物柔化整理工艺中的应用提供重要依据。
1 试验部分
1.1 材料与仪器
试验材料:脱氧核糖核酸限制性内切酶、脱氧核糖核酸连接酶、质粒纯化试剂盒、脱氧核糖核酸分子量标准品、脱氧核糖核酸片段纯化试剂盒(大连宝生物公司);羧甲基纤维素钠(美国西格玛奥德里奇公司);纯苎麻坯布(江西恩达麻世纪科技股份有限公司);嗜松篮状菌(Talaromyces pinophilus)DX17、质粒pTPHA(本实验室保藏)。
仪器设备:ZF-288凝胶成像系统(上海嘉鹏科技有限公司);UV-6100型紫外可见分光光度计(上海元析仪器有限公司);YM-06Z型程式化刺痒感分析测定仪(莱州元茂仪器有限公司);HD026H型多功能电子织物强力仪(南通宏大实验仪器有限公司);XRD-7000型衍射仪(岛津企业有限公司);DHG-9140A型烘箱(上海一恒科学仪器有限公司)。
1.2 重组嗜松篮状菌的构建
1.2.1 培养基
PDA培养基:称取200g马铃薯切成小方块,加水煮沸20min,纱布过滤,弃去土豆渣,加入20g葡萄糖和18g琼脂,补纯水至总体积为1000mL,高压蒸汽灭菌。产酶培养基:微晶纤维素30g/L,酵母提取物1g/L,(NH4)2SO4 4g/L,KH2PO4 2g/L,MgSO4 0.8g/L,吐温-800.8g/L,CaC12 0.2g/L,FeSO4×7H2O 0.01g/L,MnSO4×H2O 0.01g/L,ZnSO4×7H2O 0.01g/L,CoCl2×6H2O 0.01g/L。115℃湿热灭菌30min。
1.2.2 载体的构建
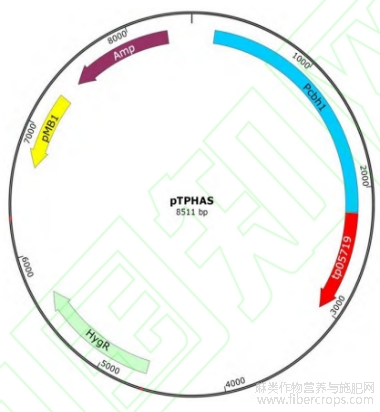
合成cbh1启动子及膨胀因子基因序列,连接到含有氨苄青霉素和潮霉素抗性基因的质粒pTPHA,获得表达载体pTPHAS。载体pTPHAS具有pMB1复制子序列和膨胀因子基因表达盒,可以在大肠杆菌中进行复制。
1.2.3 T.pinophilus 的转化
将T.pinophilus在PDA平板上培养72h,取培养后菌体接种于50mL液体YPD培养基中培养72h,收集菌体用蜗牛酶制备嗜松篮状菌原生质体,将质粒转化至T.pinophilus原生质体内,然后将原生质体悬浮液涂布于PDA筛选培养基平板上,28℃培养5天后观察阳性重组菌生长情况。
1.2.4 重组菌发酵产酶
将重组菌在PDA平板上培养,培养72h后挑取重组菌接到种子培养基,培养48h后转接至50mL产酶培养基,在温度30℃和转速200r/min条件下培养72h,将发酵液离心收集上清酶液。蛋白电泳样品取发酵液离心后的上清液,采用质量分数12%的聚丙烯酰胺、质量分数0.1%考马斯亮蓝R-250染色,乙酸、甲醇和水脱色配比为1:2:7。电泳凝胶的配方、电泳的参数以及凝胶的染色、脱色等参照标准试验方法进行。
1.3 苎麻织物整理
将纯苎麻织物作为试样,以浴比1:10、入浴温度50℃加酶入浴整理30min,整理后放入100℃水中水洗两次,每次3min,烘干后保存。
1.4 性能测试
1.4.1 酶活力测定
内切葡聚糖酶活(EGA)、纤维二糖水解酶活(CBHA)、β-葡萄糖苷酶活(BGA)和滤纸酶活力(FPA)的测定参考文献方法[12]进行。内切葡聚糖酶活的测定底物为质量分数1%羧甲基纤维素钠,每个单位的内切葡聚糖酶活力为每小时由底物产生1.0mg还原糖所需的酶量,用U/mL表示。纤维二糖水解酶活的测定底物为微晶纤维素,每个单位的纤维二糖水解酶活力为每小时由底物产生1.0mg还原糖所需的酶量,用U/mL表示。β-葡萄糖苷酶活的测定底物为纤维二糖,每个单位的β-葡萄糖苷酶活力为每小时生成2.0mg葡萄糖所需的酶量,用U/mL表示。滤纸酶活力的测定底物为Whatman No.1滤纸,每个单位的滤纸酶活力为每小时生成1.0mg还原糖所需的酶量,用U/mL表示。
1.4.2 苎麻织物纤维素结晶度的测定
将苎麻织物酶解30min,用纯水反复洗涤,干燥后研磨,使用X射线衍射仪分析织物纤维素。
1.4.3 刺痒感降低率、失重率和断裂强力的测试
刺痒感降低率、失重率和断裂强力的测试参考文献方法[13]进行。刺痒感降低率=(整理前压缩比功-整理后压缩比功)/整理前压缩比功×100%。失重率=(整理前织物质量-整理后织物质量)/整理前织物质量×100%。断裂强力降低率=(整理前断裂强力-整理后断裂强力)/整理前断裂强力×100%。
2 结果与分析
2.1 膨胀因子基因的序列分析
T.pinophilus膨胀因子基因由813个核苷酸组成,GC含量53%,编码蛋白长度为270个氨基酸残基。将T.pinophilus膨胀因子基因序列在NCBI中进行比对分析,发现T.pinophilus膨胀因子基因序列与Talaromyces pinophilus 1-95(NCBI登录号:CP017351.1)和Talaromyces marneffei(NCBI登录号:XM_054268719.1)相应同源序列的一致性分别为99.63%和87.84%。
2.2 载体构建
合成cbh1启动子及膨胀因子基因序列,连接到质粒pTPHA,获得T.pinophilus表达载体pTPHAS见图1。由图1可知,载体pTPHAS具有氨苄青霉素抗性基因、pMB1复制子序列和膨胀因子基因表达盒,可以在大肠杆菌中进行复制。
图1 质粒pTPHAS图谱
2.3 膨胀因子基因的表达
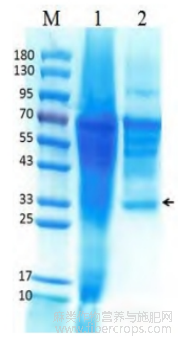
用于丝状真菌转化的常用方法有原生质体转化法、基因枪法和根癌农杆菌介导转化法,其中原生质体-PEG转化法试验周期较短,成本相对较低。将表达载体pTPHAS转入T.pinophilus,获得的重组T.pinophilus与出发菌株进行发酵产酶,发酵上清酶液电泳结果见图2,其中,条带M为蛋白标样,条带1为出发菌株分泌蛋白,条带2为重组T.pinophilus分泌蛋白。图2显示重组T.pinophilus的酶液有大小约33kD的显著条带,而出发菌株在该位置条带相对较弱,表明膨胀因子基因在重组T.pinophilus中得到了表达,而且表达的蛋白分泌到重组T.pinophilus胞外。
图2 蛋白电泳图
2.4 重组T.pinophilus纤维素酶组分
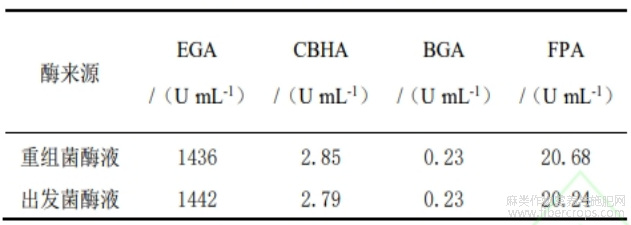
分别取重组T.pinophilus和出发菌株发酵72h的酶液,测定其纤维素酶组分的酶活,结果见表1。表1表明,膨胀因子基因的表达对重组T.pinophilusβ-葡萄糖苷酶的酶活力基本没有影响,内切葡聚糖酶的酶活力略有降低,可能是膨胀因子表达量的增加影响了内切葡聚糖酶的表达。重组T.pinophilus纤维二糖水解酶和滤纸酶的活力较出发菌株都有较显著增加,可能是由于膨胀因子对纤维素结晶的协调降解作用。
表1 纤维素酶的组分
2.5 纤维素结晶度的测定
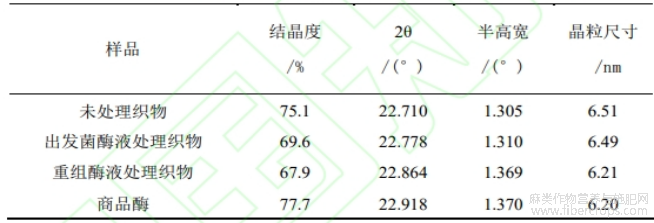
通过XRD测量酶解苎麻织物纤维素的结晶度,与未处理织物样品比,重组T.pinophilus酶液处理样品的2θ为22.864°,衍射峰位置略有偏移;出发菌酶液处理样品的2θ为22.778°,与未处理织物样品的2θ(22.71°)较接近。两种酶液处理样品的纤维素结晶度都有较大下降,出发菌酶液处理样品的结晶度从未处理的75.1%降至69.6%,重组酶液处理样品的结晶度降至67.9%。结果表明重组酶液中膨胀因子的协调降解可以破坏苎麻织物纤维素的结晶度,提高酶水解纤维素的效率。
表2 苎麻织物酶解产物XRD分析结果
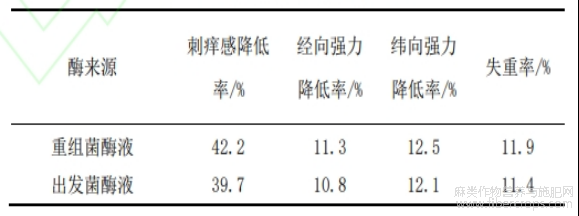
2.6 苎麻织物整理
将重组T.pinophilus酶液和出发菌酶液用于苎麻织物整理,纤维素酶会影响织物的刺痒感,酶解效率越高,织物表面的毛羽被酶水解得越充分,但用酶量过多,对织物纤维素的破坏越强,会降低织物的断裂强力。结果显示重组酶液对苎麻织物刺痒感的影响更大,苎麻织物有更好的柔软舒适性。
表3 苎麻织物纤维素酶整理
3 结论
Talaromyces pinophilus膨胀因子基因由813个核苷酸组成,构建表达载体将膨胀因子基因在T.pinophilus中表达,表达蛋白大小为33kD,获得的重组T.pinophilus发酵72h时的纤维二糖水解酶和滤纸酶的活力分别为2.85U/mL和20.68U/mL。X射线衍射显示重组T.pinophilus发酵酶液处理苎麻织物的结晶度为69.6%,酶解效率的提高主要是由于苎麻织物结晶度的降低。重组T.pinophilus酶液对苎麻织物整理的刺痒感降低率为42.2%,显著降低了苎麻织物的刺痒感。
参考文献:
[1] 杨洁,唐昀,申香英,等.我国苎麻产业现状与振兴发展[J].中国麻业科学,2022,44(4):253-256.
[2] 钱丽莉,陈红霞,杜志敏,等.在棉纺设备上加工麻纤维的回潮率控制研究[J].棉纺织技术,2024,52(7):18-21.
[3] 冯浩,胡拓宇,何智涛,等.混合多元羧酸在苎麻织物抗皱整理中的应用[J].棉纺织技术,2022,50(8):57-60.
[4] 胡萍,杨陈.纤维素酶对丝光苎麻织物的抗刺痒感整理[J].毛纺科技,2018,46(6):42-44.
[5] 喻红芹,张琦,李虹,等.苎麻纤维改性方法的对比分析[J].河南工程学院学报(自然科学版),2015,27(3):1-4.
[6] 张勇,鄢勇气.苎麻纤维化学改性研究进展[J].化学研究,2021,32(3):277-282.
[7] GODA A D,SHAKAM M H,METWALLY E M, et al. Correction: enhancement of cellulolytic enzyme production from intrageneric protoplast fusion of aspergillus species and evaluating the hydrolysate scavenging activity[J].Microbial cell factories,2024,23(1):136-136.
[8] 赵鑫,张红,门中华,等.纤维素酶的研究与应用进展[J].化学与生物工程,2023,40(9):1-9.
[9] LI J,CHEN Y,GAO A, et al. Simultaneous production of cellulase and β-carotene in the filamentous fungus Trichoderma reesei[J].Journal of Agricultural and Food Chemistry,2023,71(16):6358-6365.
[10] 罗凤香,刘海燕,周衡书,等.复合酶降低苎麻机织物刺痒感工艺研究[J].湖南工程学院学报(自然科学版),2022,32(2):77-82.
[11] SALOHEIMO M,PALOHEIMO M,HAKOLA S, et al. Swollenin,a Trichoderma reesei protein with sequence similarity to the plant expansins , exhibits disruption activity on cellulosic materials[J].European Journal of Biochemistry,2002,269(17):4202-4211.
[12] 顾斌涛,黄国昌,熊大维.内切葡聚糖酶基因cel7b在里氏木霉中的同源表达[J].中国酿造,2016,35(8):129-132.
[13] 顾斌涛,曾静,郭建军,等.苎麻织物退浆与整理一浴法工艺优化[J].棉纺织技术,2024,52(7):29-32.
文章摘自:顾斌涛,曾静,郭建军,熊大维,袁林.膨胀因子基因的同源表达及在苎麻织物整理中的应用[J].棉纺织技术.https://link.cnki.net/urlid/61.1132.TS.20250613.1501.004。