摘 要: 倍性育种是一种通过改变染色体组数目实现提高作物产量、抗逆性等目的的一种较新型育种方式。为了探究多倍化对工业大麻的影响,研究分别用流式细胞法和直接压片法鉴定出四倍体工业大麻,随后对工业大麻二倍体及其同源四倍体的形态进行差异分析。结果显示,四倍体工业大麻植株具有器官增大的特点,其中叶长、叶宽、叶柄长、叶厚、叶面积的变化尤其显著。四倍体植株叶片气孔显著变大,但其密度比二倍体一半还低。此外还发现四倍体大麻雌株开花时间较二倍体延迟。该研究为工业大麻的倍性育种工作提供了理论依据。
关键词: 多倍体;工业大麻;育种;表型差异
多倍体是指每个细胞核中同时具有两个或多个完整染色体组的个体,根据是否涉及种间杂交分为同源多倍体和异源多倍体[1]。被子植物中有七成的种类在漫长的进化过程中均发生过一次甚至多次多倍化事件[2]。一般而言,多倍体植物相较二倍体植物的农艺性状有明显变化,在形态方面表现为器官明显增大,比如叶片、花、气孔、花粉等[3-8]。在生理方面,同源多倍体易出现染色体间配对异常,导致育性差,结实率低[9]。而异源多倍体则恰恰相反,其自交亲和,结实率高[10]。在生化方面,多倍体新陈代谢旺盛,有机合成速率提高,表现为体内植物碱、单宁等一些次生代谢物和维生素、蛋白质等物质含量增加[11]。因为多倍体有诸多的优势,因此将染色体多倍化,创制新的多倍体育种材料,是一种快速高效的培育新品种的方法。目前,多倍体育种已经被广泛用于作物、药用植物等育种中[12-15]。
大麻(CannabissativaL.)是一种重要的草本经济作物,种植历史悠久,被用于纺织、造纸、建材、食品及医药等多个领域。大麻因为其含特有的大麻素而被大众认知。大麻素类中有两种重要物质被广泛研究,分别是四氢大麻酚(THC)和大麻二酚(CBD)。四氢大麻酚具致幻作用,而大麻二酚可被用来治疗癫痫、抑郁、焦虑等[16-18]。国际上将四氢大麻酚含量低于0.3%的大麻定义为工业大麻,而高于0.3%的大麻定义为娱乐性大麻[19]。目前,国内外常用混合选择、杂交育种、自交育种和混交育种等方法进行工业大麻育种,例如意大利品种Bolognese、Toscana和Ferrarese都是通过长期混合选择培育的[20],而我国的云麻2号和云麻4号就是通过杂交育种选育的[21]。由于常规育种费时费力,近年已有研究者开始对大麻进行倍性育种并取得了一些成果[22]。
本研究以染色体加倍的工业大麻为试验材料,观察、比较其与二倍体的一系列生长发育动态变化,旨为工业大麻的倍性育种工作提供理论依据。
1试验材料
本研究以工业大麻材料DMG265及其同源四倍体雌株为试验材料,同源四倍体工业大麻由本课题组创制[23]。
材料培养:取二倍体和四倍体健康雌性大麻植株嫰梢进行扦插扩繁,在浓度为0.3g/L生根水中浸泡10~15min后置于育苗盘中培养,约4~5周后移栽至盆中,将其放置在室温(26±2)℃,16h光照/8h黑暗环境中,每周施肥一次(苗期肥)。在6周以后选取株高接近的植株转移至生殖生长环境中,以诱使其开花。培养条件为室温(26±2)℃,12h光照/12h黑暗,每周施一次花期肥。
2试验方法
2.1倍性鉴定
2.1.1流式细胞术鉴定
参照MahsaBagheri[24]的方法,随机选取20株经诱导染色体加倍处理的大麻,采集茎尖生长状况良好幼嫩的叶片置于预冷4℃的直径为35mm的培养皿中,加入1mLLB01解离液,用刀片快速将叶片切碎,将液体用40μm过滤网滤至离心管中,加入在冰上预冷的RNase,置于冰上15~30min后,加入PI(碘化丙啶)染色15min后用BDAccuriC6流式细胞仪检测。
2.1.2压片法鉴定
剪取大麻植株顶端嫩枝,经过0.3g/L浓度的生根水浸泡一段时间后插入水培箱中进行室温培养。约三周后取1cm左右根尖冲洗浸泡在蒸馏水中,于4℃冰箱中静置12h以上,随后用卡诺氏固定液(V甲醇:V冰醋酸=3:1)固定8~20h。接着用蒸馏水将幼根上的固定液洗净转移至1mol/LHCL中,在60℃环境下解离3~5min,再利用45%的乙酸对其软化45min。取根尖白色生长点部位在载玻片上用改良版石炭酸-品红染色1h。按照常规方法压片,用镊子轻轻敲击根尖,将其完全压碎铺平在玻片上,再用光学显微镜油镜观察细胞中染色体数目。
2.2形态指标测定
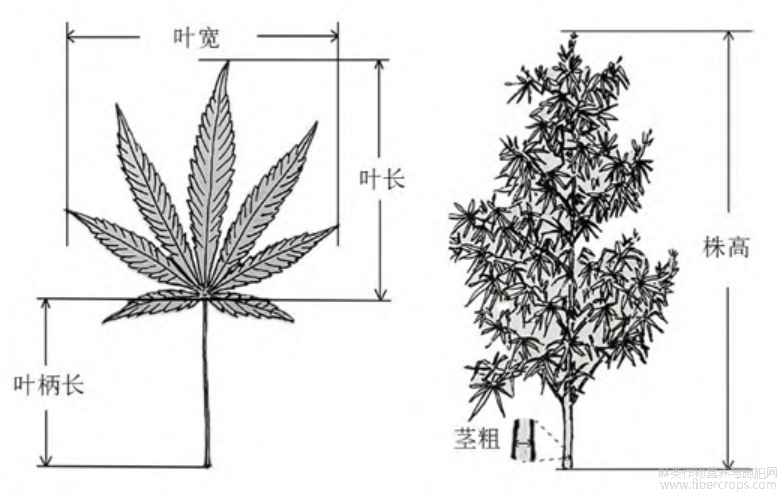
大麻形态测定方法参照《大麻种质资源描述规范和数据标准》(图1)[25]。叶长:叶基部至最尖端的距离;叶宽:叶片最宽处的距离;株高:茎基部至生长点的距离;茎粗:茎基部直径;花序长:主茎花序基部至花序最顶端;叶厚:用植物叶片厚度计测量叶片中心蘖中间位置厚度;叶面积:拍下主茎最幼嫩的成熟营养叶照片,用Imaje-J软件测量像素数后转换为面积,照片分辨率为72dpi。
按照以上测定方法,分别选取8株健壮、生长状况良好的二倍体和四倍体大麻雌株进行连续十周的观测。1~6周时植株在16h光照下生长,每周测量株高、茎粗、叶长、叶宽、叶柄长、叶厚、叶面积和分枝数。7~10周植株转入8h光照下,每周测量株高。根据中华人民共和国农业行业标准(NY/T3252.1—2018),在花叶成熟期(授粉雌株的始果期,即10%雌株顶端叶腋间出现簇生绿色小果时;未授粉雌株的盛花末期,即50%雌株顶端叶腋间雌蕊柱头萎蔫、呈褐色时),测量花序长度、称量大麻整株鲜重和花序鲜重,再在烘干后称量整株干重和花序干重。
分别记录两种倍性大麻雌株始花期(整个植株出现第一对柱头[26])、顶端开花期(顶端出现一个单花)、花序开花期(顶端出现三对柱[27])和花叶成熟期的时间。
测定和记录进行3次重复,结果用SPSS25和Excel分析处理,采用独立性样本T检验评估两个样本间差异的显著性。
注:图中标示为工业大麻株高、茎直径、叶长、叶宽、叶柄长测量标准[25]。
图1大麻表型测量标准
2.3扫描电镜观察雌花结构
在花头顶端切取约5mm的雌花组织,在70%乙醇中固定10min以上,然后经90%、100%分级乙醇系列脱水,再置于临界点干燥器(QuorumK850)中使用液态CO2进行干燥。从干燥后的组织上摘取一个柱头用导电双面胶粘在导电短柱上,用扫描电镜(日立SU-3500)调节电压为5kV进行观察。
2.4印迹法气孔观测
各选二倍体和四倍体新鲜大麻叶片3片,用蒸馏水冲洗叶片表面,并用吸水纸擦干。在表面均匀涂上一层透明指甲油(主要成分为珍珠粉、挥发性溶剂、硝化纤维素等一些油性溶剂),待晾干后用尖头镊子将指甲油薄膜小心撕取,在载玻片上展平,滴加一滴蒸馏水赶走气泡,制成临时装片镜检。每片叶片观察并统计15个视野内气孔的平均长度、宽度和密度。
3结果与讨论
3.1倍性检测
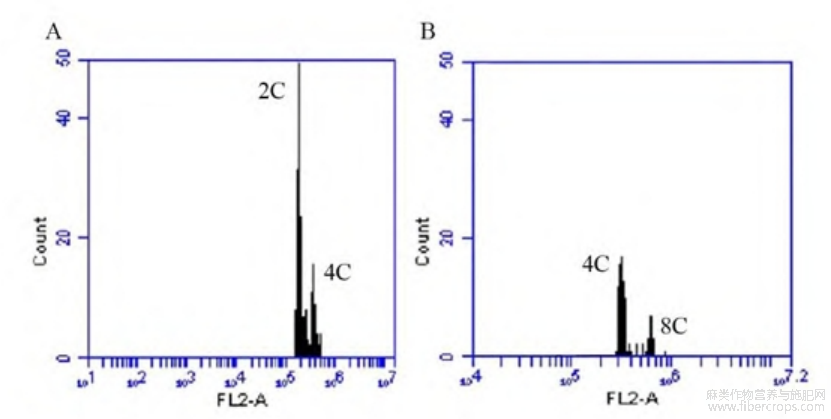
流式细胞仪检测工业大麻细胞内DNA含量,结果见图2。图2(A)为二倍体,其主峰荧光值约为1.7×105,次峰荧光值为3.4×105,即材料2C值为1.7×105。图2(B)显示检测植株的主峰荧光值约为3.4×105,次峰荧光值为6.8×105,表明其为四倍体。
图2不同倍性工业大麻流式细胞检测结果
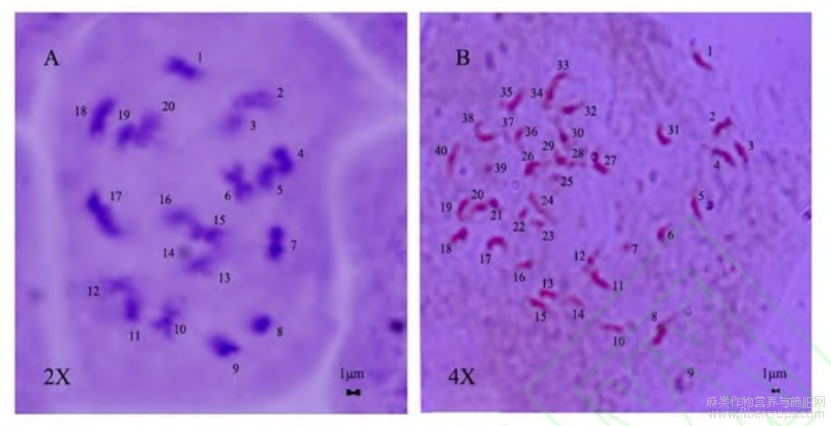
由图3(A)可知,压片法鉴定二倍体大麻根尖染色体数目2n=20,由图3(B)可知,检测大麻根尖染色体数目2n=40,是二倍体染色体数目的两倍。压片法鉴定被测植株的倍性与流式细胞法鉴定结果一致。
图3不同倍性大麻根尖染色体数目计数
3.2形态差异分析
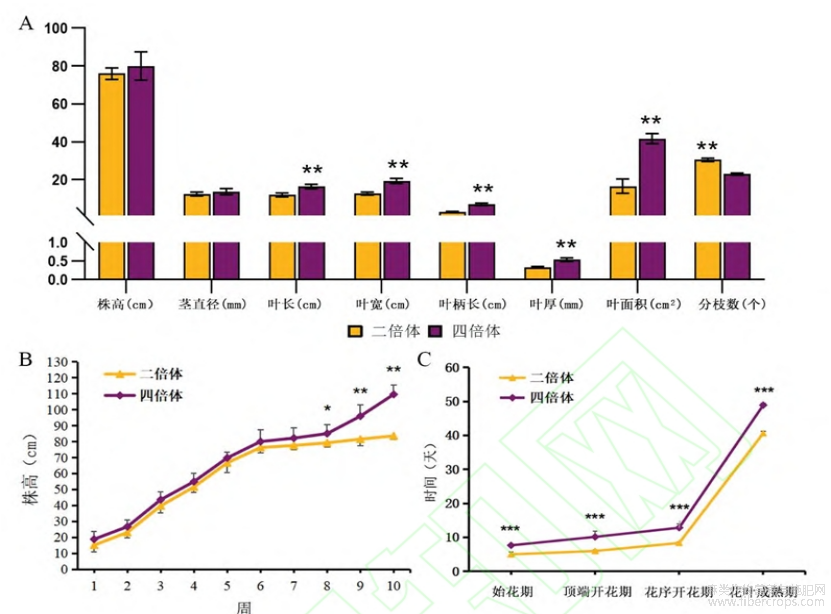
由图4(A)可知,在长日照环境下生长6周的四倍体植株的平均株高为80.06cm、茎直径为15.30mm、叶长18.62cm、叶宽19.79cm、叶柄长7.08cm、叶厚0.41mm、叶面积为41.74cm2、分枝数为23.00个。二倍体植株的平均株高为76.33cm、茎直径为12.74cm、叶长11.60cm、叶宽12.46cm、叶柄长3.03cm、叶厚0.30mm、叶面积为16.69cm2、分枝数为29.67个。相比于二倍体,四倍体大麻的叶长、叶宽、叶柄长、叶厚、叶面积、分枝数均具有极显著差异,增幅分别为60.52%、58.83%、133.66%、36.67%、150.09%、-22.48%。株高和茎粗无明显差异,分别相差3.73cm、2.56cm。二倍体大麻虽然叶面积小,但分枝却更多,平均每株较四倍体多6.67个,大部分集中在主茎基部。
两种倍性大麻的株高情况见图4(B),在长日照条件下其生长趋势一致,先是生长缓慢,两周后开始迅速生长。在第6周时,二倍体和四倍体植株平均株高分别达到76.33、80.06cm;第七周,将植株转移到短日照环境诱导其开花,二倍体植株株高的生长基本停滞,但四倍体植株在经过前两周缓慢生长后,开始了较快的生长;第8周两者平均株高相差了5.78cm,形成了显著差异;9~10周株高差异变为极显著,平均株高分别相差14.43、26.01cm;第10周,二倍体和四倍体大麻平均株高分别为83.63、109.64cm。
另外,四倍体大麻雌株开花过程的几个时期较二倍体均出现延迟,见图4(C)。二倍体大麻经短日照后5d开始开花,6d顶端开花,8.38d花序开花,40.63d达到花叶成熟期。四倍体大麻在这四个时期都极显著的晚于二倍体,每个时期分别延迟2.67、4.15、4.48、8.29d。
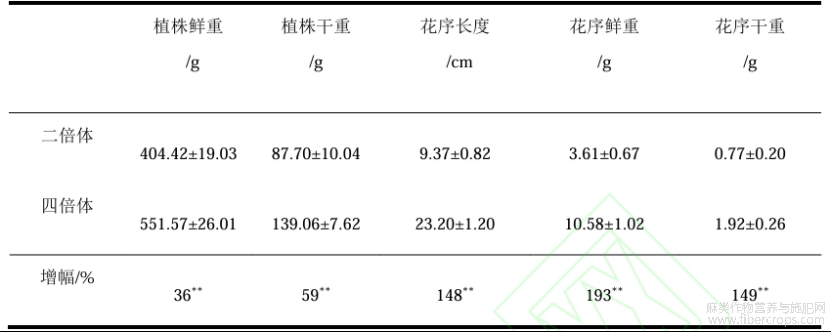
花序长度、鲜重和干重、整株植株的鲜重和干重的结果见表1。二倍体大麻花序平均长度为9.37cm,花序平均鲜重和干重为3.61、0.77g,整株植株平均鲜重和干重为404.42、87.70g。四倍体大麻与二倍体大麻在这些方面均存在极显著差异,花序平均长度增加了13.83cm,花序的鲜重和干重分别提高1.93倍和1.49倍,植株整体的鲜重和干重也分别增加了36.39%和58.56%。除此之外,四倍体大麻的叶片和花序颜色也更深,见图5。
注:( A)为大麻表型差异分析;(B)为大麻从幼苗移栽至花序成熟的株高;(C)为大麻不同时期开花时 间。“*”和“**”代表二倍体与四倍体差异显著(p<0.05)和极显著(p<0.01)
图4工业大麻与其同源四倍体表型及开花时间分析
注:(A)为大麻营养生长时期植株(B)为大麻成熟花序;(C)为大麻叶片。
图5工业大麻与其同源四倍体植株和成熟花序
表1工业大麻花序成熟时期表型分析
3.3扫描电镜观察雌花结构
大麻的雌花是由很多单花形成的花序,每个单花由苞片、边缘苞片、柱头组成,并且随着花逐渐发育成熟在苞片和边缘苞片上出现一些腺毛,见图6(A)(B)。每个单花有两个柱头,并且通常两个柱头长度不一致。
注:b—苞片;r—边缘苞片;t—腺毛;s—柱头。
图6 工业大麻雌花
3.4印迹法气孔观察
二倍体大麻气孔保卫细胞平均长度为21.31μm,平均宽度为13.68μm,密度为10.60个/mm2。经染色体加倍后,大麻气孔整体较二倍体增大,并且达到极显著水平。四倍体大麻保卫细胞的平均长度和宽度较二倍体增加8.93μm和4.05μm,见图7。但密度极显著变小,减少了56.21%,仅有4.63个/mm2,见表2。
图7二倍体与同源四倍体工业大麻气孔
表2工业大麻叶片气孔大小和密度
注:“**”代表二倍体与四倍体差异极显著(p<0.01)
4 讨论
大麻在医疗、纺织、食品等领域具有广泛的应用,而优良的大麻品种对大麻产业发展非常关键。与传统杂交育种相比,倍性育种更加快速高效。目前,在作物育种中,多倍体育种技术已被广泛运用。多倍体植株的鉴定可以从形态、染色体数目等方面进行。根据多倍体植物具有器官增大性的特点,可以先挑选出一些叶片增大增厚、植株健壮的进行流式细胞和直接压片法鉴定,以提高鉴定效率。在四倍体大麻扦插扩繁时发现,其较二倍体植株生根的速度较慢,这一现象在其他四倍体植物的扦插过程中也有发现[28]。生根缓慢的原因尚不清楚,需要进一步研究。本研究发现二倍体大麻进入短日照开花诱导后株高变化小,这一结果与Sankari等[29-30]提出的大麻开花时茎通常停止生长这一观点一致。但四倍体大麻在进入短日照后植株继续长高,原因有待研究。
本研究还发现大麻经染色体加倍后花、叶等器官增大,这将使叶、花等单株产量增加。其他麻类作物多倍化后形态也发生了相似的变化,比如,苎麻中多倍化导致植株矮化,茎秆变粗壮、皮变厚,纤维产量大大增加[31];罗布红麻多倍体叶长和叶宽都有一定幅度的增大[32]。染色体加倍影响作物表型变化的分子机制十分复杂,如DNA甲基化、基因沉默等[33]。多倍体植物为了增强对环境压力的适应能力,开花调控基因高度重复,增加了调控机制的复杂性[34]。已发现多种植物多倍化后会导致开花延迟,不同物种发生这种开花期变异的分子机制未必相同[35]。如异源四倍体棉花(Gossypium hirsutum)是由于对光周期敏感的COL2基因的甲基化水平发生改变[36]。异源四倍体拟南芥(Arabidopsis thaliana)中对花期调控通路上游的FLC基因启动子中的H3K9位点去乙酰化和抑制H3K4位点二甲基水平受到影响[37]。异源甘蓝型油菜多倍体(Brassica napus)的四个基因座中有三个发生染色体重排[38]。木槿(Hibiscus)多倍体中具有调节生物钟功能的基因FAR1拷贝数提升[39]。多倍体芥菜(Brassica juncea)的开花由光周期途径和春花途径共同调控,光周期途径下由B亚基因组控制开花,春化途径下由A亚基因组控制开花[40]。目前,多倍体大麻表型差异及开花延迟的分子机制研究未见报道,还有待开展。另外,次生代谢物是大麻育种研究最需要关注的目标之一。有研究表明[41],大麻体内最重要的两种大麻素四氢大麻酚和大麻二酚的含量在染色体加倍后并没有明显的变化,但多倍体化会对一些具有药理作用的代谢物的合成造成影响。随着研究的深入,多倍体大麻更多优异特性有望被发掘和利用。
参考文献
[1] Madlung A, Wendel J F. Genetic and epigenetic aspects of polyploid evolution in plants[J].Cytogenetic And Genome Research,2013, 140(2-4): 270-285.
[2] Canman J C, Hoffman D B, Salmon E D. The role of pre- and post-anaphase microtubules in the cytokinesis phase of the cell cycle[J]. Current Biology, 2000, 10(10): 611-614.
[3] Yao H, Kato A, Mooney B, et al. Phenotypic and gene expression analyses of a ploidy series of maize inbred Oh43[J].Plant Molecular Biology, 2011, 75(3): 237-251.
[4] Cohen H, Tel-Zur N. Morphological changes and self-incompatibility breakdown associated with autopolyploidization in Hylocereus species (Cactaceae)[J]. Euphytica, 2012, 184(3): 345-354.
[5] Chao D Y, Dilkes B, Luo H, et al. Polyploids exhibit higher potassium uptake and salinity tolerance in Arabidopsis[J]. Science, 2013,341(6146): 658-659.
[6] del Pozo J C, Ramirez-Parra E. Deciphering the molecular bases for drought tolerance in Arabidopsis autotetraploids[J]. Plant Cell and Environment, 2014, 37(12): 2722-2737.
[7] Marfil C F, Duarte P F, Masuelli R W. Phenotypic and epigenetic variation induced in newly synthesized allopolyploids and autopolyploids of potato[J]. Scientia Horticulturae, 2018, 234: 101-109.
[8] FU L, ZHU Y, LI M, et al. Autopolyploid induction via somatic embryogenesis in Lilium distichum Nakai and Lilium cernuum Komar[J]. Plant Cell Tissue and Organ Culture, 2019, 139: 237-248.
[9] 李朋飞.西瓜多倍体诱导及其分子生物学基础[D].保定:河北农业大学,2013.
[10] YONG Z, WU Y Y, HU X R, et al. Analysis of agronomic characters of new wheat variety Chuanmai 42 derived f
[11] 吴志刚.番茄(Lycopersicon esculentum Mill.)同源四倍体离体诱导研究[D]. 重庆: 西南大学, 2007.
[12] 杜艳伟,阎晓光,赵晋锋.药用植物多倍体育种的研究进展[J].生物技术进展,2011,1(4):249-253.
[13] 陈金焕.多倍体育种是林木产业化的“芯动力”[J].绿色中国,2022(16):58-61.
[14] 温晓敏,张娜,月丫,等.葡萄多倍体育种成果及影响因素概述[J].中外葡萄与葡萄酒,2017(4):95-99.
[15] 蒋淑磊,李志斌,徐立军,等.观赏植物多倍体育种研究进展[J].河北林业科技,2015(6):82-85.
[16] Andre C M, Hausman J F, Guerriero G. Cannabis sativa: The plant of the thousand and one molecules[J]. Frontiers in Plant Science, 2016, 7: 19.
[17] Corroon J, Phillips J A. A cross-sectional study of cannabidiol users[J]. Cannabis and Cannabinoid Research, 2018, 3(1): 152-161.
[18] Kicman A, Toczek M. The effects of cannabidiol, a non-intoxicating compound of cannabis, on the cardiovascular system in health and disease[J]. International Journal of Molecular Sciences, 2020, 21(18): 6740.
[19] Weiblen G D, Wenger J P, Craft K J, et al. Gene duplication and divergence affecting drug content in Cannabis sativa[J]. New Phytologist, 2015, 208(4): 1241-1250.
[20] Hennink S. Optimisation of breeding for agronomic traits in fibre hemp (Cannabis sativa L.) by study of parent offspring relationships[J]. Euphytica, 1994, 78: 69-76 .
[21] Ranalli P, Venturi G. Hemp as a raw material for industrial applications[J]. Euphytica, 2004, 140: 1-6.
[22] Parsons J L, Martin S L, James T, et al. Polyploidization for the genetic improvement of Cannabis sativa[J]. Frontiers in Plant Science, 2019, 10: 476. T r i t i c u
[23] TANG Q, XU Y, GAO F, et al. Transcriptomic and metabolomic analyses reveal the differential accumulation of phenylpropanoids and terpenoids in hemp autotetraploid and its diploid progenitor[J]. BMC Plant Biology, 2023, 23: 616. m
[24] Mahsa Bagheri M H. Effect of induced polyploidy on some biochemical parameters in Cannabis sativa L[J]. Applied Biochemistry and Biotechnology, 2015, 175(5): 2366-2375.
[25] 粟建光,戴志刚.大麻种质资源描述规范和数据标准[M].北京:北京农业出版社,2006:14-23.
[26] Stefano A, Michele C, Alessandro Z, et,al. Flowering dynamics in monoecious and dioecious hemp genotypes[J]. Journal of Industrial Hemp, 2008, 13(1): 5-19.
[27] Spitzer-Rimon B, Duchin S, Bernstein N, et al. Architecture and florogenesis in female Cannabis sativa plants[J]. Frontiers in Plant Science, 2019, 10: 350.
[28] 马振华,王吉斌,周贵平,等.四倍体刺槐嫩枝扦插生根过程中内源激素的变化[J].西北林学院学报,2013,28(5):18-23.
[29] Sankari H S, Mela T J N. Plant development and stem yield of non-domestic fibre hemp (Cannabis sativa L.) cultivars in long-day growth conditions in Finland[J]. Journal of Agronomy and Crop Science, 1998, 181: 153 159.
[30] de Meijer E P M, Keizer L C P. Variation of Cannabis for phenological development and stem elongation in relation to stem production[J]. Field Crops Research, 1994, 38: 37-46.
[31] 晏春庚,李宗道.苎麻多倍体育种研究进展[J].湖南农业科学,1997(4):30-31.
[32] 王悦,黄晓钰,陈平,等.罗布红麻多倍体诱导条件优化及生物学特征变化分析[J].分子植物育种,1-14[2024-09-14].
[33] 程治军,秦瑞珍,张欣,等.多倍体化引起植物表型突变的分子机理研究[J].作物学报,2005(7):940943.
[34] Hong S, Lim Y P, Kwon S Y, et al. Genome-wide comparative analysis of flowering-time genes; insights on the gene family expansion and evolutionary perspective[J]. Frontiers in Plant Science, 2021, 12: 702243.
[35]裴芸,虞夏清,赵晓坤,等.多倍化与植物新表型关联性的研究进展[J].园艺学报,2023,50(9):18541866.
[36] SONG Q, ZHANG T, Stelly D M, et al. Epigenomic and functional analyses reveal roles of epialleles in the loss of photoperiod sensitivity during domestication of allotetraploid cottons[J]. Genome Biology, 2017, 18(1): 99.
[37] SONG Q, CHEN Z J. Epigenetic and developmental regulation in plant polyploids[J]. Current Opinion in Plant Biology, 2015, 24: 101-109.
[38] Pires J C, Zhao J, Schranz M E, et al. Flowering time divergence and genomic rearrangements in resynthesized Brassica polyploids (Brassicaceae)[J]. Biological Journal of the Linnean Society, 2004, 82(4): 675-688.
[39] Kim Y M, Kim S, Koo N, et al. Genome analysis of Hibiscus syriacus provides insights of polyploidization and indeterminate flowering in woody plants[J]. DNA Research, 2017, 24(1): 71-80.
[40] ZHAO N, LIU C, MENG Y, et al. Identification of flowering regulatory genes in allopolyploid Brassica juncea[J]. Horticultural Plant Journal, 2019, 5(3): 109-119.
[41] TANG Q, XU Y, GAO F, et al. Transcriptomic and metabolomic analyses reveal the differential accumulation of phenylpropanoids and terpenoids in hemp autotetraploid and its diploid progenitor[J]. BMC Plant Biology, 2023, 23: 616.
文章摘自: 徐莹,许英,程超华,戴志刚,张小雨,杨泽茂,陈基权,邓灿辉,粟建光, 唐蜻,四倍体工业大麻形态特征分析,[J] 中国麻业科学. https://link.cnki.net/urlid/43.1467.s.20240918.1129.010。