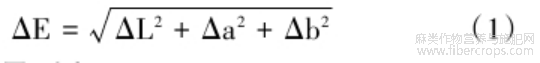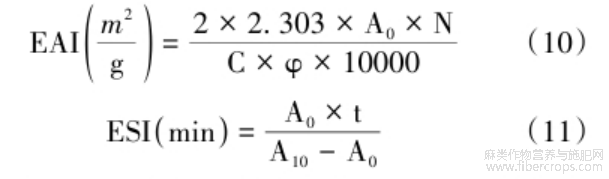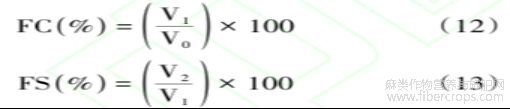摘 要: 为挖掘特色油料种子蛋白在食品领域的高值化利用潜力,以苏籽(紫苏籽、白苏籽两个类型)、芝麻、亚麻籽为原料,采用碱溶酸沉法提取三种特色油料蛋白,分析其蛋白组成、营养价值及功能特性。结果表明,三种特色油料蛋白的亚基组成与分布存在差异。从含量上看,紫苏籽蛋白的蛋白质含量最高(~84%);从氨基酸含量上看,三种特色油料蛋白中谷氨酸含量均为最高,且富含苯丙氨酸和亮氨酸,其中亚麻籽蛋白的必需氨基酸指数和生物价最高;从蛋白特点看,三种特色油料蛋白的等电点均在pH4~5之间;在pH值为7时,紫苏籽蛋白和芝麻蛋白的溶解度最高(~50%),白苏籽蛋白的乳化性最高(~13m2/g),芝麻蛋白的乳化稳定性最高(~68min),亚麻籽蛋白的泡沫稳定性最高(~82%)。综上,三种特色油料蛋白的组成及理化特性都存在差异,且都具有较高的营养价值。
关键词:苏籽蛋白;芝麻蛋白;亚麻籽蛋白;组成;营养价值;功能特性
近年来,全球人口急剧增长,预计2050年将达97亿,将会导致蛋白质供给不足,缺口巨大[1]。植物蛋白来源广泛、营养丰富、价格较低、对环境友好,深入挖掘植物蛋白资源将助力我国蛋白供给平衡。据报道,油料种子占全球粮食产量的20%[2],资源丰富。除含有大量的油脂外,绝大部分油料种子中还含有丰富的蛋白质,高效利用油料种子中的蛋白质资源是保障我国蛋白质供给平衡的有效途径之一。
苏籽、芝麻、亚麻籽是我国重要的特色油料作物,其中芝麻和亚麻籽被列为我国现代农业产业技术体系的重要农作物,芝麻和亚麻籽的全球年产量分别为589.9和290万吨[3,4]。苏籽、芝麻、亚麻籽分别含有39%~58%、37%~63%、30%~41%的油脂和20%~30%、18%~25%、20%~30%的蛋白质,其制油后的副产物饼粕中含有更为丰富的蛋白质(苏籽,35%~45%;芝麻,45%~50%;亚麻籽,35%~40%)[5~8],且三种特色油料蛋白的氨基酸组成较为合理,含有人体所需的8种必需氨基酸,消化率均高于80%[9,10],与大豆蛋白接近[11],可作为优质蛋白的重要来源。
目前有关三种特色油料蛋白加工方面的研究较少,现有报道主要集中在蛋白制取、修饰改性等方面,Görgüç[12]等人采用酶法、超声辅碱法和超声辅酶法提取芝麻蛋白,与碱法相比,蛋白质的提取率、总酚化合物和抗氧化能力都得到了提高。Yang[5]等人发现经超声辅助pH处理后的紫苏分离蛋白的溶解性、乳化性和起泡性均得到了提升。在食品领域应用方面,现有报道发现此三种特色油料蛋白主要被用于食品配料、食品包装和递送体系,如Qiu[13]等人以紫苏分离蛋白-海藻酸钠复合凝聚物为壳,制备玫瑰精油微胶囊,将其掺入碎牛肉后,有效延长了牛肉在4℃条件下的保质期。Sharma[14]等人将芝麻蛋白与三种不同浓度的苹果酸、柠檬酸和琥珀酸交联,制备出了均匀且光滑无孔的薄膜。Kaushik[15]等人发现,与大豆蛋白、乳清蛋白、明胶相比,亚麻籽蛋白稳定的乳液在较低的pH值下稳定性更高,有助于在肠道中控制/靶向输送油溶性营养物质。但目前三种特色油料蛋白的应用潜力远未被挖掘,这与其功能特性优势等因素未明晰有关。
因此,本文以苏籽(紫苏籽、白苏籽两个类型)、芝麻、亚麻籽为研究对象,采用植物蛋白最常用的碱溶酸沉法制备三种特色油料蛋白,首先测定了蛋白的组成,然后评价了营养价值,最后挖掘了其功能特性优势,以期为提升三种特色油料蛋白在食品领域的高值化利用潜力提供基础数据支撑。
1材料与方法
1.1材料与试剂
紫苏籽,珍爱生物科技有限公司提供;白苏籽,北京同仁堂购得;芝麻,中芝28号,中国农业科学院油料作物研究所提供;亚麻籽,宁夏固原21号,宁夏六盘珍坊生态农业科技有限公司提供。亚麻籽油,锡林郭勒盟红井源有限责任公司购得;其它试剂均为分析纯。
1.2仪器与设备
T25高速剪切均质机,德国IKA公司;AvantiJ26XP型离心机,美国Beckman公司;Alpha2-4LSCBasic真空冷冻干燥,德国Christ;K9860凯氏定氮仪,海能未来技术集团股份有限公司;Bio-RadMini-Protean-3电泳仪,美国伯乐(Bio-Rad);Bio?chrom30+氨基酸分析仪,英国百康;ZetaSizerNano纳米粒径及电位分析仪,英国马尔文仪器公司;VIC?TORNivoTM酶标仪,美国珀金埃尔默(PerkinElmer)公司。
1.3蛋白质的提取
将亚麻籽置于55℃水中洗涤脱胶,换水重复操作至无胶感,在55℃下烘干得到脱胶亚麻籽。将紫苏籽、白苏籽、芝麻、脱胶亚麻籽冷榨后收集饼粕,经粉碎研磨后过60目筛后得到紫苏籽、白苏籽、芝麻、亚麻籽粕粉。
参考Yang[5]的方法并做适当修改,用于制备三种特色油料蛋白:称取一定量的粕粉,以1:15(m/V)的比例溶于超纯水中,用2mol/LNaOH调节pH(苏籽、芝麻、亚麻籽的pH值依次为10?9?9),搅拌2h后离心(8500r/min,30min)收集上清液,用2mol/LHCl调节pH(苏籽、芝麻、亚麻籽的pH值依次为4.5?5?4.2)后离心(8500r/min,30min),收集沉淀,用超纯水复溶,并调pH至7,最后经冷冻干燥得到紫苏籽、白苏籽、芝麻、亚麻籽蛋白。
1.4基本成分的测定
蛋白质含量:参照GB5009.5-2016,凯氏定氮法测定(苏籽、亚麻籽蛋白的蛋白质系数为6.25,芝麻蛋白的蛋白质系数为5.3);水分含量:参照GB5009.3-2016,直接干燥法;灰分含量:GB5009.42016,第一法;粗脂肪含量:GB5009.6-2016,第一法;总碳水化合物含量:样品的总质量减去其它成分的总质量。
1.5颜色分析
参考Shen[16]的方法。蛋白的颜色测量使用CR410色度计进行测定。在样品测量之前,使用标准白板进行校准。颜色参数以L*(亮度)、a*(红/绿)和b*(黄/蓝)值表示。样品之间的总色差(ΔE)使用以下公式计算:
1.6总酚含量测定
参考Hadna?ev[17]的方法并做适当修改。准确称取0.25g蛋白粉于10mL离心管中,加入2.5mL70%甲醇,于涡旋仪上混合20min,离心(4000r/min,20min),重复操作3次收集上清液。吸取0.5mL提取液(0.5mL70%甲醇作空白)于10mL比色管中,加入5mL超纯水和0.5mL福林酚,摇匀,反应3min后加入1mL饱和碳酸钠溶液,用超纯水定容至10mL,摇匀,避光放置1h,使用酶标仪于765nm处测定其吸光值。结果以mg没食子酸/g蛋白表示。
1.7 SDS-PAGE
参考Yang[18]的方法并做适当修改。用超纯水配制的蛋白溶液(2mg/mL)与上样缓冲液(10%甘油、3%十二烷基硫酸钠(SDS)、0.05%溴酚蓝和5%β-巯基乙醇)以4∶1的比例混合(非还原SDS-PAGE不使用β-巯基乙醇),在沸水中煮5min。配置12.5%的胶,用15μL样品填充凝胶孔,用10-250kD分子量的蛋白Marker做标记,条件设置为150V运行60min,再将凝胶用考马斯亮蓝染色30min,然后用甲醇、乙酸和水混合脱色液脱色,最后成像分析。
1.8氨基酸组成测定
参考GB5009.124-2016《食品安全国家标准食品中氨基酸的测定》测定蛋白质的氨基酸组成及含量。
1.9营养价值评价
基于四种与人体蛋白结构比例相近的必需氨基酸模式[19],按照徐蓓蓓[20]和Wang[21]对蛋白质的评价方法,计算氨基酸比值(ratio of amino acid,RAA)、 氨基酸比值系数(ratio coefficient of amino acid,RC)、 氨基酸比值系数分(score of ratio coefficient of amino acid,SRC)、氨基酸评分(amino acid score,AAS)、化 学评分(chemical score,CS)、必需氨基酸指数(es-sential amino acid index,EAAI)和生物价(biological value,BV),计算公式如下:
式中:CV是RC的变异系数,CV=标准差/均数;n为比较的必需氨基酸数;a为样品中氨基酸的含量,b为模式中相应氨基酸的含量;样品中某一种必需氨基酸含量,mg/g蛋白;模式中相应氨基酸含量,mg/g蛋白;鸡蛋蛋白中相应必需氨基酸含量,mg/g蛋白。
1.10等电点的测定
参考Li[22]的方法。用超纯水配制0.1%(m/V)蛋白的溶液,室温下搅拌溶解2 h,调节pH至3.5?4.0?4.2?4.4?4.6?4.8?5.0,用Zeta电位仪测定其电位。
1.11溶解性
参考Zdemir[23]的方法。用超纯水配制0.1%(m/V)的溶液,室温下搅拌溶解2h,调节pH至7,离心(4000r/min,10min),采用考马斯亮蓝法测定上清液中蛋白质的含量。
1.12乳化性
参考Karaca[24]的方法并做适当修改。用超纯水配制1%(m/V)的蛋白溶液,在室温下搅拌2h,调节pH至7,取18mL蛋白溶液与2mL亚麻籽油混合,用剪切均质机高速(13000r/min)均质2min,快速吸取50μL的乳液,加入5mL0.1%的SDS稀释,以0.1%SDS溶液为空白参比,于500nm处测定稀释乳状液的吸光度值A0,乳液静置10min后在上述相同条件下再次测定吸光值A10。
乳化活性指数(EAI)和乳化稳定性(ESI)的计算公式如下:
式中:A0为0min的吸光度值;A10为10min的吸光度值;N为乳状液的稀释倍数;C为乳状液形成前蛋白质的质量浓度,g/mL;φ为油相体积分数;t为两次测量的时间间隔,min。
1.13起泡性
参考Kai[25]的方法并做适当修改。用超纯水配制1%(m/V)的蛋白溶液,在室温下搅拌2h,调节pH至7,将15mL蛋白溶液置于50mL离心管中,用剪切均质机高速(13000r/min)均质2min,将蛋白质溶液连同泡沫立即倒入至量筒中,读出泡沫体积,静置0.5h后再次读出泡沫体积。
起泡性及起泡稳定性的计算公式如下:
式中:V0为蛋白溶液均质化之前的体积,mL;V1为均质化后初始泡沫的体积,mL;V2为静置0.5h后泡沫的体积,mL。
1.14统计与分析
所有实验均重复3次,实验数据以平均值±标准差形式表示。数据的差异显著性使用统计分析软件SPSS26进行单因素方差分析法进行比较,P<0.05表示结果存在显著性差异。实验结果使用Ori?gin2021进行绘制并作图。
2结果与分析
2.1三种特色油料蛋白成分及颜色分析
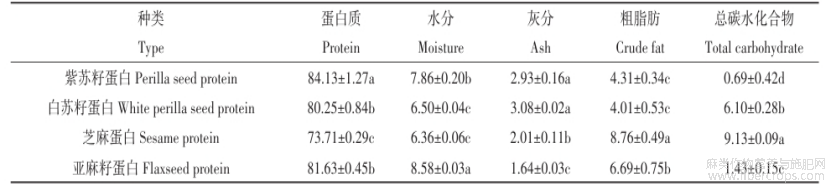
三种特色油料蛋白的基本成分如表1所示,紫苏籽、白苏籽、芝麻、亚麻籽蛋白的蛋白质含量依次为84%、80%、74%、82%,其中紫苏籽蛋白的含量最高,可能是碱提pH值较高,导致蛋白表面所带的负电荷变多,使得蛋白质分子间静电斥力和水合力增强,蛋白质溶解度增加,蛋白质溶出更多[26]。芝麻蛋白的蛋白含量相对较低,可能是由于在提取蛋白过程中更弱的蛋白质-蛋白质相互作用所致[17]。
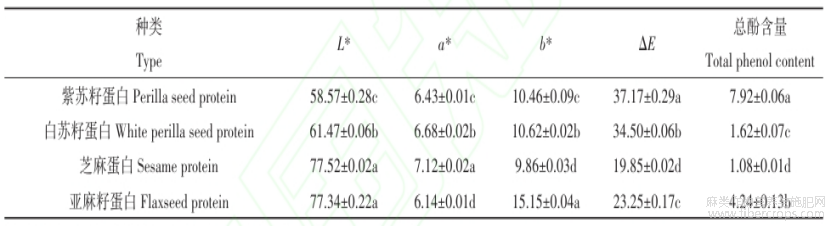
三种特色油料蛋白粉的外观状态如图1所示,苏籽蛋白呈棕色,其中紫苏籽蛋白颜色更深,而芝麻蛋白和亚麻籽蛋白外观色泽较浅,前者呈米白色,后者偏黄色。通过颜色测量分析(表2)可知,苏籽蛋白的亮度值(L*)远低于芝麻和亚麻籽蛋白,而芝麻蛋白的红度值(a*)相对较高,亚麻籽蛋白的黄度值(b*)更高。通过计算总色差值(ΔE),发现苏籽蛋白的值显著高于另外两种蛋白,且紫苏籽蛋白的ΔE最高(37.17),与蛋白粉的外观颜色相吻合。蛋白粉的颜色差异可能由原料种子的成分差异所引起,还可能是因为在碱提取过程中共提取出来的酚类物质通过相互作用与蛋白质结合,进而导致蛋白粉颜色的变化[27]。通过测定蛋白粉中总酚含量可知(表2),紫苏籽蛋白总酚含量高达7.92mg没食子酸/g蛋白,这可能是导致其颜色深于白苏籽蛋白的主要原因。
表1紫苏籽、白苏籽、芝麻、亚麻籽蛋白的基本成分
注:同列数据后不同小写字母表示差异显著(P< 0.05)
图1 紫苏籽(A)、白苏籽(B)、芝麻(C)?亚麻籽(D)蛋白粉外观状态图
表2紫苏籽、白苏籽、芝麻、亚麻籽蛋白的颜色分析及总酚含量(mg没食子酸/g蛋白)
注:同列数据后不同小写字母表示差异显著(P< 0.05)
2.2三种特色油料蛋白组成与营养价值评价
2.2.1亚基组成
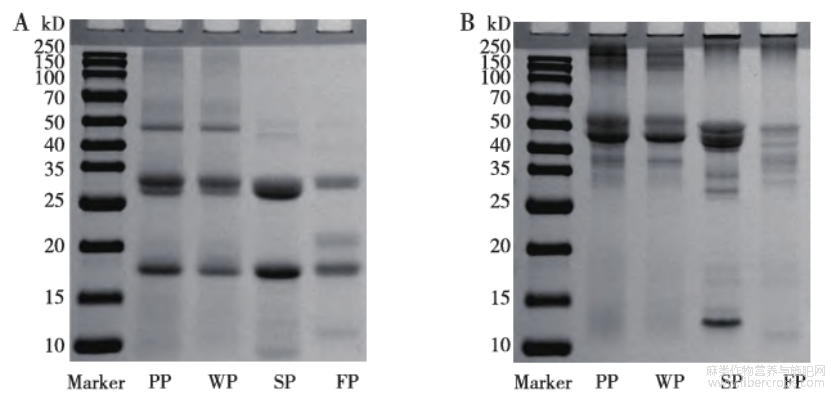
图2显示了三种特色油料蛋白在还原和非还原条件下的亚基条带组成和分布,三种蛋白的条带之间存在明显差异,而两个品种的苏籽蛋白(紫苏籽蛋白和白苏籽蛋白)的亚基组成无明显差异。在还原条件下,苏籽蛋白条带均主要集中在18?26~34和50kD,在非还原条件下,其条带集中在30~55kD,这与之前的报道相似[28]。在还原条件下,芝麻蛋白在9?13?18?25~34?45~50kD均有条带,其中以18kD和25~34kD为主,在非还原条件下,其条带集中在13~14?16~18?30~35?40~50kD,与之前的报道相似[29]。在还原条件下的9kD和非还原条件下的13kD对应芝麻蛋白的2S清蛋白,其中9kD是由2S清蛋白的二硫键裂解形成[30]。在还原条件下,亚麻籽蛋白的条带集中在12?18?20?30kD,在非还原条件下,其条带集中在12?16~18?30~50kD,与之前的报道相似[18,31]。
注:PP:紫苏籽蛋白;WP:白苏籽蛋白;SP:芝麻蛋白;FP:亚麻籽蛋白
图2还原(A)和非还原(B)条件下三种特色油料蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)结果
2.2.2氨基酸组成
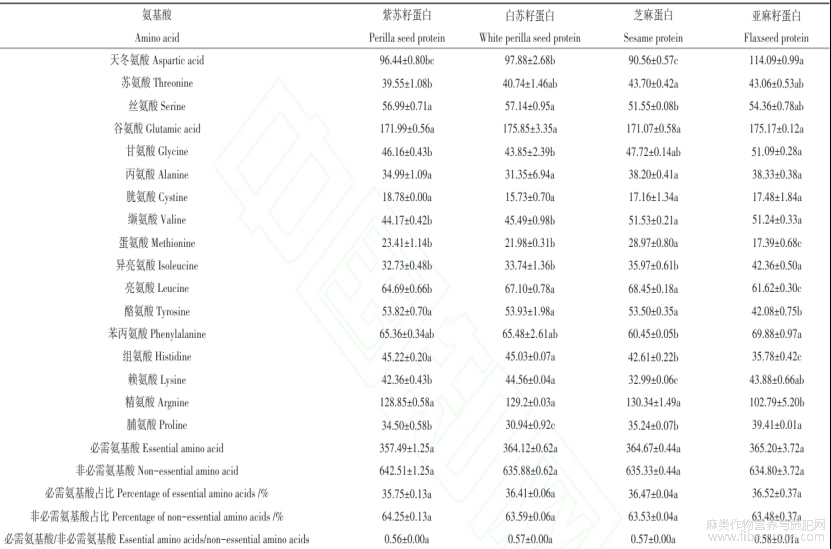
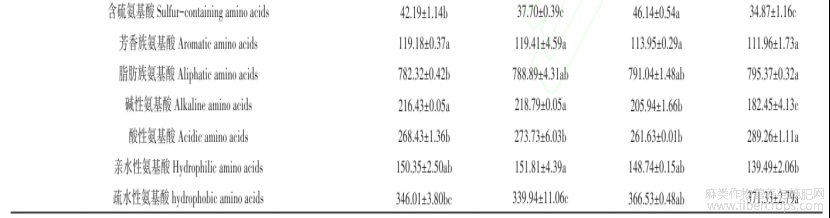
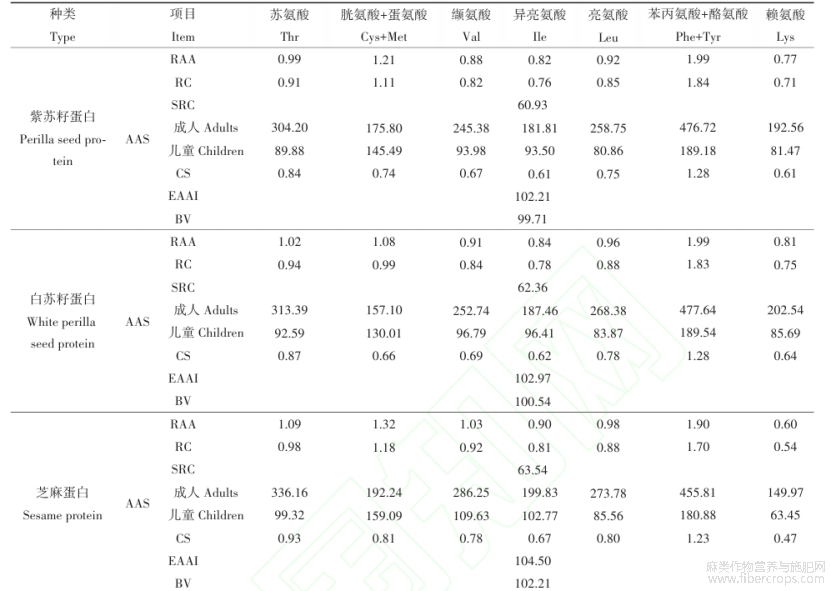
如表3所示,三种特色油料蛋白共检测出了17种氨基酸,其中色氨酸在酸水解过程被破坏。紫苏籽、白苏籽、芝麻、亚麻籽蛋白的必需氨基酸含量占总氨基酸含量的35.75%?36.41%?36.47%?36.52%。三种特色油料蛋白的氨基酸组成中均是谷氨酸含量最高,依次为171.99?175.85?171.07?175.17mg/g蛋白。据文献报道谷氨酸是大脑的主要神经递质,参与大脑的学习和记忆等认知功能,能增强大脑功能和智力活动,还有助于钾通过血脑屏障的运输[32]。紫苏籽、白苏籽、芝麻、亚麻籽蛋白的必需氨基酸中均含有丰富的苯丙氨酸和亮氨酸,据文献报道,苯丙氨酸可以调节人体中酪氨酸的浓度,合成神经递质和激素,参与机体糖代谢和脂肪代谢[33]。亮氨酸是合成蛋白质和激活mTOR途径以合成肌肉蛋白质的原材料和能量载体,在蛋白质代谢和能量平衡中起着至关重要的作用[34]。通过计算三种特色油料蛋白的含硫氨基酸、疏水性氨基酸等数值可知,芝麻蛋白的含硫氨基酸最高(46.14mg/g蛋白),苏籽蛋白的碱性氨基酸含量最高,亚麻籽蛋白的脂肪族氨基酸(795.37mg/g蛋白)、酸性氨基酸(289.26mg/g蛋白)和疏水性氨基酸(371.33mg/g蛋白)最高。由表3数据可以算出紫苏籽、白苏籽、芝麻、亚麻籽蛋白的赖氨酸/精氨酸比例依次为:0.33?0.34?0.25?0.43,低于大豆蛋白[35]和菜籽蛋白[36],而更低的赖氨酸/精氨酸比例对于老年吞咽困难人群的肌肉和免疫功能以及心血管健康均具有很好的促进作用[8]。由以上分析可以看出,苏籽、芝麻、亚麻籽蛋白具有较高的营养价值。
表3紫苏籽、白苏籽、芝麻、亚麻籽蛋白的氨基酸组成(mg/g蛋白)
注:同列数据中不同字母(a-c)表示差异显著(P< 0.05)
2.2.3营养价值评价
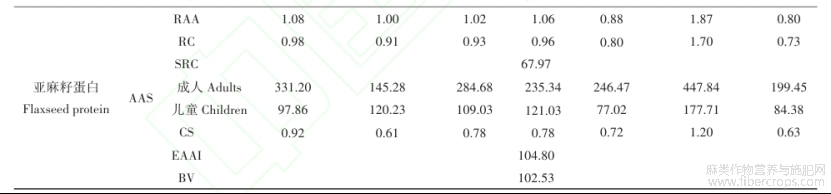
通过比较与模式氨基酸的接近程度,氨基酸比值(RAA)、氨基酸比值系数(RC)、氨基酸比值系数分(SRC)、氨基酸评分(AAS)、化学评分(CS)可以用来评估蛋白质的营养价值。RC值越接近1,表明其与模式氨基酸越一致,RC>1,表明该氨基酸过剩,RC<1,表明该氨基酸相对不足,且RC最小的氨基酸即为限制性氨基酸[37]。由表4可知,紫苏籽、白苏籽、芝麻、亚麻籽蛋白第一限制性氨基酸为赖氨酸,而紫苏籽、芝麻蛋白的胱氨酸和蛋氨酸、苯丙氨酸和酪氨酸含量和白苏籽、亚麻籽蛋白中的苯丙氨酸和酪氨酸含量相对过剩,因此可将三种特色油料蛋白与其它蛋白按一定比例互补,提高营养价值[38]。SRC是指各种必需氨基酸偏离氨基酸模式的离散度[20],当其值越接近100,则表示该蛋白质的氨基酸组成与模式氨基酸越接近,营养价值越高。亚麻籽蛋白的SRC为67.97,大于紫苏籽(60.93)、白苏籽(62.36)和芝麻蛋白(63.54),因此亚麻籽蛋白的营养价值较高。在成人和儿童模式下,白苏籽蛋白的苯丙氨酸和酪氨酸、赖氨酸,芝麻蛋白的苏氨酸、胱氨酸和蛋氨酸、缬氨酸、亮氨酸,亚麻籽蛋白的异亮氨酸的AAS较高。紫苏籽、白苏籽、芝麻、亚麻籽蛋白的苏氨酸的化学评分(CS)更接近于1。
必需氨基酸指数(EAAI)和生物价(BV)可用来进一步评估样品中所有必需氨基酸,从而评价蛋白质的营养价值。EAAI越高,表明氨基酸组成越均衡,营养价值高,是优质的蛋白质来源[39]。BV代表生物体为维持组织、发育和生长而吸收氨基酸的比例[40],必需氨基酸组成越接近模式氨基酸,BV越高。由表4可以发现,亚麻籽蛋白的EAAI(104.80)和BV(102.53)最高。
表4 紫苏籽、白苏籽、芝麻、亚麻籽蛋白的营养价值评价
2.3三种特色油料蛋白的等电点
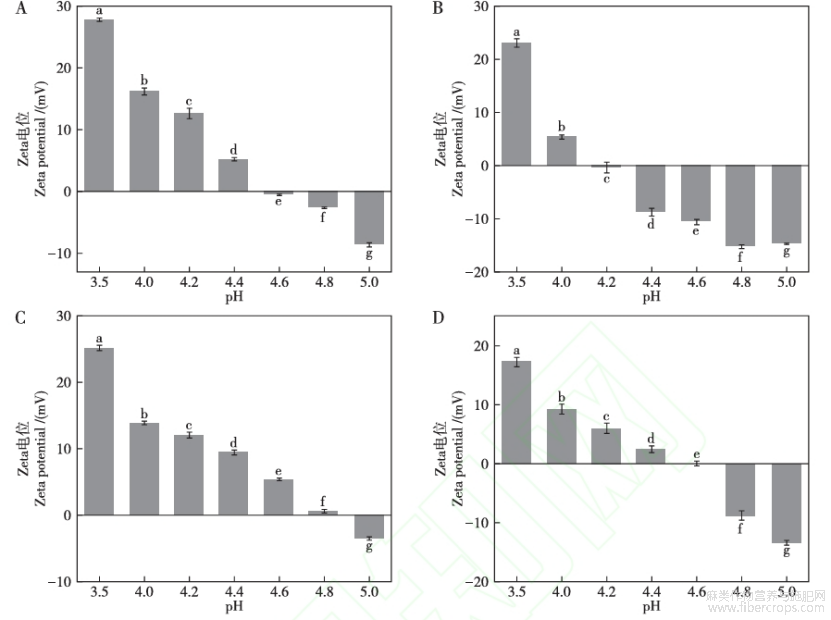
图3显示了三种特色油料蛋白在不同pH值(3.5~5.0)条件下的ζ-电位,其绝对值均呈现先下降后上升的趋势。当蛋白质溶液的净表面电荷趋于零时,即接近蛋白质的等电点pI,此时颗粒之间的静电斥力降低,由图3可知,紫苏籽、白苏籽、芝麻、亚麻籽蛋白的pI依次接近4.6?4.2?4.8?4.6,均在pH4~5的范围内。当pH小于pI时,蛋白质的ζ电位大于0,表面带正电荷,当pH大于pI时,蛋白质的ζ-电位小于0,表面带负电荷。
图3不同pH条件下(3.5~5.0)的紫苏籽(A)、白苏籽(B)、芝麻(C)、亚麻籽(D)
蛋白的ζ-电位
2.4三种特色油料蛋白的功能特性
2.4.1溶解性
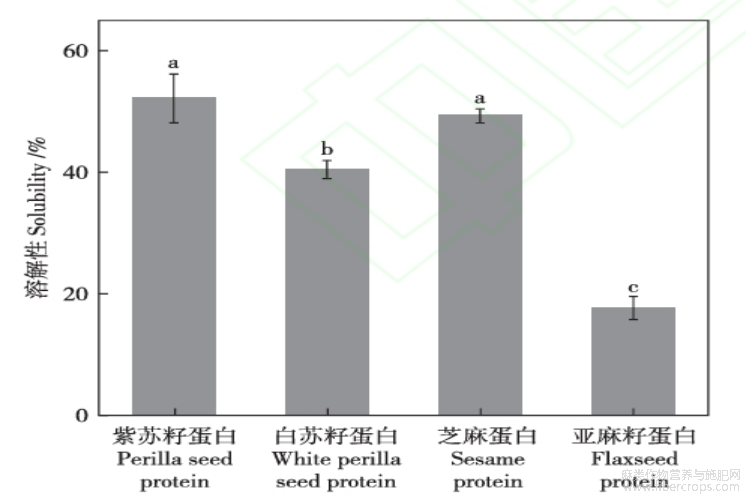
紫苏籽、白苏籽、芝麻、亚麻籽蛋白在pH为7条件下的溶解度如图4所示,紫苏籽蛋白和芝麻蛋白的溶解性(~50%)显著高于白苏籽蛋白(~40%)和亚麻籽蛋白(~18%),三种特色油料蛋白在pH7条件下的溶解性与文献报道相似[5,18,25]。亚麻籽蛋白溶解度低可能与其疏水性氨基酸含量高(371.33mg/g蛋白)、亲水性氨基酸含量低(139.49mg/g蛋白)以及亚基组成有关。
图4紫苏籽、白苏籽、芝麻、亚麻籽蛋白的溶解性
2.4.2乳化性
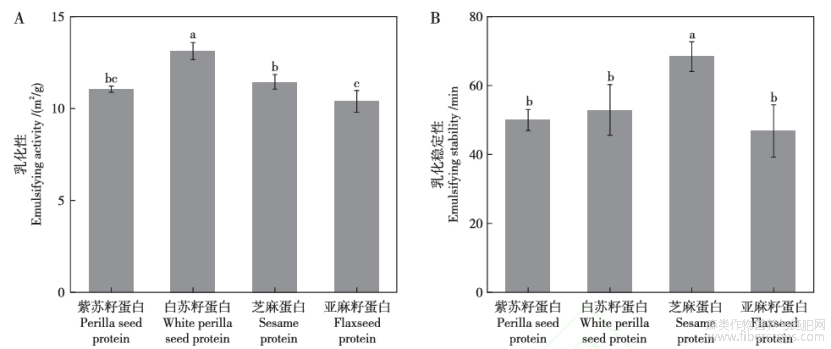
乳化性是指蛋白质在新形成的液滴表面的吸附能力,可降低油相和水相之间的界面张力并稳定乳液。乳化稳定性是指乳状液保持稳定不出现絮凝或者分层情况的能力[41]。如图5所示,在pH值为7时,紫苏籽、白苏籽、芝麻、亚麻籽蛋白的乳化性和乳化稳定性分别依次为11?13?11?10m2/g,50?53?68?47min,其中白苏籽蛋白的乳化性最高,芝麻蛋白的乳化稳定性最高。
图5紫苏籽、白苏籽、芝麻、亚麻籽蛋白的乳化性(A)、乳化稳定性(B)
2.4.3起泡性
泡沫特性是指蛋白质在界面上被吸附后在空气周围形成凝聚层并在空气-水界面展开、重新排列和保持稳定的能力[42]。起泡性是指搅打或搅拌后产生的泡沫的初始量,起泡稳定性表示在特定时间后保持的泡沫量[43]。当pH值为7时,亚麻籽蛋白的起泡性(~37%)和起泡稳定性(~82%)都相对较高,这可能与其疏水性氨基酸含量高和亚基组成有关。
3讨论
油料种子是我国食用植物油的重要原料来源,近年来我国食用油市场对于“小油种”的需求量逐渐增大,特色油料种子产量显著增加,其榨油的副产物饼粕富含蛋白质,可作为蛋白质资源开拓植物蛋白市场。本研究首先从三种油料种子的副产物饼粕中采用碱溶酸沉法提取蛋白质,测得其蛋白质含量在73%以上,蛋白质含量较高。其次与其它研究相比,本研究从组成成分、营养价值和功能特性三方面较系统全面分析比较了三种特色油料蛋白,而营养价值数据可以直观明晰蛋白质的营养水平优势,综合利用油料蛋白可以解决蛋白质资源紧缺等实际问题,同时本研究为三种油料种子加工副产物的高附加值加工利用和特色油料蛋白的研究提供一定的数据基础。
4结论
本研究对苏籽(紫苏籽、白苏籽)、芝麻、亚麻籽蛋白的组成、营养价值和功能特性进行了对比分析,发现在亚基组成方面,两个品种的苏籽蛋白(紫苏籽蛋白和白苏籽蛋白)的亚基组成无明显差异,三种特色油料蛋白在还原和非还原条件下的条带分布存在明显差异。在营养价值方面,三种特色油料蛋白的氨基酸组成中均含有丰富的谷氨酸,必需氨基酸种类齐全且比例相对适宜,且富含苯丙氨酸和亮氨酸,三种特色油料蛋白都有着较高的精氨酸含量和较低的赖氨酸/精氨酸比例,具有较高的营养价值,可作为优质蛋白质的良好来源。三种特色油料蛋白的等电点均在pH4~5范围内。在功能特性方面,在pH7的条件下,紫苏籽蛋白和芝麻蛋白的溶解度(~50%)、白苏籽蛋白的乳化性(~13m2/g)、芝麻蛋白的乳化稳定性(~68min)、亚麻蛋白的泡沫稳定性(~82%)最高,在食品加工工业中具有开发乳化剂和起泡剂的潜力。本文为三种特色油料蛋白在食品工业中作为优质蛋白的替代品提供了数据支撑。
参考文献
[1]吴萍,周际松,邓乾春,等.核桃蛋白的结构?营养价值?制备?功能特性及在食品中的应用[J].食品科学,2023:1-12.(2023-12-26).
[2] Cravotto C, Claux O, Bartier M, et al. Leading edge technologies and perspectives in industrial oilseed extrac? tion[J]. Molecules, 2023, 28(16): 5973.
[3] Wei P P, Zhao F L, Wang Z, et al. Sesame (Sesamum indicum L.): a comprehensive review of nutritional val? ue, phytochemical composition, health benefits, devel? opment of food, and industrial applications[J]. Nutri? ents, 2022, 14(19): 4079.
[4] Avazkhanloo M, Shahir M H, Khalaji S, et al. Flaxseed extrusion and expansion coupled with enzyme and pellet? ing changed protein and lipid molecular structure of flax? seed and improved digestive enzymes activity, intestinal morphology, breast muscle fatty acids and performance of broiler chickens[J]. Anim Feed Sci Technol, 2020, 260: 114341.
[5] Yang J, Duan Y Q, Geng F, et al. Ultrasonic-assisted pH shift-induced interfacial remodeling for enhancingthe emulsifying and foaming properties of perilla protein isolate[J]. Ultrason Sonochem, 2022, 89: 106108.
[6] Mujtaba M A, Cho H M, Masjuki H H, et al. Critical re? view on sesame seed oil and its methyl ester on cold flow and oxidation stability[J]. Energy Rep, 2020, 6: 40 54.
[7] Bekhit A E D A, Shavandi A, Jodjaja T, et al. Flax? seed: Composition, detoxification, utilization, and op? portunities[J]. Biocatal Agric Biotechnol, 2018, 13: 129-152.
[8] Marambe H K, Wanasundara J P D. Protein from flax? seed (Linum usitatissimum L.)[M]//Sustainable Protein Sources. Amsterdam: Elsevier, 2017: 133-144.
[9] Longvah T, Deosthale Y G. Effect of dehulling, cooking and roasting on the protein quality of Perilla frutescens seed[J]. Food Chem, 1998, 63(4): 519-523.
[10] Almeida Sá A G, da Silva D C, Pacheco M T B, et al. Oilseed by-products as plant-based protein sources: Amino acid profile and digestibility[J]. Future Foods, 2021, 3: 100023.
[11] Qin P X, Wang T R, Luo Y C. A review on plant-based proteins from soybean: Health benefits and soy product development[J]. J Agric Food Res, 2022, 7: 100265.
[12] Görgüç A, Bircan C, Y?lmaz F M. Sesame bran as an un? exploited by-product: Effect of enzyme and ultrasound assisted extraction on the recovery of protein and antioxi? dant compounds[J]. Food Chem, 2019, 283: 637-645.
[13] Qiu L Q, Zhang M, Adhikari B, et al. Microencapsula? tion of rose essential oil using perilla protein isolate-sodi? um alginate complex coacervates and application of mi? crocapsules to preserve ground beef[J]. Food Bioprocess Technol, 2023, 16(2): 368-381.
[14] Sharma L, Sharma H K, Saini C S. Edible films devel? oped from carboxylic acid cross-linked sesame protein isolate: barrier, mechanical, thermal, crystalline and morphological properties[J]. J Food Sci Technol, 2018, 55(2): 532-539.
[15] Kaushik P, Dowling K, McKnight S, et al. Preparation, characterization and functional properties of flax seed protein isolate[J]. Food Chem, 2016, 197(Pt A): 212 220.
[16] Shen P Y, Gao Z L, Xu M W, et al. The impact of hemp? seed dehulling on chemical composition, structure prop?erties and aromatic profile of hemp protein isolate[J]. Food Hydrocoll, 2020, 106: 105889.
[17] Hadna?ev M, Dap?evi?-Hadna?ev T, Lazaridou A, et al. Hempseed meal protein isolates prepared by different isolation techniques. Part I. physicochemical properties [J]. Food Hydrocoll, 2018, 79: 526-533.
[18] Yang J, Duan Y Q, Zhang H H, et al. Ultrasound cou? pled with weak alkali cycling-induced exchange of free sulfhydryl-disulfide bond for remodeling interfacial flexi? bility of flaxseed protein isolates[J]. Food Hydrocoll, 2023, 140: 108597.
[19] 邓文亚,徐婧婷,郭顺堂,等.火麻仁蛋白与大豆蛋白的营养评价及比较[J].食品工业科技,2021,42(23):273-279.
[20] 徐蓓蓓,姜晓明,薛勇,等.不同南极磷虾产品中蛋白的营养价值评价[J].食品工业科技,2019,40(23):1723,30.
[21] Wang Y, Sánchez-Velázquez O A, Martínez-Villaluen? ga C, et al. Effect of protein extraction and fractionation of chia seeds grown in different locations: Nutritional, antinutritional and protein quality assessment[J]. Food Biosci, 2023, 56: 103238.
[22] Li K Y, Ye J T, Yang J, et al. Co-extraction of flaxseed protein and polysaccharide with a high emulsifying and foaming property: enrichment through the sequence ex? traction approach[J]. Foods, 2023, 12(6): 1256.
[23] Özdemir E E, Görgüç A, Gençda? E, et al. Physico? chemical, functional and emulsifying properties of plant protein powder from industrial sesame processing waste as affected by spray and freeze drying[J]. LWT, 2022, 154: 112646.
[24] Karaca A C, Low N, Nickerson M. Emulsifying proper? ties of canola and flaxseed protein isolates produced by isoelectric precipitation and salt extraction[J]. Food Res Int, 2011, 44(9): 2991-2998.
[25] Yang K, Xu T R, Fu Y H, et al. Effects of ultrasonic pre treatment on physicochemical properties of proteins ex? tracted from cold-pressed sesame cake[J]. Food Res Int, 2021, 139: 109907.
[26]王丹,李河,张志军,等.紫苏籽粕蛋白糖基化产物结构及功能特性[J].浙江大学学报:农业与生命科学版,2023,49(4):557-565.
[27] Xu L, Diosady L L. Interactions between canola proteins and phenolic compounds in aqueous media[J]. Food Res Int, 2000, 33(9): 725-731.
[28] Zhao Q L, Xie T T, Hong X, et al. Modification of func? tional properties of perilla protein isolate by high-intensi? ty ultrasonic treatment and the stability of o/w emulsion [J]. Food Chem, 2022, 368: 130848.
[29] Saatchi A, Kiani H, Labbafi M. A new functional protein polysaccharide conjugate based on protein concentrate from sesame processing by-products: Functional and physico chemical properties[J]. Int J Biol Macromol, 2019, 122: 659-666.
[30] Achouri A, Nail V, Boye J I. Sesame protein isolate: Fractionation, secondary structure and functional proper? ties[J]. Food Res Int, 2012, 46(1): 360-369.
[31] Chung M W Y, Lei B, Li-Chan E C Y. Isolation and structural characterization of the major protein fraction from NorMan flaxseed (Linum usitatissimum L.)[J]. Food Chem, 2005, 90(1/2): 271-279.
[32] Dutta S, Ray S, Nagarajan K. Glutamic acid as antican? cer agent: an overview[J]. Saudi Pharm J, 2013, 21 (4): 337-343.
[33]徐杰,廖津,林泽安,等.石斑鱼肉肽粉的氨基酸组成分析与营养价值评价[J].食品与发酵工业,2021,47(23):221-226.
[34] Song M Q, Yu Q R, Li E C, et al. Leucine improves di? etary protein use efficiency by regulating protein synthe? sis by activating amino acid transporters and the mTORC1 pathways in Chinese mitten crab (Eriocheir si? nensis)[J]. Aquaculture, 2024, 581: 740423.
[35] Marambe H K, Shand P J, Wanasundara J P D. Release of angiotensin I-converting enzyme inhibitory peptides from flaxseed (Linum usitatissimum L.) protein undersimulated gastrointestinal digestion[J]. J Agric Food Chem, 2011, 59(17): 9596-9604.
[36] Tan S H, Mailer R J, Blanchard C L, et al. Canola pro? teins for human consumption: extraction, profile, and functional properties[J]. J Food Sci, 2011, 76(1): R16-R28.
[37]王芳,乔璐,张庆庆,等.桑叶蛋白氨基酸组成分析及营养价值评价[J].食品科学,2015,36(1):225228.
[38]庞雪风,何东平,胡传荣,等.不同水解度牡丹籽蛋白氨基酸组成及营养评价[J].食品工业,2014,35(11):288-292.
[39] Sibian M S, Saxena D C, Riar C S. Effect of germination on chemical, functional and nutritional characteristics of wheat, brown rice and triticale: a comparative study[J]. J Sci Food Agric, 2017, 97(13): 4643-4651.
[40] Aguilar E G, Albarracín G D, Uñates M A, et al. Evalu? ation of the nutritional quality of the grain protein of new amaranths varieties[J]. Plant Foods Hum Nutr, 2015, 70(1): 21-26.
[41] Wang D, Li H, Hou T Y, et al. Effects of conjugated in? teractions between perilla seed meal proteins and differ? ent polyphenols on the structural and functional proper? ties of proteins[J]. Food Chem, 2024, 433: 137345.
[42] Zhao Q L, Yan W Q, Liu Y F, et al. Modulation of the structural and functional properties of perilla protein iso? late from oilseed residues by dynamic high-pressure mi? crofluidization[J]. Food Chem, 2021, 365: 130497.
[43] Shevkani K, Singh N, Chen Y, et al. Pulse proteins: secondary structure, functionality and applications[J]. J Food Sci Technol, 2019, 56(6): 2787-2798.
文章摘自:周倩,李峰,孙帅,邓乾春,吴烨婷,王林海,彭登峰,李廷钊,三种特色油料蛋白的组成、营养价值及功能特性分析,[J]中国油料作物学报,doi:10.19802/j.issn.1007-9084.2024058.