摘要:为获取四倍体红麻植株,研究以二倍体红麻(2n=2x=36)为试验材料,采用不同浓度的秋水仙素对红麻种子及幼苗生长点进行处理,并通过气孔鉴定、流式细胞术和染色体计数法对变异株进行观察及鉴定。结果表明:浸渍法的秋水仙素浓度为0.2%,处理24h,变异率为53.85%,成活率25.49%,诱导效果较佳;棉球覆盖法的秋水仙素浓度为0.4%,处理5d,变异率为15%,其诱导效果低于浸渍法。该研究创制了红麻新种质,为红麻多倍体育种的选育工作提供了参考。
关键词:红麻;秋水仙素;多倍体
红麻((Hibiscus cannabinus L.)属于锦葵科木槿属,是一种潜力巨大的纤维素原料[1],具有高产量、强适应性、生产周期短和良好的抗逆性等优点,可用于制造麻袋、麻绳、纺织品和家具等商业产品[2]。近年来,随着红麻用途的不断拓展,其在农田基本建设、环境工程、水利设施和道路施工等领域的应用日益广泛。此外,红麻也是非洲和印度的传统民族药材,在临床上常用于治疗贫血、疲乏等多种病症,现代药理研究也证实了红麻具有广泛的药理作用[3],因此,红麻作为一种多功能植物,不仅在传统产业中有着丰富的应用前景,在应对环境挑战和可持续发展方面也具备独特优势[4],被认为是21世纪最具发展潜力的多用途作物之一。
红麻分布广泛,遍布世界各地,主要集中在亚洲和拉丁美洲等热带和亚热带地区。自从红麻从印度引入中国后,其种植规模迅速发展,种植面积较大的地区主要集中在黄淮海地区、华南地区和长江流域[5]。然而,由于农业结构调整,红麻种植区域逐渐向中西部地区转移,随着红麻纤维的高效综合利用,对其育种提出了更高的要求,因此,选育红麻新种质显得尤为重要。
在自然界,植物多倍体主要由天然杂交或自然突变引起,通常是由于生长环境的变化对染色体产生影响,导致染色体加倍[6]。研究[7-8]表明,多倍体植物通常表现出对环境的适应性增强和具有更强的遗传可塑性等优势特征,因此人工多倍体育种技术得到越来越广泛的应用。通过诱导红麻产生多倍体,不仅可以改良其农艺性状,还有望提高其对逆境的适应性,如耐盐性、耐旱性等。这为红麻的育种方法创新提供了基础,有助于满足人们对天然纤维需求的不断增长。本研究采用棉球覆盖法和浸渍法两种方式对红麻进行多倍体诱导,旨在获得更多具有优良性状的品种,为后续优质红麻种质资源的选育提供一定的材料基础。
1材料与方法
1.1供试材料
红麻品种“中红21”种子由中国农业科学院麻类研究所提供。试验在2022年6月—2023年1月于中国农业科学院麻类研究所和试验基地中进行。
1.2秋水仙素诱导试验方法
1.2.1浸渍法
选取籽粒饱满,大小相近的红麻种子,将充分洗净的红麻种子分别放入0.1%、0.2%、0.3%、0.4% 4种不同浓度秋水仙碱溶液中,置于26℃恒温培养箱中培养,分别静置12、
24、36、48h后,清水冲洗干净,置于铺有一层脱脂棉纱布、一层定性滤纸的培养皿中,空白对照组用无菌水进行处理。将培养皿置于恒温光照培养箱中,温度25℃,暗处理。每隔两天加蒸馏水一次,保持培养皿中环境湿润。待种子露白后,均匀播入育苗盘中,置于恒温光照培养箱中(控制温度25℃,光照时间16h/d,光照强度3000xl)[9]。每组处理51粒种子,观察并记录,变异率=变异株数/存活株数×100%。
1.2.2棉球覆盖法
选取籽粒饱满,大小相近的红麻种子,红麻种子萌发后,待长至2至3片真叶时,选择生长状况一致的幼苗平均分成4组,每组60棵,用0.4%、0.8%、1.2%秋水仙素滴于脱脂棉包裹的红麻幼苗生长点上,如图1,连续5d,定点滴液。
图1棉球覆盖法示意图
1.3多倍体鉴定方法
1.3.1气孔鉴定
根据诱变苗与二倍体红麻苗的植株形态特征,初步筛选出形态变异株,采用指甲油涂抹撕取法[10],观察气孔形态。
1.3.2 流式细胞术鉴定
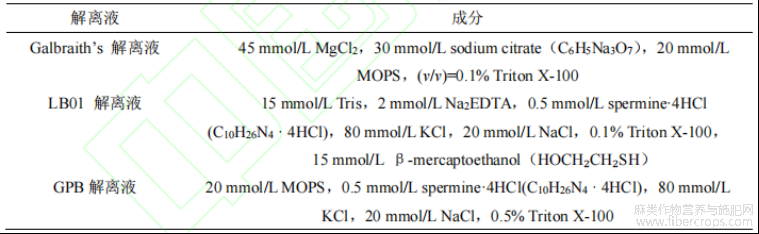
使用由美国Becton,Dickinson and Company (BD)公司生产的Accuri C6流式细胞仪对待测液体进行倍性鉴定和分析,配置4种不同的解离液解离红麻叶片。用流式细胞仪对不同解离液Count((吸收的颗粒数)和FL2-A((荧光强度(fluorescence in-tensity,FL)关系直方图,即DNA相对含量直方图)中相对荧光强度、碎片背景与变异系数等参数进行综合分析,以确定最适宜红麻叶片倍性检测的细胞核解离液。
表1 3种解离液配比
取幼嫩叶片置于预冷过的培养皿中,加入1mL解离液,使用手术刀迅速切碎叶片,并用移液枪充分吸打,确保叶片碎片与解离液均匀混合。通过400目滤网将混合液过滤至1.5mL离心管中,向滤液中加入2.5μL的RNaseA,并在4℃黑暗条件下孵育30min,随后加入17.5μL碘化丙啶(PI),待1~2min后得到细胞核解离液,随即上机检测[11-12]。
1.3.3染色体计数法鉴定
以1~1.5cm的幼嫩根尖作为原材料,在4℃冰箱中处理12~24h后,置于0.002mol/L的8-羟基喹啉水溶液中预处理1~2h后放置于V(无水乙醇):V(冰乙酸)=3:1的卡诺氏固定液中,室温下,固定18h,冲洗数次后,将根尖置于1mol/L的盐酸中,在60℃水浴锅下处理5min,清洗数次后,转入45%乙酸中室温下乳化30min以上,将软化结束的红麻根尖清洁后截取根尖白色不透明的生长点部位,滴上石炭酸卡宝品红染色液进行染色,室温下一般染色约0.5~2h,利用5×、10×和40×物镜的显微镜观察并进行拍照计数。
2结果与分析
2.1秋水仙素对红麻四倍体的诱导效果
2.1.1秋水仙素浸泡法对红麻种子的诱导效果
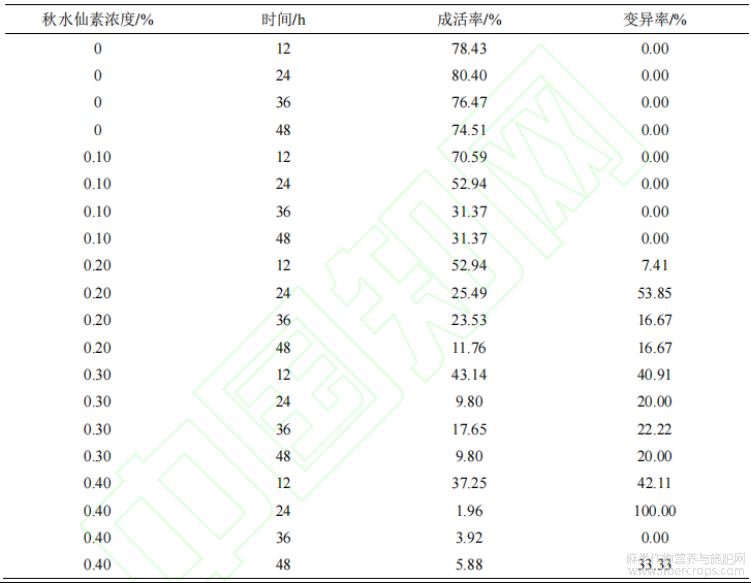
经观察和统计出现四倍体植株的变异率((表2),发现在浓度为0.4%的秋水仙素处理24h后,变异率达到100%,但成活率较低。而在秋水仙素浓度为0.2%处理24h后,变异率为53.85%,成活率为25.49%,表现出较佳的诱导效果。其次是秋水仙素浓度为0.4%处理12h的情况。此外,在相同诱导时间下,红麻的成活率随着秋水仙素浓度的增加呈现整体下降的趋势,而变异率则因秋水仙素浓度的不同呈现出不同的变化趋势,但总体上呈现出增加的趋势。
表2 秋水仙素浸泡法对红麻种子的诱导效果
当秋水仙素浓度为 0.1%和 0.2%时,成活率随着时间延长而降低。而当浓度达到 0.3%和 0.4%时,随着时间延长呈现出较低的成活率。此外,在秋水仙素浓度为 0.2%和 0.4%时,变异率呈现出先增加后减少的趋势,而在秋水仙素浓度为 0.3%时,在浸泡 12 h 后,其变异率达到最高点。
2.1.2秋水仙素棉球覆盖法对红麻幼苗的诱导效果
由表3可知,在秋水仙素浓度为0.40%时,其变异率最高,而随着浓度的逐渐升高,其变异率呈现降低趋势。
表3 秋水仙素棉球覆盖法对红麻幼苗的诱导效果
2.2四倍体鉴定
2.2.1气孔鉴定
通过浸渍种子法和棉花覆盖法对红麻进行多倍体诱导后,先进行形态鉴定,再进行气孔鉴定。由图4及表4可知,在相同视野下,秋水仙素诱导的变异植株的叶片气孔纵径显著增大,达到34.74μm,与对照株相比存在显著差异。同时,气孔横径也呈现增加的趋势,而气孔密度则极显著减少了58.8%。这些结果表明,秋水仙素诱导引起了红麻植株气孔的明显变化。因此,通过对气孔密度和气孔大小的初步筛选,可以有效地筛选出具有气孔结构差异的变异植株。
图2 对照株和变异株的幼苗
图3 对照株和变异株的叶片
图4 红麻变异株与对照株的气孔大小
表4 红麻变异株与对照株的气孔比较
注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
2.2.2流式细胞术鉴定
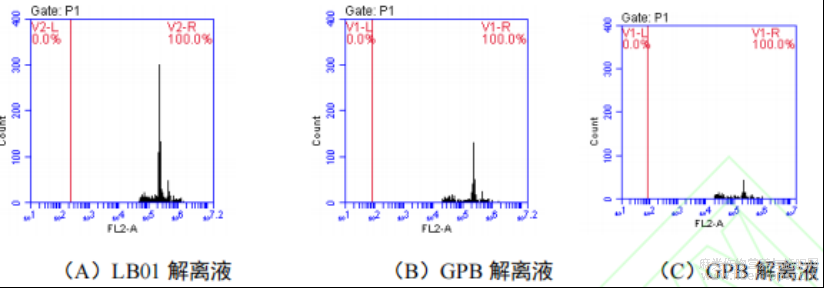
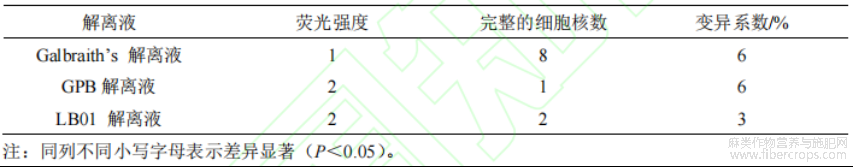
由表5及图5可知:不同细胞核解离液的细胞核数、变异系数与荧光强度均有所差异。LB01解离液的变异系数显著低于Galbraith’s解离液和GPB解离液的变异系数。LB01解离液和GPB解离液的荧光强度显著高于其他Galbraith’s解离液的荧光强度。LB01解离液变异系数较小,且荧光强度和完整细胞核数均高于其他两种解离液。综合对比后,LB01解离液是最适宜红麻进行多倍体鉴定的解离液。
图5 不同解离液获得的红麻叶片体细胞 DNA 相对含量
表 5 不同解离液的细胞核参数
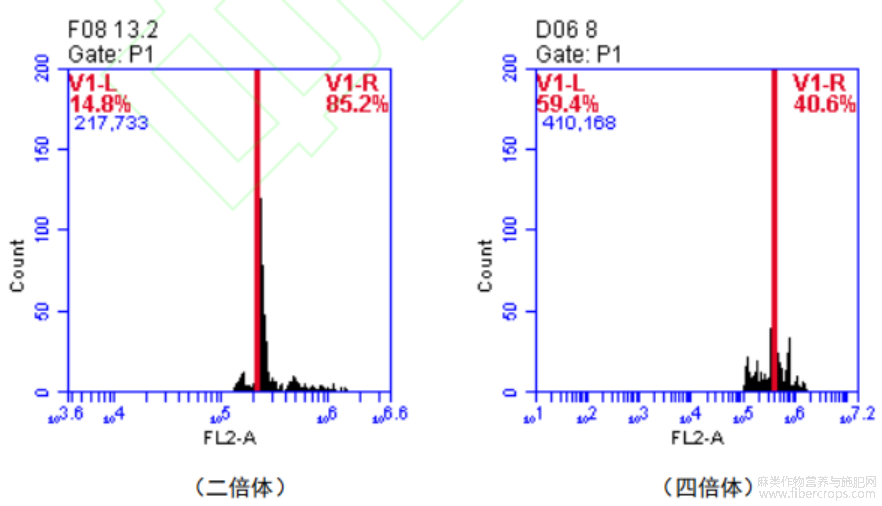
将对照株与变异株进行倍性检测。图6结果显示,对照植株在细胞数量为220000左右时出现单峰值((约为135),而变异植株在细胞数量为410000左右时出现单峰值((约为140),约为对照株的2倍,这一结果明确表明,经诱变处理的此样品为四倍体植株。
图6 二倍体与四倍体红麻 DNA 相对含量
2.2.3染色体计数鉴定
对植物根尖染色体进行计数是植物倍性鉴定中最精确的方法之一。由图7可知,在红麻中,二倍体植株的染色体数目为2n=36,而四倍体植株的染色体数目为4n=72。根尖染色体的计数提供了一种准确鉴定各植株倍性的手段。这一方法能够有效地区分不同倍性植株,并为后续的遗传学研究和育种工作提供可靠的基础。
图7 二倍体与四倍体红麻根尖染色体数目
3讨论
进行植物多倍体诱导时,化学诱导因具有专一性和操作简便等特点而被广泛应用。秋水仙素是目前化学诱导中最常用的试剂,其诱导效果受处理浓度、作用时间、环境温度和植物材料等因素的影响显著[13-14]。首先,多种植物物种均已使用秋水仙素成功获得多倍体,然而不同植物物种之间的多倍体诱导效果存在一定差异。例如,本研究中的红麻种子与前人研究中的郁金香种子[15]的诱导率不同,这可能与植物材料本身对秋水仙素的耐受能力有关。其次,研究表明,秋水仙素的处理浓度和时间对诱导效果也有显著差异。本研究采用浸泡法处理红麻种子,发现在16个处理中有4个组的诱导率大于40%,其中秋水仙素浓度为0.2%、处理时间24h的诱导率最高,达到53.85%,与前人的研究结果相一致[16]。不同的处理方法,如浸渍法、棉球覆盖法、注射法等,对植物的诱导效果也存在显著差异。本研究结果显示,浸渍法对红麻的诱导效果更佳,这与前人对高丹草的多倍体研究结果相反[17]。这可能是由于秋水仙素浓度的提高和处理时间的延长会导致植物畸形苗和嵌合体增加、致死率上升,从而降低多倍体诱导率,同时也可能受环境因素的影响,而本研究中由于样本量较大,因而并未设置重复处理,也可能存在一定的关联。
植物的倍性鉴定在多倍体育种中扮演着至关重要的角色,通常采用形态学观测、气孔观测、染色体计数、流式细胞仪测定等方法。气孔观测属于细胞学观测范畴,气孔大小与植物光合作用及蒸腾作用中的CO2浓度及水分释放密切相关,因此可以作为倍性水平的指标。本研究发现,变异植株的气孔频度显著减小,气孔显著增大,这与前人[18]研究结果一致。染色体计数法能够直观、准确地对植物倍性进行鉴定,流式细胞仪作为快速鉴定加倍植株倍性的工具,还能判断是否为嵌合体[19]。分子标记可以在细胞或组织中准确地识别和定位特定的分子或结构,跟踪生物分子或细胞的运动、变化或相互作用,从而了解其在生物学过程中的功能和行为,进一步对生物分子或细胞进行定量和定性分析,以深入了解其结构、功能和相互关系[20]。在标记基因型分析中,多倍体的最明显标志是观察到来自假定单一位点标记的多个带状图案,多倍体的进行基因型检测可能是在单个基因组区域存在两个以上的单倍型,同时在序列读取的组装方面存在额外的困难[21],因此,综合利用三种鉴定方法可以更全面地评估植物的倍性,为多倍体育种的选育工作提供重要参考。
多倍体育种是一项重要的植物遗传改良技术,其应用广泛且潜力巨大,可以改善作物的品质、产量和抗逆性,加速育种进程,提高植物的价值,本研究通过对化学诱导方法和倍性鉴定的深入研究,不仅为红麻植株的改良和适应不同环境的栽培提供了新途径、为红麻多倍体育种的选育工作提供了参考,同时在农业生产和科学研究领域具有实际和理论上的重要意义。
参考文献
[1]李德序,汪青,黄鑫,等.碱处理提取红麻纤维素的研究[J].毛纺科技,2023,51(4):37-43.
[2]刘倩,戴志刚,陈基权,等.应用SRAP分子标记构建红麻种质资源分子身份证[J].中国农业科学,2013,46(10):1974-1983.
[3]Yi Y S, Lin K N. Hibiscus cannabinus L. (kenaf) studies: Nutritional composition, phytochemistry, pharmacology, and potential applications [J]. Food Chemistry,2020,344:128582-128588.
[4]CHEN M X, SHE Z Y, Aslam Mohammad, et al. Genomic insights of the WRKY genes in kenaf (Hibiscus cannabinus L.) reveal that HcWRKY44 improves the plant’s tolerance to the salinity stress[J]. Frontiers in Plant Science,2022,13:984233-984233.
[5]熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008.
[6]Sattler M C, Carvalho C R, Clarindo W R. The polyploidy and its key role in plant breeding [J]. Planta,2016,243(2):281-96.
[7]Tossi V E, Martínez T L, Laino L E, et al. Impact of polyploidy on plant tolerance to abiotic and biotic stresses [J]. Frontiers in Plant Science,2022,13:869423.
[8]JIANG Y L, LIU S L, HU J, et al. Polyploidization of Plumbago auriculata Lam. in vitro and its characterization including cold tolerance[J]. Plant Cell, Tissue and Organ Culture, 2020, 140 (2): 315-325.
[9]SHI H X, GUO X B, WANG Q, et al. Induction and flow cytometry identification of tetraploids from seed-derived explants through colchicine treatments in Catharanthus roseus (L.) G. Don[J]. Journal of Biomedicine and Biotechnology,2011,2011:793198-793198.
[10]刘明智,努尔巴衣·阿布都沙力克,潘晓玲.指甲油涂抹撕取法制取植物叶气孔装片[J].生物学通报,2005(10):44-63.
[11]Galbraith D W. Simultaneous flow cytometric quantification of plant nuclear DNA contents over the full range of described angiosperm 2C values.[J]. Cytometry Part A: the Journal of the International Society for Analytical Cytology,2009,75(8):692-698.
[12]张仕超.南红梨和杜梨多倍体诱导及鉴定[D].咸阳:西北农林科技大学,2022.
[13]陈建新,张春来,张海楠,等.秋水仙素诱导万寿菊多倍体种质创制研究[J].种子,2022,41(11):54-61.
[14]Hirokazu T. Controlling size in multicellular organs: focus on the leaf[J]. Plos Biology,2008,6:e174.
[15]陈娟娟.两种野生郁金香种子萌发特性及多倍体诱导研究[D].沈阳:沈阳农业大学,2018.
[16]任雪羽,王晓红,肖芬,等.木槿种子的多倍体诱导及鉴定研究[J].西部林业科学,2019,48(4):119-125.
[17]王炜,陈琛,葛玉彬,等.高丹草多倍体的诱导与鉴定[J].西北农业学报,2021,30(9):1394-1401.
[18]成敏,石萤,王金乙,等.秋水仙素诱导辣椒多倍体研究[J/OL].分子植物育种:1-8[2024-09-13].http://kns.cnki.net/kcms/detail/46.1068.S.20231024.1414.006.html.
[19]许蕾,陈佩琳,冯光燕,等.利用流式细胞仪鉴定鸭茅倍性[J].草业学报,2019,28(3):74-84.
[20]Hayward A C,Tollenaere R, Dalton-Morgan J, et al. Molecular marker applications in plants.[J]. Methods in Molecular Biology (Clifton, N.J.),2015,1245:13-27.
[21]Mason A S. Challenges of genotyping polyploid species.[J]. Methods in Molecular Biology,2015,1245:161168.
文章摘自:史盈盈,高泽昕,陈建华,邓勇,李建军,唐慧娟,潘根,栾明宝.红麻四倍体的诱导方法比较与鉴定[J].中国麻业科学,1-9.