摘 要:为研究喷施植物激素赤霉素(GibberellinA3,GA3)对不同苎麻(BoehmerianiveaL.Gaudich.)种质农艺性状和不同器官绿原酸、黄酮和木质素含量的变化,筛选在激素调控下,木质素含量降低、纤用品质提高及功能成分含量増加的纤用苎麻种质资源。本试验以10个苎麻种质为试验材料,以同期喷施蒸馏水为对照组,在成熟期喷施50mg·L-1GA3为处理组。结果表明:1.喷施50mg·L-1GA3后孙新品种、中苎一号和周博不育系鲜重总产量分别提高12.19%、26.85%、10.42%,干重总产量分别提高40.00%、6.31%、31.56%。2.喷施50mg·L-1GA3的苎麻种质厚皮种一号的麻叶、苎麻种质B的麻骨的绿原酸含量较对照分别提高了15.79%和44.82%,黄酮含量分别提高了22.56%和32.23%。10个供试苎麻种质中的9个苎麻种质的麻骨的绿原酸含量均较对照提高,提高幅度在5.90%~74.36%。供试苎麻种质B、厚皮种一号、中苎一号的麻骨木质素含量较对照分别下降0.55%、2.54%和1.67%,供试苎麻种质红皮小麻、昆池一号、湘饲纤兼用苎麻一号、周博不育系的麻叶木质素含量较对照分别下降4.04%、1.87%、4.25%和1.01%。不同的苎麻种质对GA3调控的响应并不相同,在选用苎麻种质时要根据需求选择合适的调控方法。50mg·L-1GA3处理比较适合孙新品种、中苎一号和周博不育系增产,有助于苎麻种质B累积次生代谢物。
关键词:苎麻;GA3;绿原酸;黄酮;木质素
苎麻(BoehmerianiveaL.Gaudich.)是荨麻科苎麻属植物[1],是中国特产的多年生韧皮纤维作物,可用于织布、造纸[2]等,根系发达,生物量大,种质资源丰富[3],苎麻作为药用植物开发利用,其绿原酸和总黄酮物质是最常见的核心药理成分[4]。
绿原酸(Chlorogenicacid,CGA)是一种重要的生物活性物质,具有抗菌、抗病毒、清除自由基和提高白血球数目等作用[5],同时具有解热功能,可增强巨噬细胞吞噬能力,并对多种致病菌及流感病毒、孤儿病毒、疱疹病毒等产生抑制作用[6-7]。绿原酸所具有的多种保健和治疗功能,已经应用于医学、保健、食品、动物饲料等领域[8]。黄酮(Flavonoid)类物质是多种药用、饲用植物如红车轴草(TrifoliumpratenseL.)等的主要药效成分,是一类生物活性物质的总和,包括芦丁、黄芪苷、异槲皮素、山萘酚、槲皮素、山萘酚3-β-D-木糖苷等[9-10]。黄酮类物质具有降低血脂、血压、抗菌解热的作用,同时对心脑血管系统具有很好保护作用,有助于增强免疫力,提高机体抗性[11-12]。木质素(Lignin)是植物中肉桂醇脱氢聚合产生的酚类高分子聚合物,是高等植物特定细胞壁中沉积的第二丰富的天然化合物[13]。木质素占植物生物量的25%~30%,是苯丙氨酸途径生物合成的产物之一,该途径的许多中间产物和最终产物作为植物抗毒素、抗氧化剂、紫外线保护剂、颜料、芳香化合物和抗生素化合物等,在植物生长和利用中发挥重要作用[14-16]。对植物自身来说,木质素具有基本的生物学作用,可强化特殊细胞壁的防水力,对高等植物病理机制、溶质电导和疾病防御起着根本性支持作用[17]。苎麻木质素含量过高,会严重的影响苎麻韧皮部纤维的品质,如木质素含量过高,使麻类织物产生刺痒感,影响其舒适性;饲用苎麻是在幼嫩时期采收进行全茎饲喂,虽然其木质素含量相对较低,但仍会影响饲喂口感和消化。因此在不影响植物生长发育的前提下,降低木质素含量或改变其组成,已成为国际上研究的热点。近年来,科研工作者在木质素合成方面投入较多的精力,并着重研究相关酶的表达活性,以及与之相对应的次级代谢产物间的调节关系。
绿原酸是苯丙烷途径中代谢产物,与木质素合成有关[18-20]。Wang[21]等证明绿原酸处理可通过阻碍木质素合成来抑制‘金冠’苹果的果锈形成。苯丙氨酸在苯丙氨酸解氨酶(Phenylalaninammonialyase,PAL)作用下脱去氨基形成反式肉桂酸,并在肉桂酸–4–羟化酶(Cinnamate-4-hydroxylase,C4H)作用下羟基化形成反式–4–香豆酸,然后分别在香豆酸–3–羟化酶(Coumarate3-hydroxylas,C3H),4–香豆酸辅酶A连接酶(4-coumarate:coenzymeAligase,4CL)、乙酰转移酶(hydroxycinnamoyl-CoA:shikimate/quinatehydroxycinnamoyltransferase,HCT)、查尔酮合成酶(Chalconesynthase,CHS)等酶作用下进入木质素合成、绿原酸合成以及黄酮类化合物(花青素、原花青素、芦丁、单宁)合成的代谢途径[22]。已有研究表明,将VvMYB5a在烟草中超量表达,能上调苯丙烷代谢途径上游的关键酶基因PAL,C4H和4CL的表达,使转基因烟草中的花青素和单宁含量均增加,但却下调了木质素合成途径中的关键酶基因CCoAOMT1的表达,阻碍了木质素的合成进而影响了花药的发育[23-24]。
GA3是一类广泛存在于植物体内的生长调节剂,对植物种子萌发、茎伸长、叶伸长、种子和果实发育等生理过程具有调节作用[25]。GA3处理,能够防止苎麻的早花,减少开花及结实,有利于茎部纤维的合成。短日照下使用GA3较长日照下使用效果更明显[26-27]。GA3]还调节植物生长和次生代谢产物的合成,包括黄酮类化合物[25]。在甘薯(DioscoreaesculentaLour.Burkill)茎尖喷施GA可显著提高72h后甘薯茎尖绿原酸含量[26]。兰阿峰3[28]研究发现喷施四个不同浓度的GA3均可以提高金银花(LonicerajaponicaThunb.)的绿原酸含量。而对于黄酮化合物,Furuya[29]证实了紫萍(SpirodelapolyrhizaL.Schleid.)中生理浓度的GA3对花色苷和黄酮类成分的生物合成具有显著抑制作用。
GA3在苎麻领域的研究主要针对某一种质资源[30],而对多个种质资源不同器官的产量和次生代谢物含量的系统研究较少。关于低木质素、高黄酮、高绿原酸研究几乎属于空白状态,严重影响苎麻低木质素、高黄酮高绿原酸的品种选育和生产应用。本研究通过对多个苎麻种质进行GA3喷施,分麻叶和麻骨两个器官收获,测定苎麻中的功能成分绿原酸、黄酮含量和木质素含量,同时测定其农艺性状,以筛选出在激素调控下,木质素含量降低、纤用品质提高及功能成分含量増加的纤用苎麻种质资源。
1.材料与方法
1.1材料与试验地概况
试验地点位于湖南省长沙浏阳市沿溪镇试验基地。地理位置北纬28.29776°,东经113.835823°,海拔36.6m。土壤pH值为6.33,有机质含量为12.98g·kg-1,全氮含量为1.12g·kg-1,全磷含量为0.71g·kg-1,全钾含量为13.75g·kg-1。土壤镉含量为0.412mg·kg-1。实验材料为周博不育系、耒阳青麻、红皮小麻、中苎一号、昆池一号、厚皮种1号、湘饲纤兼用苎麻一号、湘苎三号、孙新品种和B共10个苎麻种质。
1.2试验设计
试验材料来自湖南农业大学苎麻种质资源圃,采用嫩梢扦插[31]的方式进行无性繁殖,于2015年9月30日选用长势一致的苎麻扦插苗进行大田移栽,10份材料随机排列,3次重复,共30个小区,小区规格为3m×2.4m,株行距为0.5m×0.5m,(每个小区共计24蔸,每个种质共移栽72蔸)。四周设有保护行,厢面宽2m,长37.5m,共8厢。2022年(7龄苎麻,每年按常规管理,属壮龄麻,生长正常)调查取样测定分析。
供试材料为10个苎麻种质,50mg·L-1GA3的始喷期为2022年10月14号三麻生长到15节左右,每隔7d喷洒一次,共喷3次。空白于同期喷施蒸馏水。采用手压式小喷壶全株喷洒,药剂现用现配,注意在喷施过程中用挡板遮挡,避免喷到其它处理上,为保证药效能发挥作用,喷后12h未下雨。对照和处理的每个苎麻种质各3个重复,每个重复喷5株,共10×2×3×5=300株。每喷一次测定一次农艺性状,于2022年11月20日收获已选定植株的叶、皮、骨作为供试材料。用锋利刀具在贴地处割断茎杆,每个苎麻种质的植株分别用网袋装好、挂牌,并尽快带回室内进行测定。
1.3测定指标与方法
1.3.1农艺性状调查
10份苎麻种质每喷一次测定一次株高茎粗,于2022年11月20日收获,麻叶、麻骨、麻皮分离,测量已选定植株鲜皮厚,测定小区株数、有效株、无效株、蔸数、单蔸株数、单蔸有效株、单蔸无效株。
株高:用直尺测量苎麻植株基部至叶顶端的距离,并取平均值。
茎粗:用游标卡尺测量苎麻植株的中间部位,避开叶节处,并取平均值。
分株数:接近土面处所发生的分枝数量,通过目测数植株的分株数,取平均值。
无效株和有效株:生产上难以收剥、无利用价值矮小或未成熟的小麻株,称为无效株。实践中常以高度不足正常株高1/2的称为无效株。相反在工艺成熟期能正常收获的麻株称为有效株。分株数=无效株数+有效株数;有效株率=有效株数/分株数×100%。
鲜皮厚度:在工艺成熟期,将苎麻鲜皮从苎麻茎秆上剥离后,用游标卡尺测量鲜皮中部的厚度,每个重复随机测量15次,并取平均值。
嫩茎叶鲜质量:分小区收获后,用电子秤称量,精度1g;
嫩茎叶干质量:分小区105℃杀青30min,65℃烘至质量恒定,用电子秤称量,精度1g;
叶茎比:苎麻叶干质量/苎麻茎干质量
指标测定方法参照农业行业标准《农作物种质资源鉴定技术规范:苎麻》(NY/T1321-2007)[32]。
1.3.2次生代谢物及木质素含量测定方法
采用紫外分光光度计测定黄酮[33]、绿原酸[34]、木质素[35]的含量。
1.4样品处理及保存
准确称重后,将苎麻样装在网袋中,放入105℃烘箱中杀青30min,65℃条件下烘干至恒重并称量干物质产量。将烘干后的样品用筛网孔径为0.2mm的粉碎机(DF-25大德连续投料粉碎机)粉碎,封口袋保存,编号。
1.5统计分析
采用Excel2019对数据进行初步整理制表,用DPS9.01软件进行数据方差分析,并用Tukey法对数据进行多重比较。
2.结果与分析
2.1GA3处理对苎麻农艺性状的影响
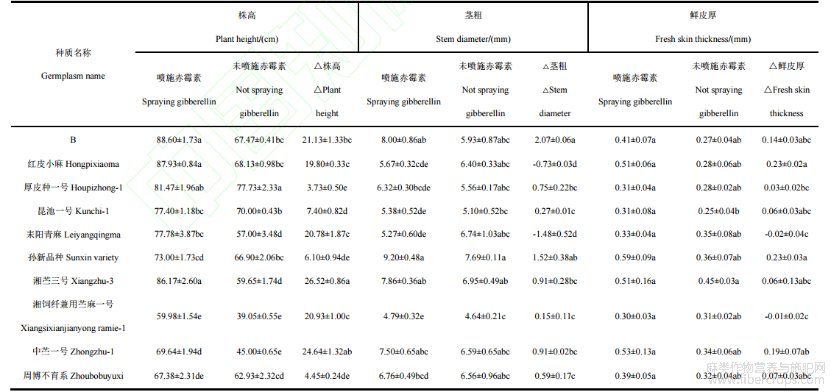
从表1可知,GA3喷施后,湘苎三号株高增加量显著高于红皮小麻、B、厚皮种一号、昆池一号、耒阳青麻、孙新品种、湘饲纤兼用苎麻一号和周博不育系,但与中苎一号无显著差异(P<0.05)。GA3喷施后湘苎三号、中苎一号、B、湘饲纤兼用苎麻一号、耒阳青麻、红皮小麻、昆池一号、孙新品种、周博不育系和厚皮种一号10个苎麻种质生长速度加快,与对照比较,依次分别提高44.45%、54.77%、31.32%、53.61%、36.45%、29.06%、6.17%、9.12%、12.02%和4.80%。GA3处理对湘苎三号、中苎一号、B、湘饲纤兼用苎麻一号、耒阳青麻和红皮小麻促进株高生长效果明显,与对照比较,依次分别提高26.52cm、24.64cm、21.13cm、20.93cm、20.78cm和19.80cm。GA3处理下,苎麻种质B的茎粗增加量显著高于红皮小麻、厚皮种一号、昆池一号、耒阳青麻、湘苎三号、湘饲纤兼用苎麻一号、中苎一号、周博不育系,但与孙新品种无显著差异(P<0.05)。GA3处理下红皮小麻和耒阳青麻等2个苎麻种质茎粗增加量比对照减小,其他8个苎麻种质茎粗增加量比对照增大。GA3处理后,8个苎麻种质茎粗增加量B>孙新品种>湘苎三号>中苎一号>厚皮种一号>周博不育系>昆池一号>湘饲纤兼用苎麻一号,与对照比较,依次分别增大2.07mm、1.52mm、0.91mm、0.91mm、0.75mm、0.59mm、0.27mm和0.15mm,苎麻种质B和孙新品种茎粗增加均大于1.5mm。GA3处理下10个苎麻种质的鲜皮厚度以孙新品种最高,为0.59mm,湘饲纤兼用苎麻一号最低,为0.30mm。喷施GA3后红皮小麻和孙新品种的鲜皮厚度相比于对照显著增加,并显著高于厚皮种一号、耒阳青麻、湘饲纤兼用苎麻一号,但与周博不育系、中苎一号、湘苎三号、昆池一号、B无显著差异(P<0.05)。喷施50mg·L-1GA3后,孙新品种、红皮小麻、中苎一号、B、周博不育系、湘苎三号、昆池一号和厚皮种一号等8个苎麻种质鲜皮厚较对照增加,依次分别增加0.23mm、0.23mm、0.19mm、0.14mm、0.07mm、0.06mm、0.06mm、0.03mm;耒阳青麻和湘饲纤兼用苎麻一号皮厚变薄。
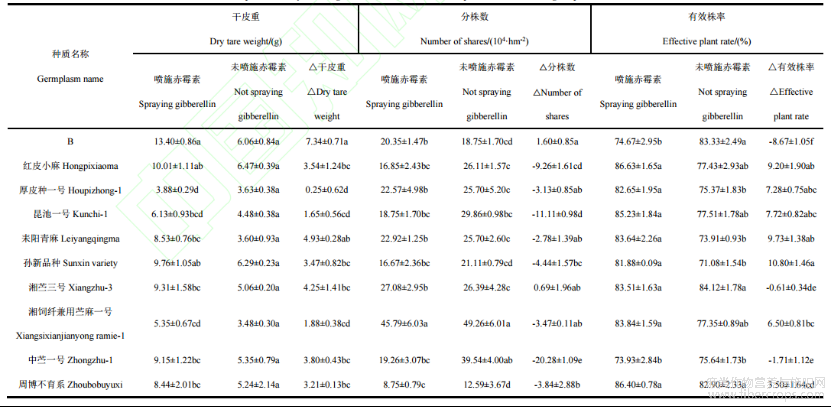
从表2可知,50mg·L-1GA3喷施下,10个苎麻种质干皮重较对照均增加,苎麻种质B干皮重增加量显著高于红皮小麻、厚皮种一号、昆池一号、孙新品种、湘苎三号、湘饲纤兼用苎麻一号、中苎一号、周博不育系,但与耒阳青麻无显著差异(P<0.05)。耒阳青麻、苎麻种质B、湘苎三号、中苎一号、周博不育系、孙新品种、红皮小麻和湘饲纤兼用苎麻一号较对照明显增加,依次分别增加136.76%、121.18%、84.04%、71.12%、61.20%、55.17%、54.69%和53.97%。GA3处理下10个苎麻种质的分株数也以湘饲纤兼用苎麻一号最高,为45.79×104·hm-2,周博不育系最低,为8.75×104·hm-2。GA3喷施后,与对照比较,苎麻种质B的分株数显著高于红皮小麻、昆池一号、孙新品种、中苎一号、周博不育系,但与厚皮种一号、耒阳青麻、湘苎三号、湘饲纤兼用苎麻一号无显著性差异(P<0.05)。GA3处理下红皮小麻、昆池一号、耒阳青麻、孙新品种、中苎一号、厚皮种一号、湘饲纤兼用苎麻一号和周博不育系等8个苎麻种质分株数比对照减少。GA3处理下10个苎麻种质的分株数以B增加最多,较对照增加8.53%,湘苎三号分株数增加最少,较对照增加2.61%。喷施GA3相比于未喷施GA3苎麻种质孙新品种有效株率显著高于湘苎三号、湘饲纤兼用苎麻一号、中苎一号、周博不育系、B,而与红皮小麻、厚皮种一号、昆池一号、耒阳青麻无显著差异(P<0.05)。GA3处理下苎麻种质B有效株率较对照减少明显,孙新品种、耒阳青麻、红皮小麻、昆池一号、厚皮种一号和湘饲纤兼用苎麻一号有效株率较对照明显增大,依次分别增大10.80%、9.73%、9.20%、7.72%、7.28%和6.50%。
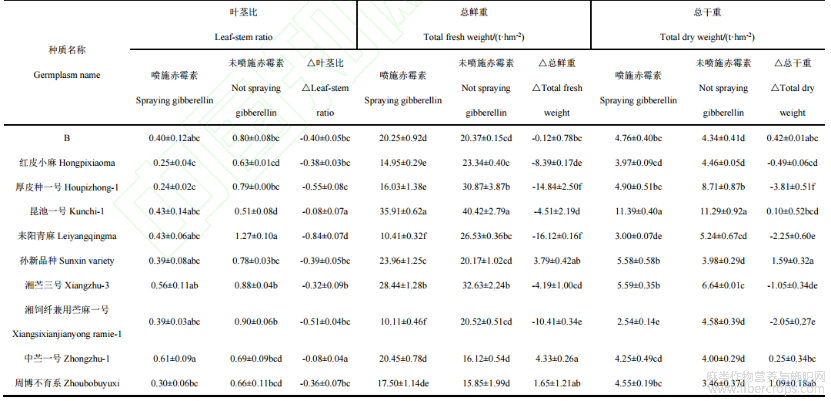
从表3可知,10个苎麻种质喷施GA3比未喷施GA3的叶茎比均较低。50mg·L-1GA3浓度处理下,昆池一号鲜产量高达35.91t·hm-2,湘饲纤兼用苎麻一号最低10.11t·hm-2。GA3喷施后中苎一号鲜重增加量显著高于湘饲纤兼用苎麻一号、B、红皮小麻、厚皮种一号、昆池一号、耒阳青麻、湘苎三号,但与孙新品种、周博不育系无显著差异(P<0.05)。中苎一号、周博不育系和孙新品种鲜产量较对照提高,依次分别提高26.86%、10.41%和18.79%。50mg·L-1GA3浓度处理下,昆池一号干物质产量高达11.39t·hm-2,湘饲纤兼用苎麻一号最低2.54t·hm-2。孙新品种干重增加量显著高于中苎一号、B、红皮小麻、厚皮种一号、昆池一号、耒阳青麻、湘苎三号、湘饲纤兼用苎麻一号,但与周博不育系差异不显著(P<0.05)。苎麻种质孙新品种、周博不育系、中苎一号、B和昆池一号的干物质产量较对照增加,依次分别增加40.00%、31.56%、6.31%、9.73%和0.86%。苎麻种质红皮小麻、厚皮种一号、耒阳青麻、湘苎三号、湘饲纤兼用苎麻一号的干物质产量较对照减少,依次分别减少10.94%、43.77%、42.89%、15.78%和44.66%。
表1 10个苎麻种质资源的株高、茎粗、鲜皮厚比较
注:同列数值为均值±标准差;同列不同小写字母表示显著差异(P<0.05)。△代表处理减去CK的结果。下同
表2 10个苎麻种质资源的干皮重、分株数、有效株率比较
表3 10个苎麻种质资源的叶茎比、总鲜重比总干重比较
2.2 GA3处理对苎麻不同种质功能成分含量的影响
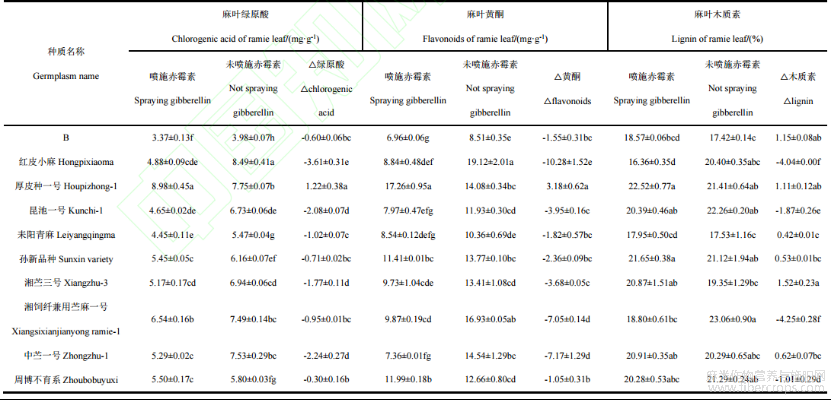
从表4可知,经50mg·L-1GA3激素处理后,不同种质对激素处理的响应也不同。GA3处理情况下,10个苎麻种质麻叶的绿原酸含量介于3.37mg·g-1~8.98mg·g-1之间,厚皮种一号最高,苎麻种质B最低。麻叶的绿原酸含量只有厚皮种一号相较对照增加,增加1.22mg·g-1。厚皮种一号麻叶的绿原酸含量增加量显著高于其他九个苎麻种质(P<0.05)。GA3-处理情况下,10个苎麻种质麻叶的黄酮含量介于6.96mg·g-1~17.26mg·g1之间,厚皮种一号最高,苎麻种质B最低。经50mg·L-1GA3激素处理后,厚皮种一号麻叶的黄酮含量相比于对照显著增加,增加3.18mg·g-1。厚皮种一号麻叶的黄酮含量增加量显著高于其他九个苎麻种质(P<0.05)。喷施GA3后麻叶木质素含量在16.36%~22.53%之间。红皮小麻和湘饲纤兼用苎麻一号麻叶的木质素含量相比于其他八个苎麻种质显著降低(P<0.05)。GA3能够有效降低供试苎麻种质红皮小麻、昆池一号、湘饲纤兼用苎麻一号、周博不育系的麻叶木质素含量,依次分别下降4.04%、1.87%、4.25%和1.01%。
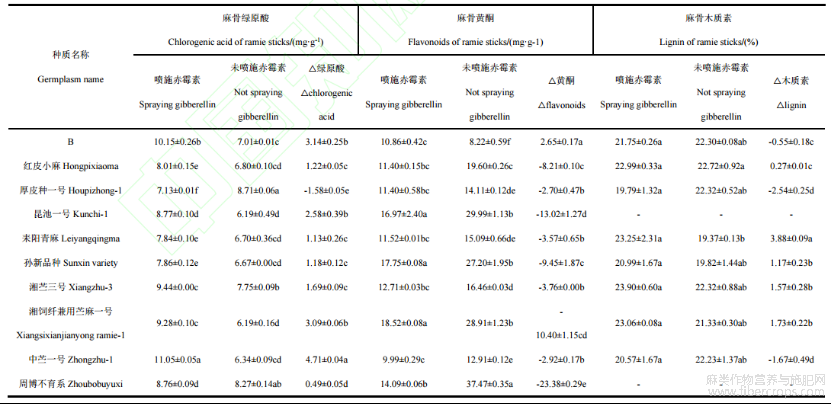
从表5可知,GA3处理情况下,10个苎麻种质麻骨的绿原酸含量介于7.13mg·g-1~11.05mg·g-1之间,中苎一号最高,厚皮种一号最低。供试10个苎麻种质中的9个苎麻种质的麻骨的绿原酸含量均较对照提高,中苎一号麻骨的绿原酸含量增加量显著高于其他九个苎麻种质(P<0.05)。苎麻种质B、红皮小麻、昆池一号、耒阳青麻、孙新品种、湘苎三号、湘饲纤兼用苎麻一号、中苎一号和周博不育系的麻骨的绿原酸含量依次提高44.82%、17.90%、41.78%、16.92%、17.75%、21.78%、49.82%、74.36%和5.90%,中苎一号的麻骨的绿原酸增加的最多,增加4.71mg·g-1。GA处理情况下,10个苎麻种质麻骨的黄酮含量介于9.99mg·g-1~18.523mg·g-1之间,湘饲纤兼用苎麻一号最高,中苎一号最低。经50mg·L-1GA3激素处理后,苎麻种质B麻骨的黄酮含量相比于对照提高32.11%,显著高于其他九个苎麻种质(P<0.05)。喷施GA3后麻骨的木质素含量在19.79%~23.90%之间。厚皮种一号和中苎一号麻骨的木质素含量显著低于其他几份苎麻种质。供试苎麻种质B、厚皮种一号、中苎一号的麻骨木质素含量较对照有所下降,依次分别下降0.55%、2.54%和1.67%。厚皮种一号麻骨的绿原酸、黄酮和木质素含量均下降,而麻叶的绿原酸、黄酮和木质素含量均上升。
表4 GA3对苎麻麻叶功能成分含量的调控
表5 GA3对苎麻麻骨功能成分含量的调控
3.讨论
外源激素对苎麻叶和麻骨中次生代谢物的含量会产生影响,但影响程度不同。喷施GA3后孙新品种、中苎一号和周博士不育系鲜重和干重产量都有所增加,这与吴显荣等[27]和肖之平[36]的研究结果相同。吴显荣等[27]研究发现,GA3应用在生长20d的幼苗上,能够迅速促进植株茎部的生长,增加产量及干物质的积累。GA3作为重要激素具有促进生长的作用,GA3最明显的生物活性之一是刺激植物细胞伸长,使植株长高,叶片增大[37]。张强等[38]研究表明,GA3处理提高了杜仲叶绿原酸含量。本试验中10个种质中麻叶绿原酸含量提高的只有厚皮种一号,而麻骨除了厚皮种一号其他9个种质绿原酸含量均提高,有的苎麻种质喷施GA3后次生代谢物含量并没有增加,可能原因是种质资源本身响应GA3不明显。50mg·L-1GA3喷施情况下,厚皮种一号的麻叶和苎麻种质B的麻骨黄酮含量提高,郭晋鸣[39]研究得出GA3质量浓度为100mg·L-1时,‘农大7号’欧李果实的总酚和类黄酮含量及抗氧化能力均得以提高,外源激素GA3能显著提高雪莲毛状根培养物中总黄酮的含量[40],较低的GA含量有利于银杏叶类黄酮合成[41]。本研究中,除上述列出的,其他种质绿原酸和黄酮3含量均降低,这与GA使‘农大6号’欧李果实的总酚和类黄酮含量及抗氧化能力降低[39],30mg·L-1的GA33能减少花青苷的积累但使成熟期蓝莓的类黄酮含量下降[42]研究结果基本一致。内源激素中乙烯促进黄酮包括花青苷形成,而GA3的作用效果相反,较低的GA3含量有利于叶类黄酮的合成,外源乙烯利也能促进叶类黄酮的积累[43]。蔡葛平[44]研究结果表明:湿润环境有助于光合作用产物的累积,进而能促进黄酮类成分的合成,而干旱在短时间内会使得植物应激合成大量的黄酮类物质来抵抗细胞氧化损伤,但过度干旱则会导致植物病理状态的出现,本试验在2022年进行,浏阳2022年7月后出现重度高温热害,干旱发展迅速,根据蔡葛平研究论证干旱影响黄酮类化合物累积与本试验结果吻合。以上说明GA3对苎麻叶和麻骨黄酮的合成既有抑制又有促进的作用,这不仅与GA3的使用剂量有关,而且还与每个种质响应激素的调控敏感程度不同。在苎麻生长的前期外施GA3,促进细胞伸长,加速植株生长,同时降低了木质素合成速率;在生长后期外施乙烯利,促进植株的成熟,加快黄酮等功能成分的合成,提高营养品质。苯丙烷复合途径可以产生类黄酮、花青素、木质素、植保素、原花青素(缩合单宁)等次生物质,其中木质素的单体生物合成途径位于苯丙烷途径的下游,与苯丙烷的其它分支途径如类黄酮途径等具有平行地位[45]。木质素单体生物合成的前体与黄酮前体、绿原酸前体来源相同,因此,调控木质素含量很可能会直接影响黄酮等功能成分的生物合成。本试验中苎麻种质B的麻骨的绿原酸、黄酮含量增加而木质素降低,叶的绿原酸和黄酮含量减少而木质素增加,这一结果符合正常规律。
4.结论
不同的苎麻种质对GA3调控的响应并不相同,在选用苎麻种质时要根据需求选择合适的调控方法。50mg·L-1GA3处理比较适合孙新品种、中苎一号和周博不育系增产,有助于苎麻种质B累积次生代谢物。
5.展望
GA3对苎麻农艺性状、绿原酸、黄酮、木质素的调控有一定的效果,但仍有很多问题需要进一步深入的研究。如GA3是在苎麻生长的什么阶段发挥作用,GA3对木质素合成的关键酶活性的影响,GA3后喷施一定浓度的乙烯利是否效果会更加显著,干旱、老麻蔸是否对功能成分含量产生影响,苎麻地下部分木质素和功能成分含量是否也受激素调控的影响等等。
参考文献
[1]陈平, 喻春明, 王延周, 陈继康, 卢凌霄, 熊和平. 苎麻cpSSR标记筛选及在亲缘关系研究中的应用. 湖北农业科学, 2014, 53(21):5084-5086.
CHEN P, YU CH M, WANG Y ZH, CHEN J K, LU L X, XIONG H P. Screening of cpSSR markers and its application in ramie kinship research. Hubei Agricultural Science, 2014, 53(21):5084-5086.
[2]朱子君, 李婷婷, 邹煜琦, 朱玥玮, 陈彪. 中国古代造纸的纺织源考. 武汉纺织大学学报, 2024, 37(02):3-9.
ZHU Z J, LI T T, ZOU Y Q, ZHU Y W, CHEN B. The textile source examination of paper-making in ancient China. Journal of Wuhan Textile University, 2024, 37(02):3-9.
[3] 张蕾, 全芮萍, 陈建福, 许明志, 崔国贤, 佘玮. 苎麻BnPCS1响应重金属镉胁迫功能分析. 农业生物技术学报, 2023, 31(09):1846-1856.
ZHANG L, QUAN R P, CHEN J F, XU M Z, CUI G X, SHE W. Functional analysis of BnPCS1 in response to cadmium stress of heavy metals. Journal of Agricultural Biotechnology, 2023, 31(09):1846-1856.
[4] 盛忠梅, 刘湘新, 朱天倬, 黎觐臣, 李宗道, 王春桃. 苎麻根叶有效成分及其药理作用研究. 湖南农学院学报, 1989, (S1):144-148.
SHENG ZH M, LIU X X, ZHU T Z, LI J CH, LI Z D, WANG CH T. Study on the active components of ramie root leaves and their pharmacological effects. Journal of Hunan Agricultural University, 1989, (S1):144-148.
[5] KIM S, SOHN D W, KIM Y C, KIM S A, LEE S K, KIM H S. Fine tuning of a reported synthetic route for biologically active flavonoid, baicalein. Archives of Pharmacal Research, 2007, 30(1):18-21.
[6] SHIMODA H, SEKI E, AITANI M. Inhibitory effect of green coffee bean extract on fat accumulation and body weight gain in mice. BMC complementary and alternative medicine, 2006, 6:9.
[7] 盛卸晃, 刘文谦, 薛霞, 张海艇, 刘兆平. 绿原酸体外抗单纯疱疹病毒作用. 中国天然药物, 2008, (03):232-234.
SHENG X H, LIU W Q, XUE X, ZHANG H T, LIU ZH P. In vitro anti-herpes simplex virus effect of chlorogenic acid. Chinese Journal of Natural Medicine, 2008, (03):232-234.
[8] 晏玉平, 晏和平. 中草药活性成分绿原酸在动物饲料中的应用. 广东饲料, 2005, (01):37-39.
YAN Y P, YAN H P. Application of chlorogenic acid, an active ingredient in Chinese herbal medicine, in animal feed. Guangdong Feed, 2005, (01):37-39.
[9] 王燕. 柿叶中黄酮类化合物的研究进展. 亚太传统医药, 2011, 7(04):173-174.
WANG Y. Research progress on flavonoids in persimmon leaves. Asia-Pacific Journal of Traditional Medicine, 2011, 7(04):173-174.
[10] 曹珊, 张小莉, 白明, 王和平, 苗明三. 柿叶总黄酮药理作用研究及其临床应用探讨. 中医学报, 2012, 27(08): 987-989.
CAO SH, ZHANG X L, BAI M, WANG H P, MIAO M S. Pharmacological effects of total flavonoids in persimmon leaves and their clinical application. Journal of Traditional Chinese Medicine, 2012, 27(08):987-989.
[11] MIZOKAMI H, TOMITA K, TOMITA-YOKOTANI K, YOSHITAMA K. Flavonoids in the leaves of oxalis corniculata and sequestration of the flavonoids in the wing scales of the pale grass blue butterfly, pseudozizeeria maha. Journal of Plant Research, 2008, 121(1):133-136.
[12] 李键. 葛根总黄酮的研究进展. 安徽医药, 2008, (12):1117-1118.
LI J. Research progress on total flavonoids of Pueraria lobata. Anhui Medicine, 2008, (12):1117-1118.
[13] LIU C J. Deciphering the Enigma of Lignification: Precursor Transport, Oxidation, and the Topochemistry of Lignin Assembly. Molecular Plant, 2012, 5(2):304-317.
[14] LLEVOT A, GRAU E, CARLOTTI S, GRELIER S, CRAMAIL H. From lignin-derived aromatic compounds to novel biobased polymers. Macromolecular Rapid Communications, 2016, 37(1):9-28.
[15] DONG N Q, LIN H X. Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions. Journal of Integrative Plant Biology, 2021, 63(1):180-209.
[16] DIXON R A. Natural products and plant disease resistance. Nature, 2001, 411(6839):843-847.
[17] BAURHOO B, RUIZ-FERIA C A, ZHAO X. Purified lignin: Nutritional and health impacts on farm animals - A review. Animal Feed Science and Technology, 2008, 144(3-4):175-184.
[18] TOMáS‐BARBERáN F A, ESPíN J C. Phenolic compounds and related enzymes as determinants of quality in fruits and vegetables. Journal of the Science of Food and Agriculture, 2001, 81(9):853-876.
[19] CAI Y, LI G, NIE J, LIN Y, NIE F, ZHANG J, XU Y. Study of the structure and biosynthetic pathway of lignin in stone cells of pear. Scientia Horticulturae, 2010, 125(3):374-379.
[20] 关晔晴, 秦晓丽, 裴颖, 李雪玲, 冯云霄, 魏创奇, 程玉豆, 关军锋. 外源绿原酸对'雪花'梨果点形成和相关基因表达的影响. 农业生物技术学报, 2021, 29(02):258-267.
GUAN Y Q, QIN X L, PEI Y, LI X L, FENG Y X, WEI CH Q, CHENG Y D, GUAN J F. Effect of exogenous chlorogenic acid on pear fruit spot formation and expression of related genes. Journal of Agricultural Biotechnology, 2021,29(02):258-267.
[21] WANG L J, LI J H, GAO J J, FENG X X, SHI Z X, GAO F Y, XU X L, YANG L Y. Inhibitory effect of chlorogenic acid on fruit russeting in 'Golden Delicious' apple. Scientia Horticulturae, 2014, 178:14-22.
[22] 王星, 罗双霞, 于萍, 罗蕾, 赵建军, 王彦华, 申书兴, 陈雪平. 茄科蔬菜苯丙烷类代谢及相关酶基因研究进展. 园艺学报, 2017, 44(09):1738-1748.
WANG X, LUO SH X, YU P, LUO L, ZHAO J J, WANG Y H, SHEN SH X, CHEN X P. Progress of phenylpropane metabolism and related enzymes in solanaceae vegetables. Journal of Horticulture, 2017,44(09):1738-1748.
[23] DELUC L, BOGS J, WALKER A R, FERRIER T, DECENDIT A, MERILLON J-M, ROBINSON S P, BARRIEU F. The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries. Plant Physiology, 2008, 147(4):2041-2053.
[24] CAVALLINI E, ZENONI S, FINEZZO L, GUZZO F, ZAMBONI A, AVESANI L, TORNIELLI G B. Functional Diversification of Grapevine MYB5a and MYB5b in the Control of Flavonoid Biosynthesis in a Petunia Anthocyanin Regulatory Mutant. Plant and Cell Physiology, 2014, 55(3):517-534.
[25] RACHAPPANAVAR V, PADIYAL A, SHARMA J K, GUPTA S K. Plant hormone-mediated stress regulation responses in fruit crops- a review. Scientia Horticulturae, 2022, 304.
[26] XIE J Y, LI J Q, JIE Y C, XIE D Y, YANG D, SHI H Z, ZHONG Y L. Comparative transcriptomics of stem bark reveals genes associated with bast fiber development in Boehmeria nivea L. gaud (ramie). Bmc Genomics, 2020, 21(1).
[27] 吴显荣. 赤霉素对苎麻生长发育及纤维质量的影响. Journal of Integrative Plant Biology, 1973, (02):195-203.
WU X R. Effects of gibberellin on the growth and development of ramie and fiber quality. Journal of Integrative Plant Biology, 1973, (02):195-203.
[28] 兰阿峰, 纪薇, 梁宗锁. 赤霉素对金银花成花过程的调控. 西北农林科技大学学报(自然科学版), 2007, (05):163-165.
LAN A F, JI W, LIANG Z S. Regulation of the honeysuckle flower formation process by gibberellin. Journal of Northwest A & F University (Natural Science Edition), 2007,(05):163-165.
[29] FURUYA M, THIMANN K V. The biogenesis of anthocyanins. Xi. Effects of gibberellic acid in two species of spirodela. Archives of biochemistry and biophysics, 1964, 108:109-116.
[30] JIE H, MA Y, XIE D-Y, JIE Y. Transcriptional and metabolic characterization of feeding ramie growth enhanced by a combined application of gibberellin and ethrel. International Journal of Molecular Sciences, 2022, 23(19).
[31] 孙进昌. 苎麻嫩梢扦插繁殖技术. 农村实用技术, 2007, (01): 49.
SUN J CH. Cutting propagation technique of ramie. Rural practical technology, 2007, (01): 49.
[32] 农作物种质资源鉴定技术规程 苎麻. 农业标准. 2007: 15p:A4
Technical specification for the identification of crop germplasm resources Ramie. Agricultural Standards. 2007: 15p:A4
[33] 肖呈祥. 苎麻总黄酮的基因型差异及黄酮分离与检测工艺优化研究.长沙:湖南农业大学硕士学位论文, 2014.
XIAO CH X. Genotype difference of flavflavonoids and optimization of ramie. Master Thesis. Changsha:Hunan Agricultural University, 2014.
[34] 陈小倩. 赤霉素与乙烯利对苎麻木质素代谢的调控与利用研究.长沙:湖南农业大学硕士学位论文, 2016.
CHEN X Q. Regulation and utilization of lignin metabolism by gibberellin and ethlide in ramie. Master Thesis. Changsha:Hunan Agricultural University, 2016.
[35] 王建庆, 曹佃元, 张玉. 乙酰溴法测定棉籽壳中木质素的含量. 纺织学报, 2013, 34(09):12-16.
WANG J Q, CAO D Y, ZHANG Y. Determination of lignin in cottonseed shells by acetyl bromide method. Journal of Textile, 2013,34(09):12-16.
[36] 肖之平. 喷施赤霉素对苎麻增产效果的研究. 湖南农学院学报, 1989, (S1):104-109.
XIAO ZH P. Study on the effect of gibberellin spraying on ramie yield increase. Journal of Hunan Agricultural University, 1989, (S1):104-109.
[37] 张宇, 黄国弟, 庞新华, 唐志鹏, 高兴, 杨培丽. 赤霉素对台农16号菠萝生长及果实品质的影响. 经济林研究, 2014, 32(04):110-113.
ZHANG Y, HUANG G D, PANG X H, TANG ZH P, GAO X, YANG P L. Effects of gibberellin on the growth and fruit quality of Tainong 16 pineapple. Economic Forest Research, 2014, 32(04):110-113.
[38] 张强, 苏印泉, 徐咏梅. 采样时间对赤霉素处理杜仲叶次生代谢物含量的影响. 西北林学院学报, 2010, 25(06): 130-133.
ZHANG Q, SU Y Q, XU Y M. Effect of sampling time on the content of secondary metabolites in Eucommia ulmoides leaves treated with gibberellin. Journal of Northwest Forestry University, 2010, 25(06):130-133.
[39] 郭晋鸣, 付鸿博, 张瑜, 王鹏飞, 穆霄鹏, 杜俊杰, 张建成. 喷施赤霉素对欧李果实抗氧化能力的影响. 经济林研究, 2019, 37(02):198-203.
GUO J M, FU H G, ZHANG Y, WANG P F, MU X P, DU J J, ZHANG J CH. Effect of gibberellin spray on the antioxidant capacity of plum fruit. Economic Forest Research, 2019, 37(02):198-203.
[40] 乔献丽, 蒋曙光, 吕晓芬, 李凤霞, 赵德修. 激素对转基因雪莲毛状根植株再生及类黄酮产生的影响. 生物工程学报, 2011, 27(01):69-75.
QIAO X L, JIANG SH G, LYU X F, LI F X, ZHAO D X. Effects of hormones on the regeneration and flavonoid production of transgenic yacon hairy root plants. Chinese Journal of Biotechnology ,2011, 27(01):69-75.
[41] 程水源, 王燕, 李俊凯, 费永俊, 朱桂才. 内源激素含量与银杏叶中类黄酮含量的关系. 林业科学, 2004, (06):45-49.
CHENG SH Y, WANG Y, LI J K, FEI Y J, ZHU G C. The relationship between endogenous hormone content and flavonoid content in ginkgo biloba. Scientia Silvae Sinica, 2004, (06):45-49.
[42] 孙莹, 侯智霞, 苏淑钗, 袁继鑫. ABA、GA3和NAA对蓝莓生长发育和花青苷积累的影响. 华南农业大学学报, 2013, 34(01):6-11.
SUN Y, HOU ZH X, SU SH CH, YUAN J X. Effects of ABA, GA3 and NAA on growth and development and anthocyanin accumulation in blueberry. Journal of South China Agricultural University, 2013, 34(01):6-11.
[43] SAURE MC. External control of anthocyanin formation in apple. Scientia Horticulturae, 1990,42(3):181-218.
[44] 蔡葛平. 光周期、土壤水分及外源激素对黄芩中黄酮类成分累积的影响及其分子机制.上海:复旦大学博士学位论文, 2009.
CAI G P. Effects of photoperiod, soil moisture and exogenous hormones on the accumulation of flavonoids in Scutellaria baicalensis and its molecular mechanism . PhD Thesis. Shanghai:Fudan University, 2009.
[45] BLANKENSHIP S, UNRATH R. PAL and ethylene content during maturation of red and golden delicious apples.Phytochemistry, 1988, 27(4):1001-1002.
文章摘自:刘小春,揭红东,许妍,许岳军,揭雨成. GA3对苎麻生长和次生代谢物含量的影响[J/OL]. 草业科学.