摘 要:研究以工业大麻“云麻7号”(Y7)为材料,克隆CsIAA1(Auxin-responsive protein IAA1)基因,通过生物信息学分析CsIAA1序列特征,经RT-qPCR 研究CsIAA1组织特异性表达模式。结果表明,CsIAA1基因的CDS全长为621 bp,编码了206个氨基酸,含AUX_IAA保守结构域,属于不稳定蛋白。系统进化分析可知,工业大麻CsIAA1与糙叶山黄麻、东山麻等亲缘关系较近。通过烟草叶片瞬时表达和共聚焦试验得知,CsIAA1基因定位在细胞核中。通过RT-qPCR分析发现,在外源IAA处理12h内,CsIAA1在1h时快速响应生长素的处理,表达量最高。在工业大麻雄蕊不同发育阶段中,发育初期表达量比发育期和盛花期要高,且随着发育的进行呈逐渐下降趋势,推测CsIAA1参与调控工业大麻雄蕊发育。该研究从工业大麻中克隆出生长素响应基因CsIAA1并对其进行生信和表达分析,为后续探究工业大麻性别发育机制奠定了研究基础。
关键词:工业大麻;CsIAA1;氨基酸序列;保守结构域;表达量
大麻(Cannabis sativa L.)为大麻科大麻属一年生草本植物,主要用于生产纤维、大麻素、种子和油[1],而大麻素是大麻中特有的酚类物质,目前发现大约有100种不同类型[2]。自然界中,大麻为雌雄异株,雄花为复总状花序,雌花为穗状花序。雌花是积累大麻素的主要场所[3],会产生具有药用价值的萜烯类化合物,而雄株比雌株能生产更细的纤维[4]。
生长素(IAA)是一种植物激素,能够调节植物细胞的分裂、生长和分化,以及根、茎、叶和果实的发育。植物可以迅速感知和响应生长素水平的变化,以调节自身的生长和发育过程。而生长素信号传导途径(SCFTIR1/AFBs-Aux/IAA)[5]主要通过负调控因子 Aux/IAAs(Auxin/Indole Acetic Acids)、生长素受体 TIR1/AFBs(Transport Inhibitor Resistanti/Auxin Signaling F-boxs)以及生长素激活或抑制因子ARFs之间的相互作用来完成。其中,Aux/IAA 蛋白含有 4 个高度保守的结构域:结构域I被确定为抑制结构域,带有乙烯反应因子(ERF) 相关两亲抑制(EAR)基序“LxLxL”,可招募 TOPLESS(TPL)共抑制因子[6];结构域 II是带有保守基序“VGWPP”的降解单元,可与SCFTIR1(SKP-Cullin-F box)直接相互作用,影响蛋白的稳定性[7];结构域III包含一个βαα折叠,其与 Aux/IAA或ARF蛋白的同源和异源二聚化中起重要作用[8];结构域III和IV可与生长素响应因子ARF相结合,这两个结构域与ARF的CTD结构域具有相同的起源,能够促使Aux/IAA蛋白自身形成二聚体、多聚体,并与ARF蛋白特异性结合,从而抑制生长素响应基因的表达[9]。
植物性别分化是植物在生长过程中形成了性别上的差异[10]。生长素能促进植物雌性发育,这在猕猴桃(Actinidia arguta)[11]和黄瓜(Cucumis sativus)[10]研究中已报道,生长素对雌花促进作用可能是通过诱导乙烯合成来实现的。在大麻中,通过外源喷施生长素可使得大麻雄株转变为雌株[12]。外源 IAA 可影响山靛(Mercurialis leiocarpa)雄性发育[13]。此外,高水平的生长素与大麻雌化相关,如大麻雌性花序中的生长素含量高于雄性花序[14]。研究[10]表明,生长素影响植物的性别分化是通过诱导植物器官发育相关调控基因的表达来实现。Aux/IAA 蛋白 AtIAA8 与 ARF6 和ARF8 之间存在互作关系,这种互作关系会影响下游生长素诱导基因的表达,从而调节拟南芥花器官的发育[15]。通过抑制 SI-IAA9 的表达,可以导致番茄的萼片不对称,从而影响叶、花和果实的形成[16]。拟南芥中,IAA8突变体会使得雌雄蕊发育异常[15]。iaa7/axr2-1在短日照下出现晚花,iaa16表现为花丝缩短,且iaa16纯合体不育[17]。综上所述,IAA基因在调节花器官的发育中起到了一定作用。
转录组包括特定组织或细胞在特定功能状态下的所有转录本,能分析不同生长阶段和生理条件下的基因表达模式[18]。近年来,已有诸多通过转录组测序研究进而挖掘性别发育的关键基因。对砂梨雌雄花组织进行转录组测序分析发现,乙烯相关基因表达量上调,而赤霉素和脱落酸相关基因表达量下调[19]。对芦笋的雌雄花进行转录组测序分析发现,在芦笋雌花和雄花上调表达的部分基因可能参与了花芽分化[20]。对柿的雌花芽和雄花芽进行转录组测序分析发现,在雌雄花芽上调表达的基因中,有27个是与性别分化相关的基因[21]。对木薯雌花和雄花转录组分析发现,激素通路中生长素基因表达下调,推测其负调控木薯雌花发育[22]。对大麻雌雄花转录组分析发现,参与植物激素生物合成和信号传导的基因与性别决定相关[23]。由此可知,转录组测序技术为揭示植物性别分化机制奠定了良好基础。
本研究利用课题组前期获得的工业大麻品种“云麻 7 号”雌雄蕊转录组测序结果,筛选出在雄蕊发育阶段具有显著性差异表达的CsIAA1基因(∣Log2FC∣≥1, P<0.05),并对CsIAA1基因进行了克隆及生信分析,对其在大麻不同组织、不同处理后的表达量进行研究,旨为CsIAA1在工业大麻雄蕊发育过程中的作用机制提供理论依据。
1材料方法
1.1 植物材料
工业大麻雌雄异株品种“云麻 7 号”简称Y7,是由中国农业科学院麻类研究所提供。选取籽粒饱满的种子于室温超纯水浸泡一晚,均匀播在含有湿润纸巾的发芽盒里,于恒温培养箱(26℃,光照16h,黑暗8h)进行催芽。一周后,选取长势一致的大麻幼苗播种在装有育苗基质的培养盆中,置于人工气候室培养。
1.2 CsIAA1基因克隆
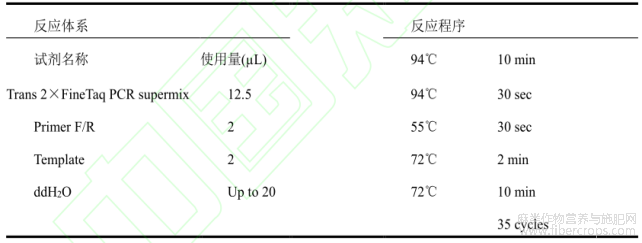
从工业大麻 Y7 转录组数据中筛选出 CsIAA1(Auxin-responsive protein IAA1)基因,参照工业大麻基因组上该基因的ORF区(LOC115719320)序列信息,利用 Primer5软件设计基因克隆引物 CsIAA1-F/R(表5),并由北京擎科生物科技有限公司合成。使用SteadyPure植物RNA提取试剂盒(艾科瑞生物科技有限公司,长沙)提取工业大麻Y7雄蕊的总RNA,用1%琼脂糖凝胶电泳检测提取的总RNA的纯度及浓度。然后,使用赛默飞生物科技有限公司的Thermo Scientific RevertAid First Strand cDNA Synthesis Kit 反转录试剂盒合成cDNA,具体步骤如见说明书。使用TOYOBO Bio公司的 TOYOBO KOD FX DNA Polymerase 试剂进行目的基因CDS区的扩增,反应程序为:预变性94℃ 2 min,变性98℃ 10 s,退火55℃ 30 s,延伸68℃ 2 min,35个循环,最后72℃延伸10 min,于4℃保存。
目的基因PCR产物经1%琼脂糖凝胶电泳分离后,使用美国Omega生物公司的OmegaD2500-01胶回收试剂盒进行胶回收。使用全式金生物科技有限公司的 pEASY-Blunt Cloning Vector克隆载体将回收产物通过平末端的方式和克隆载体相连,连接体系及程序见说明书。然后转化至大肠杆菌感受态细胞(全式金生物科技有限公司,北京)中,随后涂布在含有1/1000终体积Amp(50mg/mL)抗生素的LB固体培养基上,37℃倒置培养一晚。待平板上长出单一的菌落,挑取单克隆于10 µL灭菌超纯水中吸打混匀。取2 µL为模板, 以Taq DNA聚合酶(全式金科技生物有限公司)做菌液PCR检测(表1)。检测为阳性克隆送至北京擎科生物科技有限公司进行测序。
表1 PCR 反应体系及程序
1.3 CsIAA1 基因生物信息学分析
使用CsIAA1的CDS序列及其翻译蛋白进行以下生物信息学分析(表2)。
表2 生物信息学分析网站
1.4 亚细胞定位分析
使用的植物双元表达载体PBI121-GFP购自北京天恩泽基因科技有限公司。选取BamHⅠ为限制性酶切位点。利用同源重组方法构建PBI121-CsIAA-GFP。PBI121-CsIAA-GFP农杆菌(GV3101)过夜培养至OD=0.6,4000 r/min离心20 min 收集菌体,将菌体重悬至侵染液(10 mmol/L MgCl2、10 mmol/L MES、150μmol/L 乙酰丁香酮,pH=5.6)中,室温静置3h后,用1 mL的针头注射烟草叶片(烟草培养条件为:16 h光照/8h黑暗,温度25℃,相对湿度70%,培养大概4~5周),48h后制片观察。
1.5 CsIAA1 表达模式分析
选择 UBQ5 作为内参基因,qRT-PCR 引物使用 Primer3 在线网站进行设计,序列如表3所示。使用艾科瑞生物科技有限公司的 SteadyPure 植物RNA提取试剂盒提取工业大麻不同组织和不同处理下的RNA,反转录为cDNA后,使用艾科瑞生物科技有限公司 SYBR Green Premix Pro Taq HS qPCR Kit 进行qPCR 扩增,具体操作步骤见说明书。每个样品设计3个生物学重复,每个生物学重复设计3个技术重复,采用 2-ΔΔCT 进行基因表达水平的计算,采用 GraphPad Prism 8软件对数据进行分析处理。
表3 引物序列
2结果与分析
2.1 工业大麻CsIAA1基因克隆
以工业大麻Y7雄蕊的cDNA为模板,使用CsIAA1-F/R进行目的片段的克隆。结果显示,测序片段与目的基因片段序列比对结果一致,表明克隆成功(图1)。
图1 CsIAA1基因克隆
2.2 工业大麻 CsIAA1 生物信息学分析
2.2.1 CsIAA1 基因结构域分析
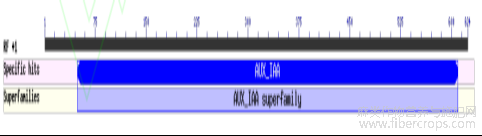
对CsIAA1基因进行分析发现,该基因CDS区全长为621bp,编码206个氨基酸。利用NCBI中CD-search对CsIAA1蛋白的功能结构域进行预测,结果表明,该蛋白含有一个植物特有的AUX_IAA保守结构域(图2),提示其属于Aux/IAA基因家族。
图2 CsIAA1保守结构域
2.2.2 CsIAA1基因理化性质分析
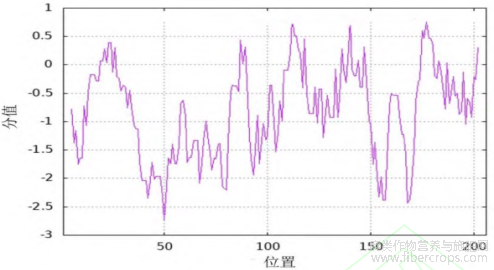
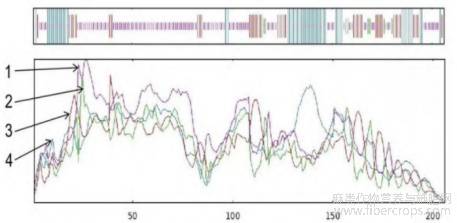
CsIAA1的分子式为C1006H1578N272O328S13,原子总数3197个,分子量为23148.00,理论等电点为5.30。CsIAA1蛋白是由206个氨基酸组成的,其中丝氨酸Ser(9.7%)、谷氨酸Gln(9.2%)、赖氨酸Lys(8.7%)含量最多。蛋白质不稳定系数为42.10%,为不稳定性蛋白。该蛋白平均亲水性为-0.766,为亲水性蛋白(图3)。
图3 CsIAA1蛋白亲疏水性分析
2.2.3 CsIAA1蛋白一级结构分析
通过对CsIAA1信号肽和跨膜区进行预测分析发现,CsIAA1中不存在信号肽和跨膜区(图4)。通过Netphos3.1Server在线网站对CsIAA1蛋白进行预测,CsIAA1蛋白有23个磷酸化位点(Ser位点为13个,Thr位点为7个,Tyr位点为3个),其中,蛋白Se磷酸化位点最多,CsIAA1的磷酸化可能主要发生在丝氨酸残基上。
图4 CsIAA1蛋白跨膜区预测
2.2.4 CsIAA1蛋白二级和三级结构分析
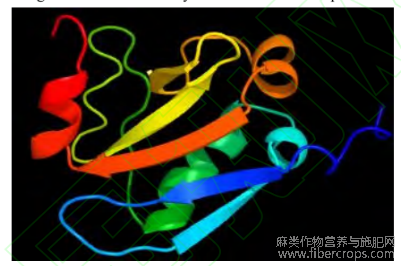
通过对CsIAA1蛋白二级结构预测分析发现,CsIAA1蛋白是由α螺旋结构(26.21%)、延伸链结构(17.96%)、β转角结构(4.37%)和无规则卷曲结构(51.46%)组成(图5),三级结构预测结果与二级结构预测结果相一致(图6)。
图5 CsIAA1蛋白的二级结构预测
图6 CsIAA1基因编码蛋白产物的三级结构
2.2.5 CsIAA1基因系统发育分析
使用NCBI-blastp对蛋白序列进行同源性分析发现,工业大麻CsIAA1与糙叶山黄麻PaIAA1、东山麻ToIAA1及青叶苎麻BnIAA1等的序列相似性为86.73%(图7)。
图7 工业大麻IAA1 蛋白与其他植物IAA1蛋白的氨基酸序列同源比对
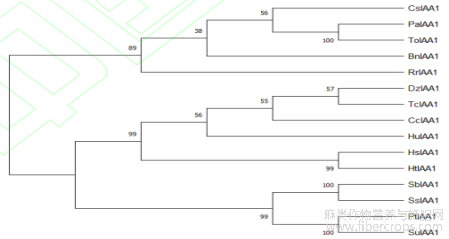
使用MEGA7.0构建系统进化树,发现工业大麻CsIAA1与糙叶山黄麻PaIAA1、东山麻ToIAA1等亲缘关系较近(图8)。
图8 进化树分析
2.3亚细胞定位分析
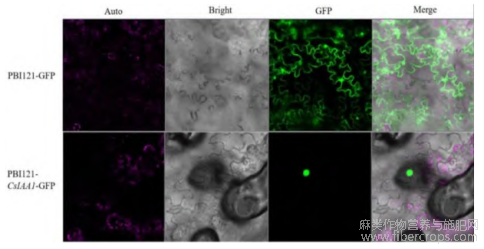
利用含PBI121-CsIAA1-GFP农杆菌对烟草叶片进行了瞬时转化,共聚焦显微镜检测结果如图11所示,PBI121-GFP空载对照在所有细胞器中都能发出绿色荧光,而PBI121-CsIAA1-GFP在细胞核中发出绿色荧光,表明CsIAA1基因定位在细胞核中(图9)。
图9 CsIAA1亚细胞定位
2.4 CsIAA1在工业大麻Y7雄蕊不同发育阶段的表达分析
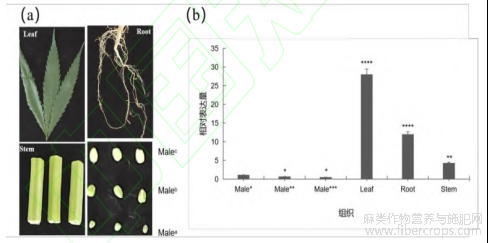
以不同发育阶段雄蕊大小划分为盛花期(直径2.398 mm、长度3.547 mm,接近开花散粉阶段)、发育期(直径1.897 mm、长度2.892 mm)和发育初期(直径1.098 mm、长度1.528 mm)[24]。发现 CsIAA1 在其他组织中的表达量远高于在雄蕊中的表达量,在雄蕊发育初期的表达量比发育期和盛花期高。CsIAA1基因随着工业大麻雄蕊的发育,其表达量逐渐降低(图10)。
图10 雄蕊不同发育阶段基因表达分析
2.5 CsIAA1对外源生长素处理的表达分析
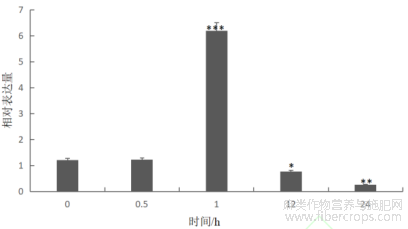
为了观察生长素对CsIAA1基因的表达是否有影响,使用 20μmol/L外源 IAA喷施六叶期工业大麻雄株,当叶面湿润并有液体下滴时停止喷施,于 0、0.5、1、6、12h 取处理叶片。结果如图11所示,在IAA处理1h后,CsIAA1基因表达量最高,随后降低。以上结果表明,CsIAA1基因能够快速响应IAA,且是在1h内快速响应的。
图11 IAA处理后CsIAA1基因的相对表达量
3讨论
生长素在植物生长发育中扮演着重要的角色,是许多植物生长发育过程中的关键信号分子,通过调控基因表达来影响植物的生长发育过程[25]。植物原初响应基因是一类可以被生长素诱导表达的特异性基因家族,包括Aux/IAA、GH3 和 SAUR 三大类。Aux/IAA 基因在调控生长素信号传导途径中扮演着重要的角色,它们以基因家族的形式存在于许多植物中[26]。在本研究中,从工业大麻中克隆了一个与雄蕊发育相关的 Aux/IAA 家族基因拷贝,其cDNA序列的CDS全长为621 bp,编码了206个氨基酸,属于不稳定蛋白质。据报道,小麦(Triticum aestivum)中有84个Aux/IAA成员[27],玉米(Zea mays)中有40个[28],水稻(Oryza sativa) 中有31个[29],拟南芥(Arabidopsis thaliana)中有29个[30],龙眼(Dimocarpus longan)有18个[31],番茄(Lycopersicon esculentum)[32]、高粱(Sorghum bicolor)[33]和葡萄(Vitis vinifera)[34]等多种植物中有25个,陆地棉(Gossypium hirsutum)中有10个[35],桑树(Morus alba)有 51个MnAux/IAA基因家族成员[36],这表明高等植物中存在多样化现象。结构域分析结果显示,CsIAA1属于 Aux/IAA超家族成员。
CsIAA蛋白中含有Domain III,推测该蛋白可能通过这个结构域中βαα-fold与其他Aux/IAA 或ARF蛋白形成同源二聚体和异源二聚体[37]。Dl-IAA基因在龙眼花的芽分化过程中发挥作用,并且Dl-IAA2和Dl-IAA17可能在促进开花过程中发挥作用[31]。研究表明,AtIAA8与AtARF6和AtARF8互作,影响下游生长素诱导基因的表达,进而表明Aux/IAA参与调节花器官的发育[15]。在番茄中,SI-IAA9蛋白能够影响花器官的发育[17],敲除 SI-IAA27会显著降低胚珠和花粉的育性[38]。由此可见,Aux/IAA 基因可以影响植物的性别分化。
在本研究中,经过亚细胞定位得出,CsIAA1基因在细胞核中发出绿色荧光,推测其在细胞核中表达。经系统发育进化分析,工业大麻CsIAA1与糙叶山黄麻、东山麻等亲缘关系较近。通过使用 20μmol/L 的外源IAA处理发现,在IAA处理12h内,CsIAA1在0.5 h时快速响应生长素的处理,其表达量最高,说明IAA 具有促进Aux/IAA基因表达的作用。而在核桃中,外源喷施生长素,12个IAA基因下调[39]。在雄蕊不同发育阶段中,CsIAA1 在雄蕊发育初期的表达量比发育期和盛花期高,且随着发育呈现出逐渐下降的趋势。因此,推测CsIAA1基因参与调控工业大麻雄蕊发育。
4结论
本研究从工业大麻 Y7中克隆出CsIAA1基因。生信分析表明,CsIAA1蛋白二级结构以无规则卷曲为主,占51.46%,其次是α-螺旋,占26.21%,还有17.96%的延伸链和4.37%的β-转角。该蛋白具有不稳定性、亲水性、不跨膜、不含信号肽的特点。经亚细胞定位分析,其定位在细胞核中。qPCR 结果显示,随着雄蕊的发育,CsIAA1表达量逐渐降低,提示其可能参与工业大麻雄蕊发育的调控。以上结果为进一步研究Aux/IAA基因家族在雄蕊发育中的功能提供了参考。
参考文献:
[1]Salentijn M E,Zhang Q Y,Amaducci S,et al.New developments in fiber hemp (Cannabis sativa L.) breeding[J].Industrial Crops & Products, 2015,68:32-41.
[2]M C A,Jean-Francois H,Gea G.Cannabis sativa:The plant of the thousand and one molecules[J].Frontiers in plant science,2016,7:19.
[3]Harm B V,M J S,G A C,et al.The draft genome and transcriptome of Cannabis sativa[J].Genome biology,2011,12(10):R102.
[4]Amaducci S,Scordia D,LIU F H,et al.Key cul tivation techniques for hemp in Europe and China[J].Industrial Crops & Products,2015,68: 2-16.
[5]Salehin M,Bagchi R,Estelle M.SCFTIR1/AFB-based auxin perception: mechanism and role in plant growth and development[J].The Plant Cell, 2015,27(1):9-19.
[6]Szemenyei H,Hannon M,Long J A.TOPLESS mediates auxin-dependent transcriptional repressionduring Arabidopsis embryogenesis[J]. Science,2008,319(5868):1384-1386.
[7]Kepinski S,Leyser O.The Arabidopsis F-box protein TIR1 is an auxin receptor[J].Nature,2005,435(7041):446-451.
[8]Hagen G,Guilfoyle T.Auxin-responsive gene expression:Genes, promoters and regulatory factors[J].Plant molecular biology.2002, 49(3-4):373-385.
[9]Woodward A W,Bonnie B.Auxin:regulation,action,and interaction[J]. Annals of botany,2005,95(5):707-35.
[10]陈学好,曾广文,曹碚生.黄瓜花性别分化和内源激素的关系[J].植物生理学通讯,2002,38(4):317-320.
[11]李晓艳,王振兴,秦红艳,等.软枣猕猴桃雌雄株花蕾发育过程中内源激素的动态变化[J].吉林农业大学学报,2016,38(3):281-286.
[12]刘丽杰,孙玉婷,丁美云,等.植物激素IAA和6-BA对汉麻生理代谢及性别分化的影响[J].分子植物育种,2023:1-8.
[13]邵宏波,初立业,姜恩来.高等植物性别研究的新进展[J].世界科学, 1993(5):26-28.
[14]景文昭.生长素和蔗糖调控文冠果不同位置雌蕊发育的机理研究[D].北京: 北京林业大学,2020.
[15]王婧.拟南芥Aux/IAA家族基因IAA8参与花器官发育的研究[D].湖北:武汉大学,2012.
[16]ZHANG J H,CHEN R G,XIAO J H,et al.A single-base deletion mutationin SI-IAA9 gene causes tomato (Solanum lycopersicum) entire mutant[J]. Plant Research,2007,120(6):671-678.
[17]RINALDI M A,LIU J,ENDERS T A,et al.A gain-of-function mutation in IAA16 confers reduced responses to auxin and abscisic acid and impedes plant growth and fertility[J].Plant Molecular Biology,2012,79(4-5): 359-373.
[18]闫春冬.南瓜性别分化转录组及差异表达基因分析[D].哈尔滨:东北农业大学,2018.
[19]SONGLING B,TAKANORI S,DAISUKE S,et al.Tanalysis of Japanese pear (Pyrus pyrifolia Nakai) flower buds transitioning through endodormancy[J].
[20]GAO W,LI S,ZHANG G,et al.Comparative analysis of gene expression by microarray analysis of male and female flowers of asparagus officinalis[J].Biosci Biotechnol Biochem,2013,77(6):1193-1199.
[21]杜改改.柿花性别分化调控的关键基因筛选及表达模式分析[D].北京:中国林业科学研究院,2017.
[22]陈会鲜,梁振华,黄珍玲,等.木薯花性别分化关键时期的转录组分析及雌花分化相关候选基因的筛选[J].作物学报,2023,49(12):3250-3260.
[23]Adal AM,Doshi K,Holbrook L,et al.Comparative RNA-Seq analysis reveals genes associated with masculinization in female Cannabis sativa[J].Planta,2021,253(1):17.
[24]陶杰.工业大麻雄性连锁InDel标记的筛选及雄性发育机制的探究[D].北京:中国农业科学院,2022.
[25]李艳林,高志红,宋娟.植物生长素响应因子ARF与生长发育[J].植物生理学报,2017,53(10):1842-1858.
[26]Ljung K.Auxtin metabolism and homeostasis during plant development[J].Development,2013,140(5):943-950.
[27]Bhumica S,Archana C,Jitendra P K,et al.An early auxin-responsive Aux/IAA gene from wheat (Triticum aestivum) is induced by epibrassinolide and differentially regulated by light and calcium[J]. Journal of experimental botany,2006,57(15):4059-4070.
[28]WANG Y J,DENG D X,BIAN Y L,et al.Genome-wide analysis of primary auxin-responsive Aux/IAA gene family in maize (Zea mays L.)[J]. Molecular biology reports,2010,37(8):3991-4001.
[29]李司敏.水稻 Aux/IAA 基因家族进化分析及 OsIAA23基因功能的鉴定[D]. 南京:南京大学,2019.
[30]Dreher K A,Browen J,SAW R E,et al.The Arabidopsis Aux/IAA protein family has diversified in degradation and auxin responsiveness[J]. The Plant Cell,2006,18(3):699-714.
[31]梁钒,张艺勇,张梦媛,等.龙眼 Aux/IAA 基因家族全基因组鉴定及表达分析[J].果树学报,2021,38(11):1839-1853.
[32]SU L H,XIE Y D,HE Z Q,et al.Network response of two cherry tomato (Lycopersicon esculentum) cultivars to Cadmium stress as revealed by transcriptome analysis[J].Ecotoxicology and Environmental Safety, 2021,222:112473.
[33]Jain M,Kaur N,Garg R,et al.Structure and expression analysis of early auxin-responsive Aux/IAA gene family in rice(Oryza sativa)[J].Funct Integr Ge-nomics,2006,6(1):47-59.
[34]袁华招,赵密珍,吴伟民,等.葡萄生长素响应基因家族生物信息学鉴定和表达分析[J].遗传,2015,37(7):720-730.
[35]HAN X,XU X,FANG D D,et al.Cloning and expression analysis of novel Aux/IAA family genes in Gossypium hirsutum[J].Gene,2012,503(1): 83-91.
[36]冯曦,豆浩,孙佳佳,等.桑树 Aux/IAA 基因家族鉴定与 IBA处理下表达模式分析[J].河南农业大学学报,2023,1-16.
[37]Gretchen H,Tom G.Auxin-responsive gene expression:genes,promoters and regulatory factors[J].Plant molecular biology,2002,49(3-4): 373-85.
[38]Bassa C,Mila I,Bouzayen Met,al.Phenotypes associated with down-regulation of SI-IAA27 support functional diversity among Aux/IAA family members in tomato[J].Plant Cell Physiol,2012,53(9): 1583-1595.
[39]李义霞,鱼尚奇,郭众仲,等.外源IAA 对核桃内果皮生长发育的影响[J]. 果树学报,2024,41(05):941-955.
文章摘自:杨晓娟,阳锡涛,苏雨娟,等.工业大麻CsIAA1基因克隆及表达分析[J/OL].中国麻业科学,1-14[2024-08-03].http://kns.cnki.net/kcms/detail/43.1467.S.20240719.1106.006.html.