摘 要:近年来,随着大众对自身的健康意识的不断提高,多酚类物质对机体的有益影响逐渐被人们认识。国内外学者对于多酚的研究颇多,目前研究,证实多酚类物质由于自身的化学性质,有较好的抗炎抗氧化作用,对许多疾病,例如:癌症、糖尿病和结肠炎等均有改善作用。中国是全球最大的亚麻生产和消费国家之一。其中亚麻籽中存在大量的亚麻木酚素,亚麻木酚素也是多酚类物质的一种,其对机体的影响不言而喻。亚麻木酚素作为一种对众多疾病的都有一定的辅助治疗的物质,表现出巨大的发展潜力。因此,本文对亚麻的来源,代谢过程,生物作用进行了描述,并从与亚麻木酚素相关信号通路的角度,全面综述亚麻木酚素干预疾病的机制。研究发现,亚麻籽木酚素可通过直接调节基因表达或间接调节信号通路的方式,促进机体健康。此外,亚麻木酚素还能根据特定的生理条件发挥不同的作用。
关键词:亚麻木酚素;多酚;抗炎抗氧化;信号通路
随着社会的进步和科技的发展,人们对于健康问题的关注逐渐增加。特别是近年来,大众对自身健康的意识不断提高,使得多酚类物质这一具有广泛生物活性的天然产物受到了极大的关注。多酚是一类存在于植物中的化合物[1-2],由于其独特的化学结构,它们在抗氧化、抗炎以及抗肿瘤等方面表现出显著的生物活性[11]。
亚麻籽作为中国传统的农作物之一,不仅在纺织业中有着重要的地位,更因其富含的亚麻木酚素而成为近年来研究的焦点[3-6]。亚麻木酚素是一种具有多种生物活性的多酚类物质,其在调节机体健康方面的作用日益受到重视。国内外学者对其进行了深入研究,并发现它在预防和治疗多种疾病上具有潜在的价值。亚麻木酚素的生物活性与其对细胞信号通路的调控密切相关。研究表明,亚麻木酚素能够通过直接或间接的方式影响基因的表达,进而调节细胞的生长、分化和凋亡。此外,它还可以根据机体的生理状态,展现出不同的生物效应,这种特性使其在药物研发和临床应用中具有巨大的潜力。
鉴于亚麻木酚素的重要性,本文旨在全面综述亚麻木酚素的来源、代谢过程以及其对机体的影响。本文将深入探讨亚麻木酚素如何通过调节相关的信号通路,发挥其对疾病的干预作用。希望通过本文的阐述,为读者提供一个关于亚麻木酚素及其在健康领域应用的全面视角,同时为未来的研究和应用提供参考和启示。
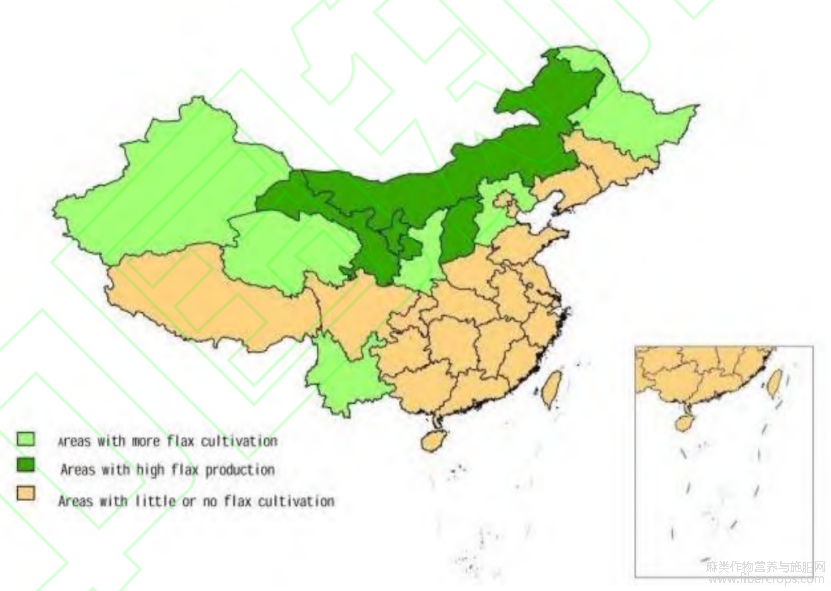
木酚素是由2个苯基丙烷单元氧化二聚而产生的一类天然酚类。它也是一种植物多酚[1]。木酚素具有温和的植物雌激素特性,可在多种谷物中发现,但亚麻籽中的木酚素含量最高[2]。亚麻籽中含有大量的木酚素——开环异落叶松树脂酚二葡萄糖苷[6](secoisolariciresinol diglucoside,SDG),其含量约为1%至4%,是其他来源的75至800倍,其次是芝麻[3]。SDG的含量取决于品种、气候条件和栽培方法,通常为种子重量的0.9%至1.5%[4]。虽然亚麻在中国的内蒙古、宁夏、青海、新疆、黑龙江、山西、河北、甘肃和陕西等地区都有广泛种植,但余晓等人[5]的研究表明,山西和河北生产的亚麻籽总酚含量明显高于宁夏和新疆生产的亚麻籽总酚含量(图1)。
图1 亚麻种植分布图
SDG在结肠中被肠道微生物群转化,产生未结合的衍生物开环异落叶松树脂酚(secoisolariciresinol,SECO),SECO被结肠细菌去糖基化并部分转化为活性动物木酚素[7]肠二醇(enterodiol,END)和肠内酯(enterolactone,ENL)也称为肠木质素,被归类为植物雌激素[12]。肠木质素可表现出雌激素活性,这是因为它们的分子结构与17β雌二醇相似[9],在诱导雌激素活性的相同位置上有相同的羟基取代基[8]。有些代谢物还可能经过肝-肠循环[10],在肝中形成葡萄糖醛酸和硫酸盐的结合体,然后分泌到胆汁中,最后被肝菌剥离结合体,在胃肠道中被重新吸收[8]。木酚素以共轭葡萄糖醛酸的形式从胆汁和尿液中排出,也以非共轭形式从粪便中排出。
图2 亚麻籽在人体内的代谢
3 亚麻木酚素的作用
植物多酚等植物化学物质通常被认为具有抗癌、抗炎、抗病毒,抗菌和免疫调节作用,这归功于多酚的羟基有较强的供电子能力[11]。多酚能够通过细胞和分子靶点的直接或间接相互作用,调节癌症发生的多个靶点,标记营养药物的癌症靶向[7]。而木酚素是一种普遍存在的重要的植物多酚,在亚麻籽等食物来源中含量很高。有关木酚素的文献表明[2],木酚素在癌症预防和治疗中具有潜在的益处。研究发现[8]木酚素能降低急性冠心病发病率。此外SDG在众多疾病中有良好的疗效,包括降低血脂、预防心血管疾病[7,13]和糖尿病的发生发展[13]等。多项研究表明,SDG可显著降低炎症标志物浓度[14],SDG与白细胞介素(interleukin,IL)-6浓度呈显著负相关,研究发现,亚麻籽可以减少单个核细胞分泌的IL-6,肿瘤坏死因子α等促炎因子的产生[16]。在肥胖人群中,食用亚麻籽后对其有改善作用,主要体现在减少脂肪细胞肥大、T细胞聚集和单核细胞趋化蛋白-1的产生等[15]。SDG对于中度高胆固醇血症的治疗也有显著作用。Fukumitsu等人[17]实验发现,低剂量的SDG可以降低中度高胆固醇血症男性的血胆固醇和肝病危险因素。作为天然抗氧化剂,亚麻籽的抗氧化作用主要来自SDG[18]。研究发现[5],SDG和SECO有较强的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazylradical,DPPH)自由基清除能力,相比之下END和ENL的表现较弱并且随着SDG的浓度增大,DPPH的清除率逐渐提高。而对偶氮二异丁脒盐酸盐(2,2'-Azobis(2-methylpropionamidine)dihydrochloride,AAPH)诱导的DNA损伤和脂质过氧化反应中,抗氧化活性分别为SDG优于SECO,END和ENL。
4 亚麻木酚素在信号通路中的作用
SDG通过其独特的抗氧化和抗炎特性,能够针对特定的信号分子和途径进行调控,从而在分子层面上影响疾病的进程和治疗效果。下面将系统描述SDG在特定信号通路中的具体作用机制。
4.1亚麻木酚素与 TXNIP / NLRP3 信号通路
硫氧还蛋白相互作用蛋白(thioredoxin-interacting protein, TXNIP)是一种内源性的抗氧化硫氧还蛋白和活性氧(reactive oxygen species,ROS)传感器的抑制剂[19]。硫氧还蛋白(thioredoxin,TRX)是硫醇还原系统的主要组成部分之一[20],在细胞增殖、凋亡和基因表达等细胞过程中发挥多种作用。TXNIP是硫氧还蛋白的内源性抑制剂和调节剂。TXNIP在无应激状态时是抗氧化剂硫氧还蛋白的负调节因子,TXNIP与硫氧还蛋白在细胞核内结合[20]。TXNIP已被证明在不同的细胞区室之间穿梭,包括细胞核、线粒体和质膜[22]。在氧化应激条件下[20],TXNIP从细胞核转到细胞质。
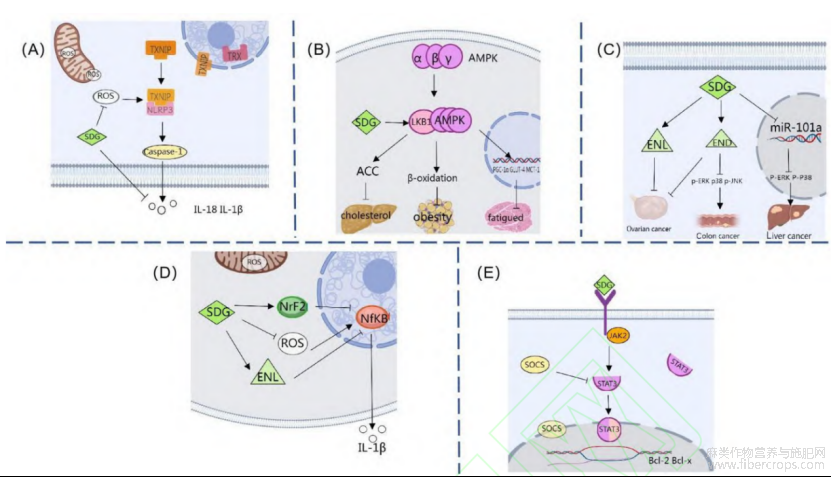
柳媛媛等人刺激IL-10的释放,进而延缓了疾病的进展。在小鼠的[23]在多囊卵巢综合征(polycystic ovary syndrome,PCOS)大鼠模型的研究中发现,SDG可以通过抑制促炎因子肿瘤坏死因子-α(tumor necrosis factor,TNK-α),慢性间歇性缺氧(chronic intermittent hypoxia,CIH)阶段[22],由于肾皮质或髓质缺氧,加速了局部ROS的产生,炎症小体激活物在ROS条件下诱导TXNIP从硫氧还蛋白中解离,与NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)激活受体并结合,促进NLRP3炎性小体形成。NLRP3炎症小体会使得胱天蛋白酶1(cysteinyl aspartate specific proteinase,Caspase-1)活化,激活的胱天蛋白酶1反过来会裂解,并释放促炎因子IL-1β和IL-18,从而导致炎症的发生。任静等人[21]研究发现,在给予SDG后改善了CIH小鼠诱导的氧化应激反应,说明SDG通过抑制ROS的产生从而减弱TXNIP在心肌组织中的表达,从而减轻了CIH小鼠心肌损伤。正如Ding等人[24]在小鼠模型中所证明的那样,给予抗氧化剂可以有效地减少ROS的产生,从而降低了NLRP3的水平。综上所述,在不同情况下,SDG可以通过直接抑制促炎因子或通过TXNIP/TRX通路抑制促炎因子的产生,从而对机体产生作用(图2)。目前已被证实,蛋白质与抗氧化剂结合可以使得机体的抗炎功能加倍。而多酚类物质作为一种天然的抗氧化剂,其功能就毋庸置疑了。
4.2 亚麻木酚素与AMPK通路
单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路是一种细胞内的信号通路,参与细胞代谢的调节,与细胞的能量代谢密切相关,可调节ATP消耗和ATP合成。在AMPK信号通路中,AMPK是一种关键的细胞能量传感器[25]。AMPK是一种重要的蛋白激酶,由肝激酶B1(liverkinaseB1,LKB1)和钙调素依赖性蛋白激酶β(calmodulin dependent protein kinase β,CAMKKβ)激活,调节细胞的代谢和生长[26]。
AMP激活蛋白激酶α(AMP activated protein kinase α,AMPKα) 是整个身体和细胞能量平衡的主要调节剂,其中在最大摄氧量达到85%时会增加AMPKα的活性[27]。当细胞能量需求过多或剩余能量不足时[26],AMPKα就会被激活,AMPK会通过抑制代谢合成途径或刺激能量产生的方式来恢复机体的ATP水平。此时摄入的SDG会通过激活AMPKα来抑制脂肪形成。在能量供给充足情况下,SDG会增加LKB1和AMPK的磷酸化水平,激活的AMPK会直接磷酸化乙酰辅酶A羧化酶(acetylCoAcarboxylase,ACC)来抑制胆固醇的形成。研究发现[26],SDG可以显著增加AMPKα及其上游激活剂LKB1的磷酸化水平的表达。所以SDG可以通过激活AMPKα来抑制脂肪的形成。无独有偶,在Puukila等人[28]的大鼠心肌缺血再灌注研究中发现,SDG促进铁诱导的AMPK蛋白的表达,减轻氧化应激诱导的心肌损伤,从而达到保护心肌的目的。进一步表明SDG在心血管铁超载时具有保护心肌的作用。周蕾等人[29]的研究发现,SDG可以通过增加AMPKα的磷酸化水平,促进AMPKα下游能量代谢调控基因PGC-1α、GLUT-4、MCT-1和NRF1等基因的转录,从而提高力竭训练大鼠的运动能力和抗氧化能力,调节能量代谢途径,从而有效减轻运动性疲劳。综上所述,在一定情况下,SDG可以激活AMPK通路,对机体产生影响(图3)。虽然上游激酶对α亚单位结构域Thr172的磷酸化是AMPK的主要激活事件[30],但SDG具体是通过对α亚单位哪一个结构域发挥作用仍有待确定。
有丝分裂原激活蛋白激酶信号通路(mitogen-activated protein kinase,MAPK)是信号从细胞表面向细胞核增殖的主要信号通路。该信号通路在许多肿瘤中被激活,其多种成分已被确定为癌基因[31]。MAPK通路分为三部分:细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路、p38MAPK信号通路和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路[32]。Wang等人[33]研究发现,非编码RNA与癌症发展之间存在强烈的相关性。不同非编码RNA会通过刺激MAPK相关通路的打开来促进/抑制细胞增殖,从而引发/避免癌症。
Ge等人[34]在肝肾损伤小鼠模型中发现,SDG通过抑制miR-101a表达,下调ERK和p38表达水平,上调丝裂原激活蛋白激酶磷酸酶-1(mitogen-activated protein kinase phosphatase-1,MKP-1)水平,从而调节炎症和细胞凋亡。这可以抵制苯并[a]芘(benzo[a]pyrene,BaP)毒性从而保护小鼠的肾和肝。众所周知,SDG摄入人体后,会在肠道内代谢产生END。Shin等人[35]研究发现,ERK、JNK和P38MAPK的表达水平随着END浓度的增加而降低,END对结肠癌细胞有促凋亡作用,这进一步解释了SDG可以促进癌症细胞凋亡的原因。综上所述,SDG对炎症和细胞凋亡的调节作用是多途径的(图3),一方面SDG可以通过直接抑制非编码RNA,下调相关蛋白酶表达量,从而控制细胞凋亡,另一方面,SDG的产物END也可以促进细胞凋亡。关于SDG的另一产物ENL,有研究表明[36,37],在卵巢癌治疗中ENL表现出比END更好的疗效和更少的副作用。产生这一结果的原因可能是在卵巢癌患者中,体内雌激素分泌过多,肠木质素与体内的雌激素竞争性结合雌激素受体,在与雌激素的竞争性结合方面,因为ENL与雌二醇等内源性雌激素结构更加相似,所以ENL比END有更强的亲和力。
4.4 亚麻木酚素与NF-KB通路
核因子KB(nuclearfactorkappa-B,NF-KB)通路是参与炎症、关节破坏、肿瘤生成等的一种典型的促炎信号通路。其通过调控多种基因表达来引发不同的生物学活动。NF-KB也是引发癌症的关键[38]。核因子红细胞2相关因子2(nuclear factor-erythroid 2-related factor-2,Nrf2)通路是一种内源性的抗氧化通路,该通路是人体自发产生对抗自由基的通路,其可以调节重要的生理过程,例如炎症和细胞凋亡等。Nrf2通过协调抗氧化基因的表达,来保证体内的自由基平衡[39]。Li等人[40]研究发现,Nrf2的激活会抑制NF-KB通路,而SDG可以通过激活Nrf2并抑制ROS的积累,从而达到抑制NF-KB通路的效果。Zhang等人[41]在骨性关节炎的小鼠模型中同样发现,SDG可抑制软骨细胞内ROS的产生,对该疾病有一定的治疗作用。SDG除了可以抑制ROS的积累减轻疾病进展,也可以直接对NF-KB通路产生作用。Bowers等人[42]的乳腺癌小鼠模型研究证明,SDG可以通过抑制NF-KB活性来抑制肿瘤生长。另外,Wang等人[43]发现,SDG的抑制作用部分依赖于抑制"核苷酸结合寡聚化结构域样蛋白1(NOD-like receptor containing pyrin domain 1,NLRP1)炎症小体的激活,部分依赖于NF-KB通路的抑制,从而抑制炎症过程,减轻了小鼠结肠炎的病理严重程度。这一结果在多囊卵巢综合症[42]大鼠模型中也有相同发现(图3)。目前已知,SDG在人体内会代谢产生END和ENL,而ENL的产生会让癌症风险降低,Lampe等人[44]研究发现,与高浓度ENL相比,在低浓度ENL中,NF-KB和诱导型一氧化氮合酶(Recombinant Nitric Oxide Synthase 2,NOS2)表达增多,过氧化物酶体增殖物激活受体γ(peroxi‐some proliferator-activated receptor γ, PPARγ)被抑制,更容易发生炎症。已知SDG具有抗氧化和ROS清除特性,基于此,Pietrofesa的研究进一步提出了一种人工合成的SDG(LGM2605)[45],经过实验证明,其可以增强小鼠腹膜巨噬细胞的抗氧化能力,减少石棉诱导的ROS生成,进而提出LGM2605也可以成为一种理想的无毒且有效的化学预防剂。综上所述,SDG对炎症的治疗作用已被关注,不管是SDG还是LGM2605,其对炎症的治疗方式主要是抑制炎症标志物的产生或抑制NLRP1的激活,而作用产生的原因可能是其代谢产物ENL的作用结果。但在Lampe文中低浓度ENL与高浓度ENL的划分只是通过简单的含量差距来区分,并未通过实验来进一步精确的证明。所以到底是在多少浓度产生显著变化,有待进一步研究。
酪氨酸激酶信号转导和转录激活因子通路(Janus kinase signal transducers 2 and activator of transcription 3,JAK2/STAT3)是一条与细胞凋亡有关的信号通路,信号通路[46]。有意思的是,Chen等人[47]研究发现,信号传导转录激活因子1(signal transducer and activator of transcription 1,STAT1)在促进细胞凋亡中发挥关键作用,而STAT3具有抗凋亡作用。JAK-STAT通路也有自己的负向调节机制[48],细胞因子信号抑制因子(suppressor of cytokine signaling,SOCS)蛋白就是与信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)竞争或与两面神激酶(Janus Kinase,JAK)结合来负向调节该通路的分子[49]。STAT3的靶点是抗凋亡基因如Bcl-2和Bcl-xl[50],所以该信号通路受到抑制时,Bcl-2的表达会减少,而促凋亡蛋白Bax的表达会增加,从而诱导细胞凋亡。在单独对SDG实验的研究中发现,Bcl-xl表达水平显著增加,JAK2和STAT3磷酸化会随着SDG的浓度增大而增加,随着研究的深入进行发现,SDG可能通过JAK2来激活STAT3信号[46]。而且,近期也有研究发现[51],用SDG干预后的心肌损伤小鼠模型中,JAK2和STAT3蛋白质表达增高,说明SDG可以通过激活JAK/STAT3信号来减轻心肌细胞的损伤(图3)。同样是多酚类物质,鸢尾苷元也有类似的作用[52],但需要通过调控miR-449a才能抑制JAK2/STAT3信号通路的活化,从而发挥作用。对于其他多酚类物质是否也需要通过调控基因的表达来参与到此通路中,仍需要进一步讨论。
图3 开环异落叶松树脂酚二葡萄糖苷(SDG)在特定途径中的作用
4.6 SDG与其他信号通路
磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)传导通路在调节癌细胞增殖、抗凋亡通路和分化中发挥重要作用[53]。在肿瘤发生中,不同量的ROS产生不同作用[54]。中等ROS使蛋白酪氨酸磷酸酶(Protein Tyrosine Phosphatase,PTP)失活并促进PI3K和酪氨酸激酶受体(Tyrosine Kinase Receptor,TKR)信号传导,促进肿瘤的发生。过量的ROS则会损害细胞结构,诱导DNA突变,导致细胞衰老和死亡,对肿瘤细胞造成破坏,此时肿瘤细胞为了生存,会激发抗氧化功能,且该功能会随着ROS水平增高而增强。
Chen等[55]研究发现,在直肠癌细胞中,SDG与刺激ROS产生,抑制PI3K/AKT信号通路和激活Bax蛋白有密切关系,SDG会通过提高ROS水平来抑制PI3K/AKT信号通路,从而促进细胞焦亡。该研究还发现SDG可以提高Caspase-1和上调消皮素D(gasdermin-D,GSDMD)蛋白的表达,抑制肿瘤生长。而GSDMD可通过靶向ROS来激活Caspase并促进细胞焦亡。对于该通路,王君实等[56]发现在卵巢大鼠心肌缺血再灌注损伤模型中,SDG可能通过激活雌激素受体α活化PI3K-Akt-eNOS信号通路,从而对心肌起保护作用。与SDG相似,具有类雌激素作用的β-谷甾醇-d-葡萄糖苷(β-sitosterol-D-glucoside,β-SDG)是一种从甘薯中新分离出的植物甾醇[57],Xu等[57]实验证明,β-SDG可以通过上调miR-3a表达和灭活PI3K-Akt信号通路相关因子来抑制肿瘤生长。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路被认为与细胞炎症和自噬有关,mTOR是一种丝氨酸/苏氨酸蛋白激酶,是细胞营养状态的传感器[58]。
Khater等[59]研究发现,接受SDG治疗的肥胖大鼠表现出mTOR蛋白和P62基因显著下调,Beclin、LC3-II和AMPK基因显著上调。这说明SDG可以调节肥胖大鼠自噬基因和凋亡蛋白。木酚素会抑制mTOR下游因子来阻断mTOR通路。mTOR的激活受AMPK的能量代谢调节,即激活的AMPK会抑制mTOR信号传导以及细胞生长和增殖。SDG可以阻止铁诱导的p70S6激酶1(p70S6K1)蛋白表达增加从而避免氧化应激导致的心肌细胞增大,而在应激条件下mTOR也可能是p70S6K1的调节因子[58]。综上所述,对于不同疾病,SDG可以通过直接调节基因的表达或者间接调节信号通路的方式,来达到有益于机体的目的,在不同情况下,SDG对于ROS的作用也是不一样的,但关于SDG在PI3K/AKT通路,mTOR通路的国内外研究较少,还需要进一步研究。
5 问题与展望
随着社会的进步和生活质量的提升,人们开始更加关注预防疾病和保持健康。SDG作为一种新兴的抗炎抗氧化剂,逐渐引起了大众的关注。然而,SDG的研究尚处在早期阶段,对于其在疾病治疗中的具体作用机制仍需深入探索。当前,SDG多被应用于功能性食品中,以口服的方式摄取。不过,鲜少有研究探索SDG药物的开发及其传递效率的增强,可能是因为SDG在慢性疾病治疗中的确切效果尚存不确定性。基于现有的研究,我们还需要进一步确认含有各种木酚素化合物的药物制剂的制剂设计。同时,需要更多的临床试验和科学研究来验证SDG的效果和安全性,从而更全面地挖掘其在治疗疾病中的潜力,以期望为治疗慢性炎症性疾病提供更多选择。
[1]Saleem M, Kim H J, Ali M S, et al. An update on bioactive plant lignans[J]. Nat Prod Rep, 2005, 22(6): 696-716.
[2]伊六喜, 萨如拉, 王树彦, 等. 亚麻木酚素含量的 SSR 关联分析[J]. 华北农学报 (Yi L X, Sa R L, WS Y, et al. SSR correlation analysis of lignans content in flax[J]. Acta Agric.Boreali-Sin), 2021, 36(1):63-70.
[3]Johnsson P, Kamal-Eldin A, Lundgren L N, et al. HPLC method for analysis of secoisolariciresinol diglucoside in flaxseeds[J]. J Agr Food Chem, 2000, 48(11): 5216-5219.
[4]于潇. 亚麻木酚素提取工艺研究[J]. 辽宁师专学报(自然科学版) (Yu X. Research on the extraction process of linen lignans[J]. Journal of Liaoning Normal College(Natural Science Edition)), 2011,13(1): 95-97
[5]禹晓, 黄沙沙, 聂成镇, 等. 亚麻籽酚类化合物抗氧化和油相迁移特性研究进展[J]. 中国油料作物学报 (Yu X, Huang S S, Nie C Z, et al. Progress of antioxidant and oil-phase migration properties of phenolic compounds from linseed[J]. Oil Crop Science), 2019, 41(4): 643-649.
[6]刘寒, 郭亚净, 赵亚硕, 等. 亚麻木酚素通过抑制 TXNIP 和激活 NLRP3 炎症小体减轻慢性间歇性低氧小鼠肾脏炎症损伤[J]. 中国病理生理杂志 (Liu H, Guo YJ, Zhao Y S, et al. Linum usitatissimum attenuates renal inflammatory injury in chronic intermittent hypoxia mice by inhibiting TXNIP and activating NLRP3 inflammatory vesicles[J]. Chin J Pathophysiol), 2020, 36(9): 1631-1638.
[7]Mueed A, Deng Z, Korma S A, et al. Anticancer potential of flaxseed lignans, their metabolites and synthetic counterparts in relation with molecular targets: current challenges and future perspectives[J]. Food Funct, 2023, 14(5): 2286-2303.
[8]沈晓东, 李多伟, 赵蓉, 等. 亚麻木酚素的研究进展[J]. 中成药 (Shen X D, Li D W, Zhao R, et al. Research progress of linamarin[J]. CJCR), 2009, 31(4): 598-600.
[9]Tanwar A K, Dhiman N, Kumar A, et al. Engagement of phytoestrogens in breast cancer suppression: Structural classification and mechanistic approach[J]. Eur J Med Chem, 2021, 213: 113037.
[10]Durazzo A, Zaccaria M, Polito A, et al. Lignan content in cereals, buckwheat and derived foods[J]. Foods, 2013, 2(1): 53-63.
[11]Ramsay A, Fliniaux O, Quéro A, et al. Kinetics of the incorporation of the main phenolic compounds into the lignan macromolecule during flaxseed development[J]. J A Food C, 2017, 217: 1-8.
[12]Teponno R B, Kusari S, Spiteller M. Recent advances in research on lignans and neolignans[J]. Nat Prod Rep, 2016, 33(9): 1044-1092.
[13]Hajibabaie F, Abedpoor N, Safavi K, et al. Natural remedies medicine derived from flaxseed (secoisolariciresinol diglucoside, lignans, and α ‐linolenic acid) improve network targeting efficiency of diabetic heart conditions based on computational chemistry techniques and pharmacophore modeling[J]. J Food Biochem, 2022, 46(12): e14480.
[14]王维义, 许帅强, 何宏燕, 等. 亚麻籽的营养成分及功能研究进展[J]. 中国油脂 (Wang W Y, Xu SQ, He H Y, et al. Progress of research on nutritional composition and function of flaxseed[J]. COF),2020, 45(4): 83-85.
[15]贡丽雅, 王燕, 石剑. 亚麻木酚素对糖尿病患者血糖及血脂的影响[J]. 中国医药导报 (Gong L Y, Wang Y, Shi J. Effects of flaxseed lignans on blood glucose and blood lipids in diabetic patients[J]. China Medicine Herald), 2022, 19(3): 63-66.
[16]Rahimlou M, Jahromi N B, Hasanyani N, et al. Effects of flaxseed interventions on circulating inflammatory biomarkers: a systematic review and meta-analysis of randomized controlled trials[J]. Adv Nutr, 2019, 10(6): 1108-1119.
[17]Fukumitsu S, Aida K, Shimizu H, et al. Flaxseed lignan lowers blood cholesterol and decreases liver disease risk factors in moderately hypercholesterolemic men[J]. Nutr Res, 2010, 30(7): 441-446.
[18]Pilar B, Güllich A, Oliveira P, et al. Protective role of flaxseed oil and flaxseed lignan secoisolariciresinol diglucoside against oxidative stress in rats with metabolic syndrome[J]. J Food Sci, 2017, 82(12): 3029-3036.
[19]Abais J M, Xia M, Li G, et al. Nod-like receptor protein 3 (NLRP3) inflammasome activation and podocyte injury via thioredoxin-interacting protein (TXNIP) during hyperhomocysteinemia[J]. JBC, 2014, 289(39): 27159-27168.
[20]Zhang J, Li X, Zhao Z, et al. Thioredoxin signaling pathways in cancer[J]. Antioxid Redox Sign, 2023, 38(4): 403-424.
[21]任静, 郭亚净, 刘寒, 等. 亚麻木酚素通过调控 TXNIP/NLRP3 信号通路改善 CIH 小鼠心肌损伤[J].中国药理学通报 (Ren J, Guo Y J, Liu H, et al. Linamarin ameliorates myocardial injury in CIH mice by modulating TXNIP/NLRP3 signalling pathway[J]. Chin Pharmacol Bull), 2020, 36(8): 1094-1099.
[22]Choi E H, Park S J. TXNIP: A key protein in the cellular stress response pathway and a potential therapeutic target[J]. Exp Mol Med, 2023, 55(7): 1348-1356.
[23]柳媛媛, 汪婷, 李一唯, 等. 亚麻木酚素对多囊卵巢综合征大鼠髓源抑制细胞及炎症因子的影响[J]. 免疫学杂志 (Liu Y Y, Wang T, Li Y W, et al. Effects of linamarin on myeloid-derived suppressorcells and inflammatory factors in rats with polycystic ovary syndrome[J]. ChinJ Immunol), 2023, 39(1): 1-11.
[24]Ding W, Guo H, Xu C, et al. Mitochondrial reactive oxygen species-mediated NLRP3 inflammasome activation contributes to aldosterone-induced renal tubular cells injury[J]. Oncotarget, 2016, 7(14): 17479.
[25]Trefts E, Shaw R J. AMPK: restoring metabolic homeostasis over space and time[J]. Mol Cell, 2021, 81(18): 3677-3690.
[26]Kang J W, Park J, Kim H L, et al. Secoisolariciresinol diglucoside inhibits adipogenesis through the AMPK pathway[J]. Eur J Pharmacol, 2018, 820: 235-244.
[27]Clark S A, Chen Z P, Murphy K T, et al. Intensified exercise training does not alter AMPK signaling in human skeletal muscle[J]. Am J Physiol Endocrinol Metab, 2004, 286(5): E737-E743.
[28]Puukila S, Bryan S, Laakso A, et al. Secoisolariciresinol diglucoside abrogates oxidative stressinduced damage in cardiac iron overload condition[J]. PLoS One, 2015, 10(3): e0122852.
[29]周蕾, 贺帅, 席海燕, 等. 亚麻木酚素对力竭训练大鼠的抗疲劳作用及 AMPK 通路的影响[J].分子植物育种 (Zhou L, He S, Xi H Y, et al. Anti-fatigue effects of linum usitatissimum on force-trained rats and the effects of AMPK pathway[J]. Mol Breed), 2023, 21(17): 5809-5816.
[30]Steinberg G R, Hardie D G. New insights into activation and function of the AMPK[J]. Nat Rev Mol Cell Bio, 2023, 24(4): 255-272.
[31]Dhillon A S, Hagan S, Rath O, et al. MAP kinase signalling pathways in cancer[J]. Oncogene, 2007, 26(22): 3279-3290.
[32]高天舒, 肖愉箫, 苏晓语, 等. 尿酸性肾病发病机制相关信号通路研究进展[J]. 药学研究 (Gao T S, Xiao Y X, Su X Y, et al. Progress of signalling pathways related to the pathogenesis of uric acid nephropathy[J]. Pharmaceutical Research), 2022, 41(2): 113-116.
[33]Wang Q, Feng J, Tang L. Non-coding RNA related to MAPK signaling pathway in liver cancer[J]. Int J Mol Sci, 2022, 23(19): 11908.
[34]Ge J, Hao R, Rong X, et al. Secoisolariciresinol diglucoside mitigates benzo [a] pyrene-induced liver and kidney toxicity in mice via miR-101a/MKP-1-mediated p38 and ERK pathway[J]. Food Chem Toxicol, 2022, 159: 112733.
[35]Shin M K, Jeon Y D, Jin J S. Apoptotic effect of enterodiol, the final metabolite of edible lignans, in colorectal cancer cells[J]. J Sci Food Agric, 2019, 99(5): 2411-2419.
[36]Liu H, Liu J, Wang S, et al. Enterolactone has stronger effects than enterodiol on ovarian cancer[J]. J Ovarian Res, 2017, 10(1): 49.
[37]滕晖, 向大位. 肠内脂与肠二醇的生理活性研究进展[J]. 中南药学 (Teng H, Xiang D W. Research progress on the physiological activities of enterolipin and enterodiol [J]. Central South Pharmacy),2012, 10(3): 219-223.
[38]Capece D, Verzella D, Flati I, et al. NF-κB: Blending metabolism, immunity, and inflammation[J]. Trends Immunl, 2022, 43(9): 757-775.
[39]Loboda A, Damulewicz M, Pyza E, et al. Role of Nrf2/HO-1 system in development, oxidative stress response and diseases: an evolutionarily conserved mechanism[J]. Cell Mol Life Sci, 2016, 73: 3221-3247.
[40]Li S, Shi Y, Zhang S, et al. Corynoline alleviates osteoarthritis development via the Nrf2/NF-κB pathway[J]. Oxid Med Cell Longev, 2022, 2022: 2188145.
[41]Zhang Z, Wang S, Liu X, et al. Secoisolariciresinol diglucoside ameliorates osteoarthritis via nuclear factor-erythroid 2-related factor-2/nuclear factor kappa B pathway: In vitro and in vivo experiments[J]. Biomed Pharmacother, 2023, 164: 114964.
[42]Bowers L W, Lineberger C G, Ford N A, et al. The flaxseed lignan secoisolariciresinol diglucoside decreases local inflammation, suppresses NFκB signaling, and inhibits mammary tumor growth[J]. Breast Cancer Res Tr, 2019, 173: 545-557.
[43]Wang Z, Chen T, Yang C, et al. Secoisolariciresinol diglucoside suppresses dextran sulfate sodium salt-induced colitis through inhibiting NLRP1 inflammasome[J]. Int J Immunopharmacol, 2020, 78: 105931.
[44]Lampe J W, Kim E, Levy L, et al. Colonic mucosal and exfoliome transcriptomic profiling and fecal microbiome response to a flaxseed lignan extract intervention in humans[J]. Am J Clin Nutr, 2019, 110(2): 377-390.
[45]Pietrofesa R A, Velalopoulou A, Albelda S M, et al. Asbestos induces oxidative stress and activation of Nrf2 signaling in murine macrophages: chemopreventive role of the synthetic lignan secoisolariciresinol diglucoside (LGM2605)[J]. Int J Mol Sci, 2016, 17(3): 322.
[46]Rao T, Tong H, Li J, et al. Exploring the role and mechanism of hyperoside against cardiomyocyte injury in mice with myocardial infarction based on JAK2/STAT3 signaling pathway[J]. Phytomedicine, 2024, 128: 155319.
[47]Chen-Scarabelli C, Saravolatz II L, Mccaukey R, et al. The cardioprotective effects of urocortin are mediated via activation of the Src tyrosine kinase-STAT3 pathway[J]. Jak-Stat, 2013, 2(3): e24812.
[48]Bao N N, Kong D Y, Zhu D, et al. Influence of overexpression of SOCS2 on cells of DN rat[J]. Asian Pac J Trop Med, 2015, 8(7): 583-589.
[49]李涛, 杨丽霞, 高博, 等. JAK/STAT 信号通路干预糖尿病微血管并发症研究进展[J]. 中国临床药理学与治疗学 (Li T, Yang L X, Gao B, et al. Progress of JAK/STAT signalling pathway in diabetic microvascular complications[J]. Chinese Clinical Pharmacology and Therapeutics), 2023, 28(12): 1415.
[50]Kim H C, Kim E, Bae J I, et al. Sevoflurane postconditioning reduces apoptosis by activating the JAK-STAT pathway after transient global cerebral ischemia in rats[J]. J Neurosurg Anesth, 2017, 29(1): 37-45.
[51]王玉燕, 铁虎光, 金丽山, 等. 亚麻木酚素对 TGF-β1 诱导的心肌细胞 H9C2 损伤的影响[J]. 中国免疫学杂志 (Wang Y Y, Tie H G, Jin L S, et al. Effects of linamarin on TGF-β1-induced H9C2 injury in cardiomyocytes[J]. Chinese Journal of Immunology), 2022, 38(8): 915-920.
[52]杜姣, 张梦婕, 黄联杰. 鸢尾苷元通过 miR-449a 调控 JAK/STAT 信号通路对人牙龈成纤维细胞增殖及凋亡的影响[J]. 中成药 (Du J, Zhang M J, Huang L J. Effects of irisinogen on the proliferation and apoptosis of human gingival fibroblasts through miR-449a modulation of the JAK/STAT signalling pathway[J]. Chinese Traditional Patent Medicine), 2023, 45(9): 3073-3076.
[53]Jang W Y, Kim M Y, Cho J Y. Antioxidant, anti-inflammatory, anti-menopausal, and anti-cancer effects of lignans and their metabolites[J]. Int J Mol Sci, 2022, 23(24): 15482.
[54]Zhao Y, Hu X, Liu Y, et al. ROS signaling under metabolic stress: cross-talk between AMPK and AKT pathway[J]. Mol Cancer, 2017, 16: 1-12.
[55]Chen T, Wang Z, Zhong J, et al. Secoisolariciresinol diglucoside induces pyroptosis by activating caspase‐1 to cleave GSDMD in colorectal cancer cells[J]. Drug Develop Res, 2022, 83(5): 1152-1166.
[56]王君实, 马敏, 赵志武, 等. PI3K-Akt-eNOS 信号通路在 SDG 抑制去卵巢大鼠心肌缺血再灌注损伤中的调控作用[J]. 临床心血管病杂志 (Wang J S, Ma M, Zhao Z W, et al. Regulation of PI3K-Akt-eNOS signalling pathway in myocardial ischemia-reperfusion injury in SDG-inhibited de-ovulated rats[J]. Journal of Clinical Cardiology), 2016, 32(8): 848-852.
[57]Xu H, Li Y, Han B, et al. Anti-breast-cancer activity exerted by β-sitosterol-D-glucoside from sweet potato via upregulation of microRNA-10a and via the PI3K–Akt signaling pathway[J]. J Agr Food Chem, 2018, 66(37): 9704-9718.
[58]Puukila S, Bryan S, Laakso A, et al. Secoisolariciresinol diglucoside abrogates oxidative stressinduced damage in cardiac iron overload condition[J]. PLoS One, 2015, 10(3): e0122852.
[59]Khater S I, Shalabi M, Alammash B B, et al. Evaluation of flaxseed lignan-enriched extract targeting autophagy, apoptosis, and hedgehog pathways against experimentally induced obesity[J]. J Adv Vet Anim Res, 2023, 10(2): 321.
文章摘自:颜雪茹,何恩鹏,蔡啸镝.亚麻木酚素在干预疾病中涉及的信号通路及作用机制[J/OL].中国生物化学与分子生物学报. 1-13[2024-06-25].https://doi.org/10.13865/j.cnki.cjbmb.2024.06.1462