摘 要:研究发现含有半胱氨酸残基即巯基的植物蛋白肽具有铅离子螯合能力,可以降低铅中毒人群体内铅的浓度,缓解中毒症状,减轻铅损伤。本研究以脱脂亚麻籽饼为原料,从中提取亚麻籽蛋白并进行酶解,优化酶解工艺得到高巯基含量的酶解物,采用共价色谱法对亚麻籽蛋白酶解物中半胱氨酸肽进行富集,并鉴定其结构,最后通过分子对接技术探究其与铅离子的螯合机制,旨在获得具有铅离子螯合作用的半胱氨酸肽。结果发现,采用proteaseM酶,在酶解温度50℃、酶解pH3.5、酶添加量900U/g、酶解时间4h条件下,得到巯基含量为13.37μmol/g的亚麻籽蛋白酶解肽,铅离子螯合量为11.40mg/g;通过共价色谱法对其进行富集得到巯基含量为44.8μmol/g、铅离子螯合量为24.98mg/g的亚麻籽蛋白源半胱氨酸肽,比亚麻籽蛋白提高了6.74倍和3.92倍;对亚麻籽蛋白源半胱氨酸肽进行结构鉴定,得到3种含有半胱氨酸的肽段,分别为WAIINLQHSGEGLCGRVV、CTGLLEAVAAALMMNIYIVGLNQLTDIE、QGGQGQQQQCEKQIQEQDYLRSCQQFLWEKVQKGGRS,且3种肽段都可以与铅离子稳定螯合,其中半胱氨酸中的巯基在螯合过程中起重要作用。以上结果表明,对亚麻籽蛋白酶解工艺进行优化并富集,可以得到高巯基含量且能与铅离子螯合的半胱氨酸肽,提高亚麻籽榨油后副产物的利用率,并为亚麻籽蛋白源半胱氨酸肽缓解铅中毒的研究提供理论依据。
关键词:亚麻籽蛋白;半胱氨酸肽;正交试验;制备;结构鉴定
随着工业化和城市化的快速发展,有关铅污染问题已严重威胁公众的健康。铅(Pb)是人类最早使用的重金属之一,在环境中的长期积累使得其造成了广泛的环境污染。铅可以通过消化道、呼吸道及皮肤进入人体,通过引起氧化应激反应产生大量自由基,导致肾、肝、心脏、免疫和神经系统功能障碍,同时还会导致细胞损伤,如酶活性耗竭,以及对人体脂质双层结构和DNA的损伤[1,2]。现今治疗铅中毒主要依赖螯合疗法,然而美国国立研究院研究显示,传统的螯合剂普遍存在许多副作用和缺点,如血液钙水平异常降低和肾脏损害等[3]。因此,开发有效且安全的天然化合物用于防止铅在人体中过度积累具有重要意义。
亚麻籽是内蒙古地区的重要优势资源,富含α-亚麻酸(ALA)、亚麻籽胶、亚麻籽蛋白和木脂素等生物活性物质[4]。将亚麻籽制取油脂后可以得到具有高蛋白含量的亚麻籽饼[5]。研究证实,亚麻籽蛋白氨基酸组成较为均衡,且具有抗氧化、降血糖、降胆固醇、抗高血压、抗癌和免疫抑制等多种生理活性,是优质的植物蛋白资源[6-8]。但目前我国食品工业生产中的亚麻籽饼绝大多数被用作动物饲料,这导致大量优质植物蛋白资源的流失[9]。2020年被称做植物基食品的元年,植物蛋白的深加工应用在世界范围内备受关注,因此充分利用内蒙古特色资源亚麻籽蛋白,对其进行深度加工尤为重要。
研究表明,含有丰富半胱氨酸残基的多肽与重金属铅离子具有较高的亲和力,可以缓解重金属中毒,减轻机体损伤[10]。孙媛[11]研究发现从小麦面筋蛋白中分离出含半胱氨酸肽(HCPs)可以与铅离子结合,形成稳定结合物,并且在体外模拟消化实验中以高结合率与铅离子在胃肠道中进行结合以发挥其解毒作用。Ding等[12]研究发现,大米蛋白水解物中的巯基肽(TCPs)与Hg2+、Cd2+和Pb2+均可发生结合反应,其中TCPs与Pb2+的亲和力明显大于Hg2+和Cd2+。阮琼珠等[13]研究发现,大豆蛋白富含巯基,可通过结合铅离子阻止其对机体造成伤害,降低血液与骨头中铅含量,同时可以改善小鼠的营养状况,增强铅中毒小鼠的免疫力。除此之外还有谷胱甘肽(GSH)、金属硫蛋白(MTs)和植物螯合素(PCs),这些金属螯合肽与铅离子结合的主要机制也是与半胱氨酸残基进行配位[14]。亚麻籽蛋白中含有较多半胱氨酸,本实验室前期使用木瓜蛋白酶对其进行酶解,得到了巯基含量较高的亚麻籽蛋白酶解肽,但有研究表明,环境中的巯基极易被氧化形成二硫键从而失去活性,这种氧化反应在碱性环境中更易发生,在酸性条件下巯基更为稳定[15]。ProteaseM酶是一种酸性蛋白酶,可以在酸性环境下对亚麻籽蛋白进行酶解,然而其对酶解产物中巯基含量的影响尚未可知。因此本文以脱脂亚麻籽饼为原料提取蛋白,通过单因素正交试验对酶解工艺进行优化,获得巯基含量较高的亚麻籽蛋白酶解肽,进一步通过ThiopropylCrystarose6FastFlow共价色谱法从中富集亚麻籽蛋白源半胱氨酸肽,并对其进行结构鉴定,进一步采用分子对接技术,探究其与铅离子的螯合作用,为亚麻籽蛋白的深加工利用提供理论依据。
1材料与方法
1.1原料与试剂
低温脱脂亚麻籽饼(产自内蒙古自治区)、ProteaseM酶(46800U/g,最适pH3.0~3.5,最适温度50~55℃,购自日本天野酶制剂株式会社)、ThiopropylCrystarose6FastFlow凝胶(购自武汉晶诚生物科技股份公司);二硫苏糖醇(DTT)(购自上海麦克林生化科技有限公司)、三羟甲基氨基甲烷(Tris)(购自上海麦克林生化科技有限公司)、EDTA(购自天津市大茂化学试剂厂)、甘氨酸(购自北京索莱宝科技有限公司)、正己烷、氢氧化钠、盐酸等为分析纯(均购自国药集团化学试剂有限公司)。
1.2仪器与设备
UV-2300紫外线分光光度仪,YC-2超低温层析柜,HD-3紫外检测仪,HL-2B恒流泵,TAS-990型原子吸收光谱仪,FDU-2200型真空浓缩冷冻干燥机,Ultimate3000纳升液相色谱,Qexactive质谱仪,Kromasil100-5C18高效液相色谱。
1.3实验方法
1.3.1深度脱脂亚麻籽饼粉的制备
将亚麻籽粕去杂破碎过80目筛,称取样品置于烧杯中,以1:3(g/mL)的料液比加入正己烷,置于25℃水浴锅中,180r/min反应120min,反应结束后4000r/min离心15min取沉淀。重复以上操作两次,将沉淀取出晾干备用。
1.3.2亚麻籽分离蛋白的制备
将深度脱脂亚麻籽饼粉以1:20(g/mL)的比例加入蒸馏水搅拌均匀,调节pH至8.5,在50℃水浴锅中以200r/min匀速搅拌2h,4000r/min离心15min取上清液,调节上清液pH至4.2,再以4000r/min离心15min取沉淀,以1:20(g/mL)的比例加入蒸馏水,搅拌分散,再以4000r/min离心15min,反复操作两次洗涤沉淀,将最终沉淀加入适量蒸馏水调节pH至7.0,冷冻干燥备用。
1.3.3亚麻籽蛋白酶解物的制备及蛋白质回收率计算
取亚麻籽蛋白以1:50(g/mL)的比例加入超纯水搅拌均匀,调节溶液pH值,添加proteaseM酶在恒温水浴锅中以固定的温度开始酶解。酶解完成后,在85℃以上水浴灭酶15min,然后将其降温到室温,4000r/min离心20min,最后将其上清液收集,冰冻干燥备用。采用凯氏定氮法测定其蛋白含量,蛋白质回收率=上清液中总蛋白质含量/底物蛋白质含量×100%。
1.3.4单因素正交试验设计
以巯基含量为标准,分别对酶解温度(45、50、55、60、65℃)、pH(2.0、2.5、3.0、3.5、4.0)、酶解时间(3、4、5、6、7h)、酶添加量(400、900、1400、1900、2300U/g)进行单因素实验,确定各因素的最适值。以单因素实验为依据展开正交试验,进行对酶解工艺的优化。
1.3.5共价色谱法富集亚麻籽蛋白源半胱氨酸肽
取1.3.4中最佳工艺条件下制得的亚麻籽蛋白酶解肽0.1g,加入50mL超纯水搅拌均匀,用0.45μm滤膜对其进行过滤,制备上样样品。将凝胶用超纯水溶胀,用5~10个床体积的去离子水洗涤干净,并将其转移到色谱柱中,利用UV检测仪检测流出液在280nm处的吸光值。用0.05mol/LTris-HCl缓冲液(pH7.5)调节色谱柱环境,将过滤的样品进行上样,上样速度为5mL/min,上样结束后用上述Tris-HCl缓冲液进行清洗,直到流出液的吸光值低于0.1为止,使用20mmol/LDTT对其进行洗脱,吸光值发生改变开始收集洗脱液,收集的洗脱液使用1000u超滤管4000r/min离心20min,收集超滤液冷冻干燥。
1.3.6巯基含量测定
参照Ellman’s试剂法[16],称取15mg样品,用5mLTris-Gly缓冲液(每1L溶液中含有10.4gTris,6.9g甘氨酸,1.2gEDTA,pH8.0)溶解,加入0.1mLEllman’s试剂(0.2g2-硝基苯甲酸溶于50mLTris-Gly缓冲液),快速搅拌,在室温避光处反应1h,将反应后的试样以4000r/min离心10min,得到上清。在412nm(用无蛋白质样品的Tris-Gly缓冲剂作为对照)下测量上清液的吸光值。巯基含量计算公式:
式中:A412为样品在412nm处的最大吸光值;D为稀释系数;C为样品质量浓度(mg/mL)。
1.3.7铅离子螯合量测定
根据冯伟等[17]的方法,将100mg样品溶于10mL超纯水,磁力搅拌器搅拌1h使样品完全溶解,调节pH至7.5,加入铅标准溶液,再加入超纯水将溶液体积补充到20mL,使得溶液Pb2+的最终质量浓度为6mg/mL。调节水浴锅温度为37℃,以150r/min均速搅拌2h,反应结束后10000r/min离心3min,将上清液采用火焰原子吸收分光光度计测定Pb2+质量浓度。Pb2+螯合量(Qe)可参照下方公式计算。
式中:Qe为Pb2+螯合量/mg/g;C0为初始溶液中Pb2+的质量浓度/mg/L;C1为反应后溶液中Pb2+质量浓度/mg/L;m为亚麻籽蛋白质量/g;V为最终溶液体积/L。
1.3.8氨基酸序列测定
采用MALDI-TOF-MS/MS进行氨基酸序列测定,色谱柱为C18(3μm,100A)及AcclaimPePmap100(75μm×2cm),流动相:A相(0.1g/100mLFA水溶液)、B相(0.1g/100mLFA乙腈溶液)。将样品用体积分数50%乙腈溶解,过柱进行纯化处理,将纯化后的样品使用含有体积分数0.1%三氟乙酸超纯水溶解,使用体积分数50%乙腈溶解体积分数0.1%三氟乙酸和5mg/mLα-氰基-4-羟基肉桂酸,将其作为基质溶液与样品溶合(按照1:1比例)。取1μL上述混合溶液,将其分别点在Scorce384靶上,常温下风干进行检测。对样品的一级质谱进行350~2000u扫描,分辨率70000,得到MALDI-MS图,从图中选择出待测离子进行二级扫描,扫描范围依赖于一级母离子质荷比自动选择,NCEs为28%,分辨率17500,温度360℃,离子源电压1800V,以HCD碎裂模式进行分析,得到MALDI-MS/MS图谱,分析得到样品一级结构。
1.3.9分子对接
利用Modeller进行结构的模建。使用鉴定出的半胱氨酸肽序列通过PDB数据库搜索模板蛋白,运行脚本进行序列对比,而后进行三维结构的构建,通过Prochek得出的拉式图对蛋白结构进行评估,完成模型的构建,随后利用AutoDockVina软件进行分子对接,将铅离子对接到建立好的模型中,使用Pymol软件进行结构可视化查看及结构分析。
1.3.10数据处理
所有实验做3次平行,使用Origin2021处理图片,用SPSS17.0处理数据并进行显著性分析。
2结果与分析
2.1单因素试验结果分析
2.1.1酶解温度对酶解产物中巯基含量的影响
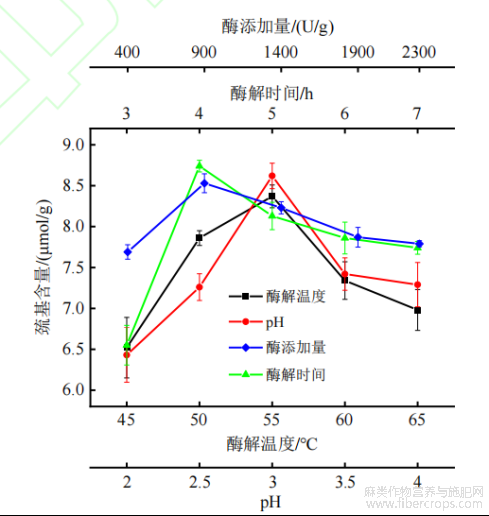
固定酶解pH为3.0、酶添加量900U/g和酶解时间5h,通过改变酶解温度,研究酶解产物中巯基含量的变化,温度依次为45、50、55、60、65℃,结果如图1所示。
图 1 不同酶解条件对酶解产物中巯基含量的影响
由图1可知,酶解产物中的巯基含量在45℃到55℃的温度变化中逐渐升高,当酶解温度为55℃时,酶解产物中巯基含量达到最高,为8.37μmol/g。随着酶解温度升高,体系内蛋白分子的运动速度加快,导致酶与亚麻籽蛋白碰撞几率增加[18],亚麻籽蛋白的酶解程度提高,可能导致更多的巯基暴露出来,因此酶解产物中巯基含量升高。酶解温度在55℃到65℃变化时,酶解产物中的巯基含量下降,这是因为proteaseM酶作为蛋白酶,其分子间的肽键具有特定的空间结构,反应温度升高,分子吸收能量过多会引起次级键解体,因此会丧失或部分丧失酶的活性,使得酶解速率下降[19],酶解产物的相对减少可能导致暴露出的巯基减少,产物中的巯基含量降低。因此,选择最适合的酶解温度为55℃。
2.1.2酶解pH对酶解产物中巯基含量的影响
固定酶解温度为55°C、酶添加量900U/g和酶解时间5h,改变酶解pH分别为2.0、2.5、3.0、3.5、4.0,其酶解产物中巯基含量的变化如图1所示。
由图1可以看出,在酶解pH从2.0到3.0变化时,酶解产物中的巯基含量逐渐增加,在酶解pH为3.0时达到最大值,为8.62µmol/g。但随着酶解pH的持续上升,酶解产物中巯基的含量呈现下降趋势。pH值对酶促反应的影响,主要体现在对酶活力的影响,体系过酸或过碱都会影响酶的活性,导致酶解反应无法达到最佳效果[20],而酶解程度的降低可能会导致暴露出的巯基减少。因此,选择3.0为最合适的酶解pH。
2.1.3酶解时间对酶解产物中巯基含量的影响
固定酶添加量为900U/g、酶解pH3.0和酶解温度55℃条件下,研究酶解时间对产物巯基含量的影响,酶解时间依次为3、4、5、6、7h,结果如图1所示。
从图1可以看出,酶解时间由3h增加到4h时,酶解产物的巯基含量上升,酶解4h时巯基含量达到8.74µmol/g。酶解反应开始时,亚麻籽蛋白扩散到溶液中与酶分子快速结合,酶解反应迅速[21],导致亚麻籽蛋白中的巯基快速暴露出来,巯基含量升高明显。随着酶解时间延长,产物浓度增加,由于产物对酶的抑制作用,使得酶的活力下降,酶解反应进行不彻底[22],可能导致酶解产物中暴露出的巯基减少,巯基含量呈缓慢下降趋势。因此,选择4h为最合适的酶解时间。
2.1.4酶添加量对酶解产物中巯基含量的影响
固定酶解为pH3.0、酶解时间5h和酶解温度55°C,研究酶添加量对酶解产物中巯基含量的影响,酶的添加量依次为400、900、1400、1900、2300U/g,结果如图1所示。
从图1可以看出,酶解产物中巯基含量在酶添加量从400U/g上升到900U/g的过程中迅速增加,在酶添加量较少的情况下,底物浓度较大,酶被底物饱和,故而酶解反应与酶添加量成正比,随着酶添加量的增加,酶解反应充分进行,暴露出的巯基也逐渐增加[23]。在酶添加量为900U/g时,巯基含量为8.53μmol/g,达到最高。但随着酶添加量的持续增加,酶解反应达到饱和状态,酶分子之间接触面变大且互相影响,降低酶分子与亚麻籽蛋白的反应效率[24],酶解反应效率的降低可能导致暴露出的巯基减少,因此酶解产物中的巯基含量呈现缓慢下降趋势。因此将900U/g作为酶的添加量。
2.2正交试验结果分析
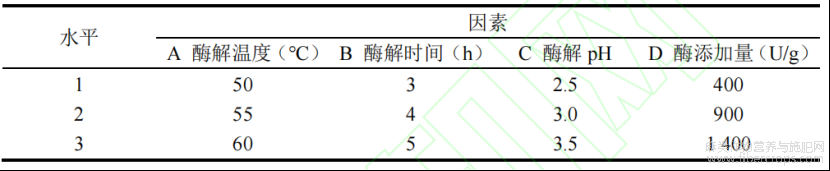
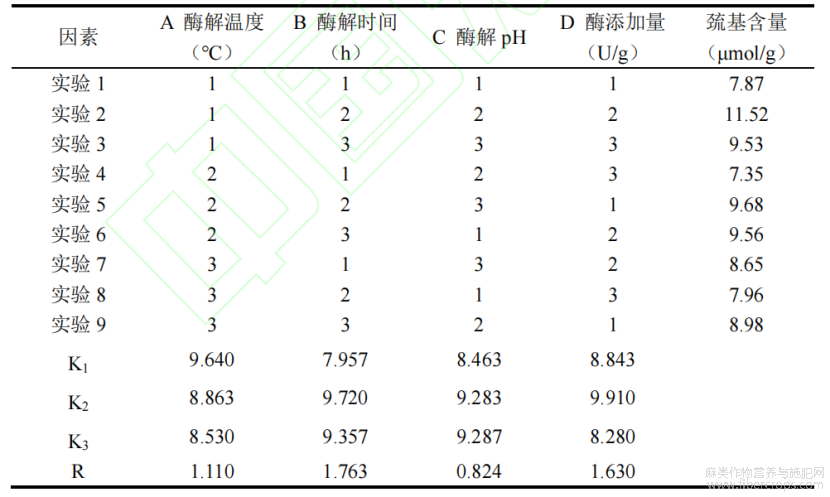
在上述单因素试验的基础上,用正交试验对酶解工艺条件进行优化。正交试验的因素水平列于表1中,在表2中列出了正交试验设计及结果。
表1正交试验因素水平
表2 正交试验设计与结果
由表2可以得知,四个因素对酶解产物中巯基含量的影响程度为B>D>A>C,即酶解时间>酶添加量>酶解温度>酶解pH,根据试验结果得出的最优预测水平关系为A1B2C3D2,即酶解温度50℃,酶解时间4h,酶解pH3.5,酶添加量900U/g。在上述条件下进行实验,对预测结果进行验证,得到酶解产物的巯基含量为13.37μmol/g。进一步对最适酶解条件下蛋白质的回收率进行分析,得到酶解产物的蛋白质回收率为34.78%。
2.3亚麻籽蛋白源半胱氨酸肽富集及巯基含量、铅螯合量测定
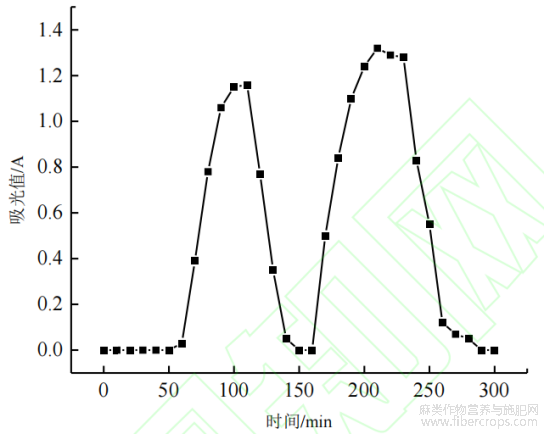
最优酶解条件下制得的亚麻籽蛋白酶解物中的半胱氨酸肽,通过ThiopropylCrystarose6FastFlow共价色谱法进行富集,富集实验的吸附及解吸曲线如图2所示,比较富集产物与蛋白及酶解肽的巯基含量和铅螯合量,结果见表3。
图2 Thiopropyl Crystarose 6 Fast Flow 共价色谱法吸附及解吸曲线
在富集实验进行过程中,每 10 min 记录一次流出液的吸光值变化情况,得到如图 2 所示的吸附与解吸曲线,取第二个峰的产物冷冻干燥,即为富集产物。
表3 巯基含量和铅螯合量对比
注:数据代表3个实验的平均值±标准差(n=3),每行不同字母表示差异显著(P<0.05)。
由表3可知,在经过单因素正交试验优化酶解条件后,亚麻籽蛋白酶解物的巯基含量增加,达到亚麻籽蛋白的2.01倍,铅螯合量达到1.79倍。经ThiopropylCrystarose6FastFlow共价色谱法得到的半胱氨酸肽,其巯基含量达到亚麻籽蛋白酶解肽的3.35倍之多,而铅螯合量是酶解肽的2.19倍。以上结果均表明采用共价色谱法能有效的对含巯基的肽段进行富集,得到铅螯合量较高的亚麻籽蛋白源半胱氨酸肽。
2.4亚麻籽蛋白源半胱氨酸肽一级结构鉴定
取上述富集产物,从中鉴定出3种含有半胱氨酸的肽段,其一级结构、分子质量及蛋白来源如表4所示。
表4结构鉴定表
由表4可知,3种肽段的分子质量在2000~4500u之间,其一级结构即氨基酸序列分别为WAIINLQHSGEGLCGRVV、CTGLLEAVAAALMMNIYIVGLNQLTDIE、QGGQGQQQQCEKQIQEQDYLRSCQQFLWEKVQKGGRS。
2.5肽Ⅰ、肽Ⅱ和肽Ⅲ与铅离子的分子对接
为了进一步确定亚麻籽蛋白源半胱氨酸肽与铅离子的螯合作用,本研究选用鉴定出的三条含有半胱氨酸的肽段,利用分子对接探究其与铅离子的螯合模式。
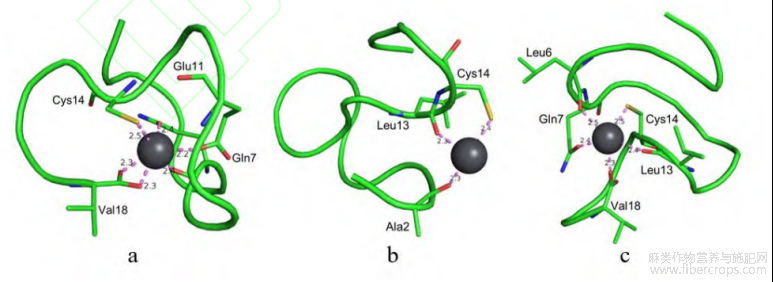
图3肽Ⅰ与铅离子的螯合模式
注:图中2.2~2.5分别表示肽链上各结合位点与铅离子的配位距离(×10-10m)。余同。
如图3所示,肽Ⅰ的氨基酸序列为WAIINLQHSGEGLCGRVV,它与铅离子的螯合模式主要有以上三种。图3a中,肽Ⅰ通过Cys14链上的S原子,以及Glu11、Gln7和Val18链上的O原子,与Pb2+间形成6组配位键,对接螯合能为-2.246kcal/mol;图3b中,肽Ⅰ通过Cys14链上的S原子,以及Ala2和Leu13链上的O原子,与Pb2+间形成3组配位键,对接螯合能为-2.168kcal/mol;图3c中,肽Ⅰ通过Cys14链上的S原子,以及Leu6、Gln7、Leu13和Val18链上的O原子,与Pb2+间形成5组配位键,对接螯合能为-2.149kcal/mol。
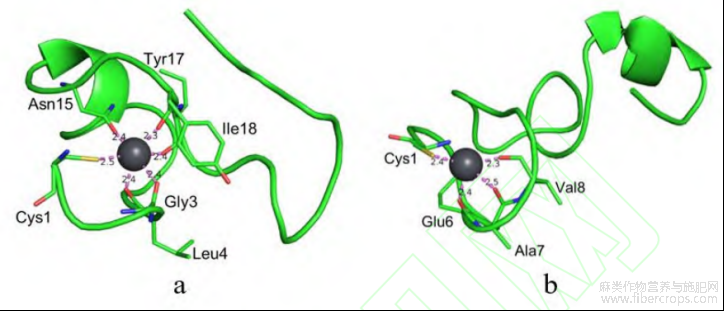
图4肽Ⅱ与铅离子的螯合模式
肽Ⅱ的氨基酸序列为CTGLLEAVAAALMMNIYIVGLNQLTDIE,如图4所示,它与铅离子的螯合模式主要有以上两种。图4a中,肽Ⅱ通过Cys1链上的S原子,以及Asn15、Gly3、Tyr17、Ile18和Leu4链上的O原子与Pb2+间形成6组配位键,对接螯合能为-2.209kcal/mol;图4b中,肽Ⅱ通过Cys1链上的S原子,以及Glu6、Ala7和Val8链上的O原子与Pb2+间形成4组配位键,对接螯合能为-2.088kcal/mol。
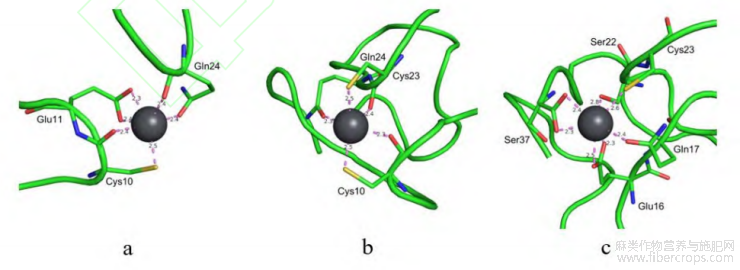
图 5 肽Ⅲ与铅离子的螯合模式
如图5所示,肽Ⅲ的氨基酸序列为QGGQGQQQQCEKQIQEQDYLRSCQQFLWEKVQKGGRS,它与铅离子的螯合模式主要有以上三种。图5a中,肽Ⅲ通过Cys10链上的S原子,以及Gln24、Glu11链上的O原子,与Pb2+间形成6组配位键,对接螯合能为-2.098kcal/mol;图5b中,肽Ⅲ通过Cys10链上的S原子、Cys23上的S原子,以及Cys23和Gln24链上的O原子,与Pb2+间形成5组配位键,对接螯合能为-2.025kcal/mol;图5c中,肽Ⅲ通过Cys23链上的S原子,以及Glu16、Glu17、Ser22和Ser37链上的O原子,与Pb2+间形成7组配位键,对接螯合能为-2.022kcal/mol。
结果表明,三种含有半胱氨酸的肽段均可以与铅离子进行螯合,且对接螯合能都为负值,表明其与铅离子的螯合状态稳定。其中,半胱氨酸在螯合作用中发挥重要作用,如肽Ⅰ提供的Cys14位点、肽Ⅱ提供的Cys1位点以及肽Ⅲ提供的Cys10、Cys23位点,都在螯合过程中提供了S原子。
3结论
本研究确定了亚麻籽蛋白的最佳酶解工艺,得到的酶解产物巯基含量达到亚麻籽蛋白的2.01倍,铅螯合量为1.79倍。富集后得到亚麻籽蛋白源半胱氨酸肽,巯基含量达到亚麻籽蛋白的6.74倍,铅螯合量为3.92倍。进一步对其进行结构鉴定,得到3种含有半胱氨酸的肽段,分别为WAIINLQHSGEGLCGRVV、CTGLLEAVAAALMMNIYIVGLNQLTDIE、QGGQGQQQQCEKQIQEQDYLRSCQQFLWEKVQKGGRS,三种肽段均可以与铅离子稳定螯合,且螯合过程中半胱氨酸的巯基发挥重要作用。综上,本研究证明了对亚麻籽蛋白酶解工艺进行优化并富集,可以得到高巯基含量且能与铅离子螯合的半胱氨酸肽,旨在提高亚麻籽榨油后副产物的利用率,并为亚麻籽蛋白源半胱氨酸肽作为解毒剂缓解铅中毒的研究提供理论依据。
参考文献
[1]IVAN S.Common mechanisms in nephropathy induced by toxic metals[J].Nephron,2006,104(3):107-114
[2]STOHS S J, BAGCHI D.Mechanisms in the toxicity of metal ions[J].Free Radical Biology and Medicine, 1995, 18(2):321-336
[3]SHARMA R, PANDITA A.Chelation in metal intoxication[J].Journal of Critical Reviews,2020, 7(10):828-832
[4]Qin X P, LI L B, YU X, et al. Comparative composition structure and selected techno-functional elucidation of flaxseed protein fractions[J]. Foods, 2022, 11(13):1820-1839
[5]王惠敏, 李茜, 蔡甜甜, 等. 亚麻籽粕抗氧化肽制备工艺的响应面法优化[J]. 食品工业科技, 2018, 39(3):220-225
WANG H M, LI X, CAI T T, et al. Optimization of preparation of antioxidant peptides from flaxseed meal by response surface methodology[J]. Science and Technology of Food Industry, 2018, 39(3):220-225
[6]SHARMA M, SAINI C S. Amino acid composition, nutritional profiling, mineral content and physicochemical properties of protein isolate from flaxseeds (Linum usitatissimum)[J]. Journal of Food Measurement and Characterization, 2022, 16(1):829-839
[7]TANG Z X, SHI L E, WANG X M, et al. Whole flaxseed-based products and their health benefits[J]. Food science and technology research, 2020, 26(5):561-578
[8]YULIA M, ELIZAVETA K, ANASTASIA A, et al. Anti-cancer properties of flaxseed proteome[J].Proteomes, 2023, 11(4):37-60
[9]李雪馨,郑睿,袁兴宇,等. 降胆固醇亚麻籽蛋白酶解肽的分离纯化及结构鉴定[J].中国油脂,2021,46(12):26-31+43
LI X X, ZHENG R, YUAN X Y, et al. Isolation and identification of peptide with cholesterol lowering activity derived from flaxseed protein[J]. China Oils and Fats, 2021,46(12):26-31+43
[10]SINGH A, WARD P O.Biodegradation and bioremediation (series: soil biology, vol.2)[J].Journal of Soils and Sediments,2004,4(3):204-209
[11]孙媛. 小麦面筋蛋白含半胱氨酸肽的分离富集及其与铅离子结合作用的研究[D]. 无锡: 江南大学, 2021:53
SUN Y. Separation and enrichment of cysteine-containing peptides fromwheat gluten and their binding interaction with Pb2±[D]. Wuxi: Jiangnan University, 2021:53
[12]Ding X Z, Hua Y F, Chen Y M, et al. Heavy metal complexation of thiol-containing peptides from soy glycinin hydrolysates[J]. International Journal of Medical Students, 2015, 16(4):8040-8058
[13]阮琼珠, 李称, 刘静文, 等. 大豆蛋白、苹果果胶及维生素C 排铅效果的探究[J].工业 微生物, 2019, 49(4):16-20
RUAN Q Z, LI C, LIU J W, et al. Effects of soy protein, apple pectin and vitamin C on lead removal[J]. Industrial Microbiology, 2019, 49(4):16-20
[14]DESILVA T M, VEGLIA G, PORCELLI F, et al. Selectivity in heavy metal-binding to peptides and proteins[J]. Biopolymers, 2010, 64(4):189-197
[15]陈海桥,张彩猛,华欲飞,等.蒜素与大豆蛋白源巯基肽的二硫键结合物的制备及其表征[J]. 食品与发酵工业,2016,42(8):75-80
CHEN H Q, ZHANG C M, HUA Y F, et al. Preparation and characterization of conjugates of allicin and thiol-containing peptides from soy protein[J]. Food and Fermentation Industries, 2016,42(8):75-80
[16]BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J]. Food Research International, 2003, 36(8):787-795
[17]冯伟, 范大明, 董田田, 等. 不同米蛋白组分与铅的结合规律[J]. 食品与生物技术学报, 2021, 40(12): 52-58
FENG W, FAN D M, DONG T T, et al. Studyon binding behaviorsof leadto different insoluble rice proteins[J]. Journal of Food Science and Biotechnology, 2021, 40(12): 52-58
[18]邓乾春, 陈春艳,潘雪梅,等. 白果活性蛋白的酶法水解及抗氧化活性研究[J].农业工程学 报,2005,21(11):155-159
DENG Q C, CHEN C Y, PAN X M, et al. Enzymatic hydrolysis of ginkgo albumin protein and its antioxidant activity[J]. Transactions of the Chinese Society of Agricultural Engineering, 2005,21(11):155-159
[19]曹方.玉米黄粉蛋白的酶法水解工艺[J]. 大连工业大学学报, 2003, 22(1):36-39
CAO F.Enzymatic hydrolysis technology for corn gluten meal[J]. Journal of Dalian Polytechnic University, 2003, 22(1):36-39
[20]史德青, 齐崴, 何志敏, 等. 胰蛋白酶水解牛血清白蛋白过程集总动力学研究[J]. 石油大学学报(自然科学版), 2003, 27(3):84-87
SHI D Q, QI W, HE Z M, et al. Lumpingkinetic model for tryptic hydrolysis of bovine serum albumin[J].Journal of China University of Petroleum(Edition of Natural Science), 2003,27(3):84-87
[21]张娅俐,洪晶, 张棚,等. 胰蛋白酶水解羊血清蛋白工艺研究[J]. 西北民族大学学报(自然科学版), 2022, 43(1):40-46
ZHANG Y L, HONG J, ZHANG P, et al. Technology researches on serum protein of Tibetan sheepwith trypsin hydrolysis method[J]. Journal of Northwest Minzu University(Natural Science Edition), 2022, 43(1):40-46
[22]孙冰玉,石彦国,朱会芳.木瓜蛋白酶提高醇法大豆浓缩蛋白乳化性的研究[J].食品科学, 2006, 27(12):505-508
SUN B Y, SHI Y G, ZHU H F. Modifying alcohol leaching soy protein concentrate to improve emulsibility by papain[J].Food Science, 2006,27(12):505-508
[23]王硕,木泰华,李鹏高. 胃蛋白酶水解甘薯蛋白制备血管紧张素转化酶抑制肽的研究[J]. 食品科技, 2011, 36(8):2-7
WANG S, MU T H, LI P G. Prepration of angiotensin I-converting enzymeinhibitory peptide from sweet potato protein by optimizationof pepsin hydrolyzation[J]. Food Science and Technology, 2011, 36(8):2-7
[24]单钱艺, 沈岳明, 张明兴, 等. 正交试验优化超声波-复合酶水解法提取中华鳖油的工艺[J]. 食品工业科技, 2022, 43(22):256-264.
SHAN Q Y, SHEN Y M, ZHANG M X, et al. Optimization of ultrasonic-compound enzyme hydrolysis method for extracting Chinese softshell turtle oil by orthogonal experiment[J]. Science and Technology of Food Industry, 2022, 43(22):256−264.
文章摘自:关心语,包小兰.具有铅离子螯合作用的亚麻籽蛋白源半胱氨酸肽的制备及结构鉴定[J/OL].中国粮油学报,1-15[2024-07-01].https://doi.org/10.20048/j.cnki.issn.1003-0174.000865.