摘 要:亚麻籽作为功能性食品原料,富含α-亚麻籽酸、优质蛋白质、可溶性多糖、木酚素等活性脂质伴随物,极具营养价值和开发利用潜力。以亚麻籽乳为研究对象,探究不同热杀菌条件(65℃-30min,85℃-15min和95℃-15s)对亚麻籽乳理化稳定性的影响,重点聚焦体系中油脂体界面特性的变化。研究结果表明:热杀菌处理后,亚麻籽乳的平均粒径逐渐增加了95.58%(P<0.05),Zeta电位绝对值逐渐减小了12.26%(P<0.05),并伴随着乳液黏弹特性减弱和物理稳定性提高。热杀菌后,亚麻籽乳中油脂体界面蛋白质量比增加64.42%(P<0.05),总糖质量比增加97.95%(P<0.05),冷场电镜成像则进一步证实外源性贮藏蛋白和可溶性多糖在油脂体界面的吸附。此外,热杀菌处理还增加了亚麻籽乳中油脂体界面总酚含量增加了1.42倍(P<0.05),黄酮含量增加了4.94倍(P<0.05),以及1,1-二苯基-2-苦基肼(DPPH)自由基清除能力增加了4.64倍(P<0.05),FRAP铁离子还原能力增加了54.05%(P<0.05)。适宜热杀菌处理(85℃-15min)能够基于油脂体界面组成结构的重组,提升亚麻籽乳物理和化学稳定性,希望为进一步拓宽亚麻籽摄入形式和应用场景提供一定的理论依据。
关键词:热杀菌;亚麻籽乳;理化稳定性;油脂体;界面组成
亚麻是我国主要的油料作物之一,富含n-3系列唯一必需脂肪酸—α-亚麻酸(α-linolenic acid, ALA),占亚麻籽油的45%~50%[1,2]。亚麻籽含20%~30%高质量蛋白质和9%~14%可溶性膳食纤维,兼具优越的功能特性和多种营养健康效应[3,4]。与其他谷物相比,亚麻籽含有75~800倍高的木酚素,还是维生素、矿物质以及酚酸类化合物的重要来源[2,5]。因此,亚麻籽作为一种功能性食品原料,极具营养价值和开发利用潜力。
目前,亚麻籽全籽化产品比较单一,主要包括亚麻籽全籽、亚麻籽全籽粉、部分脱脂亚麻籽粉、亚麻籽酱等[6]。将亚麻籽加工成全籽乳添加到植物乳饮料中,可以实现亚麻籽的全利用和营养组分间的协同增效作用[7]。热杀菌处理是植物乳生产过程中影响乳液理化稳定性的关键环节。Zaaboul等[8]研究表明,烘烤花生乳经超高压灭菌或巴氏灭菌后,油脂体发生聚集,乳液黏度增加且稳定性提高。Chen等[9]研究烘烤和煮沸对山茶籽油脂体结构及稳定性的影响,结果发现热处理通过降低油脂体界面蛋白表面疏水性,诱导蛋白质变构,进而提高了油脂体稳定性。Yan等[10]与Fu等[11]研究发现,热处理(65~100℃)豆乳诱导油脂体界面蛋白部分变性和展开,进而显著提升了豆乳油脂体的储藏稳定性。因此,不同热处理对油脂体结构和稳定性的影响表现出了明显的植物乳体系的特异性。
对于全籽乳或单一油脂体乳液而言,适宜热处理能够灭活油脂体界面脂肪酶,调节界面膜蛋白的空间构象,促进连续相中的贮存蛋白适度变性,并以特定聚集体的形式吸附在油脂体界面,实现正向影响乳液流变特性和理化稳定性的目的[12]。为寻求适宜的亚麻籽乳热处理方式尤为必要,本研究拟探讨不同模拟热杀菌对亚麻籽乳理化稳定性的影响规律,通过分析一步离心提取油脂体界面组成结构确定热处理关键参数,希望能进一步拓宽载运n-3脂肪酸的植物乳饮料的应用前景。
1 材料与方法
1.1材料与试剂
亚麻籽,甘肃省农科院作物研究所提供;福林酚(质量分数≥98.5%)、1,1-二苯基-2-苦基肼(DPPH)(质量分数≥98.5%),麦克林生化科技有限公司;三吡啶基三嗪(Tripyridyltriazine, TPTZ)(质量分数≥98%)、SDS-PAGE凝胶制备试剂盒、二喹啉甲酸(bicinchoninicacid, BCA)蛋白质测定试剂盒,上海碧云天生物技术有限公司;芦丁(质量分数≥98%),上海源叶生物技术有限公司;没食子酸(质量分数≥98.5%),北京索莱宝生物科技有限公司;水溶性维生素 E(trolox)(质量分数≥98%),美国 Sigma 公司;亚硝酸钠、硝酸铝、氢氧化钠、浓硫酸、正己烷、无水乙醇、甲醇等,国产分析纯,上海国药集团化学试剂有限公司。
1.2仪器与设备
L18-Y968 型真空破壁机,山东九阳电器有限公司;Scientz-10N 型冷冻干燥机,宁波新芝生物科技股份有限公司;Allerga 64R 型台式高速离心机,美国Beckman公司;Turbiscan 型多重光散射仪,法国 Formulaction 公司;Rheolaser Master 型光学微流变仪,法国Formulaction 公司;Zetasizer Nano-ZS90 型激光粒度仪,英国Malvern Panalytical公司;Multiskan GO型全波长酶标仪,美国Thermo Fisher Scientific公司;Discovery HR-1型旋转流变仪,美国TA仪器公司;Regulus 8100 型高分辨率场发射扫描电子显微镜,日本 Hitachi 公司;PP3010T 型冷冻传输装置,英国Quorum公司;164-5050 型电泳仪、ChemiDoc XRS 型高灵敏度化学发光成像系统,美国Bio-Rad公司。
1.3实验方法
1.3.1亚麻籽乳的制备
参考Yu等[13]方法并稍加修改。将100 g亚麻籽与去离子水按料液比(g/mL)1:10混合,使用磁力搅拌水浴锅在40℃条件下搅拌2h,过滤弃去上清后获得脱胶亚麻籽,再按1:8(g/mL)加入去离子水,使用真空破壁机在果蔬汁模式(32000r/min,2min)下磨浆,两层纱布过滤获得亚麻籽乳,4℃贮藏备用。
1.3.2亚麻籽乳热杀菌处理
取200mL亚麻籽乳于500mL烧杯中进行热杀菌处理,为保证乳体系受热均匀性,处理过程中需同时进行低速磁力搅拌(200r/min)。热杀菌处理参数为乳制品常用的巴氏杀菌条件,分别为65℃-30min、85℃-15 min和95℃-15s,测量亚麻籽乳中心温度,达到设定温度后开始计时,热杀菌处理完成后,快速冷却至室温备用。
1.3.3亚麻籽乳平均粒径和Zeta电位的测定
分别取热杀菌前后的亚麻籽乳样品稀释100倍,混匀后取1mL置于样品池中,在室温下使用激光粒度分析仪测定乳液平均粒径和Zeta电位,亚麻籽乳折射率设为1.490,去离子水的折射率设为1.330,每个样品重复测定3次。
1.3.4亚麻籽乳物理稳定性的测定
参考Yu等[14]的方法,分别取热杀菌前后的亚麻籽乳于样品瓶中,借助多重光散射分析仪分析亚麻籽乳液的Turbiscan动力学稳定性(TSI)和背散射光参比值(ΔBS)。具体测试条件:上样量18mL,扫描频率25s/次,扫描时间1800s,测定温度4℃。
1.3.5亚麻籽乳油脂体微观结构的观察
参考Nie等[15]的方法,采用低温制备系统和高分辨率场发射扫描电子显微镜(FE-SEM)观察亚麻籽油脂体的微观形态。具体为,取2.0μL亚麻籽油脂体在液氮中冷冻后,转入冷冻制备室,切成截面,然后在-80℃、1.3×10-4Pa升华8min。5mA的条件下镀金90s后,样品在3kV下使用FE-SEM进行观察。
1.3.6亚麻籽乳油脂体乳流变特性的测定
参考Yu等[14]的方法,利用动态剪切流变仪分别测定亚麻籽油脂体乳液的表观黏度。测试条件:夹具直径40mm,夹缝间隙0.5mm,测试温度2℃,剪切速率0.1~10s-1。在0.1~10s-1的剪切速率下测定亚麻籽乳的表观黏度,在0.1~10Hz测定亚麻籽乳的储能模量(G’)和损耗模量(G’’)。利用光学微流变仪测定样品的微流变特性。取20mL样品于圆柱形玻璃样品池中,扫描频率10min/次,扫描时间4h,测定温度25℃。
1.3.7亚麻籽乳中油脂体提取和基本组成分析
取适量热杀菌前后的亚麻籽乳于离心管中,4℃、11190r/min离心20min,取上层膏状物即为油脂体,4℃冰箱保存备用。对新鲜提取的油脂体进行基本成分的测定,参照GB 5009.5-2016第一法凯氏定氮法对油脂体蛋白质质量分数进行测定。采用苯酚硫酸法,以葡萄糖标准品制备标准曲线,计算样品总糖质量分数[16]。
油脂体蛋白质的提取参照Sun等[17]的方法。将冷冻干燥后油脂体加入3倍体积的石油醚,以去除中性脂质,8460r/min离心15min收集白色沉淀,重复2次。将所得残留物与3倍体积氯仿-甲醇(体积比2:1)混合,8460r/min离心15min,获得蛋白质沉淀,氮吹后冷冻干燥,获得乳油脂体蛋白。参考Yu等[14]的方法,取适当样品,加入离子水配制成质量分数为0.5%蛋白分散液,使用BCA蛋白质测定试剂盒对蛋白质含量进行定量,调整蛋白质质量浓度至1.5mg/mL,与5×SDS上样缓冲液以体积比4:1(mL/mL)混合均匀后进行热变性处理,置于SDS-PAGE电泳,用质量分数0.1%考马斯亮蓝染色液染色1h,脱色后使用ChemiDoc XRS+成像系统观察。
1.3.8亚麻籽乳油脂体中酚类化合物和体外抗氧化活性的测定
酚类化合物提取:参考Nie等[15]方法并稍加修改。称取0.1g冷冻干燥后的油脂体,加入5mL体积分数80%的甲醇水溶液,涡旋2min,超声10min,重复2次,然后4000r/min离心20min,取上清液,4℃避光保存备用。采取Folin-Ciocalteu比色法测定样品中总多酚含量,mg/100g(以没食子酸质量计)。采用硝酸铝比色法测定样品中总黄酮含量,mg/100g(以芦丁质量计)[18]。
DPPH自由基清除能力的测定:吸取40μL酚类化合物提取液,加入260μL DPPH工作液(38.0µg/mL),室温孵育30min,于517nm处测定吸光度,测定样品中DPPH自由基清除能力,mg/g(以Trolox质量计)[19]。FRAP铁离子还原能力的测定:采用FRAP法测定样品油脂体提取物总抗氧化能力。取1.0mL酚类化合物提取液和2mLFRAP工作液双蒸水定容至10mL,旋涡混匀,避光室温静置20min,于593nm处测定吸光度,测定样品中FRAP铁离子还原能力,mg/g(以FeSO4·7H2O质量计)[20]。
1.4数据处理
实验结果以平均值±标准差表示(n=3)。使用SPSS 21.0软件进行统计学分析,Tukey检验对数据进行比较,显著性水平设定为P<0.05,采用Origin 2021软件绘图。
2 结果与分析
2.1热杀菌处理对亚麻籽乳平均粒径和Zeta电位的影响
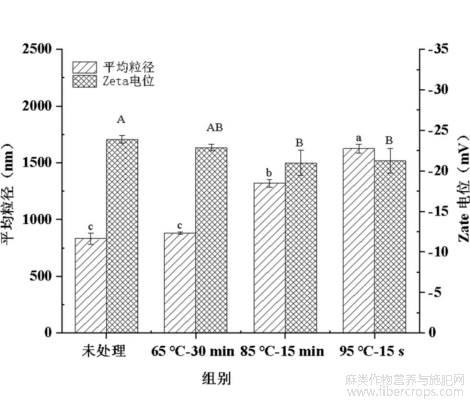
图1为热杀菌处理对亚麻籽乳的平均粒径和Zeta电位的影响。由图1可知,未处理组亚麻籽乳的平均粒径为831.40nm;热杀菌处理后,亚麻籽乳的平均粒径逐渐增加,其中热处理9℃-15s时达到最大值(1626nm),与未处理组相比显著增加了95.58%(P<0.05)。这可能是因为热处理使连续相中贮藏蛋白更易发生聚集,并部分吸附在油脂体表面,从而使乳液体系中胶体粒子的尺寸增加[21]。未处理组亚麻籽乳Zeta电位值为-23.90mV,经热杀菌处理后亚麻籽乳Zeta电位绝对值逐步降低,其中热处理85℃-15min时达到最小值(-20.97nm),与未处理组相比显著降低了12.26%(P<0.05)。事实上,热处理过程中,乳液体系中油脂体蛋白和连续相中贮藏蛋白空间构象的改变,以及进一步的热聚集行为可能会影响蛋白质分子内部氨基酸残基暴露,最终表现为暴露的携带负电荷氨基酸的残基数量减少,从而使乳液体系中胶体粒子表面电荷密度降低[11,22]。
图1热杀菌处理后亚麻籽乳平均粒径及Zeta电位的变化
不同小写字母表示各组平均粒径差异显著(P<0.05),不同大写字母表示表示各组Zeta电位差异显著(P<0.05)。
2.2热杀菌处理对亚麻籽乳物理稳定性的影响
TSI是评定乳液物理稳定的重要参数之一,TSI曲线斜率越小,则表明乳液物理稳定性越好;反之,则物理稳定性越差。图2为热杀菌处理对亚麻籽乳物理稳定性的影响。由图2(a)可知,未处理组亚麻籽乳TSI和斜率最大,表明随着测量时间的增加,乳液失稳现象会凸显;经热杀菌处理后,亚麻籽乳的TSI逐渐减小,基本稳定在0.3以下,明显低于未处理组。其中,热处理95℃-15s的TSI最低,且斜率也明显低于65℃-30min和85℃-15min组,表明在该处理参数下亚麻籽乳物理稳定性的改善效果最为明显。由图2(b)可知,未处理组亚麻籽乳的背散射光参比值(ΔBS)曲线波动较大,在0~2mm范围内出现小幅下移,37~38mm曲线上移,说明乳液脂滴出现上浮,且ΔBS曲线在3~37 mm出现大范围波动,这可能归因于乳液中部发生絮凝现象[23]。热处理65℃-30min组亚麻籽乳仅在测量池底部0~1mm和上部37~40mm处的ΔBS曲线出现较大幅度的变化,这可能是由于热处理时间较长导致乳液中油脂体发生聚集,从而导致乳液出现脂滴上浮现象,但仍明显优于未处理组。相比较而言,热处理85℃-15min和95℃-15s组亚麻籽乳在测量池底部和上部的ΔBS曲线无明显变化,未表现出明显的脂滴上浮和絮凝物沉降等,进一步支撑了这两组TSI的测定结果。这可能是因为随着热处理温度的升高和时间的缩短,油脂体界面和连续相蛋白发生聚集,形成了牢固紧密的结构,进而抑制了乳液的分层[24]。
图2热杀菌处理后亚麻籽乳物理稳定性的变化
2.3热杀菌处理对亚麻籽乳微观结构的影响
图3为热杀菌处理对亚麻籽乳微观结构的影响。由图3可知,未处理组亚麻籽乳中油脂体粒径较小,表面略粗糙,连续相的片层状结构较完整,并部分包裹在油脂体表面,这与Qin等[25]研究结果相似;经65℃-30min热处理后,亚麻籽乳中油脂体的尺寸明显增加,表面被包裹着更多的薄翼状的片层状结构,同时连续相片层趋于疏松多孔状,并出现塌陷和破裂;进一步增加热处理温度至85℃时,亚麻籽乳中油脂体尺寸进一步增大,且表面蛋白质沉积明显且趋于颗粒状;当热处理温度升高至95℃时,亚麻籽乳中油脂体表面蛋白质沉积量进一步增加,油脂体被大量蛋白质包裹且趋于皱缩和孔隙化,同时连续相的片层面结构也进一步瓦解。因此热处理过程中,亚麻籽乳中连续相贮藏蛋白(或与可溶性多糖复合物)更趋于吸附在油脂体表面,以类Pickering乳滴形式存在。
图3热杀菌处理后亚麻籽乳微观结构的变化
图中圆圈标出的为油脂体,下方为油脂体部分的放大图。
2.4热杀菌处理对亚麻籽乳中油脂体剪切特性的影响
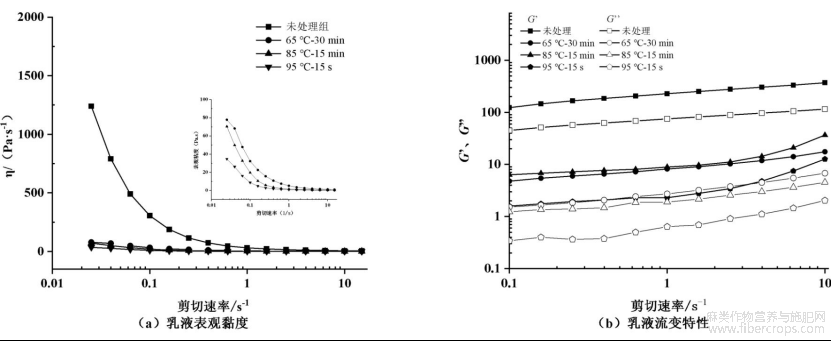
进一步对亚麻籽乳中油脂体进行一步提取分离,以更真实地进行流变学和组成结构的表征。图4为模拟热杀菌处理对亚麻籽乳中油脂体剪切流变特性的影响。由图4(a)可知,未处理组油脂体乳液的初始表现黏度为1239.74Pa·s,随着剪切速率的不断增大(0.01~10s-1),油脂体乳液的表观黏度逐渐降低后趋于稳定,呈现剪切稀变的非牛顿流体特性[26]。随着热处理条件的引入,油脂体乳液的初始剪切黏度逐渐降低,其中65℃-30min处理组降低至77.81Pa·s,85℃-15min处理组为70.37Pa·s,95℃-15s处理组达到最小值,34.58Pa·s,Qin等[25]在微波处理亚麻籽后制备的亚麻籽乳中出现了类似现象。由图4(b)可知,未处理组与热处理组乳中油脂体的储能模量(G’)和损耗模量(G’’)均随剪切速率的增加而增加,且G’均高于G’’,表明该乳液体系的弹性特征大于黏性特性。热处理65℃-30min和85℃-15min时,油脂体乳液的G’与G’’显著降低;热处理95℃-15s时,油脂体乳液的G’与G’’最低,表明该条件下油脂体乳液的黏弹性显著降低。在热处理过程中,贮藏蛋白与可溶性多糖之间形成的网络结构降低了油-水界面张力,使得油脂体界面膜结构发生改变,从而降低了油脂体乳液的黏弹性[27]。
图4热杀菌处理后亚麻籽乳中油脂体剪切流变特性的变化
2.5热杀菌处理对亚麻籽乳中油脂体界面基本组成和蛋白亚基形式的影响
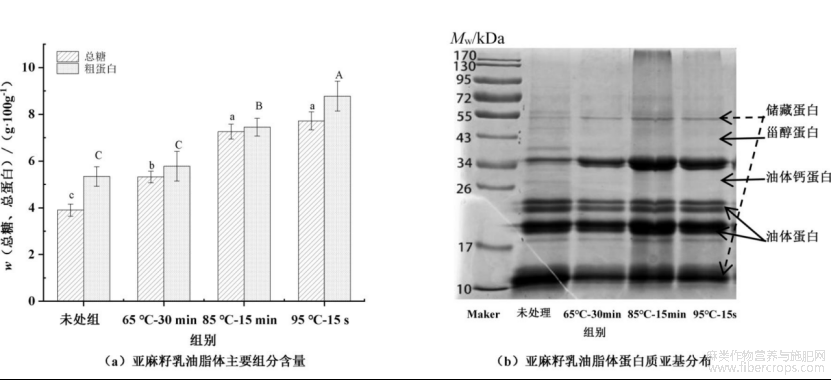
图5为热杀菌处理对亚麻籽乳中油脂体主要组分含量和蛋白亚基形式的影响。由图5(a)可知,未处理组亚麻籽乳中油脂体中总糖和粗蛋白质量比分别为3.90g/100g和5.34g/100g。经不同热处理后油脂体中总糖和粗蛋白质量比呈持续上升趋势,热处理95℃-15s组总糖和粗蛋白质量比达到最大值分别为7.72g/100g和8.78g/100g,较未处理组显著增加了97.95%和64.42%(P<0.05),且表现出明显的热处理温度-时间效应关系。已有研究表明,即使历经多次分离纯化,亚麻籽油脂体中依然存在外源性贮藏蛋白的驻留,这可能归因于亚麻籽中蛋白体与环绕蛋白体的油脂体之间的紧密连接,致使油脂体界面膜蛋白与贮藏蛋白之间存在天然且较强的交互作用[28]。随着热处理温度的升高,由于分子碰撞强度增加诱导油脂体与贮藏蛋白交互作用,并可能发生热变构和聚集[10,11,23]。此外,油脂体界面总糖含量的增加可能是因为热处理下贮藏蛋白变构、与可溶性多糖交互作用增强以及进一步界面共迁移导致[24]。
由图5(b)可知,未处理组分离提取的油脂体中主要由15~26kDa的油体蛋白组成,其次为35kDa的油体钙蛋白。此外,由于油脂体提取过程中未进行多次水洗,在45~55kDa条带上鉴定出一定量的贮藏蛋白[12]。热处理65℃-30min组分离提取的亚麻籽油脂体中10kDa和35kDa的贮藏蛋白条带较未处理组逐渐减弱,55kDa的蛋白条带逐渐增强。随着热处理温度从85℃-15min增加至95℃-15s后,分离提取的油脂体中10kDa和35kDa的贮藏蛋白条带逐渐增强,并持续存在55kDa的蛋白条带。因此,贮藏蛋白中,清蛋白组分能够基于天然非共价交互作用,而存在于天然油脂体界面,而球蛋白组分则随着热处理温度的增加,因部分变性和空间构象的展开以及分子碰撞增强,倾向于向油脂体界面迁移[11]。总之,热处理促进了连续相中贮藏蛋白-可溶性多糖复合物向油脂体的迁移和界面吸附,进而影响油脂体的组成结构和稳定性。
图5热杀菌处理后亚麻籽乳油脂体主要组分含量和蛋白亚基形式的变化
不同小写字母表示各组总糖差异显著(P<0.05),不同大写字母表示表示各组粗蛋白含量差异显著(P<0.05)。
2.6热杀菌处理对亚麻籽乳油脂体中酚类化合物含量及抗氧化活性的影响
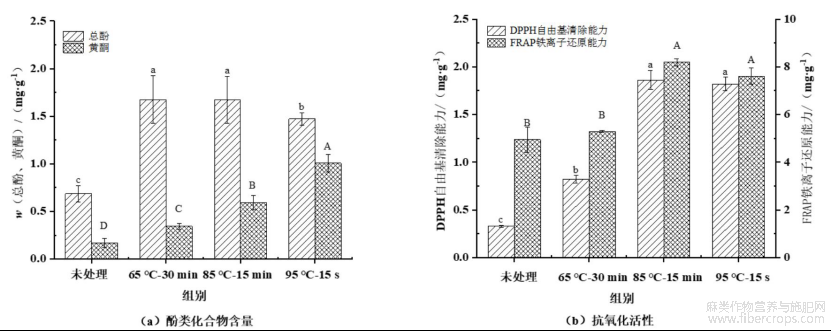
图6为热杀菌处理对亚麻籽乳中油脂体总酚、黄酮含量和抗氧化活性的影响。由图6(a)可知,未处理组亚麻籽乳的油脂体中总酚和黄酮质量比分别为0.69 mg/g和0.17 mg/g。与未处理组相比,经过热杀菌处理后,油脂体中总酚质量比呈先显著增加后降低的趋势,在65℃-30min时达到最大值1.67mg/g,显著增加了1.42倍(P<0.05)。相比较而言,而黄酮质量比则呈持续且显著增加趋势,在95℃-15s组时达到最大值1.01mg/g,与未处理组相比显著增加了4.94倍(P<0.05)。
亚麻籽中多酚类化合物主要包括以开环异落叶松树脂酚二葡萄糖苷多聚体形式存在的木酚素大分子,以及游离态没食子酸、对香豆素酸、阿魏酸等。作为亚麻籽中主要黄酮类化合物——草棉黄素糖苷直接与3-羟基-3-甲基-戊二酸连接,参与构成木酚素大分子的骨架结构[29]。当热处理条件为65℃-30min和85℃-15min时,油脂体界面蛋白发生的构象改变可能更适宜与酚类化合物发生交互作用,进而发生界面驻留,当热处理条件为95℃-15s时,界面蛋白变构的加剧可能促进了酚类化合物尤其是游离态酚酸发生界面解吸附,进而迁移至连续相贮藏蛋白-可溶性多糖复合物中[30]。不同热处理条件下,油脂体界面蛋白的变构如何更利于与木酚素大分子发生特异性交互作用,进而导致界面处黄酮类化合物的持续性驻留仍需进一步被探究。
由图6(b)可知,未处理组亚麻籽乳分离提取所得油脂体DPPH自由基清除能力为0.33mg/g,FRAP铁离子还原能力4.94mg/g。经过不同热杀菌处理后,与未处理组相比DPPH自由基清除能力在85℃-15min时达到最大值1.86mg/g,增加了4.64倍(P<0.05);FRAP铁离子还原能力在95℃-15s组时达到最大值7.61mg/g,与未处理组相比显著增加了54.05%(P<0.05),整体上表现出明显的热处理温度-时间效应关系。值得注意的是,与85℃-15min处理组相比,95℃-15s处理组油脂体的DPPH自由基清除能力无明显变化、及FRAP铁离子还原能力的轻微降低的结果进一步支撑了油脂体界面重塑和酚类化合物的界面解吸附现象,但其抗氧化活性仍明显高于未处理组。另外,不同热处理组油脂体总酚含量与DPPH自由基清除能力、FRAP铁离子还原能力的不一致性表明,界面处酚类化合物特定存在形态,而非总吸附量最终决定了提取分离的亚麻籽油脂体的抗氧化活性。已有研究发现,适宜热杀菌处理下酚类化合物在重组油脂体界面的滞留能够显著增加亚麻籽油脂体的抗氧化活性,抑制胃肠道消化过程中ALA氧化损耗,进而增加ALA生物可及性[24]。
图6热杀菌处理后亚麻籽乳中油脂体酚类化合物含量和抗氧化活性的变化
不同小写字母表示各组总酚含量差异显著(P<0.05),不同大写字母表示表示各组黄酮含量差异显著(P<0.05)。不同小写字母表示各组DPPH差异显著(P<0.05),不同大写字母表示表示各组FRAP含量差异显著(P<0.05)。
3 结论
本研究探讨了不同模拟热杀菌处理对亚麻籽乳理化稳定性的影响,并聚焦油脂体界面特性的改变。结果发现,随着模拟热杀菌温度升高,亚麻籽乳的平均粒径增加,Zeta电位绝对值减小,乳液物理稳定性提高。进一步研究显示,经热处理后油脂体界面总糖和粗蛋白含量呈持续上升趋势,在95℃-15s条件下达到最大值;微观结构观察证实了热处理诱导外源性贮藏蛋白和可溶性多糖参与了油脂体膜的重塑,进而实现了对亚麻籽乳稳定性的正向调控。此外,热处理还能够实现亚麻籽乳连续相中多酚和黄酮类化合物的界面迁移,以及抗氧化活性的大幅提升。适宜模拟热杀菌处理能够基于油脂体界面重塑显著改善亚麻籽乳的理化稳定性。
参考文献
[1] GOYAL A, SHARMA V, UPADHYAY N, et al. Flax and flaxseed oil: an ancient medicine & modern functional food[J]. Journal of Food Science and Technology, 2014, 51(9): 1633-1653.
[2] ZHANG S, CHEN Y S, JULIAN MCLEMENTS D, et al. Composition, processing, and quality control of whole flaxseed products used to fortify foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 22(1): 587–614.
[3] 禹晓, 黄沙沙, 聂成镇, 等. 亚麻籽胶结构及功能应用研究进展[J]. 食品研究与开发, 2020, 41(1): 212-217.
[4] RABETAFIKA H N, VAN REMOORTEL V, DANTHINE S, et al. Flaxseed proteins: food uses and health benefits[J]. International Journal of Food Science & Technology, 2011, 46(2): 221-228.
[5] KAJLA P, SHARMA A, SOOD D R. Flaxseed: a potential functional food source[J]. Journal of Food Science and Technology, 2015, 52(4): 1857-1871.
[6] MORITA H, SHISHIDO A, MATSUMOTO T, et al. Cyclolinopeptides B - E, new cyclic peptides from Linum usitatissimum[J]. Tetrahedron, 1999, 55(4): 967-976.
[7] BEKHIT A E D A, SHAVANDI A, JODJAJA T, et al. Flaxseed: composition, detoxification, utilization, and opportunities[J]. Biocatalysis and Agricultural Biotechnology, 2018, 13: 129-152.
[8] ZAABOUL F, RAZA H, CHEN C, et al. The impact of roasting, high pressure homogenization and sterilization on peanut milk and its oil bodies[J]. Food Chemistry, 2019, 280: 270-277.
[9] CHEN C L, PAN Y J, NIU Y F, et al. Modulating interfacial structure and lipid digestion of natural Camellia oil body by roasting and boiling processes[J]. Food Chemistry, 2023, 402: 134198.
[10] YAN Z H, ZHAO L P, KONG X Z, et al. Behaviors of particle size and bound proteins of oil bodies in soymilk processing[J]. Food Chemistry, 2016, 194: 881-890.
[11] FU L W, HE Z Y, ZENG M M, et al. Effects of preheat treatments on the composition, rheological properties, and physical stability of soybean oil bodies[J]. Journal of Food Science, 2020, 85(10): 3150-3159.
[12] SUN F S, WANG Q, GAO C, et al. Effect of extraction pH and post-extraction heat treatment on the composition and interfacial properties of peanut oil bodies[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2023, 656: 130351.
[13] YU X, HUANG S S, YANG F, et al. Effect of microwave exposure to flaxseed on the composition, structure and techno-functionality of gum polysaccharides[J]. Food Hydrocolloids, 2022, 125: 107447.
[14] YU X, DUAN Z Q, QIN X P, et al. Elucidation of the structure, antioxidant, and interfacial properties of flaxseed proteins tailored by microwave treatment[J]. Journal of Integrative Agriculture, 2023, 22(05): 1574-1589.
[15] NIE C Z, QIN X P, DUAN Z Q, et al. Comparative structural and techno-functional elucidation of full-fat and defatted flaxseed extracts: implication of atmospheric pressure plasma jet[J]. Journal of the Science of Food and Agriculture, 2022, 102(02): 823-835.
[16] 叶建芬. 花生多糖精细结构、溶液构象及其在稳定水包油乳液中应用研究[D]. 无锡: 江南大学, 2022: 18-19.
[17] SUN Y F, ZHANG S, XIE F Y, et al. Effects of covalent modification with epigallocatechin-3-gallate on oleosin structure and ability to stabilize artificial oil body emulsions[J]. Food Chemistry, 2021, 341: 128272.
[18] 禹晓, 黄沙沙, 程晨, 等. 不同品种亚麻籽组成及抗氧化特性分析[J]. 中国油料作物学报, 2018, 40(6): 879-888.
[19] SZYD?OWSKA-CZERNIAK A, TROKOWSKI K, KARLOVITS G, et al. Determination of antioxidant capacity, phenolic acids, and fatty acid composition of rapeseed varieties[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7502-7509.
[20] SZYD?OWSKA-CZERNIAK A, DIANOCZKI C, RECSEG K, et al. Determination of antioxidant capacities of vegetable oils by ferric-ion spectrophotometric methods[J]. Talanta, 2008, 76(4): 899-905.
[21] GAO Y H, ZHENG Y Z, YAO F, et al. Effects of pH and temperature on the stability of peanut oil bodies: new insights for embedding active ingredients[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022, 654: 130110.
[22] 武利春, 孙禹凡, 陈亚双, 等. 巴氏灭菌对不同油脂体乳液氧化稳定性的影响[J]. 食品科学, 2022, 43(7): 23-30.
[23] JIN W P PAN Y J, WU Y, et al. Structural and interfacial characterization of oil bodies extracted from Camellia oleifera under the neutral and alkaline condition[J]. LWT, 2021, 141: 110911.
[24] 王金梅, 夏宁, 杨娟等. 天然和热处理大豆蛋白稳定乳液的性质研究[J]. 中国粮油学报, 2012, 27(9): 16-20.
[25] QIN X P, YANG F, SUN H H, et al. The physicochemical stability and in vivo gastrointestinal digestion of flaxseed milk: implication of microwave on flaxseed[J]. Food Chemistry, 2023, 424: 136362.
[26] ZHU H, KIM Y D, DE KEE D. Non-Newtonian fluids with a yield stress[J]. Journal of Non-Newtonian Fluid Mechanics, 2005, 129(3): 177-181.
[27] CAO J, TONG X H, CHENG J J, et al. Impact of pH on the interaction between soy whey protein and gum Arabic at oil-water interface: structural, emulsifying, and rheological properties[J]. Food Hydrocolloids, 2023, 139: 108584.
[28] YU X, NIE C Z, ZHAO P, et al. Influences of microwave exposure to flaxseed on the physicochemical stability of oil bodies: implication of interface remodeling[J]. Food Chemistry, 2022, 368: 130802.
[29] 秦晓鹏, 黄沙沙, 聂成镇, 等. 微波处理对萌动亚麻籽酚类化合物油相迁移的影响[J]. 食品科学技术学报, 2022, 40(3): 124-136.
[30] YU X, HUANG S S, NIE C Z, et al. Effects of atmospheric pressure plasma jet on the physicochemical, functional, and antioxidant properties of flaxseed protein[J]. Journal of Food Science, 2020, 85(7): 2010-2019.
文章摘自:禹晓,杨帆,乔好等. 热杀菌对亚麻籽乳理化稳定性的影响 [J/OL]. 食品科学技术学报, 1-10[2024-03-04]. http://kns.cnki.net/kcms/detail/10.1151.TS.20240201.1637.002.html.