摘 要:对汉麻 Alfin-like 转录因子家族进行鉴定和生物信息学分析,为 Alfin-like 转录因子调控汉麻生长发育及抗性奠定基础。通过利用拟南芥 Alfin-like 转录因子蛋白序列作为模板,利用 TBtools、MEGA 等生物信息学工具分析汉麻全基因组数据。在汉麻基因中共鉴定出 5 个 CsALs 基因,对其进行了理化性质分析、亚细胞定位、保守基序、基因结构、染色体定位、顺式元件、共线性分析、进化分析及聚类分析等基础分析。结果表明:鉴定的 5个汉麻 AL 转录因子均含有 DUF3594 结构域(PAL 结构域)和 PHD 手指状结构域;经理化性质分析得出,CsALs蛋白质长度在 239~256 aa 之间,等电点在 4.97~5.31 之间,亲水性为–0.809~–0.623,属于酸性亲水蛋白;CsALs基因分布在 4 条染色体上,亚细胞定位发现 AL 转录因子均定位在细胞核;上游 2 000 bp 启动子元件分析与光响应、胁迫响应和激素相关;根据与拟南芥、大豆、水稻、玉米、烟草等系统发育分析共分为 B、E、F 3 个亚族;热图聚类分析表明 CsALs 基因在汉麻中具有较高表达。
关键词:汉麻;Alfin-like;成员鉴定;生物信息学;表达分析
Alfin-like 转录因子家族 N 端含有高度保守的DUF3594 结构域、C 末端含有 PHD 手指状蛋白和保守结构域之间的可变区域,是植物中小型特异性基因家族,该转录因子家族首次在苜蓿中被鉴定[1-3]。Alfin1 是苜蓿中根和愈伤组织特异性转录因子,通过结合 MsPRP2 的启动子,增强其耐盐表达,其过表达明显改善根系生长状况[4-5]。拟南芥中 AL 家族中PHD 手指蛋白可以与赖氨酸 4(H3K4me3/2)高度甲基化形式结合,也是拟南芥各种植物组织中表达的核蛋白,并参与染色质调节[6]。拟南芥 AL6、 AL7 在种子中优先表达,其中 AL PHD-PRC1 复合物以染色质的形式激活 H3K4me3 转录转换至 H3K27me3 种子萌发[7]。AL6 在拟南芥幼苗生长期间通过调节染色质结构协调磷酸盐和茉莉酸盐信号转导[8]。目前 AL 基因在拟南芥[9]、玉米[10]、核桃[11]、棉花[12]中被鉴定。
汉麻又称为工业大麻(Cannabis sativa),属大麻科(Cannabinaceae),春种夏收,是一年生直立草本植物[13]。7000 年前我国已开始将工业大麻应用于生产生活,近 30 年,工业大麻被欧美专家称为“最完美纤维”、“第二层皮肤”[14-15]。毒品大麻与汉麻的区别在于 THC 含量,低于 0.3%THC 含量的大麻为汉麻,应用于纤维制衣、食品面粉、大麻籽油、乙醇燃料[16-17]。但关于 Alfin-like 相关研究很少,对汉麻中 Alfin-like 转录因子家族进行生物信息学分析,基于汉麻全基因组数据,分析其家族成员,进行基因定位、基因结构、顺式作用元件、保守基序、与拟南芥共线性分析,并与其他作物进行同源序列比对,为进一步研究其生物学功能奠定基础。
1材料与方法
1.1汉麻 AL 转录因子家族的鉴定
汉麻、拟南芥全基因序列与蛋白质序列来源于 NCBI (https://www.ncbi.nlm.nih.gov/)、拟南芥 Alfin-like 转录因子蛋白序列来源于 TAIR (https://www.arabidopsis.org/)。根据拟南芥 AL 转录因子家族利用 TBtools 中的 blast 比对分析 CsALs候选基因,并上传 Pfam 进行结构域鉴定,除去不含 Alfin、PHD 结构域的候选基因,最终确定汉麻 Alfin-like 转录因子相关基因。
1.2汉麻 AL 转录因子定位及进化树分析
将汉麻全基因组注释文件与筛选出的 CsALs 转录因子基因号导入 TBtools 进行基因定位可视化。利用NCBI 对玉米、大豆、水稻、烟草进行 blast 比对,并下载其 Alfin-like 转录因子蛋白序列,使用 MEGA 7.0 与拟南芥 、汉麻根据邻近算法 (neighbor-joining,NJ) 构建系统发育树,利用在线工具 EvolView(https://www.evolgenius.info/)对进化树进行美化。
1.3汉麻 AL 转录因子保守基序及基因结构分析
利用在线网站 MEME ( https://meme-suite. org/meme/tools/meme)分析汉麻 Alfin-like 转录因子相关基因的保守基序,基序预测选择 10,其他设置默认。将 MEME 分析结果、汉麻全基因组注释文件、 CsALs 转录因子基因号导入 TBtools 进行保守基序、基因结构结果可视化。
1.4汉麻 AL 转录因子家族理化性质分析及亚细胞定位
使用在线网站 Expasy ( https://web.expasy. org/protparam/)分析汉麻 Alfin-like 转录因子基因的理化性质,包括氨基酸数、等电点、分子量、亲水性。利用在线工具Cell-PLoc 2.0(http://www.csbio. sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测汉麻 Alfin-like转录因子基因的亚细胞定位。
1.5汉麻 AL 转录因子顺式作用元件及共线性分析
筛选汉麻 Alfin-like 转录因子基因上游 2 000 bp利用在线软件PlantCARE 分析其启动子顺式作用元件,使用 TBtools 中 Dual Systeny Plot for MCScanX分析汉麻与拟南芥共线性共线性关系,利用 TBtools对顺式作用元件、共线性进行可视化。
1.6汉麻 AL 转录因子不同品种表达模式分析
根据已报道的 9 个大麻栽培品种(Black Berry Kush, Black Lime, Canna Tsu, Cherry Chem, Valley Fire,Mama Thai, Sour Diesel, Terple 和 White Cook- ies)腺毛转录组数据[18]筛选关于汉麻 Alfin-like 转录因子基因的表达量数据并导入 TBtools 软件中绘制热图,对其进行不同品种表达量的聚类分析。
2结果与分析
2.1汉麻 AL 转录因子家族理化性质分析及亚细胞定位
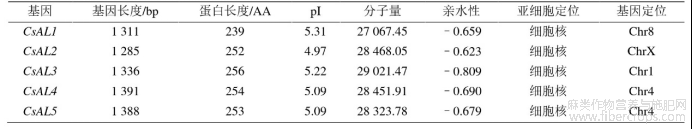
通过 Pfam 结构域验证,除去重复基因共筛选出 5 个 CsALs 基因,分别命名 CsAL1~5。CsALs 基因分别定位在 4 条染色体上,其中 4 号染色体上包含两个基因,分别为 CsAL4、CsAL5。经理化性质分析基因长度在 1 285~1 391 bp 之间。经理化性质分析得出,CsALs 蛋白质长度在 239~256 aa 之间,等电点在 4.97~5.31 之间,属于酸性蛋白。亲水性为–0.809~–0.623,均小于 0,属于亲水蛋白,亚细胞定位均在细胞核。
2.2汉麻 AL 转录因子定位及进化树分析
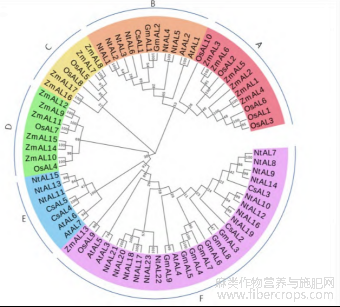
将汉麻、拟南芥、大豆、水稻、玉米及烟草中 Alfin-like 转录因子进行多序列比对,构建系统发育树(图 1),6 种植物共分为 6 个亚族(A~F)。汉麻 Alfin-like 转录因子共分为 B、E、F3 个亚族,这与拟南芥 AL 转录因子家族分类一致,CsAL1 聚类到 B 亚族、CsAL4、CsAL5 聚类到 E 亚族、CsAL2、 CsAL3 聚类到 F 亚族。汉麻与大豆、烟草亲缘关系较近,与水稻、玉米亲缘关系较远,表明单子叶植物与双子叶植物进化上发生分歧。
2.3汉麻 AL 转录因子保守基序及基因结构分析
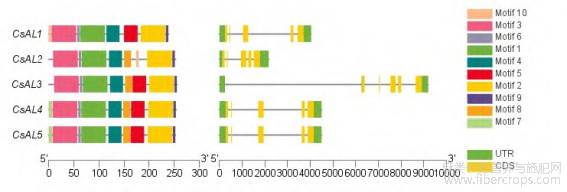
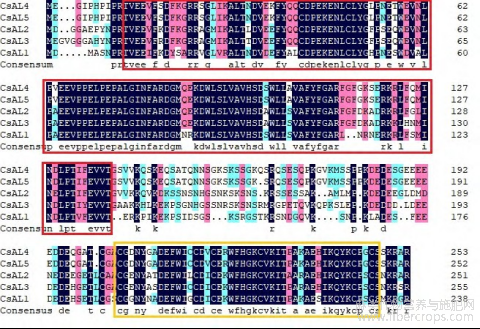
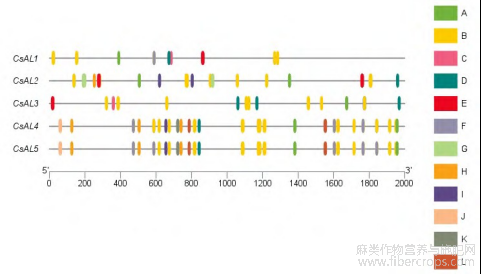
CsALs 保守基序均含有 motif1、motif2、motif3、motif4、motif6、motif9。仅有 CsAL1 含有 motif10,但不含 motif8。CsAL2 不含有 motif5,含有两个 motif8。motif7 只存在于 CsAL4、CsAL5 中。CsAL3包含所有 CsALs 共同的保守基序。图 2 中,CsAL1、CsAL2、CsAL4、CsAL5 基因含有 2 个外显子和 5个内含子,其中 CsAL4、CsAL5 基因外显子内含子所在位置、长度一致、结构相似,具有相同的基因功能,CsAL3 含有 3 个外显子和 5 个内含子,内含子长度与其他 4 个基因类似。图 3 中对 CsALs 进行了多序列比对,汉麻 Alfin-like 转录因子 N 端含有大约 130 个氨基酸的 DUF3594 结构域,C 端含有大约 60 个氨基酸的 PHD 结构域。CsAL4、CsAL5 保守基序、基因结构十分相似。综合保守基序、基因结构及多序列比对分析得出 CsALs 基因具有高度保守性。
表1 CsALs 理化性质分析及亚细胞定位
Table1 CsALs physicochemical property analysis and subcellular localization
红色为 A 亚族,橙色为 B 亚族,黄色为 C 亚族;绿色为 D 亚族,蓝色为 E 亚族,紫色为 F 亚族;CsAL 为汉麻 AL 基因,AtAL 为拟南芥 AL 基因,GmAL 为大豆 AL 基因,OsAL 为水稻 AL 基因,ZmAL 为玉米 AL 基因,NtAL 为烟草 AL 基因。
图1 汉麻、拟南芥、大豆、水稻、玉米及烟草 AL 基因系统发育树
Figure 1 Phylogenetic AL gene phylogeny of Cannabis sativa, Arabidopsis thaliana, Glycine max, Oryza sativa, Zea mays and Nicotiana tabacum
2.4汉麻 AL 转录因子顺式作用元件及共线性分析
在汉麻 Alfin-like 转录因子基因上游 2 000 bp 区域分析其顺式作用元件(图 4)。共鉴定 13 个关于激素响应元件与胁迫响应元件。其中 CsALs 含有较多的光响应元件,其次含有较多的激素类相应元件——茉莉酸甲酯(17 个)、脱落酸(14 个)、生长素(8 个),胁迫响应元件包括厌氧响应元件(7 个)、低温响应元件(4 个)。推测汉麻 Alfin-like 转录因子家族与植物激素和生物胁迫关系密切。图 5 为汉麻与拟南芥 Alfin-like 转录因子共线性关系,由此可以看出只有 CsAL4 与 AtAL6 具有相关性,CsAL4 与AtAL6 均为 E 亚族,其中说明两个基因高度同源。
图2 CsALs 保守基序及基因结构
Figure2 CsALs conserved motifs and gene structure
红色线框为 DYF3594 domain,黄色线框为PHD domain。
图3 CsALs 基因多序列比对
Figure3 Multiple sequence alignment of the CsALs genes
A:参与茉莉酸甲酯反应的顺式调节元件;B:参与光反应的顺式调节元件;C:与干旱诱导有关的顺式调节元件;D:厌氧诱导所必需的顺式调节元件;E:参与玉米醇溶蛋白代谢调节的顺式调节元件;F:参与脱落酸反应的顺式作用元件;G:与水杨酸反应有关的顺式作用元件;H:参与生长素反应的顺式作用元件;I:参与低温反应的顺式作用元件;J:参与防御和压力反应的顺式作用元件;K:参与胚乳表达的顺式调节元件;L:与分生组织表达相关的顺式调节元件。
图4 CsALs 顺式作用元件
Figure4 The CsALs cis-acting element
图5 工业大麻与拟南芥 AL 基因共线性关系
Figure5 Collinearity between Cannabis sativa L. and Arabidopsis thaliana AL genes
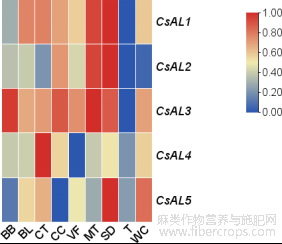
图6 CsALs 基因不同品种表达模式分析
Figure6 Analysis of the expression patterns of different vari- eties of CsALs genes
2.5汉麻 AL 转录因子不同品种表达模式分析
根据已报道的 9 个大麻栽培品种(Black Berry Kush,Black Lime, Canna Tsu, Cherry Chem, Valley Fire , Mama Thai, Sour Diesel, Terple 和 White Cookies)腺毛转录组数据,绘制 CsALs 在不同品种的表达热图(图 6)。通过聚类分析发现,在 Sour Diesel 中5 个AL 基因的表达量显著高于其他品种中的表达量;CsAL2 在 Terple 和 White Cookies 中表达量极低,在 Terple 中 CsALs 基因相较于其他品种表达量最低;CsAL3 在 9 个品种中的调表达量显著高于其他 CsALs;CsAL4 在 Canna Tsu 中表达量显著高于其他品种。相同基因在同种植物的不同品种中表达量不同,表明品种间的表型差异与基因表达量有关。
3 讨论与结论
Alfin-like 转录因子是一类含有双结构域的蛋白,N 端的 DUF3594 domain 又称为 PAL 结构域是 “心形”同源二聚体,代表一种新形式的蛋白质折叠形式,C 端的PHD domain 与染色质紧密结合[6,19]。 Alfin-like 转录因子在植物生长发育及胁迫响应方面具有重要作用[20]。本研究根据汉麻全基因组注释文件及蛋白质序列文件获得 5 个 CsALs 基因。根据理化性质分析,CsALs 蛋白是酸性亲水蛋白,其亚细胞定位显示均定位于细胞核,有研究表明植物 ALs基因定位于细胞核,这与葡萄[21]、核桃[11]亚细胞定位结果一致,葡萄 VvALs 等电点为 5.11~5.62、亲水性为–0.803~–0.569,核桃 JrALs 等电点为 5.04~5.71、亲水性为–0.751~–0.618。CsALs 基因结构中均含有 5 个内含子,含有 6 个相同的保守基序,仅有 CsAL3 含有 3 个外显子,具有相似保守基序的 CsALs 蛋白质序列聚类到相同亚族,而 CsAL1 单独聚类到 B 亚族且仅含有 motif10,motif7仅存在于 CsAL4、CsAL5 并聚类到 E 亚族,CsAL2含有两个 motif8、CsAL3 包含 CsALs 基因 6 个共同 motif 并聚类到 F 亚族。CsAL2 定位于 X 染色体,可以猜测,关于非生物因素胁迫的抗性或许是可以遗传的。CsALs 基因 CDS 编码长度差异不大,表明 CsALs 基因在进化过程中的高度保守性。根据其启动子元件分析表明,5 个汉麻 Alfin-like 转录因子含有大量光响应元件,且均与激素响应和胁迫响应有关,且 ALs 基因是参与调控大麻非生物胁迫的重要参与者,而植物通常遭遇的非生物胁迫主要是盐胁迫、低温胁迫和干旱胁迫。推测可以通过编辑 CsALs基因参与调控汉麻的生长发育与非生物胁迫。进化树分析汉麻Alfin-like 转录因子与双子叶植物同源性较高,与水稻、玉米等单子叶植物存在明显差异,其系统发育树分析中单双子叶植物的差异可能是由于植物进化造成的,推测该基因在物种间具有较高保守性。汉麻与拟南芥 Alfin-like 转录因子共线性关系中只有 CsAL4 与 AtAL6 具有相关性,AtAL6 可以通过调节 ETC1 转录本的稳定性来控制 Pi 缺陷条件下的根毛伸长,AtAL6 还需要克服在低 Pi 条件下光诱导的根毛伸长抑制,而 CsAL4 与 AtAL6 具有高度同源性[22],推测 CsAL4 在汉麻生长发育中发挥与 AtAL6 相同功能。汉麻 CsALs 基因在不同品种表达模式分析该转录因子在较多品种中有高度表达,但不同品种中存在表达差异,推测汉麻 CsALs 基因在表达调控上存在一定的功能分化,在不同品种中 CsAL3 表达量显著高于其他基因,推测该基因可能对生长发育和胁迫响应起到重要的调控作用。
本研究首次鉴定了汉麻 Alfin-like 转录因子家族,并对其进行了初步的生物信息学分析,发现该基因与植物胁迫响应、激素响应关系密切。本研究为进一步鉴定汉麻Alfin-like 转录因子的生物学功能奠定基础。
参考文献:
[1]WEI W, ZHANG Y Q, TAO J J, et al. The Alfin-like homeodomain finger protein AL5 suppresses multiple negative factors to confer abiotic stress tolerance in Arabidopsis[J]. Plant J, 2015, 81(6):871-883.
[2]BASTOLA D R, PETHE V V, WINICOV I. Alfin1, a novel zinc-finger protein in alfalfa roots that binds to promoter elements in the salt-inducible MsPRP2 gene[J].Plant Mol Biol, 1998, 38(6):1123-1135.
[3]TAO J J, WEI W, PAN W J, et al. An Alfin-like gene from Atriplex hortensis enhances salt and drought tolerance and abscisic acid response in transgenic Arabidopsis[J]. Sci Rep, 2018, 8(1):2707.
[4]WINICOV I, VALLIYODAN B, XUE L R, et al. The Ms PRP2 promoter enables strong heterologous gene expression in a root-specific manner and is enhanced by overexpression of Alfin 1[J]. Planta, 2004, 219(6):925-935.
[5]WINICOV I. Alfin1 transcription factor overexpression enhances plant root growth under normal and saline conditions and improves salt tolerance in alfalfa[J]. Planta,2000, 210(3):416-422.
[6]LEE W Y, LEE D, CHUNG W I, et al. Arabidopsis ING and Alfin1-like protein families localize to the nucleus and bind to H3K4me3/2 via plant homeodomain fingers[J].Plant J, 2009, 58(3):511-524.
[7]MOLITOR A M, BU Z Y, YU Y, et al. Arabidopsis AL PHD-PRC1 complexes promote seed germination through H3K4me3-to-H3K27me3 chromatin state switch in repression of seed developmental genes[J]. PLoS Genet,2014, 10(1):e1004091.
[8]VÉLEZ-BERMÚDEZ I C, SCHMIDT W. Chromatin enrichment for proteomics in plants(ChEP-P)implicates the histone reader ALFIN-LIKE 6 in jasmonate signalling[J].BMC Genom, 2021, 22(1):1-21.
[9]SONG Y, GAO J, YANG F X, et al. Molecular evolutionary analysis of the Alfin-like protein family in Arabidopsis lyrata, Arabidopsis thaliana, and Thellungiella halophila[J]. PLoS One, 2013, 8(7):e66838.
[10]王姣姣,孙宁,刘征.玉米Alfin-like转录因子ZmAL5a生物信息和表达分析[J].分子植物育种, 2019, 17(15):4859-4864.
[11]李洋,刘凯,路粉,等.核桃Alfin-like基因家族鉴定与转录表达分析[J].河北农业大学学报, 2021, 44(4):51-57.
[12]马盼盼,赵曾强,叶春秀,等.雷蒙德氏棉和亚洲棉Alfin-like PHD finger家族的生物信息学分析[J].分子植物育种, 2018, 16(3):724-732.
[13]韩喜财,韩承伟,赵越,等.黑龙江工业大麻田间杂草防除研究[J].中国麻业科学, 2018, 40(5):219-225.
[14]颜红宇.中国大麻育种历史进程、现状与未来发展方向[J].现代园艺, 2014(15):45-46.
[15]龚飞.汉麻纤维及其应用[J].山东纺织科技, 2010,51(3):48-50.
[16]陈来成,杨占红,何秋星,等.工业大麻法规现状及其在化妆品中开发应用概况[J].日用化学品科学, 2020,43(1):20-24.
[17]任泺彤,陈小光,马颜雪,等.麻文化发展与高值利用前景展望[J].中国麻业科学, 2021, 43(5):272-280.
[18]ZAGER J J, LANGE I, SRIVIDYA N, et al. Gene networks underlying cannabinoid and terpenoid accumulation in Cannabis[J]. Plant Physiol, 2019, 180(4):1877-1897.
[19]PENG L, WANG L L, ZHANG Y P, et al. Structural analysis of the Arabidopsis AL2-PAL and PRC1 complex provides mechanistic insight into active-to-repressive chromatin state switch[J]. J Mol Biol, 2018, 430(21):4245-4259.
[20]KAYUM M A, PARK J I, AHMED N U, et al. Alfin-like transcription factor family:characterization and expression profiling against stresses in Brassica oleracea[J].Acta Physiol Plant, 2016, 38(5):127.
[21]谢敏,王萍,何红红,等.葡萄Alfin-like转录因子家族的鉴定和表达分析[J].西北植物学报, 2020,40(9):1467-1474.
[22]CHANDRIKA N N P, SUNDARAVELPANDIAN K, YU S M, et al. ALFIN-LIKE 6 is involved in root hair elongation during phosphate deficiency in Arabidopsis[J]. New Phytol, 2013, 198(3):709-720.
文章摘自:陈晗,徐洪国,王志刚等.汉麻Alfin-like转录因子家族鉴定及表达分析[J].安徽农业大学学报,2023,50(03):410-415.DOI:10.13610/j.cnki.1672-352x.20230625.001.