摘 要;为了筛选亚麻白粉病抗性种质,解析抗性种质在群体中的分布情况,为亚麻白粉病抗性育种抗性亲本选择提供依据,本研究以国内外共379份亚麻种质为研究材料,分析不同品种亚麻大田抗白粉病的差异,利用SSR标记对其中266份材料进行多态性扫描,分析群体遗传多样性,并结合植株多个农艺性状数据和田间抗病相关性分析,研究抗白粉病材料在不同来源亚麻群体中的分布情况。结果表明,供试亚麻种质白粉病发病情况存在显著差异,379份亚麻种质中无免疫(M)植株,高抗(HR)材料1份,抗病(R)材料8份,占供试材料的2.11%,中抗(MR)材料52份,占供试材料的13.72%,感病(S)和高感(HS)材料318份,占供试材料的83.91%。SSR标记将266份亚麻种质聚为2大类群,Group II白粉病发病程度极显著低于Group I,而Group I中4个亚类群间病情指数无显著差异,Group II中2个亚类群间病情指数亦无显著差异。Group I、Group II两大类群间各农艺性状均呈现极显著差异,Group I明显表现为纤用亚麻特征,Group II表现为油用亚麻特征。已知分类的油用、纤用亚麻类群白粉病抗性存在极显著差异,油用类群白粉病病情指数极显著低于纤用亚麻类群。农艺性状与病情指数相关性分析结果与油用和纤用亚麻发病程度差异具有较高一致性。266份供试亚麻材料聚为2大类群,抗病材料主要集中在遗传多样性丰富的油用亚麻群体中。综合白粉病抗性与农艺性状表现,高抗品种Q0415可作为优良品种推广种植,其余8份抗病材料可作为抗病亲本资源。
关键词;亚麻;白粉病;抗性鉴定;简单重复序列;遗传多样性
亚麻粉孢(Oidium lini Skoric)引起的亚麻白粉病是一种全球亚麻主产区常见病害(Bansal, 2011; Aly et al., 2012)。亚麻白粉病通常在亚麻茎、叶和花等表面形成白粉状薄层,降低亚麻叶片光合作用,影响原茎光泽度、麻籽结实率、纤维产量和千粒重(何建群等,2006),对亚麻生产造成严重的影响。尽管喷洒15%三唑酮WP、10%世高WG等能减轻亚麻白粉病的发病,但农药一方面会造成生态环境破坏,另一方面也无法从根本上解决白粉病(Orton and Brown,2016)。因此,寻找亚麻白粉病抗性种质对于防控亚麻白粉病具有重要的实践意义。
国内外对于亚麻种质抗白粉病相关研究较少(陈娟和乔红霞,2012)。Rashid和Duguid(2005)在加拿大栽培亚麻中筛选得到了3个单基因抗白粉病材料。但与国内相比,加拿大等亚麻种植大国对于亚麻白粉病抗性种质筛选工作开展较早,相继筛选出了一批抗白粉病材料,在亚麻抗病品种选育研究中起到了重要的支撑作用。印度于20世纪70年代就开始了该项研究工作,Singh和Saharan(1979)、Prasad等(1988)相继从几千份种质资源中鉴定筛选出了一批抗病材料;Rashid等(1998)也在1997年首次发现亚麻白粉病之后,持续进行了抗白粉病鉴定评价等工作,并在2005年在加拿大栽培亚麻中筛选得到了3个单基因抗白粉病材料(Rashid and Duguid.,2005)。Asgarinia等(2013)利用亚麻白粉病高抗及高感材料构建F3、F4群体,利用SSR标记对抗性基因进行定位,初步得到三个候选位点。上述研究为亚麻抗白粉病育种奠定了坚实的基础。我国对于抗白粉病的鉴定筛选仅有零星报道,且缺乏多年多点的试验研究。何建群等(2007)调查了15个亚麻品种田间抗白粉病性状,没有发现免疫品种;杨学等(2008)在自然群体中筛选得到一个白粉病抗性品种9801-1,通过研究发现白粉病抗性为单基因显性性状;乔红霞和陈娟(2012)筛选了53份亚麻种质,发现仅西吉胡麻为白粉病抗性品种,并用RAPD方法进行了抗病基因的研究(陈娟和乔红霞,2012);张倩(2015,私人通信)利用杨学所发现的抗性材料9801-1,与感病品种构建BC3F6群体,并对亚麻白粉病抗性基因进行初步定位,得到候选基因Pm-Linum。
由于植物和病原菌存在协同进化现象,作物中抗病性状常是多基因控制的数量性状遗传,传统的抗性育种存在一定的盲目性,工作量大,耗时长,很难培育出突破性的优良品种(赖勇等,2013)。本研究对来自国内外的379份亚麻种质进行亚麻白粉病抗性鉴定,筛选抗性品种,利用SSR标记和多性状标记对266份材料抗病性进行遗传分析,解析抗性种质在群体中的分布情况,以期挑选出用于亚麻白粉病抗性品种选育所需的能够表现出稳定抗性的亲本品种。
1 结果与分析
1.1 亚麻白粉病发病情况调查
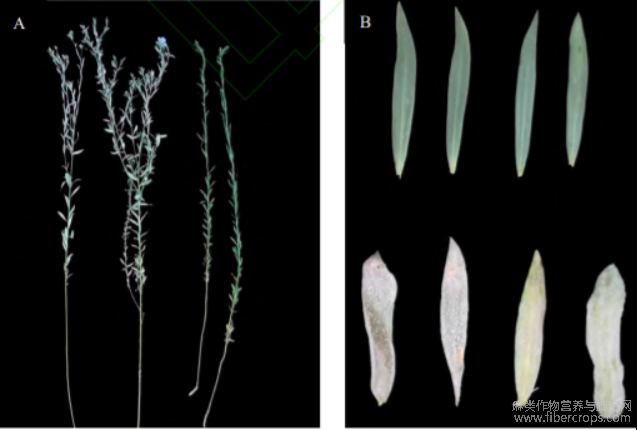
新疆伊宁地区亚麻白粉病始发于六月底,发病后病菌产生大量分生孢子,在适宜的温度和湿度下多次侵染植物,造成白粉病大规模爆发。白粉病菌侵染植株后,底层叶片先出现白色菌斑,随着病菌的指数增长和迅速传播,叶片、叶柄和茎部布满白色覆盖物,叶片变黄、脱落,植株的光合作用大幅降低,严重影响亚麻的产量和品质。在白粉病盛发期,田间发病率高达100%。在白粉病侵染后期,;种内植株发病程度高度一致,供试379份亚麻种质白粉病发病情况存在显著差异。高抗种质植株呈现绿色,感病种质植株叶片和茎杆出现大量白色粉末状的覆盖物(图1)。
图1 亚麻白粉病的发病症状
注;A;成株发病情况(左为高感材料,右为高抗材料);B;叶片发病情况(上部为高抗材料,下部为高感材料,左二为叶片正面,右二为叶片背部)
1.2 亚麻种质白粉病抗性评价及群体结构分析
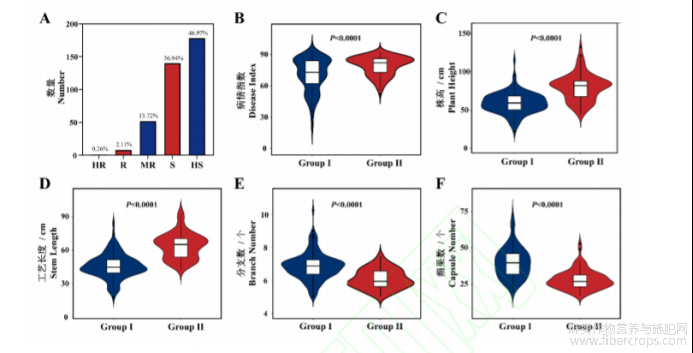
依据田间白粉病感病程度计算病情指数,379份亚麻种质白粉病病情指数在18.67~94.00之间,供试亚麻种质中没有免疫(M)品种,9份材料表现出不同程度的抗性,占供试材料的2.11%,其中Q0415对亚麻白粉病表现出高抗(HR),病情指数为18.67,中抗(MR)材料52份,占供试材料的13.72%,感病(S)材料140份,占供试材料的36.94%。高感(HS)材料178份,占供试材料的46.97%,高感材料VNIIL-519发病程度最严重,病情指数高达94.00(图3A)。
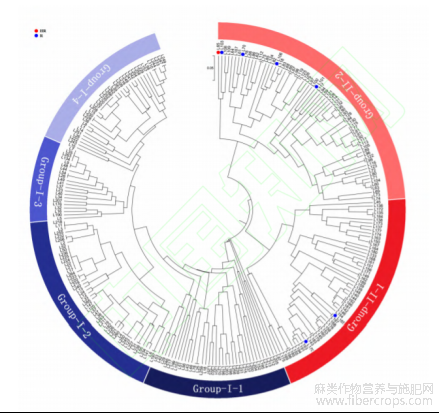
为了研究抗白粉病材料在不同来源亚麻群体中的分布情况,本研究通过SSR标记对266份供试亚麻材料进行群体分析。选择扩增条带多态性高、重复性好的19对SSR标记扩增,每个引物扩增出的条带选取其中较为清晰的4条用于后续分析,共检测到76个等位变异。基因多样性变化范围在0.4364~0.6531之间,平均为0.5109。PIC值变化范围从0.3412~0.5797,平均为0.3957(表1),这也表明了本研究所选用标记多态性较好。供试亚麻材料聚为2大类群(图2),即Group I、Group II,Group I类群又分为4个亚类群,Group II分为2个亚类群。由于田间白粉病检测获得的7个抗性材料均出现在Group II中,进一步比较两个类群的白粉病病情指数,结果表明Group II白粉病发病程度极显著低于Group I(图3B)。而Group I类群中4个亚类群间病情指数无显著差异,Group II类群中2个亚类群间病情指数亦无显著差异(数据未显示)。
通过对正常生长的亚麻株高、分枝数等重要的农艺性状进行分析,结果表明Group I、Group II两大类群间各农艺性状均呈现极显著差异(图3B-F)。与Group II相比,Group I表现为株高、工艺长度高,分枝数、蒴果数低等特征,Group II表现为株高、工艺长度低,分枝数、蒴果数高特征。现代栽培亚麻主要分为油用亚麻和纤用亚麻,前者表现为株高较矮而分枝、蒴果数多等特征,后者株高工艺长度长而少分枝等特征。Group I明显表现为纤用亚麻特征,Group II表现为油用亚麻特征。综合两个亚群的白粉病抗性情况,对纤用、油用亚麻的抗性进行分析。
图2 基于SSR标记的亚麻种质聚类分析
表1 引物遗传多样性
|
引物 |
样本量 |
主等位基因频率 |
观测等位基因数 |
基因多样性 |
多态性信息含量 |
|
M1 |
379 |
0.5135 |
4 |
0.4996 |
0.3748 |
|
M2 |
379 |
0.5324 |
4 |
0.4979 |
0.3739 |
|
M7 |
379 |
0.5730 |
4 |
0.4893 |
0.3696 |
|
M10 |
379 |
0.5000 |
4 |
0.5000 |
0.3750 |
|
M13 |
379 |
0.5216 |
4 |
0.4991 |
0.3745 |
|
M58 |
379 |
0.5541 |
4 |
0.4942 |
0.3721 |
|
M59 |
379 |
0.5378 |
4 |
0.4971 |
0.3736 |
|
M74 |
379 |
0.4270 |
4 |
0.6531 |
0.5797 |
|
M86 |
379 |
0.5486 |
4 |
0.4953 |
0.3726 |
|
M90 |
379 |
0.6784 |
4 |
0.4364 |
0.3412 |
|
M91 |
379 |
0.5703 |
4 |
0.4901 |
0.3700 |
|
M96 |
379 |
0.5514 |
4 |
0.4947 |
0.3723 |
|
M102 |
379 |
0.4865 |
4 |
0.6156 |
0.5389 |
|
M112 |
379 |
0.5000 |
4 |
0.5000 |
0.3750 |
|
M126 |
379 |
0.5027 |
4 |
0.5000 |
0.3750 |
|
M136 |
379 |
0.5027 |
4 |
0.5000 |
0.3750 |
|
M140 |
379 |
0.5162 |
4 |
0.4995 |
0.3747 |
|
M146 |
379 |
0.5027 |
4 |
0.5000 |
0.3750 |
|
M177 |
379 |
0.6081 |
4 |
0.4766 |
0.3630 |
图3 亚麻各类群农艺性状表现特征
注;A;亚麻种质白粉病抗性分级;B-F;亚麻不同类群农艺性状差异比较;B;病情指数;C;株高;D;工艺长度;E;分枝数;F;蒴果数
1.3 已知类型的亚麻种质白粉病抗性差异比较
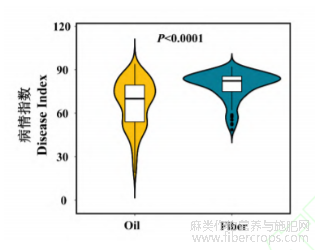
为了分析两大类群亚麻抗白粉病抗性差异,研究在供试亚麻种质中选取用途类型明确的103份(包括39份油用亚麻和64份纤用亚麻)材料,分析纤用和油用种质类群白粉病抗性差异,结果表明油用亚麻种质白粉病病情指数极显著低于纤用亚麻(图4)。纤用亚麻中大部分材料病情指数高且分布集中,而油用亚麻病情指数偏低且较为分散。与图2抗性种质分布的类群结果一致,进一步说明油用和纤用亚麻白粉病抗性存在极显著差异。
亚麻白粉病抗性与株高、工艺长度、茎粗、分枝数、蒴果数等均为关系作物产量的重要农艺性状。研究分析了亚麻白粉病病情指数与各农艺性状的相关性(表2)。两地分析结果显示,病情指数与株高、工艺长度、茎粗均呈极显著正相关(P<0.001),与未发病田间分枝数和蒴果数呈显著负相关(P<0.001),而发病田间病情指数与分枝数和蒴果数显著性水平下降(P<0.05)。不同农艺性状与病情指数相关性的分析结果与油用和纤用亚麻发病程度差异具有一致性。
表2 农艺性状与病情指数相关性分析

图4 病情指数箱形图分析
1.4 抗病品种农艺性状评价
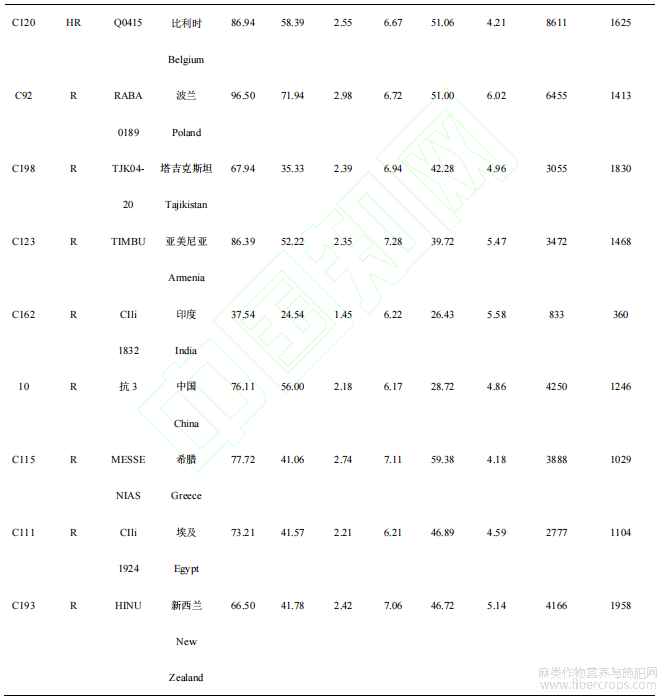
对9份抗白粉病亚麻种质(包括1份高抗和8份抗病材料)进行农艺性状统计(表3),结果显示高抗纤用品种Q0415原茎产量最高,为8611kg/hm2,种子产量较高,为1625kg/hm2,可作为油纤兼用白粉病抗性品种进行推广种植。抗病油用品种TJK04-20种子产量最高,为1830kg/hm2,原茎产量表现不佳,可作为抗病油用种质种植或培育抗白粉病油用亚麻种质。同时发现矮秆抗病材料CIli1832,株高仅为37.54cm;可作为培育矮杆抗白粉病亚麻种质的育种亲本。
表3 9份抗白粉病亚麻种质农艺性状统计
2 讨论
亚麻白粉病是亚麻常见病害,在所有亚麻主产区均有发生(Aly et al.,2012;Bansal,2011)。杨学等(2007)认为温度、湿度、光照、播种时期等是影响亚麻白粉病发病的重要因素。新疆夏季常现高温天气,田间灌溉频繁,蒸发量大,本研究发现温度是引发新疆伊犁地区亚麻白粉病发病的最主要因素。伊宁4月播种的亚麻在6月底高温来临时已基本完成绿熟期,白粉病发病对其产量影响较少;而5月初播种的亚麻,快速生长期后期就受到白粉病菌侵染,严重影响麻茎和种子的产量形成。因此适当的提早播种,可使亚麻在白粉病盛发期前进入黄熟期,从而降低白粉病对亚麻原茎产量和种子产量的影响。性状的关联分析也表明,正常大田亚麻植株株高与分枝数、蒴果数呈现极显著负相关,而在白粉病发病田间植株蒴果数与分枝数下降严重,株高与二者不再呈现相关性(表2),因此白粉病主要通过降低植株茎粗、分枝数和蒴果数来影响亚麻产量。
亚麻白粉病具有发生时期短,流行速度快等特点(哈尼帕·哈再斯等,2013)。田间灌溉可诱发白粉病病原菌迅速增殖(张秋等,2012),至盛发期基本达到对亚麻植株的饱和接菌,这种发病特点使得亚麻品种内感病程度高度一致,不同品种白粉病抗性差异得以充分表现。何建群等(2007)的研究发现,黑亚11号、范妮对白粉病表现为中抗,乔红霞和陈娟(2012)的研究中,陇亚10号对白粉病表现为感病,但在本研究中,这3个品种均表现为高感;Rashid和Duguid(2005)鉴定了单基因显性遗传的高抗白粉病材料Atalante,免疫材料LINDA,本研究中二者均表现为感病。上述不同的鉴定结果与白粉病的饱和侵染程度、不同地区菌株致病力的差异或不同生理小种侵染有关。目前已有报道的亚麻白粉病菌生理小种有Erysiphe polygoni DC(Mercer et al.,1991;Homma,1928)、Sphaerotheca lini(Mercer et al.,1991)、Oidium lini(Mercer et al.,1991;Homma,1928;Saharan and Saharan,2012;Rashid,2003;李广阔等,2007)、Lveillula taurica(Lev.)、Podosphaera lini(Preston and Cook,2019)、Erysiphecichoracearum DC(王炜等,2019)等,其中Oidium lini在英国、日本、印度、加拿大和中国等地均有报道,其余生理小种分布在世界各地。
供试379份亚麻材料中国内培育的中亚、双亚、黑亚、陇亚、伊亚、天鑫系列均表现出不同程度的感病或高感,说明国内育种材料遗传背景较为狭窄(李明,2011)。本研究用SSR标记将266份亚麻种质聚为2大类群,白粉病抗性材料均属于Group II,且Group II白粉病发病程度极显著低于Group I(图3B),农艺性状与病情指数的相关性分析表明SSR聚类结果与亚麻品种分类基本吻合。用已知纤用和油用种质材料间病情指数的验证分析(图4),进一步说明油用亚麻和纤用亚麻对白粉病抗性存在极显著差异。You等(2017)在加拿大利用连续5年的田间表型数据也证明了,在亚麻中,油用材料对于白粉病的抗性优于纤用亚麻。Allaby等(2005)和Fu和Allaby(2010)等研究认为栽培亚麻由亚麻L.bienne驯化而来,并且纤用亚麻来源于油用亚麻(Fu and Allaby,2010;Fu,2011)。与纤用亚麻相比,油用亚麻遗传多样性更为丰富(李明,2011;Fu et al.,2002)。亚麻白粉病最早的报道是在1896年(Rashid and Duguid,2005),白粉病抗性材料只出现在油用亚麻群体中的一个可能原因是纤用亚麻在早期驯化中或许未选择白粉病抗性位点。而亚麻抗性材料分布在Group II的不同亚群中,暗示白粉病抗性供体来源不同。Soto-Cerda等(2012)用SSR标记将60份材料分成不同地理分布的亚群,李明(2011)用7对AFLP标记将85份材料中油用和纤用亚麻明显区分开来,本研究结果表明上述两种聚类模式在266份亚麻种质群体分布中均有体现。
抑制白粉病发生的最有效途径是通过筛选抗性资源并培育抗病品种,但目前国内外亚麻白粉病抗病研究较少,已报道的抗性材料仅9801-1,极为匮乏(Rashid and Duguid,2005;杨学等,2008)。本研究收集来自45个国家的379份亚麻种质,具有丰富的遗传多样性,397份种质中抗性材料为9份(包括1份高抗材料),其中部分抗性材料具有较好的农艺性状(表3)。这些材料可以作为后继亚麻抗白粉病高产育种和抗白粉病基因功能研究提供依据。
3 材料与方法
3.1 试验材料
供试379份亚麻来自45个国家,大部分来自中国和加拿大,少部分来自美国、罗马尼亚和印度等国家。种质来源见表4。
表4 379份亚麻种质来源组成
|
来源 |
品种数 |
来源 |
品种数 |
|
中国 |
106 |
巴基斯坦 |
3 |
|
埃塞俄比亚 |
4 |
韩国 |
1 |
|
希腊 |
1 |
匈牙利 |
8 |
|
加拿大 |
87 |
阿富汗 |
3 |
|
埃及 |
4 |
哥斯达黎加 |
1 |
|
危地马拉 |
1 |
荷兰 |
7 |
|
美国 |
32 |
西班牙 |
2 |
|
伊朗 |
3 |
芬兰 |
1 |
|
塞浦路斯 |
1 |
亚美尼亚 |
5 |
|
罗马尼亚 |
21 |
乌拉圭 |
2 |
|
塔吉克斯坦 |
3 |
非洲 |
1 |
|
塞尔维亚 |
1 |
摩洛哥 |
4 |
|
印度 |
16 |
土耳其 |
2 |
|
日本 |
3 |
玻利维亚 |
1 |
|
瑞典 |
1 |
德国 |
4 |
|
法国 |
14 |
印度尼西亚 |
1 |
|
捷克斯洛伐克 |
3 |
北美 |
1 |
|
墨西哥 |
1 |
比利时 |
4 |
|
澳大利亚 |
10 |
意大利 |
1 |
|
波兰 |
3 |
保加利亚 |
1 |
|
津巴布韦 |
1 |
新西兰 |
1 |
|
俄罗斯 |
9 |
巴西 |
1 |
3.2 田间性状、白粉病发病情况统计
试验材料种植于新疆伊犁地区伊犁农科院国家麻类示范种植中心试验地。釆用随机区组设计,小区面积为2m2,区长1m,宽2m,5行区条播,每平方米有效播种粒数为2000粒。区间道0.4m,组间道lm,试验区四周设1.5m宽保护行,按常规生产方式进行田间管理。
新疆伊犁地区亚麻白粉病田间盛发期为7月中旬(哈尼帕·哈再斯等,2013),在亚麻现蕾至开花期进行田间抗性统计。以生育期的亚麻为研究材料,参照《亚麻种质资源描述规范和数据标准》(王玉富和粟建光,2006)选取30株统计白粉病发病情况,记录亚麻植株的病率及病级,病级的分级标准如表5。根据病级计算病情指数,公式为:

式中:DI-病情指数;si-发病级别;ni-相应发病级别的株数;N-调查总株数。亚麻种质群体对白粉病的抗性标准参见表6。于亚麻生理成熟期调查株高(Plant height)、工艺长度(Stem length)、茎粗(Stem diameter)、分枝数(Branch number)、蒴果数(Capsule number)、千粒重(1000-seedweight)、原茎产量(Stem yield)、种子产量(Seed yield)。
表5 亚麻白粉病发病标准
表6 亚麻种质群体对白粉病的抗性标准

3.3 供试亚麻的遗传关系分析
依据Cloutier等(2012)公布的遗传图谱,选择100对SSR标记用于供试亚麻种质亲缘关系分析。并从中选出扩增条带多态性较好的SSR引物19对,采用CTAB法提取亚麻基因组DNA,PCR反应体系为20µL;包括2µLDNA、0.4µLTaq酶、上下游引物各1µL、2µL10xBuffer、13.6µLddH2O。PCR程序为95℃预变性1min;引物退火温度为55℃,退火时长为1min;退火完成后72℃延伸30s;设定35个循环;循环完成后在72℃条件下延伸10min。PCR反应结束后首先用1%的琼脂糖凝胶电泳检测条带,再用8%非变性聚丙烯酰胺凝胶电泳检测,染色、显影后对所有扩增的电泳条带进行统计分析,转化数据格式后采用Power Marker3.25软件(Liu and Muse,2005)UPGMA法对亚麻种质进行聚类分析。
参考文献
Allaby R.G., Peterson G.W., Merriwether D.A., and Fu Y.B., 2005, Evidence of the domestication history of flax(Linum usitatissimum L.) from genetic diversity of the sad2 locus, Theor. Appl. Genet., 112(1): 58-65.
Aly A.A., Mansour M., Mohamed H.I., and ABD-ELSALAM K.A., 2012, Examination of correlations between several biochemical components and powdery mildew resistance of flax cultivars, Plant Pathol. J., 28(2): 149-155.
Asgarinia P., Cloutier S., Duguid S., Rashid K., Mirlohi A., Banik M., and Saeidi G., 2013, Mapping quantitative trait loci for powdery mildew resistance in flax (Linum usitatissimum L.), Crop Sci., 53(6): 2462-2472.
Bansal J., 2011, Status of the Libraries of Indian Council of Agricultural Research(ICAR) institutions in Haryana: a survey, International Journal of Information Dissemination and Technology, 1(4): 211-215.
Cloutier S., Ragupathy R., Miranda E., Radovanovic., Reimer E., Walichnowski A., Ward K., Rowland G., Duguid S., and Banik M., 2012, Integrated consensus genetic and physical maps of flax (Linum usitatissimum L.), Theor. Appl. Genet., 125(8): 1783-1795.
Fu Y.B., 2011, Genetic evidence for early flax domestication with capsular dehiscence, Genetic Resources and Crop Evolution, 58(8): 1119-1128.
Fu Y.B., and Allaby R.G., 2010, Phylogenetic network of Linum species as revealed by non-coding chloroplast DNA sequences, Genetic Resources and Crop Evolution, 57(5): 667-677.
Fu Y.B., Diederichsen A., Richards K.W., and Peterson G., 2002, Genetic diversity within a range of cultivars and landraces of flax(Linum usitatissimum L.) as revealed by RAPDs, Genetic Resources and Crop Evolution, 49(2): 167-174.
Homma Y., 1928, On the Powdery Mildew of Flax, Shokubutsugaku Zasshi, 42(499):331-334.
Liu K., and Muse S.V., 2005, PowerMarker: an integrated analysis environment for genetic marker analysis, Bioinformatics, 21(9): 2128-2129.
Mercer P.C., Hardwick N.V., Fitt B.D.L., and Sweet J.B., 1991, Status of diseases in linseed in the UK, Hgca, 3: 24-45.
Orton E.S., and Brown J.K.M., 2016, Reduction of growth and reproduction of the biotrophic fungus Blumeria graminis in the presence of a necrotrophic pathogen, Front. Plant Sci., 7: 742-750.
Prasad R., Rai M., and Kerki S A., 1988, Resistance of linseed (Linum usitatissimum L.) germplasm to rust (Melampsora lini) and powdery mildew (Oidium lini), Indian J. Agric. Sci., 58(7): 548-549.
Preston C.D., and Cook R.T.A., 2019, Podosphaera lini, an overlooked powdery mildew in Britain, Field Mycology, 0(2): 55-57.
Rashid K., Kenaschuk E.O., and Platford R.G., 1998, Diseases of flax in Manitoba in 1997 and first report of powdery mildew on flax in Canada, Can. Plant Dis. Surv., 78:100-101.
Rashid K., and Duguid S., 2005, Inheritance of resistance to powdery mildew in flax, Canadian journal of plant pathology, 27(3): 404-409.
Rashid K.Y., 2003, Principal diseases of flax, Flax: the genus Linum, 158: 124-149.
Singh B.M., and Saharan G.S., 1979, Inheritance of resistance to Oidium lini Skoric in linseed (Linum usitatissimum L.), Euphytica, 28(2):531-532.
Saharan G.S., and Saharan M.S., 2012, Identity of linseed powdery mildew pathogens and sources of resistance, Integrated Disease Management and Plant Health, 93-97.
Soto-Cerda B.J., Maureira-Butler I., Muñoz G., Rupayan A., and Cloutier S., 2012, SSR-based population structure, molecular diversity and linkage disequilibrium analysis of a collection of flax(Linum usitatissimum L.) varying for mucilage seed-coat content, Molecular Breeding, 30(2): 875-888.
You F.M., Jia G., Xiao J., Duguid S.D., Rashid K.Y., and Booker H.M., 2017, Genetic variability of 27 traits in a core collection of flax(Linum usitatissimum L.), Frontiers in plant science, 8: 1636.
Chen J., and Qiao H.X., 2012, Study on Relationship of Sowing Time with Yield and Powdery Mildew, Zhongguo Maye Kexue (Plant Fiber Science In China), 34(4): 169-173.(陈娟, 乔红霞, 2012, 播种期对亚麻白粉病发病指数及产量的影响. 中国麻 业科学, 34(4): 169-173.)
Hanipa H., Zhang H., Wang Z.H., Li Z.Q., and Xiao L., 2013, Occurrence, Growth and Decline of Flax Powdery Mildew(Oidium Lini Skoric) in Yili, Zhongguo Maye Kexue (Plant Fiber Science In China), 35(3): 155-158.(哈尼帕·哈再斯, 张辉, 王振华, 李子钦, 肖克来提, 2013, 新疆伊犁地区胡麻白粉病发生与消长规律研究. 中国麻业科学, 35(3): 155-158.)
He J.Q., Chen G.H., Li J.J., Wang J.L., Yang W.C., and Yang Y, 2006, The Effect of Olidium liniskoric on Raw Straw Yield and Quality of Flax, Zhongguo Maye Kexue (Plant Fiber Science In China), 28(6): 317-321.(何建群, 陈贵荟, 李靖军, 王家兰, 杨万春, 杨芸, 2006, 白粉病对亚麻原茎和种子产量、质量的影响, 中国麻业科学, 28(6): 317-321.)
He J.Q., Chen G.H., Li J.J., Wang J.L., Yang W.C., Yang Y., and Zhou J.H., 2007, The Analysis of Resistance of Flax to Powdery Mildew (Olidium lini skoric) in Field, Zhongguo Maye Kexue (Plant Fiber Science In China), 29(3): 141-144.(何建群, 陈 贵荟, 李靖军, 王家兰, 杨万春, 杨芸, 周进行, 2007, 亚麻品种白粉病田间抗病性分析, 中国麻业科学, 29(3): 141-144.)
Lai Y., Wang P.X., Fan G.Q., Si E.J., Wang J., Yang K., Meng Y.X., Li B.C., Ma X.L., Shang X.W., and Wang H.J., 2013, Genetic diversity and association analysis using SSR markers in barley, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 46(2): 233-242.(赖勇, 王鹏喜, 范贵强, 司二静, 王晋, 杨轲, 孟亚雄, 李葆春, 马小乐, 尚勋武, 王化俊, 2013, 大麦 SSR 标记 遗传多样性及其与农艺性状关联分析, 中国农业科学, 46(2): 233-242.)
Li G.K., Wang G.K., Wang J., Wang J., Luo J.S., and Chu Z. J., 2007, Preliminary study on powdery mildew of flax in Xinjiang, Nongye Kexue (Xinjiang Agricultural Science), (5): 591-594.(李广阔, 王锁牢, 王剑, 王静, 罗吉生, 楚振江, 2007, 新疆亚 麻白粉病的初步研究, 新疆农业科学, (5): 591-594.)
Li M., 2011, Genetic Diversity and Relationship of Flax Germplasm as Revealed by AFLP Analysis, Zuowu Xuebao (Acta Aagronomica Sinica), 37(4): 635-640.(李明, 2011, 亚麻种质资源遗传多样性与亲缘关系的 AFLP 分析, 作物学报, 37(4): 635-640.)
Qiao H.X., and Chen J., Resistance Evaluation of FIax Varieties to Powdery Mildew, Zhongguo Maye Kexue (Plant Fiber Science In China), 2012, 34(3): 118-120.(乔红霞, 陈娟, 2012, 亚麻种质对白粉病的抗性评价, 中国麻业科学, 34(3): 118-120.)
Wang W., Ye C. L., Chen Z., Hu G.F., Ou Q.M., Zhang J.P., and Luo J.J., 2019, Research progress on flax powdery mildew, Zhongguo Youliao Zuowu Xuebao (Chinese Journal of Oil Crops), 41(3): 478-484.(王炜, 叶春雷, 陈琛, 胡冠芳, 欧巧明, 张 建平, 罗俊杰, 2019, 亚麻白粉病研究进展, 中国油料作物学报, 41(3): 478-484.)
Wang Y.F., and Li J.G., 2006, Descriptors and Data Standard for Flax(Linum usitatissimum L.), China Agriculture Press, Beijing, China, pp.65-84.(王玉富, 粟建光, 2006, 亚麻种质资源描述规范和数据标准,中国农业出版社, 北京, 中国, pp65-84.)
Yang X., Li Z.G., Guan F.Z., Liu L.Y., Wu G.W., Wang X., Song X.Y., Zhao D.S., 2007, A Study on the Occurrence Regularity of Flax Powdery Mildew, Zhongguo Maye Kexue (Plant Fiber Science In China), 29(2): 86-89.(杨学, 李柱刚, 关凤芝, 刘丽艳, 吴广文, 王珣, 宋宪友, 赵东升, 2007, 亚麻白粉病发生规律研究, 中国麻业科学, 29(2): 86-89.)
Yang X., Zhao Y., Guan F.Z., Li Z.G., Liu L.Y., Wu G.W., Wang X., Song X.Y., Liu Z.J., Lu Y., Li T., and Kang Q.H., 2008, Genet analysis of resistance to powdery mildew in flax line 9801-1, Zhiwu Bingli Xuebao (Acta Phytopathologica Sinica), 38(6): 656-658.(杨学, 赵云, 关凤芝, 李柱刚, 刘丽艳, 吴广文, 王珣, 宋宪友, 刘昭军, 路颖, 李铁, 康庆华, 2008, 亚麻品系 9801-1 对白粉病的抗性遗传分析, 植物病理学报, 38(6): 656-658.)
Zhang Q., Guo D., Fan Q.Q., Huang C.Y., He M.R., and Sui X.X., 2012, Resistance identification of some wheat germplasms from Shandong Province to Powdery Mildew at Adult and Seedling Stages, Shandong Nongye Kexue (Shangdong Agricultural Science), 44(5): 86-88.(张秋, 郭栋, 樊庆琦, 黄承彦, 贺明荣, 隋新霞, 2012, 山东省部分小麦种质成株期和苗期白粉病 抗性鉴定. 山东农业科学, 44(5): 86-88.)
文献摘自:李恭泽,郭栋良,江海霞,闫文亮,杨亮杰,张喻,谢丽琼.379份亚麻种质白粉病抗性遗传多样性分析[J/OL].分子植物育种;1-21[2023-04-09].http;//kns.cnki.net/kcms/detail/46.1068.S.20230322.1820.019.html