摘 要:【背景】麻类生物脱胶与化学法脱胶相比具有环保优势。【目的】为获得用于汉麻生物脱胶的高效果胶酶菌株。【方法】使用以果胶为唯一碳源的培养基,采用平板稀释法进行菌株筛选,通过生理生化实验和 16S rRNA 基因序列比对鉴定目标菌株。采用单因素实验优化产酶条件,并验证该条件下汉麻生物脱胶效果。【结果】获得一株具备高活性的果胶酶
菌株,归类为果胶杆菌 WNH(Pectobacterium aroidearum WNH)。在培养温度 27 °C、转速为160 r/min、接种量 10%、初始 pH=7 的条件下培养 16 h 后,果胶杆菌 WNH 的粗酶液果胶酶活力达 155.03 U/mL。按上述条件对汉麻韧皮进行二次脱胶处理,处理后脱胶率为 27.18%,较对照组提高了 6.93%。【结论】果胶杆菌 WNH 具备汉麻生物脱胶的潜力。
关键词:果胶杆菌;果胶酶;汉麻;纤维;生物脱胶
汉麻纤维是一种优秀的纺织原材料,具有抗紫外线、吸湿散热、透气性能良好等特点,被广泛应用于纺织纤维和新型复合材料等领域,具有很大的应用潜力。汉麻纤维主要位于汉麻茎秆的韧皮部,分为初生纤维和次生纤维,其中初生纤维长度为 20−50 mm,次生纤维长度约 2 mm[1]。初生纤维与次生纤维的长度差异主要受纤维细胞细胞壁上糖种类不同影响,这种长度差异也导致汉麻纤维的脱胶采取的是适度脱胶而非全脱胶[2]。传统的天然沤麻法劳动力需求大,脱胶过程控制难度大;化学法脱胶胶质去除率高,但容易损伤纤维质量且能耗高、环境污染大[3]。微生物法脱胶作为一种新兴的汉麻纤维预处理技术,利用微生物分泌的果胶酶、木聚糖酶[4]等胶质降解酶在温和的反应条件下,能以较低的能量消耗、较轻微的环境污染实现汉麻纤维的适度脱胶,并保证脱胶后纤维的长度与质量。
微生物法脱胶通常分为两种,一是直接施用脱胶微生物进行脱胶,以“胶养菌,菌产酶,酶脱胶”的方式实现汉麻纤维的脱胶;二是收集并纯化脱胶微生物分泌的果胶酶等胶质分解酶,在适当的酶反应条件下完成脱胶,这两类脱胶方式的关键均是高效脱胶微生物的作用[5],优质的菌种资源该脱胶方法能取得进一步发展的基石。研究者们尝试从土壤等样本中分离功能细菌,已获得具备生物脱胶能力的菌株主要有芽孢杆菌属、果胶杆菌属、欧文氏菌属、假单胞菌属、白腐真菌[6−11]等。Cheng等人[12]在土壤样品中分离出一株苏云金芽孢杆菌,果胶酶活力达 98.2 U/mL,脱胶后纤维残胶率为8.32%。Guo[13]等对芽孢杆菌 Y1 的产果胶酶性能进行优化,使多聚半乳糖醛酸酶酶活力提高 3.44 倍,脱胶时间缩短 12 h。Nadezhda 等[14]通过在 M63 甘油培养基中添加多聚半乳糖醛酸和马铃薯提取物进行诱导,使黑腐果胶杆菌 SCRI1043 的果胶酶活性提高 64.8 倍,为 194.4 U/mL。果胶酶是汉麻生物脱胶中的关键酶类[15],Maisuria 等[16]对果胶杆菌亚种 BR1 分泌的果胶酶性质进行分析,该酶能在50−70 °C、pH 为 8.0 的条件下,保持酶活力的稳定,表明该菌具备应用于纤维脱胶的潜力。通过筛选高效果胶酶菌株,并优化菌株产果胶酶能力是改善汉麻生物脱胶效果、缩短脱胶时间的有效途径。本研究拟从雨露沤麻及原位土壤混合样品中筛选获得高效的果胶酶菌株,通过单因素试验优化菌株产果胶酶能力,改善其汉麻生物脱胶效果,以期为汉麻生物脱胶提供一定的资源储备。
1材料与方法
1.1材料
微生物分离样品来自黑龙江省大庆市东风农场,为天然环境下沤制 15−20 d 的雨露沤麻及原位土壤混合样品;汉麻韧皮同样来自于东风农场,通过手工剥制获得的晾干麻束。汉麻品种为“火麻一号”。
果胶无机盐琼脂培养基[17](PMAS),PMAS 液体培养基不添加琼脂。
主要试剂和仪器:生物扫描电镜(SEM),Hitachi 日立;测序仪,PCR 仪,ABI;细菌基因组提取试剂盒,天根生化;双束紫外分光光度计,北京普析;电热恒温培养箱,上海森信;冷冻离心机,Eppendorf。
1.2方法
1.2.1菌株的分离纯化
称取 5 g 采集的雨露沤麻样品,加入 100 mL 的无菌生理盐水,30 °C、120 r/min 振荡培养 30 min,取上清液进行后续处理。将上清液按梯度稀释法稀释,获得浓度梯度为 1×10−3、1×10−4、1×10−5 三个梯度的稀释液,吸取 100 μL 稀释液,涂布于 PMAS 固体培养基上,于 33 °C 恒温培养箱倒置培养48 h,每个稀释梯度重复三次。连续分离纯化 5−6 代后,观察菌落生长情况,将形状稳定的单菌落转移至 PMAS 液体培养基中培养,在此后将培养好的菌液通过甘油法保藏。
1.2.2产果胶酶能力细菌的筛选
初筛:将分离平板中获得的单菌落接入鉴定用平板,33 °C 静置培养 24 h 后,使用 7 g/L 刚果红溶液进行染色,染色持续 20 min,然后用 1 mol/L 氯化钠溶液进行冲洗,观察菌落周围是否出现透明圈。若出现透明圈,则测量和计算透明圈直径与菌落直径的比值,即圈径比,选取菌落直径较大,圈径比较大的细菌作为目标菌株,以用于复筛。
复筛:将初筛得到的细菌进行扩大培养,取培养 24 h 后的发酵液,经 4 °C、10 000 r/min 离心 5 min,获得上清液。取离心后的上清液进行果胶酶酶活力的测定,酶活力的测定使用 DNS 法进行,并使用考马斯亮蓝法测定此时上清液的蛋白浓度。测定过程中使用的标准样品为半乳糖醛酸和牛血清白蛋白。酶活定义为:在 50 °C 的条件下,每 1 min 水解果胶产生 1 μg 半乳糖醛酸为一个酶活单位(U)。
1.2.3 菌株形态学及生理生化特性研究
通过划线分离法在平板上获得分离后的单菌落,观察并记录单菌落的形态、颜色、透明度、边缘光滑程度及是否凸起等特征。使用扫描电镜观察菌株的形态。根据《伯杰氏系统细菌学手册》[18]对菌株 WNH 的生理生化指标进行检验。
1.2.4 细菌 16S rRNA 基因测序及序列分析
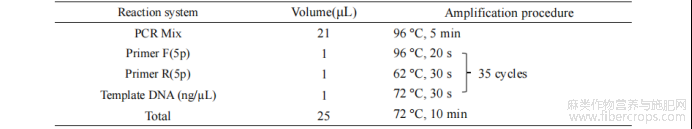
使用细菌基因组提取试剂盒按柱式法提取基因组 DNA,16s rRNA 序列 PCR 扩增采用细菌通用引物 27F 和 1492R,引物信息如表 1 所示。PCR 产物由北京六合华大基因科技有限公司完成测序,反应体系及条件如表 2 所示。在测序后将该菌株基因序列在 NCBI 上进行 BLAST 比对分析,选择同源性高的标准菌株及序列,使用软件 MEGA11.0 构建系统发育树。
表1 16s rRNA 序列扩增引物
表 2 PCR 扩增反应体系和条件
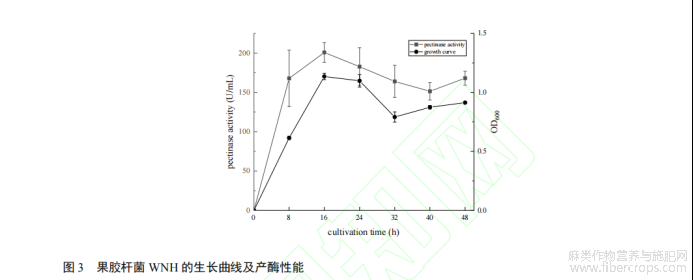
1.2.5 果胶杆菌 WNH 的生长曲线及产酶能力
取活化后的种子液,按 10%的接种量接种至 PMAS 培养基中,在 33 °C、140 r/min 的培养条件下培养 48 h。前 24 h 每 8 小时取菌液样品,后 24 h 每隔 12 h 取样,使用分光光度计测量样品在波长 600 nm 处的吸光值,获得菌株 WNH 的生长曲线;使用 1.2.2 中的果胶酶酶活测定方法对菌液样品进行处理,测定每个取样点时,果胶杆菌 WNH 的产酶性能。
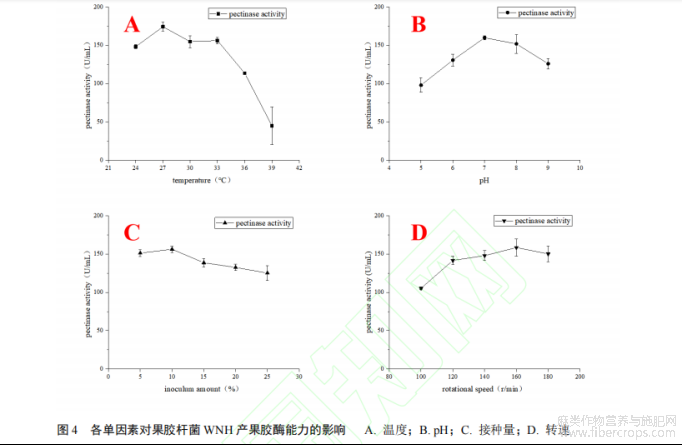
1.2.6 果胶杆菌 WNH 的产酶能力的优化
通过单因素实验设计,只改变培养温度、初始 pH、转速和接种量等因素,探索果胶杆菌 WNH分泌胞外果胶酶的最适条件。使用 1.2.2 中的酶活测定方法测定不同条件下培养后菌液样品中果胶酶酶活力,分析并选择最适条件进行产酶验证,测定该条件下果胶酶酶活力水平。
1.2.7 果胶杆菌 WNH 对汉麻韧皮的脱胶能力
使用果胶杆菌 WNH 进行脱胶实验。将保藏的菌株 WNH 进行活化,33 °C 培养 48 h 后获得种子液。将汉麻韧皮用清水冲洗一遍后晾干,取 2.1±0.1 g 的汉麻韧皮添加至对应的培养基中,将种子液按 10%的比例接种,33 °C、120 r/min 处理 24 h,对照组不接种种子液。处理后将汉麻韧皮用流水冲洗 4−5 遍,于 105 °C 烘箱中烘干至恒重。结合脱胶率、扫描电子显微镜观察等方法评估果胶杆菌 WNH 的汉麻脱胶效果。
脱胶率计算方式如下:

2 结果与分析
2.1 菌株 WNH 的形态学观察及生理生化试验
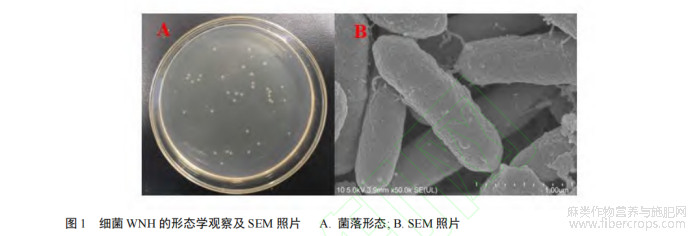
该细菌在 PMAS 固体琼脂平板上生长较快,24−36 h 即可形成成熟菌落。如图 1 所示,菌落直径为 0.3−0.5 cm,形态呈乳白色的圆形菌落,质地不透明且有光泽,边缘光滑。通过 SEM 观察可得,菌体呈杆状,约为(18.6−37.6 μm)×5 μm。刚果红染色结果为圈径比 6.06±0.53,菌落直径为 0.37 cm,在 PMAS 液体培养基中培养 24 h 后,果胶酶酶活力达 85.05 U/mL,粗酶液中蛋白浓度为 19.9 mg/mL。
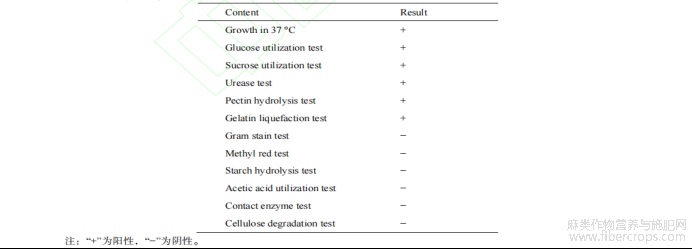
表 3 细菌 WNH 的生理生化鉴定
细菌 WNH 的生理生化鉴定结果如表 3 所示。该细菌能在 37 °C 下生长,能使明胶液化,能够利用果胶并分泌果胶酶,能以葡萄糖、蔗糖等为唯一碳源进行生长,但不能以淀粉、乙酸等为唯一碳源生长。这些特征与标准菌株 P.aroidearum SCRI 109[15−16]的特征一致。该菌革兰氏染色结果呈红色,为阴性菌;甲基红实验为阴性,不能利用丙酮酸;脲酶试验呈现阳性,说明其能分泌脲酶,降解尿素;接触酶试验呈阴性,说明该菌不能产生过氧化氢酶。这与肠杆菌目细菌的生化特征相符。纤维素降解试验为阴性,说明该菌不具备分泌纤维素酶的能力,不能分解纤维素,能够作为脱胶菌应用于汉麻生物脱胶中。
2.2 细菌 WNH 的分子生物学鉴定
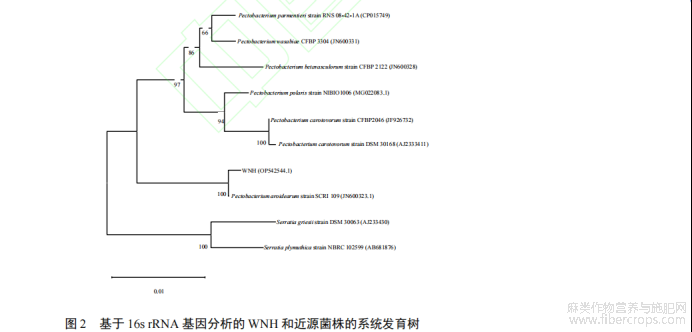
使用 BLAST 工具将细菌 WNH 的 16S rRNA 基因数据与 NCBI 数据库进行比对,选择同源性较高的菌株。结果表明,细菌 WNH 与 GenBank 中的果胶杆菌属同源性最高,相似度超过 99.9%。通过系统发育树构筑软件 MEGA−11 构建系统发育树,如图 1 所示。综合 16S rRNA 基因测序结果、
菌株形态学特征及生理生化指标的试验结果,判断细菌 WNH 为一株果胶杆菌(P. aroidearum),属于肠杆菌目溶果胶菌科。
2.3 果胶杆菌 WNH 的生长曲线及产酶性能
为评估果胶杆菌 WNH 分泌果胶酶的能力,对果胶杆菌 WNH 的生长曲线和酶活力曲线进行测定,结果如图 3 所示,果胶杆菌 WNH 的生长速度较快,接种后潜伏期较短,16 h 取样时已结束对数生长期,进入稳定期。随后直至取样结束时,体系内细菌量均维持在较高水平。果胶酶酶活力的趋势与生长曲线相似,接种后至 16 h 这一期间内,酶活力有显著提高,随后有一定降低但趋于稳定。
2.4 果胶杆菌 WNH 的产酶性能优化
为优化果胶杆菌 WNH 分泌果胶酶的能力,如图 4 所示,采用单因素优化的方法,依次探究温度、pH、接种量和转速这四个因素对果胶杆菌 WNH 果胶酶分泌能力的影响。各因素对果胶酶酶活力的影响均表现为先上升后下降的趋势,其中培养温度为 27 °C 时、pH 为 7.0、接种量为 10%和转
速为 160 r/min 时分别在各自曲线中呈现出最高的果胶酶酶活力,使用该条件培养果胶杆菌 WNH,培养 16 h 后其果胶酶酶活力为 155.03 U/mL。
2.5 生物脱胶效果
通过扫描电镜观察可得,使用果胶杆菌 WNH 对汉麻韧皮进行二次脱胶处理前,汉麻韧皮纤维表面粗糙,有大量胶质等物质残留,纤维束间连接紧密,分离现象不明显(图 5 A.B.C);处理后汉麻韧皮纤维表面光洁,胶质残留少,纤维分离明显(图 5 D.E.F)。处理后的汉麻韧皮纤维柔软蓬松,色泽柔和,实验组韧皮纤维脱胶率为 27.18%,对照组为 20.25%,较对照组提高了 6.93%。说明果胶杆菌 WNH 具备汉麻生物脱胶能力,能进一步降低汉麻韧皮中的胶质含量,有助于汉麻纤维质量的改善。
3 讨论与结论
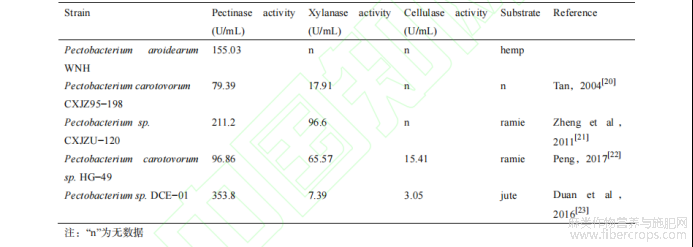
麻类纤维的生物脱胶处理始终是麻类相关研究的热点,优质的微生物资源则是生物脱胶处理的关键。研究者们发现[19],果胶杆菌多数具备较强的果胶降解能力,能够应用于麻类生物脱胶的生产实践中。本研究筛选获得的果胶杆菌 WNH 与其他已发表菌株(表 4)相比,具备较高的果胶酶酶活力水平,未检测到纤维素降解现象,但尚未验证其是否同样具备分泌木聚糖酶的能力。综上所述,该细菌拥有较强果胶酶分泌能力,能有效实现果胶类物质的降解,且对麻纤维的损伤较小。
表4 果胶杆菌 WNH 与已发表菌株产酶性能的对比
与苎麻等麻类的研究相比,汉麻生物脱胶的研究则相对较少,且由于汉麻原料的特殊性,汉麻生物脱胶难度较大。但汉麻纤维性能相对优异,吸引诸多研究者进行研究,杨田[24]等筛选的枯草芽孢杆菌可以在脱胶处理 4 d 后将残胶率降低到 13%,精干麻纤维柔软、色泽光亮。童艺翾[25]等使用厌氧生物脱胶系统,处理 72 h 后,汉麻纤维残胶率为 20.13%。Li[26]等使用裂褶菌(Schizophyllum commune)处理汉麻纤维两周,木质素、半纤维素等含量均呈现不同程度的降低,但分泌的纤维素酶的造成一定程度的纤维损伤。成莉凤[27]克隆纯化果胶解聚酶 419 和 G403,较原始菌株 DCE−01 分泌的果胶解聚酶酶活力分别提高了 13.3 倍和 2.2 倍,且两株酶均表现出良好的耐热耐碱性。Alqahtani[28]将来自枯草芽孢杆菌 15A B−92 的果胶酶进行纯化,纯化后果胶酶比活性为 99.6 U/mg,纯化程度为 11.6 倍。Xu[29]采用基因工程方法获得的分泌突变型果胶酸裂解酶(Pel419) 的菌株 V52A,其处理苎麻效果与商业果胶酶处于同一水平。Rafique [30]从胡萝卜软腐果胶杆菌中分离出编码内切半乳糖醛酸酶的基因,使用 pHT43 表达载体于枯草芽孢杆菌中进行表达,能在 IPTG 诱导培养下稳定表达胞外果胶酶。
本研究获得的果胶杆菌 WNH 进行汉麻生物脱胶,经脱胶处理后,汉麻纤维手感柔和、分散明显,通过 SEM 观察纤维表面的微观结构,发现纤维表面光滑、胶质残留少、纤维损伤少,有利于其在纺织等领域的应用,说明该果胶杆菌 WNH 具被应用于汉麻生物脱胶生产的潜力。
本研究获得一株能高效分泌胞外果胶酶、具备一定脱胶功能的果胶杆菌 WNH(P.aroidearum WNH),在培养温度 27 °C、转速为 160 r/min、接种量 10%、初始 pH=7、培养菌株 WNH 16 h 的条件下,果胶酶酶活力为 155.03 U/mL。使用果胶杆菌 WNH 对汉麻韧皮进行二次脱胶处理,其脱胶率为 27.18%,较对照组显著提高 6.93%。该菌株具备汉麻生物脱胶的应用潜力。
本研究主要就果胶杆菌 WNH 的产酶性能和脱胶效果进行研究。要进一步提高其产酶能力,更好的发挥脱胶功能,通过果胶酶纯化、果胶酶基因异源表达等方法,将是今后的研究方向。
参考文献
[1] Salentijn EMJ, Zhang QY, Amaducci S, Yang M, Trindade LM. New developments in fiber hemp (Cannabis sativa L.) breeding[J]. Industrial Crops and Products, 2015, 68: 32−41.
[2] 赵越, 王晓楠, 孙宇峰, 曹焜, 韩承伟, 姜颖, 韩喜财, 张晓艳, 边境. 工业大麻纤维产量、品质影响因素及纤维发育相关基因研究进展[J]. 中国麻业科学, 2021, 43(3): 155−160.
[3] Cheng LF, Wang QM, Feng XY, Duan SW, Yang Q, Zheng K, Liu ZY, Liu ZC, Peng YD. Screening a bacterium and its effect on the biological degumming of ramie and kenaf[J]. Scientia Agricola, 2018, 75(5): 375−380.
[4] Subash MC, Muthiah P. Eco−friendly degumming of natural fibers for textile applications: A comprehensive review[J]. Cleaner Engineering and Technology, 2021, 5: 100304.
[5] 荆瑞勇, 王丽艳, 郭永霞. 室内模拟土壤中可培养微生物数量在不同水分条件下的动态变化[J]. 黑龙江八一农垦大学学报, 2015, 27(4): 77−81.
[6] 王慧慧, 张非, 舒潼, 李攀登, 吴亚, 余天意, 付春华, 余龙江. 两株芽孢杆菌在苎麻纤维复合脱胶中的应用[J]. 微生物学通报, 2021, 48(8): 2512−2523.
[7] 吴亚, 刘一, 舒潼, 王慧慧, 李攀登, 杨英, 余龙江. 芽孢杆菌苎麻脱胶动态过程分析[J]. 生物技术通报, 2021, 37(12): 22−28.
[8] Datta S, Saha D, Chattopadhyay L, Majumdar B. Genome comparison identifies different Bacillus species in a bast fibre−retting bacterial consortium and provides insights into pectin degrading genes[J]. Scientific Reports, 2020, 10: 8169.
[9] Duan SW, Xu BR, Cheng LF, Feng XY, Yang Q, Zheng K, Gao MQ, Liu ZY, Liu CJ, Peng YD. Bacterial strain for bast fiber crops degumming and its bio−degumming technique[J]. Bioprocess and Biosystems Engineering, 2021, 44(12): 2503−2512.
[10] Rehman HU, Aman A, Nawaz MA, Qader SAU. Characterization of pectin degrading polygalacturonase produced by Bacillus licheniformis KIBGE−IB21[J]. Food Hydrocolloids, 2015, 43: 819−824.
[11] Wang YW, Bai Y, Shu T, Fan P, Zhang HS, Turunen O, Xiong HR, Yu LJ. Characterization of a versatile glycoside hydrolase Cel5M from Pectobacterium carotovorum HG−49 for ramie degumming[J]. Textile Research Journal, 2020, 90(13/14): 1602−1615.
[12] Cheng LF, Duan SW, Feng XY, Zheng K, Yang Q, Xu H, Luo W, Peng YD. Screening and identification of pectinolytic bacteria for ramie degumming[J]. Textile Research Journal, 2021, 91(9/10): 1056−1064.
[13] Guo FF, Li XZ, Zhao J, Li GX, Gao PK, Han XL. Optimizing culture conditions by statistical approach to enhance production of pectinase from Bacillus sp. Y1[J]. BioMed Research International, 2019, 2019: 8146948.
[14] Tarasova N, Gorshkov V, Petrova O, Gogolev Y. Potato signal molecules that activate pectate lyase synthesis in Pectobacterium atrosepticum SCRI1043[J]. World Journal of Microbiology and Biotechnology, 2013, 29(7): 1189−1196.
[15] Hossain MM, Siddiquee S, Kumar V. Critical factors for optimum biodegradation of bast fiber's gums in bacterial retting[J]. Fibers, 2021, 9(8): 52.
[16] Maisuria VB, Nerurkar AS. Biochemical properties and thermal behavior of pectate lyase produced by Pectobacterium carotovorum subsp. carotovorum BR1 with industrial potentials[J]. Biochemical Engineering Journal, 2012, 63: 22−30.
[17] Moawad H, El-Rahim AWM, Hashem MM, Gebreil GM, Sabbor A & Zakaria M. Retting and degumming of flax using biotechnology eco-friendly approach[J]. Egyptian Journal of Chemistry, 2019, 62(11): 2033-2045.
[18] Buchanan RE. 伯杰氏系统细菌学手册[M]. 北京: 中国科学出版社, 1984.
[19] Hélias V, Hamon P, Huchet E, Wolf JVD, Andrivon D. Two new effective semiselective crystal violet pectate media for isolation of Pectobacterium and Dickeya[J]. Plant Pathology, 2012, 61(2): 339−345.
[20] 谭秀山. CXJZ95−198 菌株分泌果胶酶和半纤维素酶的活性研究及果胶酶的分离纯化[D]. 乌鲁木齐: 新疆农业大学硕士学位论文, 2004.
[21] 郑科, 段盛文, 刘正初, 冯湘沅, 成莉凤, 郑霞. 胡萝卜软腐欧文氏菌 CXJZU−120 的选育及其脱胶性能研究[J]. 中国农业科技导报, 2011, 13(6): 72−77.
[22] 彭咏絮. 胡萝卜软腐果胶杆菌 HG−49 及其 ManA 酶在苎麻脱胶中的应用[D]. 武汉: 华中科技大学硕士学位论文, 2017.
[23] Duan SW, Feng XY, Cheng LF, Peng YD, Zheng K, Liu ZC. Bio−degumming technology of jute bast by Pectobacterium sp. DCE−01[J]. AMB Express, 2016, 6(1): 86.
[24] 杨田, 随树珍, 刘逸寒, 黎明. 大麻纤维微生物脱胶菌株的筛选、鉴定及其应用[J]. 天津科技大学学报, 2017, 32(4): 24−29, 35.
[25] 童艺翾, 李毓陵, 马颜雪, 崔运花, 刘芳, 任泺彤, 陈小光. 麻纤维厌氧生物脱胶系统的脱胶特性研究[J]. 中国麻业科学, 2021, 43(1): 26−31, 38.
[26] Li Y, Pickering KL, Farrell RL. Analysis of green hemp fibre reinforced composites using bag retting and white rot fungal treatments[J]. Industrial Crops and Products, 2009, 29(2/3): 420−426.
[27] 成莉凤. DCE−01 菌株果胶酶基因克隆与表达及其多样性研究[D]. 北京: 中国农业科学院博士学位论文, 2013.
[28] Alqahtani YS, More SS, R K, Shaikh IA, K J A, More VS, Niyonzima FN, Muddapur UM, Khan AA. Production and purification of pectinase from Bacillus subtilis 15A−B92 and its biotechnological applications[J]. Molecules: Basel, Switzerland, 2022, 27(13): 4195.
[29] Xu H, Feng XY, Yang Q, Zheng K, Yi L, Duan SW, Cheng LF. Improvement on thermostability of pectate lyase and its potential application to ramie degumming[J]. Polymers, 2022, 14(14): 2878.
[30] Rafique N, Bashir S, Khan MZ, Hayat I, Orts W, Wong DWS. Metabolic engineering of Bacillus subtilis with an endopolygalacturonase gene isolated from Pectobacterium. carotovorum; a plant pathogenic bacterial strain[J]. PLoS One, 2021, 16(12): e0256562.
文章摘自:刘嘉乐,郭媛,黄荣,赵信林,邱财生,邱化蛟,王伟东.果胶杆菌(Pectobacterium aroidearum)WNH的筛选及其汉麻生物脱胶效果[J/OL].微生物学通报:1-13[2022-12-02].DOI:10.13344/j.microbiol.china.220826.