摘 要:为了解秋水仙素处理对苎麻腋芽生长发育的影响,以湘饲纤兼用苎1号腋芽为实验材料,用不同浓度的秋水仙素溶液处理不同的时间,结果显示:用1.8mg/mL的秋水仙素处理48h,苎麻株高、茎粗和分株力状况较好;用1.5mg/mL的秋水仙素处理72h,苎麻的原麻产量较高;用5mg/mL的秋水仙素处理24h,苎麻的纤维强度较好;用10mg/mL的秋水仙素处理72h,苎麻的纤维支数最优?相关性分析结果表明:株高与茎粗、纤维强度和分株力呈显著性正相关;纤维支数与株高、茎粗和纤维强度极显著负相关?接近半致死剂量的处理组合为10mg/mL的秋水仙素处理腋芽72h,其致死率达到43.33%,秋水仙素诱变当代的农艺性状出现差异?
关键词:苎麻;腋芽;秋水仙素;化学诱变
苎麻属于荨麻科苎麻属,是一种多年生、无性繁殖的纤维作物,是我国四大纤维作物之一,其产量约占全世界苎麻产量的90%以上[1]?新中国成立后,各地苎麻育种工作者采用地方良种鉴定、引种、系统选择、杂交育种、辐射育种等各种育种手段先后培育出了30多个苎麻新品种,其中通过化学诱变选育出Tri-1和Tri-2两个品种[2]?由于苎麻品种资源高度的杂合性引起基因的复杂遗传和频繁的多倍性这两大严重障碍,使得苎麻杂交育种时间长,效率低;化学诱变育种在植物育种领域有较广泛的应用[3-4]?秋水仙素是植物化学诱变育种尤其是植物倍性育种广泛使用的诱变剂之一,可促使染色体加倍,从而有效诱导出双单倍体、四倍体或多倍体嵌合体等[5-6]?因此,应用秋水仙素进行化学诱变可能是苎麻育种的重要途径之一?前人研究表明[7],秋水仙素能够抑制纺锤丝的形成,导致细胞不能正常形成纺锤丝,进而导致染色体数目加倍?国内外曾多次利用秋水仙素处理植株种子、子叶、生长点等部位来人工诱导、培育多倍体植株,方法简单,技术要求低,处理量大,可直接从优良植株上获得多倍体[8-9]?
郑思乡等[10]研究了组织培养结合秋水仙素不同浓度和处理时间对苎麻试管苗的诱导效果,最终经不定芽诱导和继代培养后,发现获得的变异株染色体数目出现多样性,其中包括四倍体、三倍体、二倍体和多种非整倍体细胞?邓衍明等[11]用500、1000和2000mg/L秋水仙素溶液处理长度为0(未萌发)、3~5和8~10mm的茉莉腋芽24~48h,结果表明茉莉腋芽适宜的诱导条件为用500mg/L秋水滴管滴加蒸馏水保湿?每处理30个腋芽,3次重复;处理时间为24、48、72h?对照组为苎麻植株去顶芽后,腋芽不进行秋水仙素的涂抹,分别对诱变腋芽扦插苗的株高、茎粗、纤维细度和纤维强度进行分析,以明确秋水仙素诱变苎麻腋芽的最佳浓度和处理时间,为苎麻的化学诱变育种提供参考。
1材料和方法
1.1试验地点和材料
试验在湖南农业大学浏阳实习基地进行。试验材料为湘饲纤兼用苎1号,由湖南农业大学苎麻研究所提供。
1.2试验方法
1.2.1试验设计
在4月底,选择长势良好的苎麻,摘除顶芽,并用棉花沾取不同浓度(1.2、1.5、1.8、2.1、5.0、10.0mg/mL)的秋水仙素溶液包裹腋芽,每日早中晚用滴管滴加蒸馏水保湿?每处理30个腋芽,3次重复;处理时间为24、48、72h?对照组为苎麻植株去顶芽后,腋芽不进行秋水仙素的涂抹?诱变处理后等腋芽长到5~10cm高时,进行扦插、移栽,对移栽后的苎麻进行株高、茎粗、纤维品质的测量?
1.2.2测定指标及方法
株高采用直尺法,茎粗采用游标卡尺法,纤维强度和纤维支数参考汪娅梅等[12]的方法?
腋芽致死率=(死亡腋芽数/涂抹腋芽数)×100%?
1.2.3数据处理
数据采用Excel进行处理,方差分析采用DPS进行处理?
2结果与分析
2.1秋水仙素处理对湘饲纤兼用苎1号腋芽的影响
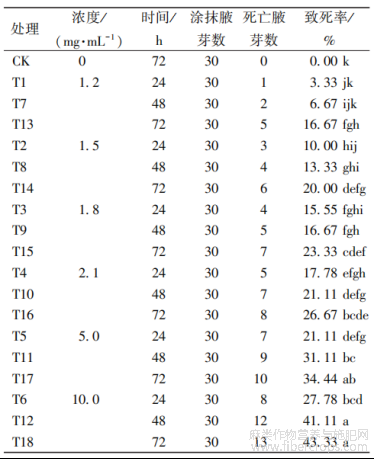
经秋水仙素不同浓度处理24、48、72h后,对其成活率(表1)统计发现,随秋水仙素浓度增加和处理时间延长,苎麻腋芽成活率逐渐下降,且不同的浓度梯度和处理时间腋芽成活率有差异,说明秋水仙素对湘饲纤兼用苎1号腋芽有影响?最大浓度
表1不同浓度和时间秋水仙素处理后腋芽的致死率
10.0mg/mL的秋水仙素处理72h后,其致死率达到43.33%,接近半致死剂量(致死率)?试验发现,同一浓度下处理时间越长致死率越高,同一处理时间下,浓度越大,致死率也越高?
2.2秋水仙素处理腋芽后对湘饲纤兼用苎1号生长和纤维发育的影响
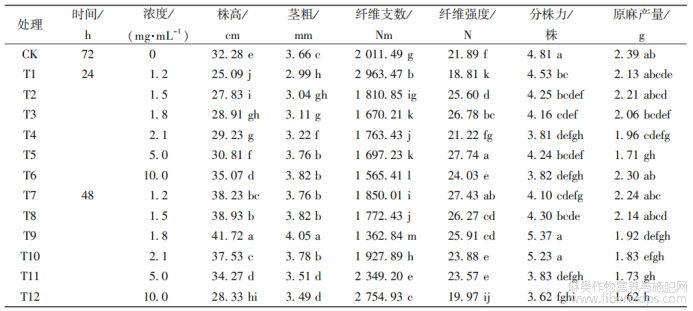
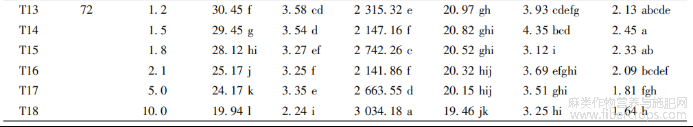
用不同浓度的秋水仙素处理湘饲纤兼用苎1号腋芽24、48、72h后,待腋芽长至5~10cm时,对其进行扦插、移栽?移栽后,待到成熟期测量其株高、茎粗、纤维支数、纤维强度、分株力和原麻产量?从表2可看出,对照组(用清水处理腋芽72h)株高、茎粗、纤维支数、纤维强度分别为32.28cm、3.66mm、2011.49Nm、21.89N?而经过秋水仙素处理后,以上各项指标差异显著,用1.8mg/mL的秋水仙素处理48h,株高为41.72cm、茎粗为4.05cm;用10.0mg/mL的秋水仙素处理72h,纤维支数为3034.18Nm;用5.0mg/mL的秋水仙素处理24h,纤维强度为27.74N?
与对照组相比,随处理浓度和时间的变化,其株高、茎粗、纤维支数、纤维强度、分株力和原麻产量均有差异?在绝大部分情况下,随秋水仙素浓度和处理时间的增加,苎麻的株高、茎粗、纤维支数、纤维强度、分株力和原麻产量表现出明显的下降趋势,同时也发现秋水仙素诱变浓度和处理时间不同,但诱变剂量相同时,处理时间越长,抑制效果越明显?
从秋水仙素处理时间看,在处理48h后的株高和茎粗提高较大,而处理72h后的各个浓度处理均显著低于对照组,有抑制作用;从秋水仙素的浓度来看,随着浓度的增大,其株高和茎粗的生长都受到抑制?在经过24h处理后,株高在10.0mg/mL处理时(T6)明显高于对照组,茎粗在5.0和10.0mg/mL处理时(T5、T6)明显高于对照组;在经过48h处理后,株高和茎粗都在1.8mg/mL处理时(T9)达到最大值,而株高在10.0mg/mL(T12)、茎粗在5.0和10.0mg/mL处理时(T11、T12)均低于对照组;在经过72h处理后,两者各个浓度处理都明显低于对照组,这说明在同一浓度下,随时间的延长,苎麻的株高和茎粗受到不同程度的抑制?
对纤维支数和纤维强度而言,在绝大部分情况下,在同一处理浓度下,随秋水仙素处理时间的增加,其纤维支数和强度都表现出先升后降的趋势?在同一处理时间下,随秋水仙素处理浓度的增加,其纤维支数和强度都呈现出无规律的上升趋势或下降趋势?在处理24h后,纤维支数随着处理浓度的增加而呈下降趋势,纤维强度随处理浓度的增加而呈上升趋势;在处理48h后,随着处理浓度的增加,纤维支数在1.8mg/mL处理时(T9)达到最小值,而纤维强度在此浓度也明显高于对照组,为25.91N;在处理72h后,纤维支数和强度都有显著性差异,纤维支数显著高于对照组,但纤维强度显著低于对照组,说明这一处理可能对苎麻的纤维支数起促进作用?
表2秋水仙素处理后苎麻农艺性状分析
在大部分情况下,同一处理时间,随秋水仙素处理浓度的增加,其分株力和原麻产量都呈现出无规律的上升或下降?在处理48h后,随处理浓度的增加,分株力在1.8mg/mL处理时(T9)达到最大值,明显高于对照组;在处理72h后,原麻产量在1.5mg/mL处理时(T14)达到最大值,为2.45g?
从总体上看,用1.8mg/mL的秋水仙素处理48h,苎麻株高、茎粗和分株力状况较好;用1.5mg/mL的秋水仙素处理72h,苎麻的原麻产量较高;用5.0mg/mL的秋水仙素处理24h,苎麻的纤维强度较好;用10.0mg/mL的秋水仙素处理72h,苎麻的纤维支数最优?
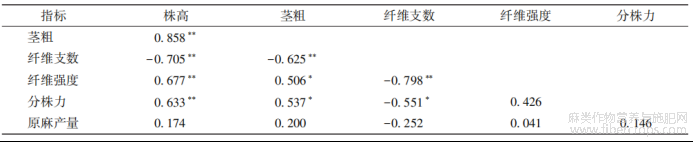
2.3秋水仙素处理湘饲纤兼用苎1号腋芽后各指标间的相关分析
相关性分析结果表明(表3),不同浓度和处理时间的秋水仙素对湘饲纤兼用苎1号腋芽处理,进行扦插、移栽后,其株高与茎粗、纤维强度和分株力呈极显著正相关,相关系数分别为0.858、0.677和0.633;纤维支数与株高、茎粗和纤维强度极显著负相关?
表3秋水仙素处理腋芽后各指标间的相关系数
3讨论
利用化学诱变技术人工诱发遗传变异是丰富作物种质资源、选育作物新品种的重要手段之一?秋水仙素可使细胞停顿在分裂中期并阻碍染色体复制和染色体向两极移动,但溶于水且有毒[13]?范国强等[14]认为,秋水仙素是一种具有毒性的化学诱变剂,它诱导植物染色体加倍时还会对植株产生毒害作用,抑制植物生长发育,严重时导致植物死亡,因此筛选秋水仙素最佳处理浓度和时间非常重要?一般认为,随着外源秋水仙素浓度和处理时间增加,处理植株的存活率、变异率和诱导率呈下降趋势?
秋水仙素在多倍体诱导育种中应用较广泛,而控制秋水仙素处理浓度和时间是诱发多倍体的关键,浓度较低或者处理时间较短都不能达到理想效果,而浓度过高或时间过长会毒害植株,甚至导致死亡[15]?另外,不同物种诱变所采用的最佳秋水仙素浓度和处理时间都存在较大差异[16-17]?本研究中,利用不同浓度的秋水仙素对湘饲纤兼用苎1号腋芽进行不同时间处理,扦插、移栽后,对其株高、茎粗、纤维支数和纤维强度的影响也有显著性差异?因此,有必要对湘饲纤兼用苎1号腋芽的秋水仙素诱变条件进行筛选和优化?
秋水仙素浓度在1.2~10.0mg/mL时,湘饲纤兼用苎1号腋芽致死率未达到50%,说明此浓度范围内秋水仙素对苎麻腋芽的破坏不大,同时秋水仙素的不同处理时间对各个指标的影响较显著?因此,在后期利用秋水仙素对苎麻进行诱变时,要对试验浓度和处理时间进行反复筛选和不断优化,争取达到较好的诱导效果?
4小结
秋水仙素可直接处理苎麻腋芽,10.0mg/mL处理腋芽72h可使苎麻腋芽致死率达43.33%?秋水仙素处理可使苎麻诱变当代(M0)个体出现性状差
异,利于育种选择?
参考文献
[1]许英,陈建华,栾明宝,等.苎麻优异种质资源评价指标体系的研究[J].中国麻业科学,2013,35(6):285-291.
[2]邢虎成,廖玮玮,揭雨成.我国苎麻育种方法研究进展及面临的问题[J].作物研究,2010,24(3):209-214.
[3]冯学金,郭秀娟,杨建春,等.诱变技术在亚麻育种中的应用[J].核农学报,2017,31(7):1310-1316.
[4]张瑞成,李魏,潘素君,等.化学诱变在种质资源改良上的应用[J].分子植物育种,2017,15(12):5189-5196.
[5]刘美妍,周国彦,李晓丽,等.秋水仙素对华北型密刺黄瓜的诱变效应[J].中国瓜菜,2021,34(11):10-16.
[6]赵建华,任国辉,郑金双.秋水仙素对菊苣多倍体的诱导[J].江苏农业科学,2020,48(16):177-182.
[7]赵祺,张凤良,杨湉,等.不同秋水仙素浓度对橡胶树无性系腋芽抽芽率的影响[J].热带农业科技,2021,44(4):6-8.
[8]李辉玲,张建文.不同浓度秋水仙素处理对色素辣椒种子发芽及幼苗生长的影响[J].新疆农业科技,2021(5):19-21.
[9]N EMRANI S,ARZANI A,SAEIDI G. Seed viability,ger? mination and seedling growth of canola ( Brassica napus L. ) as influenced by chemical mutagens [J]. African Journal of Biotechnology,2011,10(59):12602-12613.
[10]郑思乡,罗慧敏,董延瑜,等.组织培养在苎麻多倍体研究中的应用初报[J].湖南农业大学学报,1995,21(4):361-365.
[11]邓衍明,孙晓波,贾新平,等.秋水仙素浓度和处理时间对茉莉腋芽生长发育的影响[J].植物资源与环境学报,2016,25(3):62-71.
[12]汪娅梅,张英,马玉申,等.夏布衣着用苎麻品种评价与优异资源筛选[J].植物遗传资源学报,2021,22(3):707-717.
[13]李雪平,金珂,张向军.化学诱变剂诱变植物的研究进展[J].现代农业,2019(2):38-39.
[14]范国强,杨志清,曹艳春,等.秋水仙素诱导兰考泡桐同源四倍体[J].核农学报,2006,20(6):473-476,547.
[15]张世清,陈河龙,刘巧莲,等.剑麻多倍体诱导及鉴定[J].农村实用技术,2019(11):106-107.
[16]李娟宁.化学诱变剂N-甲基-N-亚硝基脲(MNU)对燕麦的诱变效应研究[D].兰州:甘肃农业大学,2021.
[17]李娟宁,吕英,赵桂琴,等.化学诱变剂EMS和MNU对燕麦种子萌发和幼苗生长的影响[J].草原与草坪,2021,41(3):108-118.
文章摘自:张晓洋,霍颖怡,张泉,蒋榕,彭文仙,何思,何也君,邢虎成.苎麻腋芽秋水仙素诱变初探[J].作物研究,2022,36(03):260-264.