摘 要:黄麻黄脉病毒(Corchorus yellow vein virus,CoYVV)属于菜豆金色花叶病毒属病毒,含有DNA-A和DNA-B两个组分。本研究利用同源重组法和酶切连接法分别对该病毒DNA-A和DNA-B进行了侵染性克隆的构建,利用农杆菌介导的植物接种法将其接种于黄麻植株,可产生花叶、黄脉等典型症状,并且通过PCR和Southern blot均检测到了病毒DNA组分。以上结果表明CoYVV侵染性克隆构建成功,也验证了黄麻黄脉病的病原是CoYVV。CoYVV侵染性克隆的构建可为病毒致病机制的解析奠定基础。
关键词:黄麻黄脉病毒;侵染性克隆;菜豆金色花叶病毒;黄麻
菜豆金色花叶病毒属(Begomovirus)病毒是双生病毒中分布最广泛、种类分化最多和危害程度最大的一类病毒,给烟草、番茄、棉花等经济作物带来重大经济损失[1,2,3,4,5,6]。根据病毒的基因组类型,双生病毒可以分为单组分(仅DNA-A)和双组分(含DNA-A和DNA-B);根据病毒的进化关系,双生病毒分为新世界病毒(New World virus)与旧世界病毒(Old World virus),新世界病毒主要为双组分病毒,旧世界病毒主要为单组分病毒,常伴有卫星分子,但也有少数是双组分病毒[7,8]。其中,DNA-A的正义链上编码2个开放阅读框(open reading frame,ORF)(AV1和AV2),互补链上编码4个ORF(AC1~AC4),DNA-B病毒链和互补链各编码1个ORF(BV1和BC1)。在DNA-A和DNA-B非编码区存在一个共同区(common region,CR)或基因间隔区(intergenic region,IR),该区域包含一个序列、位置和结构上高度保守的核苷酸序列(TAATATT/AC),含有病毒复制起始位点[7,8]。双生病毒侵染性克隆的构建必须包括2个完整的IR区[9]。
黄麻(Corchorus capsularis),又称为绿麻、火麻等,是椴树科(Tiliaceae)黄麻属(Corchorus)重要的纤维作物,种植量和用途的广泛度仅次于棉花,在长江以南被广泛栽培,为精准扶贫做出了重要的贡献[10,11]。黄麻黄脉病毒(Corchorus yellow vein virus,CoYVV)最早于2006年在越南的黄麻上被发现[12];本课题组于2015年在我国福建省福州地区的黄麻上鉴定到该病毒[13]。CoYVV属于菜豆金色花叶病毒属,可侵染黄麻并造成花叶、黄脉、植株矮化等症状,影响黄麻产量与品质,对我国黄麻产业具有潜在威胁。其基因组为双组分,作为旧世界病毒,CoYVV还具有典型的新世界双生病毒特征,即不编码AV2蛋白。本研究拟构建CoYVV的侵染性克隆,验证福州黄麻花叶病的病原,以期为CoYVV基因组功能及其致病机制的研究奠定基础。
1材料与方法
1.1材料
感病黄麻的总DNA由本实验室提取和保存,其中含有CoYVV DNA-A(NCBI登录号:KX101212)和CoYVV DNA-B(NCBI登录号:KX101213)。
pTOPO-BamHⅠ克隆载体、pBINPLUS双元表达载体、GV3101农杆菌菌株由本实验室保存;大肠杆菌T1感受态购自北京全式金生物技术有限公司。
胶回收试剂盒购自康为世纪生物科技有限公司;质粒快速小提试剂盒、MarkerⅢ(MD103)购自天根生化科技(北京)有限公司;StarMarker D15k购自北京康润诚业生物科技有限公司;Trans2k Plus DNA Marker购自北京全式金生物技术有限公司。
1.2DNA-A侵染性克隆的构建
DNA-A侵染性克隆的构建采用同源重组法。以感病黄麻总DNA为模板,利用引物CoYVV-DNA-A-F1(5′-caggtcgactctagaggatccACCGTGCAGCAGCCCCGC-3′)/CoYVV-DNA-A-R1(5′-GGCTGCTGCACGGTAATATTATAGGCGTGCAGCAGCG-3′)、CoYVV-DNA-A-F2(5′-AATATTACCGTGCAGCAGCCCCGC-3′)/CoYVV-DNA-A-R2(5′-aattcgagctcggtacccgggTGACCTTCCCTGTATGAGCA-3′)(小写字母代表与载体反向互补的同源臂序列)分别对DNA-A进行扩增,获得长度为2.7kb左右的片段A和0.5kb左右的片段B。扩增体系:总DNA1μL,正向引物(10μmol·L-1)1μL,反向引物(10μmol·L-1)1μL,dNTP Mix0.5μL,2×Phanta Max Buffer12.5μL,Phanta Max Super-Fidelity DNA Polymerase(Vazyme)1μL,ddH2O 8μL。反应程序:95℃预变性3min,95℃变性15s,52℃退火15s,72℃延伸100s,35个循环,72℃终延伸10min。产物经1%(质量分数)琼脂糖凝胶回收。利用FastDigest BamHⅠ和FastDigest SmaⅠ(以下所用内切酶均为FastDigest)对pBINPLUS载体进行双酶切,酶切体系:质粒DNA1μg,BamHⅠ1μL,SmaⅠ1μL,10×FastDigest Green Buffer2μL,ddH2O补至20μL,37℃反应30min。载体酶切产物标记为pBINPLUS-SB,经1%琼脂糖凝胶回收。
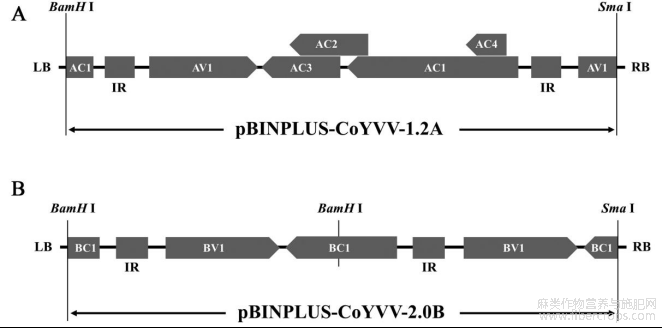
按照多片段无缝克隆试剂盒(MultiS One Step Cloning Kit)的说明书(Vazyme),将片段A和片段B以及酶切产物pBINPLUS-SB,按一定比例的摩尔数进行混合。反应体系:5×CE MultiS Buffer 4μL,Exnase® MultiS 2μL,片段A 54ng,片段B 10ng,酶切产物pBINPLUS-SB 240ng,ddH2O补至20μL,37℃反应30min。转化大肠杆菌后,提取质粒,BamHⅠ和SmaⅠ双酶切验证阳性克隆,标记为pBINPLUS-CoYVV-1.2A(图1A)。利用电击法将其转入农杆菌GV3101菌株。
1。3DNA-B侵染性克隆的构建
DNA-B侵染性克隆的构建采用传统的酶切连接法。以感病黄麻总DNA为模板,根据φ29DNA聚合酶试剂盒(GE Healthcare)的说明书进行滚环扩增,扩增产物利用BamHⅠ酶切得到2.7kb左右的片段,将其连接于pTOPO-BamHⅠ载体,即为pTOPO-DNA-B。利用BamHⅠ和SmaⅠ对pTOPO-DNA-B进行双酶切,1%琼脂糖凝胶电泳后回收较小的2.6kb左右的片段C。将片段C连接至pBINPLUS-SB,连接体系:片段C 6μL,pBINPLUS-SB 2μL,T4 Ligase(Promega)1μL,10×T4 Ligase Buffer1μL,4℃反应过夜。转化大肠杆菌后,提取质粒,利用BamHⅠ和SmaⅠ双酶切验证阳性克隆,标记为pBINPLUS-DNA-B-SB。利用BamHⅠ对pBINPLUS-DNA-B-SB进行单酶切,1%琼脂糖凝胶电泳回收后,进行去磷酸化处理,去磷酸化体系:单酶切载体片段17.5μL,10×CIAP缓冲液2μL,CIAP (TaKaRa)0.5μL,37℃反应30min,过柱纯化即可。
利用BamHⅠ对pTOPO-DNA-B进行单酶切,1%琼脂糖凝胶电泳后回收较小的2.7kb左右的片段D。将片段D与上一步去磷酸化的载体连接,转化大肠杆菌后,提取质粒,利用引物B-F570(5′-GACGAACCGTCACGTGCATCCACG-3′)/B-R570(5′-TGTCGACAGCAAAGCACTCTGTTG-3′)检测插入片段及其方向,阳性克隆标记为pBINPLUS-CoYVV-2.0B(图1B)。利用电击法将其转入农杆菌GV3101菌株。
图1CoYVV侵染性克隆构建示意图
A.CoYVV DNA-A侵染性克隆构建;B.CoYVV DNA-B侵染性克隆构建。AC1~AC4、AV1、BC1、BV1:CoYVV开放阅读框;IR:基因间隔区;LB、RB:载体左、右臂。
1.4农杆菌接种及检测
农杆菌接种方法参考文献[9]。使用医用去除针头的1mL一次性注射器,吸取等比例混合的DNA-A和DNA-B侵染性克隆的农杆菌菌液,接种于刚长出2~3片真叶的黄麻叶片,接种的黄麻置于防虫温室(16h光照/8h黑暗)中培养,同时设置未接种的空白对照,每隔3d观察一次植株症状。接种30d后,采集黄麻叶片,采用CTAB法提取其总DNA,利用引物A-F534(5′-AGGATCTATCGGACCTATAGGTCC-3′)/A-R534(5′-AGGATTAGAGGCATGAGTACATGC-3′)和B-F673(5′-ACGAATATCGTCTGACTCATGACC-3′)B-R673(5′-TCCAGCATACTTGTGCTGAGTCTG-3′)分别对病毒两个组分进行PCR检测,扩增产物送交生工生物工程(上海)股份有限公司进行测序分析;接种60d后,采集黄麻叶片约0.5g,提取其总DNA进行Southern blot检测(Roche DIG High Prime DNA Labeling and Detection Starter KitⅠ)。
2结果与分析
2.1侵染性克隆的构建
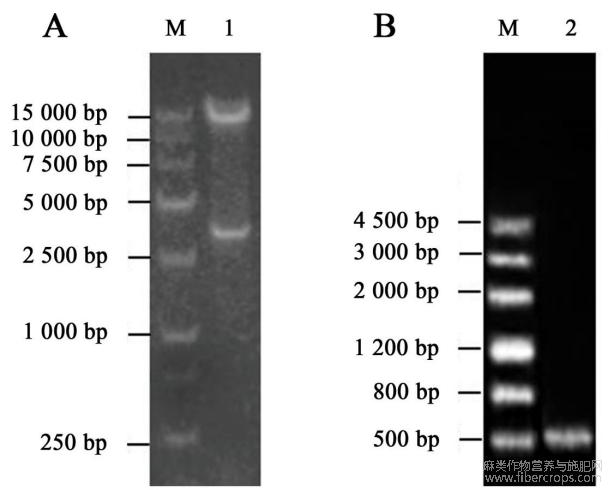
图2CoYVV侵染性克隆载体鉴定
M.分子质量标准;A.CoYVV DNA-A侵染性克隆载体酶切分析;B.CoYVV DNA-B侵染性克隆载体PCR分析。
将同源重组获得的重组载体pBINPLUS-CoYVV-1.2A进行双酶切验证,得到12kb左右的载体片段和3.3kb左右的片段(图2A),表明DNA-A侵染性克隆载体构建成功。将传统酶切连接获得的重组载体pBINPLUS-CoYVV-2.0B进行特异性引物检测,得到0.5kb左右的片段(图2B),表明DNA-B侵染性克隆载体构建成功。
2.2农杆菌接种结果
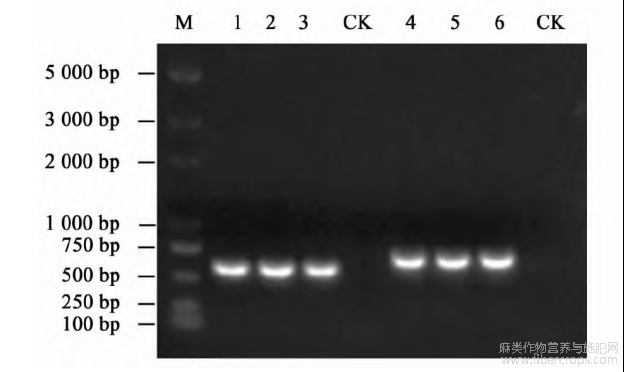
接种CoYVV侵染性克隆30d后,黄麻产生黄脉、花叶、斑驳、卷叶等症状(图3)。PCR检测结果显示,接种黄麻植株均可见DNA-A和DNA-B的特异性条带,而健康植株无任何条带(图4);测序表明,该条带确实是病毒基因组序列,说明所构建的侵染性克隆已成功侵染黄麻。Southern blot检测结果显示,接种黄麻植株可见病毒DNA-A组分的积累,而健康黄麻植株无任何特异性条带(图5),表明病毒已在黄麻体内大量复制。
图3黄麻接种CoYVV侵染性克隆30d后的症状
CK.健康黄麻;DNA-A+DNA-B。接种病毒侵染性克隆的黄麻。
图4黄麻接种CoY VV侵染性克隆30d后的PCR检测
M.分子质量标准;1~3。DNA-A;4~6。DNA-B;CK.健康黄麻.
图5黄麻接种CoY VV侵染性克隆60d后的Southern blot检测
1.接种病毒的黄麻;CK.健康黄麻。
3讨论
病毒侵染性克隆不仅是病毒病病原鉴定的基础,也是病毒基因功能及其与寄主植物互作研究的重要前提[14,15]。目前,双生病毒侵染性克隆的构建策略已经成熟[16,17,18,19]。Ha et al[12]早在2006年即鉴定了CoYVV,虽然利用本氏烟(Nicotiana benthamiana)NT1细胞证明了CoYVV DNA-A AC1/AC2/AC3可以起始DNA-B的复制,但未能构建其侵染性克隆。本研究构建了CoYVV的侵染性克隆,将其接种于健康黄麻植株,能引起与田间发病类似的症状,并且从接种的植株上检测到了CoYVV基因组组分,完成了科赫氏法则的验证。本研究对接种黄麻植株进行Southern blot检测时,DNA-A组分显示病毒已积累,但是对DNA-B组分的多次检测均未能得到较好的结果,推测可能的原因是杂交探针设计不够特异,然而,PCR的结果可以证实DNA-B组分的存在。已知双生病毒DNA-A与病毒的复制和介体传播有关,很多双组分双生病毒DNA-A单独存在可以系统侵染寄主,但不能诱导典型的病害症状;而DNA-B组分对于诱导典型的病害症状是必需的,并能增加DNA-A组分的积累量,且必须依赖DNA-A组分进行复制[9,16,20]。本研究中,DNA-A具有较高的积累量,且黄麻症状明显,表明CoYVV侵染性克隆构建成功。
参考文献
[1]何自福,佘小漫,汤亚飞.入侵我国的木尔坦棉花曲叶病毒及其危害[J].生物安全学报,2012,21(2):87-92.
[2]张洁,林文武,宛柏杰,等.福州番茄黄化曲叶病毒的全基因组结构特征[J].福建农林大学学报(自然科学版),2016,45(5):501-504.
[3]周雪平,崔晓峰,陶小荣.双生病毒——一类值得重视的植物病毒[J].植物病理学报,2003,33(6):487-492.
[6]SATTAR M N,IQBAL Z,TAHIR M N,et al.The prediction of a new CLCuD epidemic in the Old World[J/OL].Frontiers in Microbiology,2017,8:631[2021-07-30].https://www.frontiersin.org/articles/10.3389/fmicb.2017.00631/full.
[8]ZERBINI F M,BRIDDON R W,IDRIS A,et al.ICTV virus taxonomy profile:Geminiviridae[J].Journal of General Virology,2017,98(2):131-133.
[9]杨彩霞.福建省六种双生病毒的分子鉴定及RaMoV NSP互作蛋白的筛选[D].福州:福建农林大学,2009.
[10]戴志刚,粟建光,陈基权,等.我国麻类作物种质资源保护与利用研究进展[J].植物遗传资源学报,2012,13(5):714-719.
[11]粟建光,戴志刚,杨泽茂,等.麻类作物特色资源的创新与利用[J].植物遗传资源学报,2019,20(1):15-23.
[14]FENG M,LI L,CHENG R,et al.Development of a mini-replicon-based reverse-genetics system for rice stripe tenuivirus[J/OL].Journal of Virology,2021,95(14):e0058921[2021-07-30].https://journals.asm.org/doi/10.1128/JVI.00589-21.
文章摘自:林文忠,李景远,彭诗山,韩星,翟盈盈,杜振国,张洁,吴祖建.黄麻黄脉病毒侵染性克隆的构建及应用[J].福建农林大学学报(自然科学版),2022,51(03):317-321.