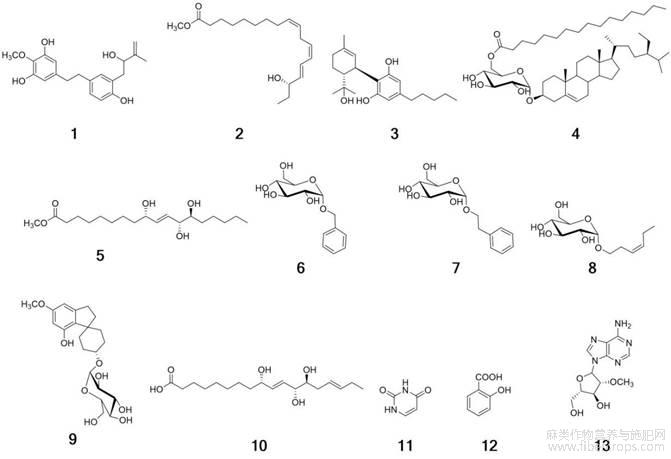
摘 要:研究工业大麻Cannabis sativa地上部分的化学成分。采用硅胶柱色谱及HPLC等色谱技术进行分离纯化,通过理化性质与波谱数据分析鉴定结构。从工业大麻地上部分的醋酸乙酯萃取物中分离得到13个单体化合物,分别鉴定为3,5′,4′′,2′′′-四羟基-4′-甲氧基-3′′′-甲基-3′′-丁烯基对二取代苯乙烷(1)、16R-羟基-9Z,12Z,14E-十八碳三烯酸甲酯(2)、(1′R,2′R)-2′-(2-hydroxypropan-2-yl)-5′-methyl-4-pentyl-1′,2′,3′,4′-tetrahydro-[1,1′-biphenyl]-[1,1′-biphenyl]-2,6-diol(3)、β-sitosteryl-3-O-β-D-glucopyranosyl-6′-O-palmitate(4)、9S,12S,13S-三羟基-10E-十八碳烯酸甲酯(5)、苯甲醇-O-β-D-吡喃葡萄糖苷(6)、苯乙醇-O-β-D-吡喃葡萄糖苷(7)、顺-3-己烯葡萄糖苷(8)、α-cannabispiranol-4′-O-β-D-glucopyranose(9)、9S,12S,13S-三羟基-10E,15Z-十八碳二烯酸(10)、尿嘧啶(11)、邻羟基苯甲酸(12)、2′-O-methyladenosine(13)。其中化合物1为新化合物,化合物3为新天然产化合物,化合物2、4~8、10、13为首次从该属植物中分离得到。
关键词:工业大麻;大麻素;二氢芪类;十八碳烯酸
工业大麻CannabissativaL.为桑科大麻属一年生草本植物,多雌雄异株[1],其植株中四氢大麻酚(THC)低于0.3%,无成瘾性且不具备提取毒性成分THC或直接作为毒品吸食的价值[2],在我国各地均广泛分布,但仅黑龙江、云南2省允许规模化种植[3]。《本草纲目》[4]记载“大麻,又叫火麻、黄麻、汉麻。雄者名牡麻,雌者名苴麻、苎麻”。《神农本草经》[5]记载“麻蕡,味辛,平。主五劳七伤,利五脏,下血寒气。多食令见鬼狂走。久服通神明,轻身。一名麻勃”“麻子,味甘,平,主补中益气,肥健不老”[6]。工业大麻起源于亚洲,具有悠久的药用历史,最早的记载可追述到公元前2500年[7],近年来人们对工业大麻进行了广泛的研究,结果表明其提取物具有抗肿瘤[8]、抗炎[9]、抗氧化[10]、抑菌[11]、镇痛[12]、神经保护[13]和治疗阿尔茨海默病[14]等作用。为进一步开发利用工业大麻资源,本研究在前期研究[15]的基础上,从工业大麻甲醇提取液醋酸乙酯萃取物中分离得到13个化合物,分别鉴定为3',5',4'',2'''-四羟基-4'-甲氧基-3'''-甲基-3′′-丁烯基对二取代苯乙烷(3',5',4'',2'''-tetrahydroxy-4'-methoxy-3'"-methyl-3′′-butenylp-disubstitutedbenzeneethane,1)、16R-羟基-9Z,12Z,14E-十八碳三烯酸甲酯(16R-hydroxyoctadeca-9Z,12Z,14E-trienoicacidmethylester,2)、(1'R,2'R)-2'-(2-hydroxypropan-2-yl)-5'-methyl-4-pentyl-1',2',3',4'-tetrahydro-[1,1'-biphenyl]-[1,1'-biphenyl]-2,6-diol(3)、β-sitosteryl-3-O-β-D-glucopyranosyl-6'-O-palmitate(4)、9S,12S,13S-三羟基-10E-十八碳烯酸甲酯(9S,12S,13S-trihydroxy-10-octadecenoatemethylester,5)、苯甲醇-O-β-D-吡喃葡萄糖苷(benzyloxy-1-O-β-D-glucopyranoside,6)、苯乙醇-O-β-D-吡喃葡萄糖苷(phenylethyl-O-β-D-glucopyranoside,7)、顺-3-己烯葡萄糖苷(3Z-enolglucoside,8)、α-cannabispiranol-4'-O-β-D-glucopyranose(9)、9S,12S,13S-三羟基-10E,15Z-十八碳二烯酸(9S,12S,13S-trihydroxyoctadeca-10E,15Z-dienoicacid,10)、尿嘧啶(uracil,11)、邻羟基苯甲酸(o-hydroxybenzoicacid,12)、2'-O-methyladenosine(13),其中化合物1为新化合物,化合物3为新天然产物,化合物2、4~8、10、13为首次从该属植物中分离得到。
图1 化合物1~13的结构
1材料
X-6显微熔点测定仪(北京泰克仪器有限公司);BrukerAV-600型核磁共振波谱仪(瑞士Bruker公司,TMS为内标);XevoQTOF质谱仪(美国Waters公司);AUTOPOLV型旋光仪(美国鲁道夫公司);制备高压液相色谱仪(杭州汇通公司);半制备高压液相色谱仪(日本日立公司,LC-6AD泵,ShodexRISE-61视差折光检测器);反相制备型C18玻璃色谱柱(60cm×5cm,40μm,杭州汇通公司);正相半制备型SIL不锈钢色谱柱(10mm×250mm,5μm,美国Agilent公司);反相半制备型C18不锈钢色谱柱(10mm×250mm,5μm,美国Agilent公司);柱色谱用硅胶(200~300目,青岛海洋化工厂);薄层色谱硅胶板(烟台化工厂)。有机溶剂为国药集团上海试剂厂产品,其他试剂为分析纯。
工业大麻于2018年7月采自于黑龙江省大兴安岭地区,经大兴安岭金亿顺汉麻种植专业合作社刘祥忠高级农艺师鉴定为工业大麻C.sativa。标本(CSL-201807)收藏于齐齐哈尔大学天然产物研究室。
2提取分离
干燥的工业大麻地上部分5.5kg,用甲醇室温浸泡3d后过滤,重复3次,合并甲醇浸提液浓缩至小体积加水混悬,依次用正己烷和醋酸乙酯萃取5次,合并醋酸乙酯萃取液并减压浓缩至恒重,得到醋酸乙酯萃取物87.7g。
取醋酸乙酯萃取物32.0g,用硅胶柱色谱分离,依次用正己烷-醋酸乙酯6:4(8.5L)、3:7(7.0L),醋酸乙酯-甲醇8:2(4.0L)、5:5(4.0L),甲醇(3.0L)洗脱,经TLC检测合并相同流分,浓缩得到12个组分F1~F12。F4(4.0g)经硅胶柱色谱分离,依次用正己烷-醋酸乙酯8:2(4.0L)、6:4(1.5L)、3:7(3.0L),醋酸乙酯-甲醇5:5(1.0L)洗脱,经TLC检测合并相同流分,浓缩得到9个组分F4-1~F4-9。F4-4(232.0mg)用正相半制备型高效液相色谱分离(流动相正己烷-醋酸乙酯8:2,体积流量4mL·min-1)得到8个组分F4-4-1~F4-4-8。F4-4-4(44.0mg)用正相半制备型高效液相色谱分离(流动相正己烷-醋酸乙酯9:1,体积流量4mL·min-1)得化合物2(2.2mg,tR=27.65min)、3(13.5mg,tR=29.93min)。F4-6(501.2mg)用正相半制备型高效液相色谱分离(流动相正己烷-醋酸乙酯75:25,体积流量4mL·min-1)得化合物1(3.0mg,tR=24.18min)。F7(600.0mg)经硅胶柱色谱分离,依次用正己烷-乙酸乙酯4:6(1.5L)、1:9(0.7L),乙酸乙酯-甲醇5:5(0.5L)洗脱,经TLC检测合并相同流分,浓缩得到10个组分F7-1~F7-10。F7-6(70.7mg)用正相半制备型高效液相色谱分离(流动相正己烷-乙酸乙酯4:6,体积流量4mL·min-1)得化合物4(4.4mg,tR=23.13min)。F8(8.6g)经硅胶柱色谱分离,依次用正己烷-醋酸乙酯2:8(3.0L)、0:1(2.0L),醋酸乙酯-甲醇9:1(3.0L)、6:4(3.0L)洗脱,经TLC检测合并相同流分,浓缩得到11个组分F8-1~F8-11。F8-5(657.0mg)用反相半制备型高效液相色谱分离(流动相甲醇-乙腈-水45:20:35,体积流量4mL·min-1)得化合物5(5.0mg,tR=29.58min)。F8-9(579.0mg)用反相半制备型高效液相色谱分离(流动相甲醇-乙腈-水21.5:8.5:70,体积流量4mL·min-1)得化合物6(3.0mg,tR=13.05min)、7(2.2mg,tR=23.87min)、8(5.1mg,tR=27.14min)。F8-10(35.4mg)用反相半制备型高效液相色谱分离(流动相甲醇-乙腈-水50:10:40,体积流量4mL·min-1)得化合物9(20.1mg,tR=18.34min)、10(3.9mg,tR=20.33min)。F9(1.3g)用反相制备型高效液相色谱分离(流动相乙醇-水35:65~100:0,体积流量80mL·min-1)得7个组分F9-1~F9-7。F9-1-1母液用反相半制备型高效液相色谱分离(流动相甲醇-水30:70,体积流量4mL·min-1)得6个组分F9-1-1-1~F9-1-1-6。F9-1-1-1(111.0mg)用反相半制备型高效液相色谱分离(流动相甲醇-水5:95,体积流量4mL·min-1)得化合物11(2.8mg,tR=6.35min)。F9-1-1-3(26.7mg)用反相半制备型高效液相色谱分离(流动相甲醇-水10:90,体积流量4mL·min-1)得化合物12(5.0mg,tR=6.89min)。F9-1-1-4(33.4mg)用反相半制备型高效液相色谱分离(流动相甲醇-水20:80,体积流量4mL·min-1)得化合物13(1.5mg,tR=16.47min)。
3结构鉴定
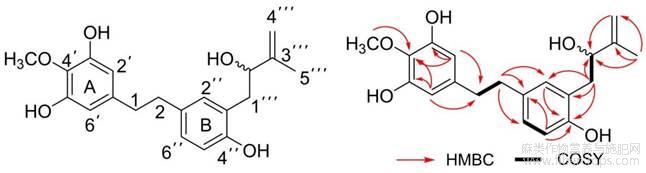
化合物1无色脂状物,[α]25D-12.3(c0.1,MeOH);HR-ESI-MSm/z343.1548[M+H]+(计算值343.1546),推得分子式为C20H24O5。1H-NMR谱(表1)中,在δ6.96(1H,dd,J=7.8,2.4Hz),6.84(1H,d,J=7.8Hz),6.81(1H,d,J=2.4Hz),给出3个芳香氢信号,根据其偶合常数判断其为偏三取代苯,δ6.32(2H,s)给出2个芳香氢信号,δ5.01(1H,s)和4.88(1H,s)给出2烯氢信号,提示其含有末端双键,δ4.36(1H,brd,J=7.8Hz)给出1个连氧碳上质子信号,δ3.85(3H,s)给出1个甲氧基信号,δ2.94(1H,dd,J=5.9,3.8Hz),2.74(5H,m),给出6个饱和质子信号,δ1.82(3H,s)给出1个甲基信号。13C-NMR谱(表1)中,给出了20个碳的信号,其中δ153.8,148.6,148.6,146.8,139.1,133.5,132.8,131.3,128.4,125.4,117.1,111.1,108.2,108.2给出14个芳香碳信号,结合氢谱可以推测含有2个苯及1个末端双键。δ78.4和61.2给出2个连氧碳,δ38.0,37.9,36.7和18.2给出4个饱和碳信号。依据该结果初步推测可能为二氢芪类化合物。由HMBC谱可知,H-1(δ2.59,2.43)与C-2(δ35.0),C-3(δ73.0),C-1′(δ133.1),C-2′,6′(δ129.5)相关;H-1(δ2.74),H-2(δ2.74)与C-1′(δ139.1),C-2′(δ108.2),C-6′(δ108.2),C-1′′(δ133.5),C-2′′(δ131.3),C-6′′(δ128.2)相关,由此可推断此为2个相连亚甲基片段,且2段与苯环相连,推测其为二氢芪类化合物;H-2′(δ6.32),H-6′(δ6.32)与C-2(δ36.9),C-1′(δ139.1),C-2′(δ108.2),C-3′(δ148.6),C-4′(δ153.8),C-5′(δ148.6),C-6′(δ108.2)相关;H-OCH3(δ3.85)与C-4′(δ153.8)相关,推测其A环为对称结构;H-1′′′(δ2.94,2.74)与C-2′′(δ131.3),C-3′′(δ125.4),C-4′′(δ153.8)相关;H-5′′(δ6.84)与C-1′′(δ133.5),C-4′′(δ153.8)相关;H-2′′(δ6.81)与C-1′′(δ153.8)相关,证实其B环结构;H-1′′′(δ2.94,2.74)与C-2′′′(δ78.4)相关;H-4′′′(δ5.01,4.88)与C-2′′′(δ78.4),C-5′′′(δ18.2)相关;H-5′′′(δ1.82)与C-2′′′(δ78.4),C-3′′′(δ146.8),C-4′′′(δ111.2)相关,由此可以进一步此推得化合物1结构为3′,5′,4′′,2′′′-四羟基-4′-甲氧基-3′′′-甲基-3′′-丁烯基对二取代苯乙烷。该化合物分离提纯后测得的旋光度值为-12.3°(c0.1,MeOH),放置一段时间后已检测不出具有旋光性,根据羟基异戊二烯基结构单元的相关现有文献报道[16,17,18,19,20],该类化合物其2′′′-C均为光学混合物,又根据文献报道[21]该结构单元的对映异构体存在互相转化的情况,在一定时间内达到外消旋,因此推测化合物1应为外消旋体。
图2 化合物1主要的HMBC(H→C)和1H-1H COSY(―)相关
表1 化合物1的核磁共振波谱数据(CDCl3,600/150MHz)
|
No. |
δC |
δH |
|
1 |
37.9(t) |
2.74(2H,m) |
|
2 |
36.7(t) |
2.74(2H,m) |
|
1′ |
139.1(s) |
- |
|
2′ |
108.2(d) |
6.32(1H,s) |
|
3′ |
148.6(s) |
- |
|
4′ |
153.8(s) |
- |
|
5′ |
148.6(s) |
- |
|
6′ |
108.2(d) |
6.32(1H,s) |
|
1′′ |
133.5(s) |
- |
|
2′′ |
131.3(d) |
6.81(1H,d,2.4) |
|
3′′ |
125.4(s) |
- |
|
4′′ |
153.8(s) |
- |
|
5′′ |
117.1(d) |
6.84(1H,d,7.8) |
|
6′′ |
128.2(d) |
6.96(1H,dd,7.8,2.4) |
|
1′′′ |
38.0(t) |
a:2.94(1H,dd,5.9,3.8) b:2.74(1H,m) |
|
2′′′ |
78.4(d) |
4.36(1H,brd,7.8) |
|
3′′′ |
146.8(s) |
- |
|
4′′′ |
111.2(t) |
a:5.01(1H,s) b:4.88(1H,s) |
|
5′′′ |
18.2(q) |
1.82(3H,s) |
|
-OCH3 |
61.2(q) |
3.85(3H,s) |
化合物2浅黄色脂状物,[α]25D-39.5°(c0.1,CH3OH);1H-NMR(CDCl3,600MHz)δ:6.52(1H,dd,J=15.0,10.8Hz,H-14),5.99(1H,t,J=10.8Hz,H-13),5.69(1H,dd,J=15.0,6.6Hz,H-15),5.40(2H,m,H-9,12),5.35(1H,m,H-10),4.11(1H,m,H-16),3.67(3H,s,-OCH3),2.93(2H,t,J=6.6Hz,H-11),2.30(2H,t,J=7.2Hz,H-2),2.06(2H,q,J=7.2Hz,H-8),1.61~1.31(12H,m,H-3,4,5,6,7,12),0.94(3H,t,J=7.2Hz,H-18);13C-NMR(CDCl3,150MHz)δ:174.4(C-1),136.1(C-15),130.8(C-9),130.7(C-12),127.8(C-13),127.2(C-10),125.7(C-14),74.2(C-16),51.5(-OCH3),34.1(C-2),30.2(C-17),29.5(C-4),29.1(C-7),29.0(C-6),28.6(C-5),27.2(C-8),26.1(C-11),24.9(C-3),9.7(C-18)。以上数据与文献报道基本一致[22],故鉴定化合物2为16R-羟基-9Z,12Z,14E-十八碳三烯酸甲酯。
化合物3浅黄油状物,[α]25D-18.6°(c1.0,CHCl3);1H-NMR(CDCl3,600MHz)δ:6.51(1H,s,OH-8),6.31(1H,s,H-3'),6.26(1H,s,H-5'),5.68(1H,brs,H-2),3.83(1H,brs,H-1),2.44(2H,t,J=7.8Hz,H-1''),2.11(2H,m,H-4),1.98(1H,m,H-5a),1.89(1H,m,H-6),1.81(3H,s,H-7),1.71(1H,m,H-5b),1.56(2H,m,H-2''),1.31(4H,m,H-3'',4''),1.23(3H,s,H-9),1.22(3H,s,H-10),0.88(3H,t,J=6.8Hz,H-5'');13C-NMR(CDCl3,150MHz)δ:156.1(C-2'),154.2(C-6'),143.6(C-4'),140.0(C-3),123.7(C-2),114.9(C-1'),109.6(C-3'),109.5(C-5'),75.1(C-8),48.3(C-6),35.5(C-1''),32.8(C-1),31.6(C-3''),30.7(C-2''),29.7(C-9),28.2(C-4),26.0(C-10),23.7(C-7),23.0(C-5),22.6(C-4''),14.0(C-5'')。以上数据与文献报道基本一致[23],故鉴定化合物3为(1'R,2'R)-2'-(2-hydroxypropan-2-yl)-5'-methyl-4-pentyl-1',2',3',4'-tetrahydro-[1,1'-biphenyl]-2,6-diol。经系统查阅文献,该化合物仅由人工合成得到,未见作为植物的次级代谢产物报道。
化合物4白色粉末,mp234~235℃;1H-NMR(CDCl3,600MHz)δ:5.37(1H,brs,H-6),4.52(1H,dd,J=12.2,3.6Hz,H-6′a),4.39(1H,d,J=7.4Hz,H-1′),4.25(1H,brd,J=12.2Hz,H-6′b),3.58(2H,overlapped,H-3,3′),3.45(1H,brd,J=7.4Hz,H-2′),3.36(2H,overlapped,H-3′,5′),2.34(2H,brd,J=7.2Hz,H-2′′),1.62(2H,m,H-3′′),1.32~1.26(2H,m,H-4′′~15′′),1.01(3H,s,H-19),0.92(3H,d,J=6.5Hz,H-21),0.88(3H,t,J=7.2Hz,H-29),0.84(3H,d,J=6.8Hz,H-26),0.82(3H,d,J=6.8Hz,H-27),0.68(3H,s,H-18);13C-NMR(CDCl3,150MHz)δ:171.2(C-1′′),140.1(C-5),122.3(C-6),101.2(C-1′),79.6(C-3),76.0(C-3′),74.0(C-5′),73.2(C-2′),70.0(C-4′),63.1(C-6′),56.8(C-14),56.1(C-17),50.2(C-9),45.8(C-24),42.3(C-13),39.8(C-12),39.7(C-4),39.1(C-1),39.0(C-10),38.5(C-20),34.2(C-2′′),33.9(C-22),32.0(C-7),31.9(C-8),29.7(C-3′′~14′′),29.4(C-2),29.3(C-25),29.2(C-16),25.0(C-23),24.2(C-15),23.1(C-28),22.7(C-15′′),21.1(C-11),19.8(C-26),19.4(C-19),19.0(C-27),18.8(C-21),14.2(C-16′′),12.0(C-29),11.8(C-18)。以上数据与文献报道基本一致[24],故鉴定化合物4为β-sitosteryl-3-O-β-D-glucopyranosyl-6'-O-palmitate。
化合物5浅黄色脂状物,[α]25D-49.6°(c0.1,CH3OH);1H-NMR(CDCl3,600MHz)δ:5.82(1H,dd,J=15.6,6.0Hz,H-10),5.71(1H,dd,J=15.6,6.2Hz,H-11),4.15(1H,q,J=6.0Hz,H-9),3.95(1H,t,J=6.2Hz,H-12),3.67(3H,s,-OCH3),3.48(1H,m,H-13),2.30(2H,t,J=7.8Hz,H-2),1.61(2H,m,H-3),1.56~1.26(16H,m,H-4~8,14~17),0.89(3H,t,J=6.8Hz,H-18);13C-NMR(CDCl3,150MHz)δ:174.4(C-1),136.3(C-10),129.7(C-11),75.3(C-12),74.6(C-13),72.0(C-9),51.5(-OCH3),37.2(C-8),34.1(C-2),33.0(C-14),31.8(C-16),29.2(C-6),29.1(C-5),29.0(C-4),25.3(C-15),25.2(C-7),24.8(C-3),22.6(C-17),14.0(C-18)。以上数据与文献报道基本一致[25],故鉴定化合物5为9S,12S,13S-三羟基-10E-十八碳烯酸甲酯。
化合物6浅黄色脂状物;1H-NMR(DMSO-d6,600MHz)δ:7.39(1H,d,J=8.0Hz,H-2,6),7.34(1H,m,H-3,5),7.28(1H,t,J=6.0Hz,H-4),4.83(1H,d,J=8.0Hz,H-7a),4.85(1H,d,J=8.0Hz,H-7b),4.23(1H,d,J=7.5Hz,H-1′),3.70(1H,d,J=11.5Hz,H-6′a),3.47(1H,dd,J=11.5,6.0Hz,H-6′b),3.14~3.03(4H,m,H-2′,3′,4′,5′);13C-NMR(DMSO-d6,150MHz)δ:138.5(C-1),128.6(C-3),128.5(C-5),128.1(C-2),128.1(C-6),127.8(C-4),102.5(C-1′),77.4(C-3′),77.2(C-5′),74.0(C-2′),70.6(C-7),69.4(C-4′),61.6(C-6′)。以上数据与文献报道基本一致[26],故鉴定化合物6为苯甲醇-O-β-D-吡喃葡萄糖苷。
化合物7浅黄色脂状物;1H-NMR(DMSO-d6,600MHz)δ:7.28(4H,m,H-2,3,5,6),7.20(1H,t,J=8.4Hz,H-4),4.19(1H,d,J=7.2Hz,H-1′),3.94(1H,m,H-8a),3.67(2H,m,H-8b,6′a),3.43(1H,dd,J=12.0,6.0Hz,H-6′b),3.15~2.94(4H,m,H-2′,3′,4′,5′),2.86(2H,m,H-7);13C-NMR(DMSO-d6,150MHz)δ:139.2(C-1),129.4(C-3),129.4(C-5),128.7(C-2),128.7(C-6),126.5(C-4),103.3(C-1′),77.4(C-3′),77.2(C-5′),73.9(C-2′),70.6(C-4′),70.0(C-8),61.6(C-6′),36.1(C-7)。以上数据与文献报道基本一致[27],故鉴定化合物7为苯乙醇-O-β-D-吡喃葡萄糖苷。
化合物8无色脂状物;1H-NMR(DMSO-d6,600MHz)δ:5.43(1H,m,H-4),5.36(1H,m,H-3),4.13(1H,d,J=7.8Hz,H-1′),3.74(1H,m,H-1a),3.66(1H,d,J=11.4Hz,H-6′a),3.44(1H,m,H-6′b),3.14~3.01(5H,m,H-3′,4′,5′),2.94(1H,t,J=8.3Hz,H-2′),2.28(2H,m,H-2),2.03(2H,m,H-5),0.93(3H,t,J=7.8Hz,H-6);13C-NMR(DMSO-d6,150MHz)δ:134.1(C-4),124.1(C-3),102.8(C-1′),76.3(C-3′),75.6(C-5′),73.3(C-2′),69.8(C-4′),69.3(C-1),61.3(C-6′),27.7(C-2),20.7(C-5),14.3(C-6)。以上数据与文献报道基本一致[28],故鉴定化合物8为顺-3-己烯醇葡萄糖苷。
化合物9浅黄色粉末,mp109~111℃,[α]25D-40.5°(c1.0,CH3OH);1H-NMR(CDCl3,600MHz)δ:6.54(1H,s,H-6),6.39(1H,s,H-4),4.75(1H,d,J=7.2Hz,H-1''),4.01(1H,brs,H-3''),3.90(2H,m,H-2'',4''),3.80(1H,m,H-5'',6''b),3.46(1H,m,H-6''b),2.87(1H,m,H-4'),2.77(2H,t,J=7.2Hz,H-3),2.50(2H,t,J=13.0Hz,H-2'a),2.04(1H,m,H-2a),1.66~1.41(6H,m,H-6',2b,2'b,3'a,5'a),1.09(2H,m,H-3'b,5'b);13C-NMR(CDCl3,150MHz)δ:159.9(C-5),155.3(C-7),145.4(C-9),132.1(C-8),103.6(C-4),102.1(C-1''),101.1(C-6),75.9(C-2''),75.8(C-4'),73.7(C-3''),69.2(C-5''),65.9(C-4''),61.4(C-6''),55.3(-OCH3),48.1(C-1),35.1(C-2),31.0(C-3),29.4(C-3'),29.2(C-5'),28.8(C-2'),27.3(C-2')。以上数据与文献报道基本一致[29],故鉴定化合物9为α-cannabispiranol-4'-O-β-D-glucopyranose。
化合物10浅黄色脂状物,[α]25D-35.8°(c0.33,CH3OH);1H-NMR(DMSO-d6,600MHz)δ:5.58(2H,m,H-10,11),5.38(2H,m,H-15,16),3.89(1H,m,H-9),3.88(1H,m,H-12),3.32(1H,m,H-13),2.16(2H,m,H-14),1.97(3H,t,J=7.2Hz,H-2),1.90(1H,m,H-8a),1.47(2H,m,H-17),1.38(3H,m,H-8b,7),1.28(6H,m,H-4,5,6),0.91(3H,t,J=3.6Hz,H-18);13C-NMR(DMSO-d6,150MHz)δ:174.6(C-1),134.6(C-10),131.9(C-11),129.4(C-16),126.7(C-15),74.0(C-13),73.6(C-12),70.5(C-9),40.1(C-8),37.4(C-2),30.0(C-14),29.0(C-4),28.8(C-5),28.6(C-6),25.0(C-7),24.6(C-3),20.2(C-17),14.1(C-18)。以上数据与文献报道基本一致[30],故鉴定化合物10为9S,12S,13S-三羟基-10E,15Z-十八碳二烯酸。
化合物11淡黄粉末,mp111~112℃;1H-NMR(DMSO-d6,600MHz)δ:11.0(2H,brs,NH-3,4),7.39(1H,d,J=7.2Hz,H-5),5.44(1H,d,J=7.2Hz,H-6);13C-NMR(DMSO-d6,150MHz)δ:164.8(C-4),152.0(C-2),142.7(C-6),100.7(C-5)。以上数据与文献报道基本一致[31],故鉴定化合物11为尿嘧啶。
化合物12白色粉末,mp154~156℃;1H-NMR(DMSO-d6,600MHz)δ:7.65(1H,m,H-6),7.12(1H,m,H-5),6.58(2H,m,H-3,4);13C-NMR(DMSO-d6,150MHz)δ:172.1(C-7),163.3(C-2),131.8(C-4),130.4(C-6),120.9(C-5),116.4(C-3),116.2(C-1)。以上数据与文献报道基本一致[32],故鉴定化合物12为邻羟基苯甲酸。
化合物13浅黄色粉末,mp159~161℃,[α]25D-21.6°(c1.0,CH3OH);1H-NMR(DMSO-d6,600MHz)δ:8.39(1H,s,H-2),8.14(1H,s,H-8),7.37(2H,brs,-NH),6.00(1H,d,J=6.0Hz,H-1'),5.43(1H,t,J=6.6Hz,OH-5'),5.28(1H,d,J=5.4Hz,OH-3'),4.36(1H,m,H-3'),4.33(1H,m,H-2'),3.98(1H,m,H-4'),3.67(1H,m,H-5'a),3.57(1H,m,H-5'b),3.30(3H,s,-OCH3);13C-NMR(DMSO-d6,150MHz)δ:156.6(C-6),153.0(C-8),149.5(C-4),140.2(C-2),119.7(C-5),86.9(C-4'),86.3(C-2'),82.9(C-1'),69.3(C-3'),62.0(C-5'),57.9(-OCH3)。以上数据与文献报道基本一致[33],故鉴定化合物13为2′-O-methyladenosine。
4讨论
现阶段对工业大麻的研究多集中于其中的大麻素类成分[34],而对非大麻素类成分的物质组成及药理作用研究尚显不足,并且在工业生产中多是针对大麻素类及挥发油类成分的提取与加工,其他成分多直接废弃[35],造成了极大的植物资源浪费,影响了工业大麻植物资源的开发利用。为进一步探讨工业大麻中非大麻素类药效基础物质,本研究在前期研究[15]的基础上,继续对工业大麻醇提液醋酸乙酯萃取物化学成分进行研究,得到了13个单体化合物,其中化合物2、4~8、10、13为工业大麻特有性成分未见属内其他植物报道。这些次生代谢产物除化合物3外,其余均为非大麻素类成分,且所分离得到的成分均与毒性成分THC属不同骨架类型,初步判断不具备毒性。通过本研究进一步了解了工业大麻中非大麻素类成分物质组成基础,可为综合利用工业大麻资源、研究开发新型药物等提供理论依据。
参考文献
[1]杨柳秀,李超然,高雯.大麻化学成分及其种属差异研究进展[J].中国中药杂志,2020,45(15):3556.
[2]张明,张利国,房郁妍,等.黑龙江省工业大麻产业现状及未来发展建议[J].黑龙江农业科学,2020,12:123.
[3]吴鹏,杨丽君,刘东麟,等.云南、黑龙江两省工业大麻种植加工的合法化对吉林省的启示[J].中国麻业科学,2021,43(2):88.
[4]陈来成,杨占红,何秋星,等.工业大麻法规现状及其在化妆品中开发应用概况[J].日用化学品科学,2020,43(1):20.
[5]邢俊波,马燕珠,孙武兴,等.大麻花、叶本草考证[J].绿色科技,2020(7):91.
[6]白云俊,周新郢,袁媛,等.药用大麻起源及其早期传播[J].中草药,2019,50(20):5071.
[7]BANISTER S D,ARNOLD J C,CONNOR M,et al.Dark classics in chemical neuroscience:Δ9-tetrahydrocannabinol[J].ACS Chem Neurosci,2019,10(5):2160.
[8]MARGARITA Z,NADYA H,LOZAN T,et al.In vitro anticancer activity and oxidative molecular damage by cannabidiol administered alone and in combination with epirubicin[J].Biotechnol Biotec Eq,2021,35(1):1613.
[9]LIU C,MA H,SLITT A L,et al.Inhibitory effect of cannabidiol on the activation of NLRP3 inflammasome is associated with its modulation of the P2X7 receptor in human monocytes[J].J Nat Prod,2020,83(6):2025.
[10]CANTELE C,BERTOLINO M,BAKRO F,et al.Antioxidant effects of hemp (Cannabis sativa L.)inflorescence extract in stripped linseed oil[J].Antioxidants,2020,9(11):1131.
[11]张正海,董艳,姬妍茹,等.工业大麻叶抑制单增李斯特菌成分初步分离及机理研究[J].食品研究与开发,2021,42(19):59.
[12]BENNICI A,MANNUCCI C,CALAPAI F,et al.Safety of medical cannabis in neuropathic chronic pain management[J].Molecules,2021,26(20):6257.
[13]KIM J,CHOI H,KANG E K,et al.In vitro studies on therapeutic effects of cannabidiol in neural cells: neurons,glia,and neural stem cells[J].Molecules,2021,26(19):6077.
[14]安娜,聂颖兰,朱法科,等.大麻二酚抗阿尔茨海默病活性研究进展[J].药学进展,2021,45(7):539.
[15]刘志华,王金兰,赵明,等.工业大麻地上部分化学成分研究[J].中草药,2021,52(15):4463.
[16]付林,孙炳夏,翟佳黛,等.5′位羟基异戊烯基查尔酮类天然产物的合成及其抗菌活性研究[J].有机化学,2020,40(1):201.
[17]REN Z Y,QI H Y,SHI Y P.Phytochemical investigation ofAnaphalis lacteal[J].Planta Med,2008,74(8):859.
[18]STEVENS J F,TAYLOR A W,NICKERSON G B,et al.Prenylflavonoid variation in Humulus lupulus: distribution and taxonomic significance of xanthogalenol and 4'-O-methylxanthohumol[J].Phytochemistry,2000,53(7):759.
[19]NGADJUI B T,WATCHUENG J,KEUMEDJIO F,et al.Prenylated chalcones,flavone and other constituents of the twigs of Dorstenia angusticornis and Dorstenia barteri var.subtriangularis[J].Phytochemistry,2005,66(6):687.
[20]NGAMENI B,NGADJUI B T,FOLEFOC G N,et al.Diprenylated chalcones and other constituents from the twigs of Dorstenia barteri var.subtriangularis[J].Phytochemistry,2004,65(4):427.
[21]SHAFFER C V,CAI S,PENG J,et al.Texas native plants yield compounds with cytotoxic activities against prostate cancer cells[J].J Nat Prod,2016,79(3):531.
[22]MASAFUMI K,YASUNORI Y,MASAO K.Monohydroxy-substituted polyunsaturated fatty acids from Swertia japonica[J].Helv Chim Acta,2008,91:1857.
[23]WAUGH T M,MASTERS J,ALIEV A E,et al.Monocyclic quinone structure-activity patterns: synthesis of catalytic inhibitors of topoisomerase II with potent antiproliferative activity [J].Chem Med Chem,2020,15(1):114.
[24]NA Y Y,BYUNG S M,HYEONG K L,et al.A potent anti-complementary acylated sterol glucoside fromOrostachys japonicas[J].Arch Pharm Res,2005,28(8):892.
[25]崔波,郭夫江,李医明.毛白前根茎化学成分的研究[J].中成药,2015,37(12):2677.
[26]贺兰云,黄海疆.红茴香甲醇部位化学成分研究[J].中国中药杂志,2014,39(5):857.
[27]SHU C K ,LAWRENCE B M.Synthesis of 2-phenylethyl.alpha.-glucoside [J].J Agric Food Chem,1994,42(8):1732.
[28]徐伟强,王威,刘小红,等.玉竹叶化学成分[J].中国实验方剂学杂志,2014,20(21):112.
[29]EL-FERALY F S,EL-SHEREI M M,AL-MUHTADI F J.Spiro-indans from Cannabis sativa[J].Phytochemistry,1986,25:1992.
[30]QIU Y K,ZHAO Y Y,DOU DE Q,et al.Two new alpha-pyrones and other components from the cladodes of Opuntia dillenii[J].Arch Pharm Res,2007,30(6):665.
[31]李根,潘争红,李海云,等.毛果巴豆枝叶的化学成分研究[J].广西植物,2021,41(7):1077.
[32]王洪玲,梁文娟,朱继孝,等.藏族药西伯利亚蓼化学成分的分离鉴定[J].中国实验方剂学杂志,2017,23(7):60.
[33]LI H,XIAO J,GAO Y Q,et al.Chaetoglobosins from Chaetomium globosum,an endophytic fungus in Ginkgo biloba,and their phytotoxic and cytotoxic activities [J].J Agric Food Chem,2014,62(17):3734.
[34]于晓瑾,刘采艳,杨连荣,等.工业大麻中大麻二酚的研究进展[J].中成药,2021,43(5):1275.
[35]TREMLOVÁ B,MIKULÁŠKOVÁ H K,HAJDUCHOVÁ K,et al.Influence of technological maturity on the secondary metabolites of hemp concentrate (Cannabis sativa L.)[J].Foods,2021,10(6):1418.
文章摘自:刘志华,王金兰,赵英楠,李军,时志春,王丹,赵明,张树军.工业大麻地上部分中1个新的二氢芪类化合物[J/OL].中国中药杂志:1-7[2022-05-09].DOI:10.19540