摘 要:汉麻是典型的一年生且雌雄异株的开花植物,是大麻素的主要来源,具有多种精神活性和药理作用,由于对人类疾病的治疗潜力而被广泛关注。除了具有精神活性的主要成分四氢大麻酚(tetrahydrocannabinol,THC)外,还含有非精神活性的酚类化合物如大麻二酚(cannabidiol,CBD),作为抗肿瘤的候选药物具有很高的价值。然而在已知的600多种大麻素中,大多数含量较低,由于其在医学、日化和工业方面具有广泛的用途,迫切需要应用新的生物技术提高大麻素的生物合成。大麻素的异源生物合成可以实现低成本且快速的生产,各种组织培养方法,如微繁殖、细胞悬浮培养、毛状根培养和农杆菌介导的基因转化方法在汉麻育种、新性状开发及规模化繁殖方面具有潜在的应用价值。综述了汉麻酚类化合物药理学、合成积累规律及其生物合成最新进展,重点探讨了大麻组织培养方面重要的成果,以期为汉麻酚类物质生物合成及其利用提供科学依据和参考。
关键词:汉麻;酚类化合物;代谢途径;生物合成;组织培养
汉麻Cannabis sativa L.又称工业大麻,属于木兰纲(Magnoliopsida)荨麻目(Urtiacales)大麻科(Cannabinaceae)大麻属Cannabis Linn.一年生草本植物[1],具有悠久的药用、工业、娱乐和农业用途[2]。大麻中含有致幻成瘾的毒性成分四氢大麻酚(tetrahydrocannabinol,THC),按照国际规定,THC含量低于0.3%的大麻称为工业大麻。虽然数千年来汉麻一直被用于传统药物和纺织纤维材料,但其越来越多地被认为是药物、调味化合物等多种次级代谢物的来源[3]。
汉麻中存在大量的活性成分,迄今为止从汉麻中分离出600多种次生代谢物[4],主要是汉麻植物特有的萜酚类化合物,即大麻素[5]。目前,已从汉麻中鉴定出超过115种大麻素,主要产生于雌花的腺毛中,大麻二酚(cannabidiol,CBD)、THC和大麻环萜酚(cannabichromene,CBC)为汉麻中的主要大麻素[6],目前已经对一些标志性大麻素及其类似物的潜在医用价值进行了广泛的研究,某些大麻素制剂已被一些国家批准为治疗一系列人类疾病的处方药,研究最多的是THC和CBD[7],二者具有治疗多种人类疾病的潜力,如缓解与癌症相关的慢性疼痛,降低细胞抑制剂和化疗的不利影响,改善与厌食症和艾滋病相关的饮食失调、炎症性疾病、癫痫以及多发性硬化症[8]。
次级代谢物的传统获取方式是从植物中提取或通过化学合成,但因其结构复杂,使用化学合成的方法成本高、效益低,无法成为大量合成大麻素的有效途径。研究表明通过工程微生物菌株生物合成大麻素已成为获得具有成本效益、高质量和可靠大麻素的有效手段[9]。Zirpel等[10]通过四氢大麻酚酸(tetrahydrocannabinol acid,THCA)合成酶在酵母Komagataella phaffii中的表达,使大麻萜酚酸(cannabigerolic acid,CBGA)转化为Δ9-四氢大麻酚酸(Δ9-tetrahydrocannabinolic acid,Δ9-THCA)。有研究报道利用合成生物学方法重组酿酒酵母中的橄榄酸生物合成模块,可以从己酸或半乳糖中生产大麻萜酚酸(cannabigerolic acid,CBGA),但大多数代谢物生物合成的量仍有待提高[11,12]。尽管已经阐明了许多参与大麻素生物合成的基因,但由于很少有关于汉麻组织稳定转化的报道,这些基因的功能尚未得到充分验证,其生物合成的遗传学仍然未知,因此,掌握及利用遗传学及生物工程技术提高大麻素含量及产量是目前研究者的主要目标。体外组织培养技术如愈伤组织培养、细胞培养、植株再生和毛状根培养是大多数生物技术工具的基础[13,14],体外培养方法与基因工程技术(如农杆菌介导的基因转化和基因组编辑)相结合,为在汉麻中产生新基因型和调控次级代谢产物的合成提供了机会[15]。另外,高效、可靠的体外培养方法是成功进行基因转化、基因组编辑、微繁殖的关键策略。本文综述利用基因工程、细胞工程技术调控汉麻酚类合成研究方面的最新进展,有助于了解汉麻生物合成途径,评估组织培养优化技术在汉麻植物繁殖中的潜在应用及价值,以期为相关领域的深入研究及广泛应用提供重要的参考依据。
1汉麻内源性大麻素系统及其抗癌作用
1.1内源性大麻素系统
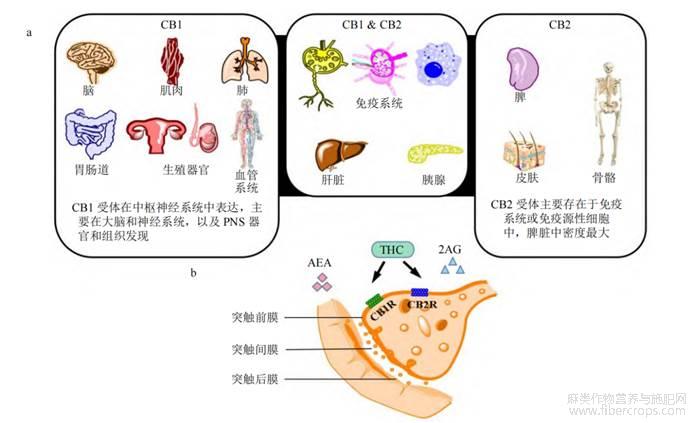
大麻素根据其来源可分为3类:植物大麻素、内源性大麻素和合成大麻素[16],植物大麻素与分布于全身的特定受体结合,称为内源性大麻素受体。内源性大麻素受体及其内源性神经递质N-花生四烯酸乙酰胺(N-anandamide,N-AEA)和2-花生四烯酸甘油酯(2-arachidonoylsn-glycerol,2-AG),以及负责内源性大麻素合成和降解的酶,形成内源性大麻素系统(endogenous cannabinoid system)。除此之外,其他分子也被认为是内源性大麻素,如N-花生四烯酰多巴胺(N-arachidonoyldopamine,NADA)、2-花生四烯酰甘油醚(2-arachidonoylsn-glycerol,2-AGE)、O-花生四烯酰乙醇胺(O-virodhamine,O-AEA)和油酸酰胺(oleic acid amide,OA)[17]。有2种内源性大麻素受体CB1、CB2(1型和2型大麻素受体),它们属于G蛋白偶联受体家族,存在于中枢神经系统(主要表达CB1)和免疫组织(主要表达CB2)。两者都在与大麻素相互作用时发挥抑制神经元活动的作用[18,19]。与CB2相比,AEA对CB1的亲和力较高,而2-AG对CB1和CB2的亲和力中等。外源性THC是部分CB1和CB2激动剂,而植物大麻素CBD对这些受体的亲和力较低[19,20](图1)。
1.2抗癌作用及机制
大麻素主要用于癌症的姑息治疗,以减轻疼痛、刺激食欲和缓解恶心。近年来,已经对大麻素作为癌症患者的抗肿瘤和症状缓解剂的潜在用途进行了广泛的研究。内源性大麻素系统在癌症中的作用机制尚不完全清楚,但一些研究表明,大麻素受体和内源性配体在肿瘤组织中过度表达[22]。已发现大麻素可通过激活大麻素受体抑制肿瘤细胞增殖、血管生成、肿瘤侵袭,并可在体内外诱导细胞凋亡[23]。Jeong等[24]证实了CBD通过抑制IAP蛋白家族成员X连锁凋亡抑制因子(X-linked inhibitor of apoptosis protein,XIAP)诱导细胞凋亡,促进了胃癌细胞死亡。Mazuz等[25]发现大麻素混合物THC和CBD以及CBD和CBGA的组合可诱导皮肤T细胞淋巴瘤(CTCL)细胞周期停滞和凋亡而引起细胞死亡。Bachari等[26]研究证实大麻素单独或组合使用抑制了肿瘤的生长,并促进了黑色素瘤细胞的凋亡和自噬。
a-人体中大麻素受体的分布b-内源性大麻素受体N-花生四烯酸乙醇胺(AEA)、2-花生四烯酸甘油酯(2-AG)和外源性Δ9-四氢大麻酚(Δ9-THC)与大麻素受体1型(CB1)和2型(CB2)的结合
大麻素诱导细胞凋亡的已知机制是其与G蛋白偶联受体55(G protein-coupled receptor 55,GPR55)、瞬时受体电位阳离子通道辣椒素受体1(transient receptor potential vanilloid 1,TRPV1)和瞬时受体电位M型8(transient receptor potential melastatin 8,TRPM8)相互作用,如CBD和大麻酚是TRPM8受体的有效拮抗剂[8,27],从而发挥抗癌作用。此外,CB2受体(CB2R)具有免疫调节作用,其激活可影响免疫细胞释放细胞因子、抑制γ干扰素(interferon-γ,IFN-γ)产生和T细胞增殖[28]。此外,大麻素具有阻断血管内皮生长因子(vascular endothelial growth factor,VEGF)通路,并通过阻断神经酰胺生物合成激活血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor2,VEGFR-2)的能力,从而抑制肿瘤细胞血管再生[29]。
2汉麻不同酚类物质的分布特性及含量积累规律
2.1汉麻不同组织部位酚类物质含量积累规律
陈璇等[30]研究表明,汉麻植株顶端叶片中主要大麻素含量在幼苗期和快生期含量接近零,盛蕾期、盛花期和始果期逐渐上升,说明大麻素在生殖阶段开始积累,苞片、花和果外围的变态叶是始果期大麻素含量最高的器官。也有研究表明,汉麻酚类化合物主要存在于包裹种子的小苞叶中,其次是植株顶部叶片,底部叶片中大麻素含量最少[31]。
研究证明大麻素的生物合成和积累发生在腺毛上[32],腺毛状体分为有柄毛状体、无柄毛状体和茎状毛状体。茎状毛状体是从无柄毛状体形成的(图2)。腺毛状体在堆积有分泌性囊泡的气球状腔中积聚大麻素[33,34,35,36]。在根表面没有发现腺毛,因此根组织不会积聚植物大麻素[37]。腺毛不仅分泌大麻素,还可以合成大麻素[38]。大麻素含量的增加对应于叶片腺毛状体的发育和生长,且叶片发育各阶段的腺体密度与大麻素含量之间存在相关性[39]。
a-开花的雌花“Finola”(芬兰品种汉麻)植物;孤立的花簇,包含无数的花萼,具密集的腺毛b-解剖单个雌花的花萼和花柱的显微镜图像c-使用常规SEM观察单个雌花花萼的图像,比例尺500μmd~f-3种类型的汉麻腺毛状体的低温SEM图,分为有柄型(d)、无柄型(e)和球茎型(f),比例尺20μm
图2 汉麻植株腺毛类型[33]
2.2不同汉麻酚类物质的合成积累及分布特性
汉麻植株中不同大麻素的分布都有其特性,用于生产大麻素的汉麻植株是雌雄异株,这些化合物在未受精的雌性花序上积累。在雌性植株的叶和花中THC含量最高,种子和根中几乎不含有THC[40],CBD的分布特征与THC十分相似,因为THC和CBD是由相同基因位点控制的互为共显性的2个性状[41]。
当干燥后的汉麻长期暴露在紫外线、空气或潮湿的环境中会产生另一种大麻素,即大麻酚(cannabinol,CBN),其在新鲜及阴干的汉麻材料中是不存在的,是THC经氧化后得到的产物[42]。在汉麻幼苗期产生的主要大麻素是大麻环萜酚(cannabichromene,CBC),CBC的含量随着植株的成熟而降低,以至可以忽略不计[43,44,45]。
3大麻素关键途径基因及合成生物学研究进展
3.1合成途径及关键基因
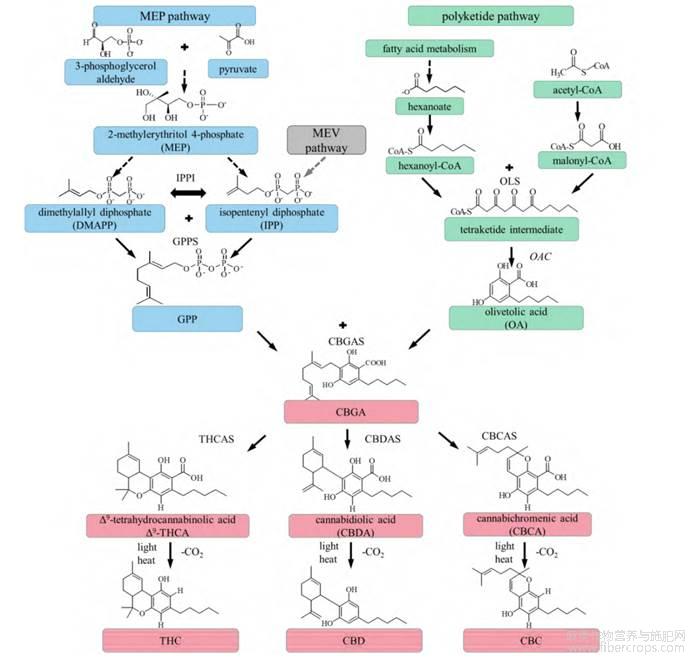
大麻素合成途径未被完全解析,是一个极其复杂的代谢过程,相关人员根据转录组测序结果,推导出了大麻素生物合成过程,包括2-甲基赤藓糖醇磷酸(2-C-methyl-D-erythritol-4-phosphate pathway,MEP)途径、焦磷酸香叶酯(geranyl diphosphate,GPP)途径、己酸途径和以这3个途径合成产物为底物的CBD途径[46]。MEP和GPP途径最终合成GPP,己酸途径最终合成己酰辅酶A(hexanoyl-Co A),己酰辅酶A生成的戊基二羟基苯酸(olivetolic acid,OLA)与GPP合成CBGA(图3)[47]。
OLA是由聚酮化合物合酶(polyketide synthase,PKS)和橄榄酸环化酶(olivetolic acid cyclase,OAC)催化下产生的[49]。产生的CBGA是下一阶段Δ9-THCA、CBDA和大麻环萜酚酸(cannabichromenic acid,CBCA)的主要前体,其中包括OLA与GPP的烷基化反应,该烷基化是由牻牛儿焦磷酸:橄榄油酸香叶烯基转移酶(cannabis GOT,GOT)催化的。在MEP途径中,异戊二烯侧链为GPP合成提供底物,从而使芳香异戊二烯基转移酶产生CBGA[50]。酶促反应包括THCA合成酶、CBDA合成酶和CBCA合成酶,它们分别将CBGA转化为THCA、CBDA和CBCA[51,52]。最后一个阶段包括通过THCA和CBDA脱羧生成THC和CBD[53]。
汉麻幼苗不积累大麻素。这一发现表明,大麻素的生物合成与器官和组织的发育有关,并受参与这些过程的基因控制。陈璇等[30]测定了汉麻不同生长发育时期大麻素含量变化以及大麻素合成途径中相关酶基因表达丰度,对其相关性进行了分析,结果表明,大麻素合成相关酶基因可能通过协同作用来调控大麻素的合成与积累,MEP和GPP途径的酶基因在大麻素合成过程中起着至关重要的作用,而CBD途径中OLS、PT和THCAS基因主要对始果期苞片腺毛中的大麻素合成起作用。相关人员对汉麻转录组和代谢组进行了分析,大麻素生物合成途径中的关键酶在腺毛体中过度表达[46,49,54],大麻素和萜类物质的生物合成和积累发生在腺毛上[42]。
CBCAS-大麻环萜酚酸合成酶CBDAS-大麻二酚酸及其合成酶CBGAS-大麻萜酚酸合酶GPPS-香叶基二磷酸合酶IPP-异戊烯二磷酸MEV-甲羟戊酸OAC-橄榄油酸环化酶OLS-橄榄醇合酶THCAS-Δ9-四氢大麻酚酸合酶IPPI-异戊烯二磷酸异构酶
图3 代表性大麻素合成途径[48]
3.2汉麻酚类化合物合成生物学研究
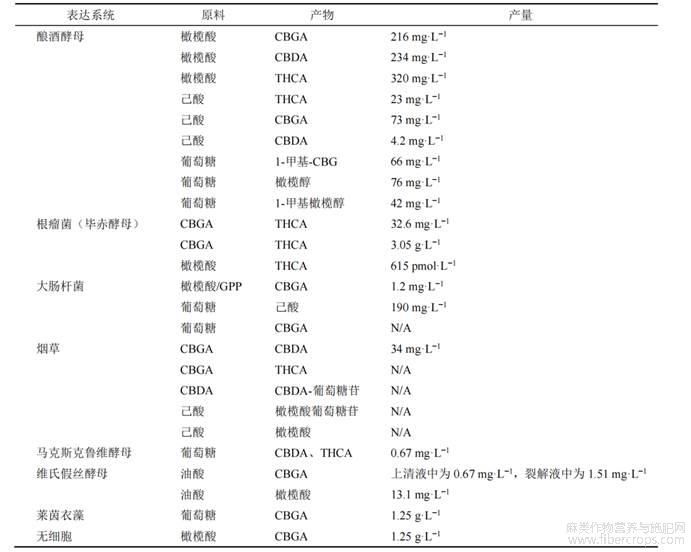
合成生物学可用于产生底盘生物,以研究和表征与这些含量较不丰富的大麻素及其衍生物的生物合成有关的酶,并通过可扩大的发酵过程生产这些化合物。此外,通过掺入定制酶,微生物生产可以产生具有增强特性的新型大麻素。基于植物大麻素生物合成途径,人们可以通过合成生物学的方法实现工业化生产大麻素或合成某些新型大麻素药物[55],目前在这方面已经取得了很大的进展(表1)。
2018年,美国加州伯克利劳伦斯国家实验室生物能源研究所Keasling教授实验室,罗小舟研究员在Nature发表论文首次报道了利用合成生物学方法在酿酒酵母中合成主要大麻素类成分,通过重组相关菌株中的橄榄酸生物合成模块,可以从更简单的前体如己酸或半乳糖中生产CBGA,从1mmol/L己酸中可合成7.2mg/LCBGA,并且可以通过工程菌株提高CBGA的表达效率,该菌株可产生8.0mg/LTHCA和4.8mg/LTHCAS[12]。在大麻素合成中,必须考虑毒性作用,因为几种大麻素生物合成途径的代谢物(如CBGA和THCA)会通过宿主植物中的细胞凋亡导致细胞死亡[38]。Gülck等[57]研究使用基于芳香异戊二烯基转移酶的方法以组合方式构建所需的新型植物大麻素结构,将在细胞质中合成的橄榄酸转移到质体中,并将橄榄酸和香叶基焦磷酸转化为CBGA,最后释放到质外体中,为异源宿主提供贮藏可能性,从而避免自身毒性。N/A-是否适合大麻素生产尚未报道。
表1 汉麻大麻素类药物异源系统合成研究[56]
4利用植物细胞工程技术合成大麻素
由于汉麻几千年来的药用特性,一些大麻素及其类似物因其潜在的医药价值而受到广泛关注。一些大麻素制剂已在某些国家被批准为处方药,用于治疗一系列人类疾病。但汉麻的大规模田间耕种很难控制,同时因受环境、品种、气候、土壤等因素的影响,汉麻中的大麻素含量会发生变化。鉴于此,人们开始研究大麻素替代的生产方法。生物技术是一种有吸引力的替代手段[9],使用植物、真菌和细菌在内的不同平台来生产大麻素[57]。如通过外植体和微繁殖技术生产大麻素,可以持续稳定地获得大麻素,除特定植株外,高生物量作物烟草也被认为是一种很有希望的生产大麻素的异源宿主。体外植物细胞培养物用于大麻素生产已经取得了一定的进展,包括遗传转化、细胞悬浮培养、多毛/不定根和异源系统等方面[58],如通过发根农杆菌和根癌农杆菌转化的遗传转化策略合成大麻素,可以加快新品种的开发并稳定旧品种。通过异源系统来产生大麻素合成的相关酶,有望实现大麻素的批量生产。
4.1汉麻组织体外扩繁
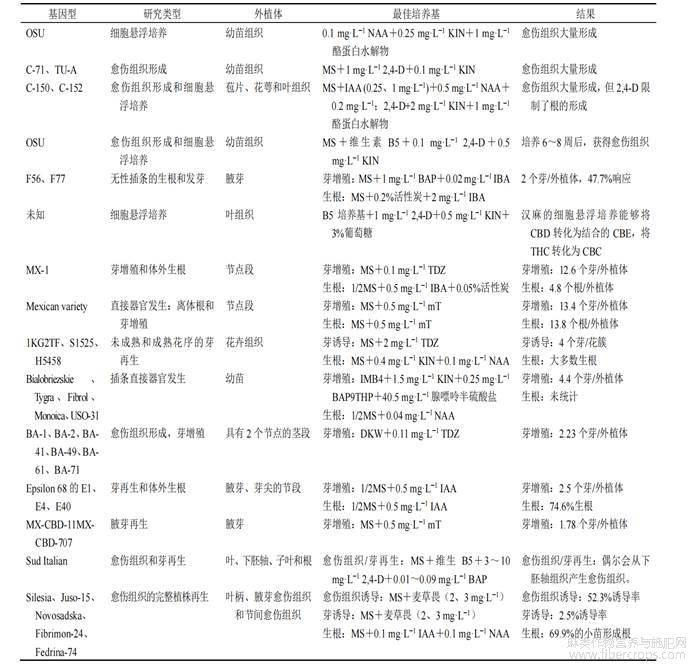
微繁殖技术的发展是遗传修饰的必要步骤,可以对大麻进行基因改造,这可能有助于将来新品种的育种。微繁殖可以实现植物快速繁殖和大规模生产。微繁殖的最大优势是优良材料的快速再生,并保存有价值的植物基因型,同时建立有效的再生体系[14]。尽管有多项关于通过微繁殖进行芽增殖的报道(表2),但通过从头再生获得完整植株的报道较少[59]。
汉麻微繁殖方式包括直接和间接器官发生,包含腋芽、枝梢、子叶和上胚轴的节段用于直接器官发生[62,63]。MX麻醉品种在含有0.5µmol/L(相当于0.11mg)噻二唑酮(thidiazuron,TDZ)的MS培养基上获得最佳繁殖率(每个外植体12~14个芽);可在加入2.5µmol/L(0.51mg)吲哚-3-丁酸(indole-3-butyric acid,IBA)的半强度MS培养基上生根[63]。mT-间-托泊林BAP9THP-6-苄基氨基-9-(四羟基吡喃基)嘌呤BAP-6-苄基氨基嘌呤DARIA(ind+)、DARIA(pro+)、DARIA(root+)-3种不同类型适用于木本植物生长的Daria培养基,分别有助于愈伤组织诱导、体细胞胚胎发生和生根。
纤维品种的繁殖率比较低,每个外植体的最大繁殖率在3~3.2个芽[62,64]。中国汉麻品种(Changtu)在添加0.2mg/LTDZ和0.1mg/Lα-萘乙酸(1-naphthylacetic acid,NAA)的MS培养基上每个外植体可以产生3.2个枝梢。在具有IBA和NAA的半强度MS培养基上,生根率达到85%,并且95%的植物在进一步驯化后仍然存活[62]。Feeney等[65]使用4个纤维麻品种的叶子、茎、叶柄和子叶来获得愈伤组织,在愈伤组织形成方面,最有效的培养基是添加了维生素B5以及2,4-二氯苯丙氨酸(2,4dichlorophenoxyacetic acid,2,4-D)和6-苄基氨基嘌呤(6-benzylaminopurine,BA)或激动素(kinetin,KIN)的MS培养基,在培养4周后生根,但未实现芽再生。Slusarkiewicz-Jarzina等[66]利用不同类型的外植体(幼叶、叶柄、节间和腋芽)的愈伤组织获得再生芽。其中叶柄外植体在含有2~3mg/L麦草畏(dicamba)的MS培养基上愈伤组织诱导率最高,达到87%。也有通过从上胚轴诱导愈伤组织再生的报道,该研究使用伊朗大麻的子叶和上胚轴为外植体,在含有2mg/LBA和0.5mg/LIBA的MS培养基上再生率最高(每个愈伤组织2个芽)[65]。Ioannidis等[67]开发了一种有效的体外微繁殖方法,用于大规模生产2种CBD和CBG高含量的汉麻品种。当全强度和半强度MS培养基均添加4.0µmol/LBA时,可获得最高的平均芽数和芽长。培育高含量CBD品种,全强度培养基中的最高芽数为3.63个,最长为5.66cm,而半强度培养基中的最高芽数为3.13个,最长为5.09cm。培育高含量CBG品种,全强度培养基平均植株芽数为3.38个,平均长度为6.23cm,而半强度培养基中的平均芽数为3.08个,平均长度为5.99cm。CBG和CBD高含量的2个品种都具有较好的生根率,分别达到了87.50%和83.33%,成活率均达到了97%。
4.2汉麻的农杆菌遗传转化及毛状根的诱导
汉麻对农杆菌转化具有相对抗性[66],但已有文献报道了基因转化和再生的方法[65,66,68,69,70]。由于再生效率低,对品种、组织、植物年龄的依赖性高以及缺乏转基因稳定性等原因,汉麻的基因转化至今仍然是一个挑战。Mackinnon等[71]第1个报道了汉麻成功转化的实验,选择芽尖外植体及根癌农杆菌进行转化,将半乳糖苷酶抑制蛋白基因(polygalacturonase-inhibitingproteins,PGIPs)和除草剂抗性基因成功引入汉麻中。在另1项研究中,利用携带二元pNOV3635载体的根瘤菌(EHA101)将愈伤组织细胞成功引入编码磷酸甘露糖异构酶(PMI)的基因,愈伤组织能够表达PMI基因,但不能实现器官和植株的再生[65]。Wahby等[69]报道了使用发根农杆菌和根癌农杆菌品系(A4、AR10、C58和IVIA251)对汉麻进行基因转化,研究者使用了5d龄的幼苗,并发现能在下胚轴和子叶节衍生的外植体上诱导毛状根,但未能使幼苗再生。Zhang等[72]报道了使用农杆菌介导的基因转化方法,成功生成了4株具有白化表型的基因编辑的汉麻幼苗,且繁殖了转基因植物并验证了T-DNA在汉麻基因组中能够稳定遗传给后代。
只有汉麻毛根被证实易受农杆菌侵染,从而在很短的时间诱发转化根培养物[69]。毛状根培养物在无激素的培养基中具有很高的生长速率,并且具有产生与野生型相当的次生代谢产物的潜力[73],是汉麻遗传转化和功能基因组学研究的重要途径之一。毛状根培养物具有诸多优点:对次生代谢产物的生物合成能力高、生长和生物量积累快、遗传稳定性高、生产成本低等。Sirikantaramas等[52]首次报道了在根培养物中产生大麻素的研究。研究者使用烟草毛状根培养物,从汉麻叶片(麻醉品种)中分离出THCAS,并对其cDNA进行克隆和测序。在花椰菜花叶病毒的pBI121质粒载体中,用带有THCAS的发根农杆菌(15834株)转化烟草的毛状根。转化的根培养物能够表达THCAS,并将外源添加的CBGA转化为THCA,最高转化率仅为8.2%。Farag等[74]从愈伤组织培养中建立了不定根。愈伤组织培养8周后,向B5固体培养基中添加生长素(NAA、IBA、IAA),从愈伤组织中诱导不定根,在黑暗条件下添加4mg/LNAA的培养基上获得了令人满意的生长和根分化。随后,将根尖转移至恒定补充生长素(IAA、IBA、NAA)的液体培养基(1/2B5)中培养。在这项研究中,大麻素的最大产量为THCA1µg/g(干质量)、CBGA1.6µg/g(干质量)和CBDA1.7µg/g(干质量)。研究结果也显示在黑暗条件下(28d的生长周期),毛状根培养物中大麻素含量非常低。
5结语
尽管人们在研究大麻素的生物合成方面付出了大量努力,但仍存在很多问题。如多种酶的结构及作用机制尚不清楚,对其他将近200种次要大麻素的产生途径和潜在应用价值也知之甚少,植物中不同毛状体的相互作用及调控机制仍不清楚;同时对汉麻生理活性的研究只限于THC和CBD,随着大麻素活性物质的药理作用越来越清晰,需要更深入地解析合成途径,以便可以在植物或重组载体中重新设计,选择性地生产高活性、高价值的大麻素及其衍生物。
用微生物发酵生产主要大麻素与植物竞争将是一项巨大的挑战,但是,异源大麻素生产能够产生用于医药用途的稀有或新的大麻素,除了主要的大麻素THC和CBD之外,合成生物学可用于构建一种底盘生物体,用于研究和表征参与那些含量较少的大麻素或其衍生物的生物合成的酶,并通过发酵生产活性化合物,使其达到工业化的生产水平。在植物方面,可以通过设计新型酶而合成植物大麻素,如汉麻酚类CBD及汉麻萜类精油等,进一步通过植物育种还可以提高这些稀有且对疾病治疗及健康有益的大麻素的产量。总之,这些策略将有助于挖掘和利用大麻素作为药物的潜在价值。
参考文献
[1]杜军强.汉麻生长过程中抗真菌活性成分的研究[D].雅安:四川农业大学,2012.
[11]Liu Y Y,Zhu P P,Cai S, et al.Three novel transcription factors involved in cannabinoid biosynthesis in Cannabis sativa L.[J].Plant Mol Biol,2021,106(1/2):49-65.
[16]Breijyeh Z,Jubeh B,Bufo S A,et al.Cannabis:A toxinproducing plant with potential therapeutic uses[J].Toxins,2021,13(2):117.
[18]Elphick M R.The evolution and comparative neurobiology of endocannabinoid signalling[J].Philos Trans R Soc Lond B Biol Sci,2012,367(1607):3201-3215.
[21]Salami S A,Martinelli F,Giovino A,et al.It is our turn to get Cannabis high:Put cannabinoids in food and health baskets[J].Molecules,2020,25(18):4036.
[22]DarišB,Tancer Verboten M,Knez?,et al.Cannabinoids in cancer treatment:Therapeutic potential and legislation[J].Bosn J Basic Med Sci,2019,19(1):14-23.
[23]Velasco G,Sánchez C,Guzmán M.Anticancer mechanisms of cannabinoids[J].Curr Oncol,2016,23(2):S23-S32.
[30]陈璇,张庆滢,郭蓉,等.不同发育时期大麻素合成相关酶基因表达特征与大麻素含量的相关分析[J].分子植物育种,2018,16(2):583-590.
[31]张建春.汉麻种植与初加工技术[M].北京:化学工业出版社,2009:61-62.
[32]Aliferis K A, Bernard-Perron D.Cannabinomics:Application of metabolomics in Cannabis(Cannabis sativa L.)research and development[J].Front Plant Sci,2020,11:554.
[42]Cole M D. The analysis of controlled substances[J].Choice Rev Online,2004,41(05):41-2835.
[50]Page J E,Boubakir Z.Aromatic prenyltransferase from Cannabis:US,9765308[P].2017-09-19.
[55]Blatt-Janmaat K,Qu Y. The biochemistry of phytocannabinoids and metabolic engineering of their production in heterologous systems[J].Int J Mol Sci,2021,22(5):2454.
[62]Wang R, He L S,Xia B, et al.A micropropagation system for cloning of hemp(Cannabis sativa L.)by shoot tip culture[J].Pak J Bot,2009,41(2):603-608.
[70]Sirkowski E E. Marked Cannabis for indicating medical marijuana:US,20120311744[P].2012-12-06.
[71]Mackinnon L,Mcdougall G,Aziz N,et al. Progress towards transformation of fibre hemp[A].Annual Report of the Scottish Crop Research Institute[R].Dundee:Scottish Crop Research Institute,2001:84-86.
文章摘自:崔素娟,武文博,谢洋,李鹏,隋新,张晓臣,郭春景,李广泽,尹静.汉麻酚类活性物质生物合成调控的研究进展[J].中草药,2022,53(04):1240-1251.