摘 要:以中大麻5号为材料,在23、26、29℃的恒温条件下进行盆栽试验,通过测定植株株高、茎粗、地上部和地下部生物量、叶片生理指标,花、叶及单株大麻二酚(CBD)含量等指标,以获得适合工业大麻生长的最佳栽培温度。结果表明:26℃恒温条件,能显著促进植株生长,在更短时间内提高CBD含量,花、叶、单株CBD平均含量分别达到了8.86、5.63、5.33mg/g,单株CBD总含量为53.82mg/株。这说明工业大麻温室栽培条件下的最佳室温为26℃。
关键词:工业大麻;恒温栽培;生理指标;大麻二酚
工业大麻(Cannabis sativa L.)是大麻科大麻属一年生草本植物,原产于中亚和东亚[1],分布于世界各地,在我国有着悠久的栽培历史,也是具有高附加值的特种经济作物。其种子、纤维和花叶中的天然活性成分被广泛用于食品、纺织、材料、化妆品和医药等领域。大麻素是具有烷基间苯二酚和单萜结构的次生代谢产物,主要存在于大麻叶和花中[2],最主要的2种为△9-四氢大麻酚酸(THCA)和大麻二酚酸(CBDA),它们可分别通过脱酸反应生成精神活性化合物四氢大麻酚(THC)和非精神活性化合物大麻二酚(CBD)[3]。近年来,国内外研究表明,CBD有治疗癫痫[4]、抗惊厥、镇痛、神经保护和抗炎(包括自身免疫性疾病)的益处[5]。目前英国GW制药公司开发的用于治疗婴儿严重肌阵挛性癫痫(Dravet Syndrome,DS)等和成人多发性硬化症(Multiple Sclerosis,MA)的药物已经在英国、加拿大等多个国家上市销售。近年来,我国在工业大麻栽培和大麻素药用提取方面也发展迅速,黑龙江和云南作为我国工业大麻种植的主产区,产品远销欧美。
目前,我国工业大麻原料主要是通过室外栽培获取,然而由于气候条件、水肥和病虫害等因素的不可控,导致获得的原料产率降低,且品质较差。相比室外栽培,受环境因素的影响小,室内种植因其条件可控性好、空间利用率高、作物产量高等特点而备受青睐[6-8]。工业大麻是一年生植物,室外栽培周期长,而室内栽培可以生产3~4周期作物。室外栽培生长条件受夏、秋、冬季环境变化和昼夜长短变化,采收不及时,会导致植株迅速衰老,而室内栽培可以通过控制光照、光周期、温度、空气循环和空气中二氧化碳浓度及空气湿度,合理调节环境参数来控制采收时间。加拿大、荷兰等国家室内栽培模式已经十分成熟。因此,开发温室或大棚栽培工业大麻是大势所趋。但是室内栽培也受多种因素影响,其中温度不仅影响植物叶绿素合成、酶活性大小、气孔限制等,还对植物有机物的合成和光合生理生态起着重要作用[9]。大麻生长的适宜温度为20~30℃[10]。利用恒温培养箱来控制大麻生长以达到调控大麻中有效成分含量的目的,目前国内外尚未见报道。
笔者以中国农业科学院麻类研究所培育的大麻品种中大麻5号为试验材料,对比23、26、29℃恒温条件下工业大麻的农艺性状(株高、茎粗、叶面积、生物量等)、生理生化指标(可溶性蛋白和可溶性糖含量、SOD和POD酶活性)、CBD含量,评估室内栽培温度对大麻CBD产量的影响,以期为工业大麻室内栽培提供参考。
1材料与方法
1.1试验材料
工业大麻品种为中大麻5号,由中国农业科学院麻类研究所栽培研究室提供,于麻产品研究室栽培实验室培养完成。CBD标准品(>98%)购自赛普瑞思北京技术有限公司。花盆(直径20cm,高18cm)栽培土为营养土与红土按1∶2混合。
1.2试验方法
1.2.1温度处理和栽培条件
试验于2020年11月至2021年3月在大麻栽培专用恒温气候箱中进行。生长周期控制在14周,营养期(前8周)光照控制在L∶D=14∶10,开花期(后6周)将光照控制在L∶D=10∶14,缩短时长,创造短日照环境诱导大麻开花。恒温气候箱中温度分别设置为23、26、29℃,保证温度恒定且相互独立,互不影响。将大麻种子播种于装满营养土的九孔穴盘中,出苗后每盆移栽3株长势均匀的健康幼苗至盆中,立即置于Biuepard恒温气候箱中。试验共3个处理,每个处理重复3次,每个重复30株雌株,施以相同的水肥管理,恒定温度,湿度75%~85%。样品分析均采用雌株。
1.2.2花叶收获时主要农艺性状测定
待到雌蕊变褐时,植株标记并收获(2021年2月17日),采用Yaxin-1241叶面积仪测定同一部位叶面积,使用直尺测量株高,游标卡尺测量茎基部到生长点部的茎粗,洗净根部泥土,吸干水分,使用电子天平(精确到0.001g)迅速称量地上部、地下部鲜重,再转至70℃烘箱烘至恒重称量干重。
1.2.3苗期生理生化指标测定
雌株收获时,选取大麻植株顶端10cm内叶片进行测定。每株同一部位取一片叶,每个重复混为1个样品,用锡箔纸装好放于液氮速冻,随后置于-80℃冰箱保存,用作可溶性蛋白、可溶性糖、SOD酶和POD酶的测定。
1.2.4花、叶CBD含量的测定
(1)CBD提取。在栽培84d(2021年1月27日)后取雌株花、叶样,间隔10d取样一次,最后一次取全部雌性花、叶样,同干重混合,每个重复混为1个样品,70℃烘箱烘干至恒重待测。样品处理参照郭孟璧等[11]的方法,每个样品重复测定3次,取平均值。
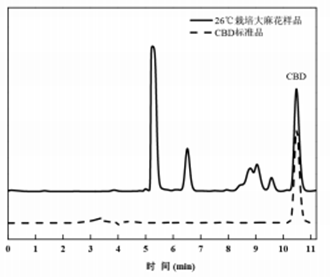
(2)HPLC检测。使用SyncronisC18色谱柱(250mm×4.6mm,粒径5µm)对样品进行检测分析,以体积比90∶10的乙腈和5%醋酸缓冲液为流动相,流速0.6mL/min,采用等度洗脱方式,柱温30℃,检测波长220nm,进样量20µm。流动相和样品溶液均经过0.45µm尼龙滤膜过滤。CBD标准曲线:Y=110447X-105.87(R²=0.9992),其中Y为峰面积,X为CBD浓度。图1为高效液相色谱检测CBD的色谱图。
图1高效液相检测CBD结果
1.2.5花、叶及单株CBD理论平均含量和产量计算
收获雌株全株花和叶,置于70℃烘箱烘干至恒重。花、叶CBD含量测定方法同上。按照公式(1)、(2)计算雌株单株CBD平均含量和总量。
单株CBD平均含量(mg/g)=(花CBD含量×花干重+叶CBD含量×叶干重)/(花干重+叶干重)(1)
单株CBD总量(mg/株)=(花CBD含量×花干重+叶CBD含量×叶干重)/株数(2)
1.2.6数据处理
采用Excel2010软件进行数据处理、SPSS26.0软件进行显著性检验,并采用Duncan法在P<0.05显著水平上对各项测定指标的平均值进行多重比较,采用GraphpadPrism8.0软件作图。
2结果与分析
2.1温度对工业大麻株高和茎粗的影响
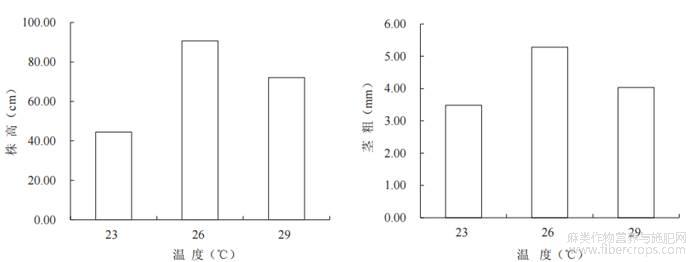
茎是植物的营养器官之一,是自下而上运输通道来供各组织器官的生命周期生长发育所需的水分和矿物质。茎越发达,越有利于营养物质的运输,从而提高植株生产力。图2显示,26℃处理的株高、茎粗分别为90.7cm、5.28mm,分别是23℃的1.5倍和2.0倍,差异性显著,表明26℃处理对株高和茎粗的增强作用明显。
2.2温度对工业大麻生物量和叶面积的影响
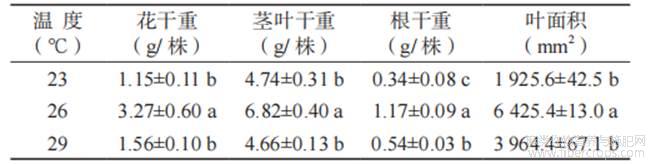
叶片是进行光合作用、呼吸作用、蒸腾作用的重要器官,从表1可以看出,26℃下叶面积最大。合适温度下,植株叶片较大,植株更高,表明该植物更能适应外界环境,因此,更有利于植物体生物量的增加。在3个处理中,叶面积最大的为26℃处理,达到6425.4mm2,与其他2个处理差异均显著,显著高于23℃和29℃,是23℃时的3.3倍。同时,26℃处理的大麻花干重、茎叶干重、根干重均高于其余2个处理,分别为3.27、6.82、1.17g,分别为23℃的2.8倍、1.4倍和3.4倍。综合植株产量及叶面积,26℃恒定温度适合于工业大麻室内土培生产。
表1温度对工业大麻生物量和叶面积的影响
注:同列数据后不同小写字母表示处理间差异显著(P<0.05)。
2.3温度对工业大麻生理指标的影响
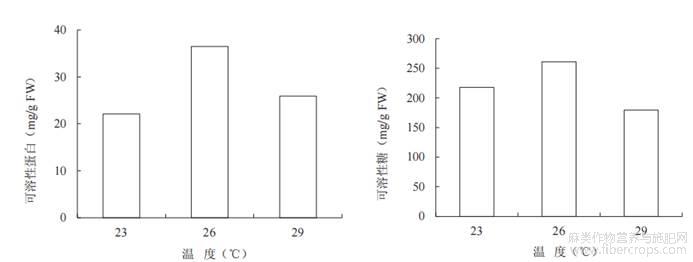
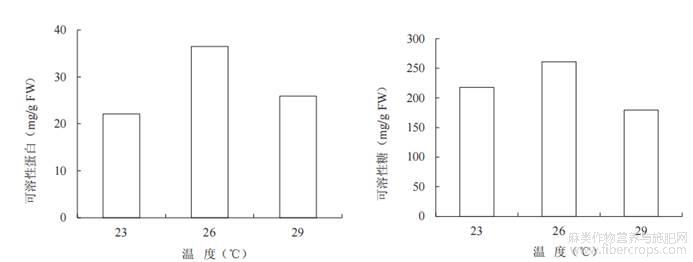
可溶性蛋白和可溶性糖可为植物细胞生长发育和呼吸作用提供能量,由图3可知,与23℃和29℃相比,26℃下叶片的可溶性蛋白质(36.5mg/g)和可溶性糖含量(261.3mg/g)都显著高于其余2个处理。
图2温度对工业大麻株高、茎粗的影响
图3不同温度对工业大麻生理指标的影响
2.4温度对工业大麻植株酶活的影响
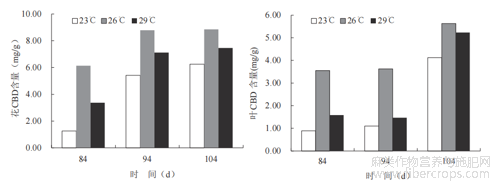
由图4可知,温度对大麻叶片中SOD酶和POD酶活性影响变化趋势均基本一致,23℃时最高,29℃时次之,26℃时最低。恒温23℃促进了大麻植株过氧化物酶和超氧化歧化酶的含量,其SOD酶活值为339.4U/g,POD酶活值为12203.1U/g,是26℃时的1.5倍和1.3倍,表明23℃下大麻植株老化程度更高,受到的环境胁迫更大,其中26℃时受到的环境胁迫最低。2.5温度对雌株花叶中CBD含量的影响从图5中可以看出,随着温度的增加,大麻二酚的含量呈现整体上升趋势,恒定26℃对大麻植株花、叶中CBD含量起显著促进作用,栽培84d到104d,23℃条件下花、叶的CBD含量分别从1.25、0.89mg/g增至6.15、4.12mg/g;26℃条件下花、叶的CBD含量从6.14、3.55mg/g增至8.86、5.63mg/g;29℃条件下花、叶的CBD含量从3.37、1.59mg/g增至7.47、5.23mg/g。
2.6温度对雌株花叶中CBD平均含量和产量的影响
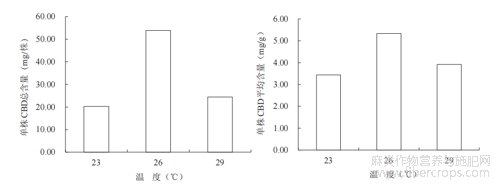
大麻二酚的产量是衡量药用工业大麻经济生产价值的重要指标之一[12]。如图6所示,26℃恒温能显著提高雌株CBD含量,达到53.82mg/株,是23℃时的2.7倍,29℃时的2.2倍。同时单株CBD平均含量达到5.33mg/g,高于2
图4温度对工业大麻SOD酶活和POD酶活的影响
图5温度对不同栽培时间花叶中CBD含量的影响
图6温度对工业大麻CBD积累量的影响
3小结与讨论
试验结果表明,工业大麻的温度响应差异明显,在26℃恒温条件下,工业大麻的生长和体内各项生理生化指标达到最佳,这可以为进一步温室工业大麻栽培提供参考。
影响室内栽培的因素很多,例如温度、光照、水分、空气中CO2浓度等,其中温度对植物生长发育的影响尤为显著,合适的温度有助于提高目标产物的产量[13]。在该研究中,不同的恒定温度对工业大麻生长和生理生化指标的影响差异显著,结果表明,26℃时,工业大麻生长(图2)和CBD积累(图6)较23℃和29℃时有显著增长。这可能是由于随着温度的升高,工业大麻的生长趋势先增加后降低,净光合作用与蒸腾作用的比率随着温度的升高增加到一定水平,再随着温度的升高而减少的结果[14]。该研究中,工业大麻在恒定温度26℃时,生物量、叶面积、株高、茎粗指标最佳,这可能与植物体对温度的适应机制有关,在23℃和29℃时,持续较低或者较高的温度使得工业大麻生长变慢,低温抑制地上部生长,使得干物质积累量减少[15]。而短时间的高温可以通过活化光合作用代谢酶来加快植株体内物质的转化和代谢,促进植物生长发育,但是持续升温,会抑制植株生长,使得植物生物量、干物质的量和生长速率都有所下降[16-17]。
过氧化物酶(SOD)和超氧化歧化酶(POD)是衡量植物逆境条件的一个指标,他们是抗氧化酶系统的重要组成部分。当植物受到环境胁迫时,体内的活性氧会大量增加,影响植物正常生长,此时植物抗氧化酶系统中过氧化物酶含量SOD含量也会增加,提高植物抵抗逆境和适应环境的能力[18-19]。在逆境条件下,它们消除过量的自由基,保护植物细胞的膜结构功能,维持植物细胞活性氧代谢平衡[20-21]。试验中,23和29℃时的SOD和POD酶活均高于26℃,这说明26℃时工业大麻的生长最适宜,受到的外界胁迫最轻。
适宜的温度能促进植物生长发育,增加有机物产量的积累。不同恒定温度对工业大麻CBD的含量和积累产生了不同影响。大麻中CBD的产量不仅取决于花、叶中CBD相对含量,也与花、叶的生物量相关[22]。该研究中,26℃能显著增加工业大麻花、叶中CBD含量,同时也能增加花、叶的生物量。
参考文献
[1] HAPPYANA N,AGNOLET S,MUNTENDAM R,et al. Analysis of cannabinoids in laser-microdissected trichomes of medicinal Cannabis sativa using LCMS and cryogenic NMR[J]. Phytochemistry,2013,87 :51-59.
[2] TAURA F ,SIRIKANTARAMAS S ,SHOYAMA Y ,et al.Phytocannabinoids in Cannabis sativa: recent studies on biosynthetic enzymes[J].Chemistry & Biodiversity,2007,4(8 ):1649-1663.
[3] PEREZ J,RIBERA M V. Managing neuropathic pain with Sativex®:a review of its pros and cons[J]. Expert Opinion on Pharmacotherapy,2008,9(7 ):1189-1195.
[4] FRANCO V,PERUCCA E. Pharmacological and therapeutic properties of cannabidiol for epilepsy[J]. Drugs,2019,79( 13 ):1435-1454.
[5] MACCALLUM C A,RUSSO E B. Practical considerations in medical Cannabis administration and dosing[J]. European Journal of Internal Medicine,2018,49 :12-19.
[6] CHANDRA S,LATA H,ELSOHLY M A. Propagation of Cannabis for clinical research: an approach towards a modern herbal medicinal products development[J]. Frontiers in Plant Science,2020 ,11 :958.
[7] CHANDRA S,LATA H,KHAN I A,et al. Photosynthetic response of Cannabis sativa L. to variations in photosynthetic photon flux densities, temperature and CO2 conditions[J]. Physiology and Molecular Biology ofPlants,2008 ,14(4 ):299-306.
[8] CHANDRA S,LATA H,MEHMEDIC Z,et al. Light dependence of photo synthesis and water vapor exchange characteristics in di?erent highΔ9-THC yielding varieties of Cannabis sativa L.[J]. Journal of Applied Research on Medicinal andAromatic Plants,2015,2(2):39-47.
[9] 李洪军,吴玉环,张志祥,等.温度变化对木本植物光合生理生态的影响[J].贵州农业科学, 2009,37(9):39-42,45.
[10] VANHOVE W,MAALSTÉ N,VAN DAMME P. Why is it so difficult to determine the yield of indoor Cannabis plantations? A case study fromthe Netherlands[J]. Forensic Science International,2017,276 :e20-e29.
[11] 郭孟璧,郭鸿彦,许艳萍,等.工业大麻酚类化合物HPLC分析前处理工艺的研究 [J]. 中国麻业科学, 2009,31(3):182-185.
[12] 郭孟璧, 陈璇, 郭鸿彦, 等.不同光质对工业大麻生长及其抗癫痫成分大麻二酚积累的影响 [J]. 中药材, 2019,42(10):2220-2225.
[13] 刘保林.光质和温度对日光温室番茄生长发育及产量品质的影响 [J]. 安徽农业科学, 2014(30):10452-10455.
[14] 徐友,曹福亮,汪贵斌,等.温度和光强对银杏生长的影响 [J].林业科技开发, 2015,29(4):41-45.
[15] CHANDRA S,LATA H,KHAN I A,et al. Temperature response of photo synthesis in different drug and fiber varieties of Cannabis sativa L.[J]. Physiology and Molecular Biology of Plants,2011 ,17(3):297-303.
[16] 张洁,李天来,徐晶,等.不同天数亚高温处理对日光温室番茄果实生长发育、产量及品质的影响 [J]. 沈阳农业大学学报, 2007,38(4):488-491.
[17] 赵锋亮.长期夜间亚低温和长期昼间亚高温对茄子生长发育的影响 [D]. 郑州 :河南农业大学, 2008.
[18] 窦俊辉,喻树迅,范术丽,等.SOD与植物胁迫抗性 [J]. 分子植物育种,2010 ,8(2):359-364.
[19] 田国忠,李怀方,裘维蕃.植物过氧化物酶研究进展 [J]. 武汉植物学研究,2001 ,19(4):332-344.
[20] 王建华,刘鸿先,徐同.超氧物歧化酶 (SOD) 在植物逆境和衰老生理中的作用 [J]. 植物生理学通讯, 1989,25(1):1-7.
[21] 徐心诚 . 低温弱光对黄瓜幼苗过氧化物酶同工酶和丙二醛含量的影响[J].河南农业科学, 2012,41(1):113-116.
[22] WEI X Y,ZHAO X L,LONG S H ,et al. Wavelengths of LED light a?ect the growth and cannabidiol content in Cannabis sativa L.[J].Industrial Crops and Products,2021 ,165 :113433.
文章摘自 王雅妮,曾粮斌,汪洪鹰,杨媛茹,谭志坚,易永健.温度对工业大麻生长及大麻二酚含量的影响[J].湖南农业科学,2021(10):27-31.