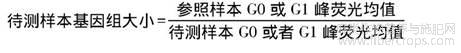摘 要:木槿属植物纤用价值高,且兼具观赏价值和药用价值,但其基因组学研究相对匮乏,严重制约木槿属植物的研究与利用。研究以玉米B73为内标,采用流式细胞仪估算4个红麻品种及其近缘种玫瑰茄(Hibiscus sabdariffa L.)和玫瑰麻(Hibiscus sabdariffa var.altissima Wester)的基因组大小,同时检测基因组大小在种内及种间是否存在差异。结果表明,红麻的基因组大小平均为1143.28Mb,2C DNA含量为2.338pg;玫瑰茄及其变种玫瑰麻的基因组大小平均为2506.40Mb,2C DNA含量为5.126pg。红麻品种间基因组大小存在显著性差异,同时木槿属在种间也存在显著性差异。此外,玫瑰茄及玫瑰麻的2C DNA含量约为红麻的两倍。该研究旨在为木槿属植物基因组学和遗传进化研究奠定基础。
基因组大小(Genome size),又称C值,是指一个基因组中所拥有的DNA含量,一般以重量计算,或是以核苷酸碱基对的数量表示[1]。植物基因组大小的测定可以估测物种的DNA含量,为该物种的基因组测序及基因组学研究提供参考。染色体组多倍化是促进物种形成的重要因素之一[2,3],大部分开花植物的祖先都经历过一轮或几轮多倍体化[4],因此鉴别植物类群的倍性水平对研究其系统进化、物种起源模式具有非常重要的价值。流式细胞术是测定基因组大小的常用方法之一,已广泛应用于植物、真菌等的基因组大小测定,该制样方法简便易行,检测结果较为稳定可靠[5]。
木槿属(Hibiscus)属于锦葵科,全属约200余种,分布于热带和亚热带地区,中国有24种和16变种或变型。该属多为草本、灌木或乔木,且多数种类有着大型美丽的花朵,是主要的园林观赏花灌木,部分种类的皮层纤维发达,多为很好的纤用植物。随着用途的不同拓展,木槿属植物越来越受到植物学家、育种家的关注。对木槿属植物进行基因组大小测定对木槿属植物的遗传改良及种质资源的利用和保护具有重要的意义。
红麻(Hibiscus cannabinus)属木槿属(Hibiscus)一年生经济作物,玫瑰茄(Hibiscus sabdariffa L.)及其变种玫瑰麻(Hibiscus sabdariffa var. altissima Wester)同样属于木槿属,他们是红麻的野生近缘种。红麻韧皮纤维柔软,纤维拉力强,对气候和环境适应性强,寒、温、热带气候均可栽培,在轻盐碱地和干湿地上也可生长。红麻是传统的麻纺产业重要的原料作物,近年来红麻纤维原料被用来研发生产汽车内衬、纸地膜、轻型板材、活性炭及环境友好吸附材料,因此,红麻被视为21世纪潜在的优势植物[6]。玫瑰茄,也叫洛神葵,其花萼可作为原料或添加剂用于食品领域,花蕾采收干制后可入药,具有诸多保健功效。玫瑰麻属于玫瑰茄纤维用的变种,高抗根结线虫,抗红麻炭疽病力强,纤维支数高、品质好。
借助测序技术的不断发展,科研人员完成了越来越多植物的基因组测序。但目前关于木槿属植物基因组测序相关研究报道较少,仅有红麻品种“福红952”的测序工作已完成[7]。木槿属植物红麻、玫瑰茄及变种玫瑰麻的测序可为其更好地遗传改良打下基础,而对两种物种的基因组大小进行测定,可为其基因组的测序提供参考。
前人[8,9,10]于2009年完成了玉米B73的测序工作,且将其作为内标广泛用于植物基因组大小的测定中。本研究拟以已测序的玉米B73为内标,采用流式细胞仪测定和估算不同红麻品种、玫瑰茄及玫瑰麻等种质资源的基因组大小,旨在为今后开展木槿属植物的基因组测序及基因组学研究等工作提供理论参考。
1材料与方法
1.1植物材料
红麻(Hibiscus cannabinus)、玫瑰茄(Hibiscus sabdariffa)、玫瑰麻(Hibiscus sabdariffa var. altissima Wester)等资源保存于中国农业科学院麻类研究所国家麻类作物种质资源中期库,作为内标的玉米B73由中国农业科学院生物技术研究所提供。玉米B73目前已成功测序,其基因组大小约为2365Mb,2C DNA含量约为4.836pg。本试验所使用的材料是植物的幼嫩叶片,需将待检测的种子培养成幼苗。
1.2 细胞核解离液
单纯的物理切碎方法无法获得大量单个完整的细胞核,还需加入特异的细胞核解离液。本试验采用的细胞核解离液是Marie nuclear isolation缓冲液[11],配方是50mmol/L葡萄糖、15mmol/L KCl、15mmol/L NaCl、5mmol/L Na2EDTA、50mmol/L柠檬酸钠、0.5%(V/V) Tween 20、50mmol/L HEPES、0.5%(V/V) β-巯基乙醇,调节pH至7.2,4℃条件下保存。
1.3植物组织匀浆的制备
取适量新鲜的植物幼苗叶片放入培养皿中,加入1mL的Marie nuclear isolation,用双面刀在冰上快速切碎,然后用直径为40μm的尼龙网将切碎的植物组织匀浆过滤至离心管中,静置于冰上备用(放置时间不宜过长)。
1.4细胞核DNA的特异性染色
取500mL过滤后的细胞核悬浮液移入新的离心管中,加入10μL的10 mg/mL的RNase A,混匀后冰上静置10 min;加1mg/mL的碘化丙啶溶液(PI, propidiumiodide)后混匀至浓度50μg/mL,然后在冰上避光静置20min以上。
1.5植物核基因组大小的测定
利用BD Accuri C6流式细胞仪(购自美国BD公司)对植物细胞核悬浮液进行测定,激发光波长为488nm,收集FL2通道的荧光信号,每个样本收集不低于2万个细胞,每个样本重复测定3次。核DNA含量(基因组大小)计算公式为:
2结果与分析
2.1单个植物玫瑰茄、玫瑰麻及红麻品种组织匀浆的检测结果波峰数据
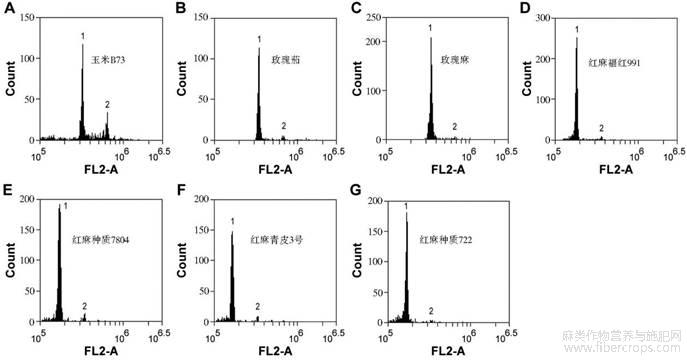
首先,为了检测细胞核解离液的适用性,使用流式细胞仪对特异性染色的植物组织匀浆进行检测,检测收集过程中设置阈值为:FSC-H:10000,FL2-H:1000。各种待测植物的细胞核DNA波峰的变异系数(CV)都相对较小,即所得到的波峰数据是可靠的,也说明Marie细胞核解离液是适用于所有待测植物的细胞核解离液。检测得到的2C峰值分别是:玉米B73,319937.6;玫瑰茄,338143.2;玫瑰麻,342389.3;红麻福红991,168909.4;红麻种质7804,169141.8;红麻青皮3号,163065.6;红麻种质722,166207.2 (图1)。
图1 流式细胞仪检测玉米B73、玫瑰茄、玫瑰麻及红麻不同品种幼苗叶片的波峰数据
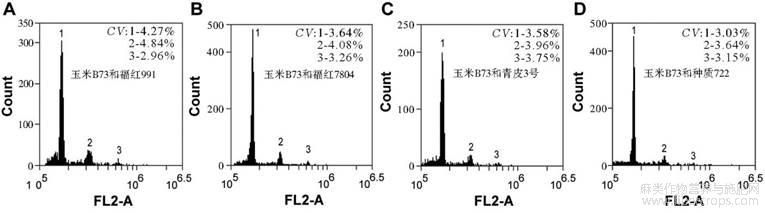
内标植物的组织匀浆与待测植物的组织匀浆混合可以有效地减少试验误差。然而玫瑰茄、玫瑰麻与玉米B73的G0/G1期峰值几乎相同,在图中无法区分,故进一步对玉米B73与红麻不同品种的组织匀浆进行混合检测。如图2所示,检测得到红麻及玉米B73的2C峰值分别是:福红991,165641.2,玉米,318941.2;种质7804,165679.6,玉米,322378.4;青皮3号,163065.8,玉米,323092.5;种质722,163658.4,玉米,323693.6。
图2 流式细胞仪检测玉米B73与不同红麻品种幼苗叶片组织匀浆混合液波峰数据
2.2木槿属种间及红麻种内及品种间的基因组大小
内标玉米B73的材料取自不同日期,经检测其平均2C峰值是321608.7±2064.5(平均值±标准差)。进一步方差分析表明,红麻不同品种基因组大小存在差异,玫瑰麻与玫瑰茄的基因组大小无显著性差异,并且研究发现玫瑰茄与玫瑰麻的2C DNA含量约是红麻的2倍(表1、2)。
表1 4个红麻品种的基因组大小
|
编号 |
材料 |
基因组大小/Mb |
最小显著差异 |
基因组大小平均值 |
变异系数/% |
|
|
福红991 |
1183.87±22.01 |
a |
1143.28±45.97 |
1.24 |
|
|
青皮3号 |
1178.00±30.81 |
ab |
||
|
|
722 |
1121.77±22.98 |
bc |
||
|
|
7 804 |
1088.51±14.18 |
c |
注:不同小写字母表示差异显著(p<0.05)。
表2 玫瑰茄、玫瑰麻及红麻基因组大小及2C DNA含量
|
|
材料 |
基因组大小/Mb |
2C DNA含量/pg |
最小显著差异 |
|
|
玫瑰茄 |
2490.58±14.38 |
5.093±0.029 |
a |
|
|
玫瑰麻 |
2522.21±14.56 |
5.158±0.030 |
a |
|
|
红麻 |
1143.28±45.97 |
2.338±0.094 |
b |
注:不同小写字母表示差异显著(p<0.05)。
3讨论
流式细胞术操作简单、重复性好、测定结果精确,已被广泛用于植物基因组大小测定和倍性鉴定,先后完成了海菜花属、兰属等植物基因组大小的测定[12,13]。除了具有较高的观赏价值外,部分木槿属植物纤维品质好、药用价值高,未来在纺织、医药、建材等领域具有良好的应用前景。但目前关于木槿属植物基因组大小的研究较少,仅在红麻中有过报道[11],该属中玫瑰茄及其变种基因组大小尚未见报道。本研究以已测序的玉米B73为内标对红麻不同品种及其近缘种玫瑰茄和其变种玫瑰麻进行了基因组大小测定,结果显示,无论是单个植物组织匀浆测定还是混合组织,DNA含量的变异系数CV均处于5%以内,表明试验结果可靠稳定。
红麻具有耐逆性好、适应性强、纤维产量高等特性,除作为传统麻纺产业重要的原料作物,近年来被广泛用于汽车内衬、纸地膜、轻型板材、活性炭及环境友好吸附材料的制备。我国现收集红麻种质资源达1800多份,但对这些资源基因组大小研究报道较少。Zhang等[7]采用二代+三代的测序策略,同时结合Hi-C染色体构象捕获技术和高密度遗传图谱,首次完成红麻全基因组测序和组装工作,其基因组大小约为1078Mb。本研究对4份红麻种质资源基因组大小进行了测定,其基因组大小平均值为1143 Mb, 且测定发现红麻种质资源“7084”基因组大小为1088.51±14.18Mb,与Zhang等[11]通过测序所获得的基因组大小相近,表明本研究通过流式细胞术估算红麻基因组大小,结果较为稳定可靠。近期研究利用EST-SSR标记对包含青皮3号、722及7804在内的44份红麻标记进行了遗传多样性分析,发现上述3份资源被聚类为不同的大类,暗示这3份种质资源存在一定的遗传距离[14]。本研究发现上述3份红麻种质间基因组大小存在差异,也同时暗示这些资源间遗传背景存在一定差异,与近期研究结果相类似。
作为红麻的近缘种,玫瑰茄用途较为广泛。花萼可作为食用原料或添加剂用于食品领域,花蕾晒干后入药,具有很好保健功效。玫瑰麻属于玫瑰茄纤用变种,具有纤维品质好的特点,但关于玫瑰茄及玫瑰麻基因组大小的研究尚未有相关报道。本研究利用流式细胞术首次对玫瑰茄及其变种玫瑰麻的基因组大小进行测定,其结果表明玫瑰茄及其变种玫瑰麻在基因组大小上无显著差异,且玫瑰茄基因组2C DNA含量约是红麻的2倍(2490.58±14.38Mb VS 1143.28±45.97Mb)。现有研究结果表明,红麻染色体数目一般为2x=36,玫瑰茄及玫瑰麻的染色体数目为4x=72,该研究结果中染色体倍性差异与本研究2C DNA含量差异相对应[15]。
4结论
综上,本研究以玉米B73为内标,采用流式细胞术对4个红麻品种及其近缘种玫瑰茄及玫瑰麻的基因组大小进行测定,发现红麻平均基因组大小约1143.28Mb,且4个红麻品种间基因组大小存在差异。同时研究发现玫瑰茄的基因组大小约为红麻基因组的2倍。该研究结果可为开展木槿属植物的基因组测序、基因组文库建立以及系统进化研究等工作提供理论基础。
参考文献
[2]Schmidt-Lebuhn A,Fuchs J,Kessler M.Flow cytometric measurements do not reveal different ploidy levels in minthostachys (lamiaceae)[J].Plant Systematics and Evollution,2008,271(1-2):123-128.
[5]韩鸿鹏,宋纯鹏.流式细胞术在植物生物学研究中应用进展[J].北方园艺,2011,15:178-181.
[6]李德芳.红/黄麻新用途综合开发与国际合作[J].中国麻业科学,2007,29(z2):411-414+419.
[8]Schnable P,Ware D,Fulton R,et al.The B73 maize genome:complexity,diversity,and dynamics[J].Science,2009,326:1112-1115.
[9]林峰,肖月娥,周翔宇,等.25份鸢尾属植物基因组DNA C值的流式测定[J].草地学报,2018,26(4):198-203.
[10]齐香玉,陈双双,冯景,等.3种瓣型茉莉基因组大小测定与比较[J].江苏农业科学,2020,48(19):40-44.
[12]林瀚,韩晓文,兰思仁,等.基于流式细胞技术两种兰属植物基因组大小的测定[J].森林与环境学报,2019,39(6):616-620.
[13]严东莹,李艳,孙文礼,等.基于流式细胞术的海菜花属植物基因组大小测定[J].植物科学学报,2020,38(2):173-180.
[14]金关荣,安霞,骆霞虹,等.红麻干旱响应基因EST-SSR标记[J].分子植物育种,2018,16(14):4735-4742.
[15]邓丽卿,黄培坤,粟建光,等.红麻和木槿属Furcaria组植物的形态分类及细胞遗传学研究[J].湖南农学院学报,1994,20(4):310-317.
文章摘自:潘根,董志雪,唐蜻,程超华,臧巩固,李德芳,黄思齐,李建军,赵立宁.流式细胞术测定玫瑰茄及红麻的基因组大小[J].中国麻业科学,2021,43(05):217-221.