摘 要:【目的】杂草野燕麦是危害作物产量及质量的主要杂草之一,为高效的防治杂草野燕麦,探究了高原特色植物大麻不同部位(全株、根、茎、叶和种子)甲醇提取物对杂草野燕麦的抑草活性。【方法】采用萃取法得到大麻不同部位提取物,用种子萌发法处理供试种子,研究10.000,5.000,2.500,1.250,0.625,0.313mg/mL质量浓度下大麻不同部位提取物对野燕麦种子发芽率及幼苗芽长、根长、鲜质量、干质量的影响,并对小麦种子萌发及幼苗生长进行安全性分析。【结果】大麻不同部位提取物对野燕麦种子的萌发呈"低促高抑"趋势,大麻根、茎、叶的粗提物为0.313~1.250mg/mL时,对野燕麦种子芽长生长表现出促进作用,在高质量浓度2.500~10.000mg/mL时,呈抑制作用;大麻全株、根、茎、叶、种子的粗提物在0.313mg/mL时,对野燕麦种子根长生长呈促进作用,在10.000mg/mL时均表现为显著抑制作用。大麻不同部位甲醇提取物在不同浓度下对野燕麦幼苗根长、芽长抑制作用强弱不同,由强到弱依次为种子浸提液、全株浸提液、茎浸提液、根浸提液和叶浸提液,其中大麻种子提取物在质量浓度为0.313~2.500mg/mL时,对野燕麦种子萌发和幼苗生长表现抑制作用,且对小麦种子生长无影响。【结论】大麻不同部位提取物均含除草的活性物质,大麻种子可能是抑草活性物质产生的主要场所,为大麻在植物源除草剂中的开发利用提供科学依据,其释放的活性物质的具体成分及其相关机制尚待进一步研究。
关键词:大麻甲醇提取物;抑草活性;野燕麦;安全性
【研究意义】我国农田杂草种类繁多。据统计,农田杂草种类高达200多种,其中发生面积大的杂草约10种,而这10种当中禾本科杂草占40%,每年小麦田草害面积达1000万hm2[1]。麦田杂草主要有野燕麦、猪秧草、硬草、早雀麦等,这些田间杂草与作物植株争夺光、水和无机物等资源[2],一定程度的减少了作物吸收的资源量,阻碍作物的生长发育,对农业影响很大,严重影响我国农作物大面积减产。野燕麦,又称燕麦草、铃铛麦,属禾本科燕麦属[3],一年生杂草,田间生长旺盛,阻碍作物生长发育。其危害作物主要表现:对田间无机物的吸收能力比农作物强,分蘖数多,影响作物正常生长发育;诱发病虫害,是作物害虫的宿主;不仅造成农作物减产,还影响谷物产品质量。据统计,全国仅常见的禾本科杂草野燕麦造成的灾害发生面积高达5×106hm2,导致年粮食的减产量约17.5×109kg[1],因此必须加大野燕麦的防治力度。大麻又名线麻、白麻、胡麻、野麻和火麻,是桑科大麻属的一年生草本植物[4]。原产产于亚洲中部,因其生长迅速且适应性强,现已在全球范围广泛分布,多变种[5,6]。大麻含有多种活性化合物,其中大麻素类成分是大麻中的主要活性成分。大麻素类成分大多不溶水,但溶于醇类和非极性有机溶剂[4]。【前人研究进展】目前,在植物资源中发现的具有除草活性的化合物主要有萜烯类、醌酚类、生物碱类、肉桂酸类、香豆素类、噻吩类、类黄酮类和氨基酸类等[7,8],商品化的植物源除草剂有三酮类除草剂、二苯醚类、人工合成壬酸等[9]。有报道称大麻中提取的纯大麻素可以杀死螨虫、昆虫、线虫、真菌和原生动物。大麻与其他作物一起种植,对杂草、真菌、昆虫和线虫也有较好的防治效果,同时干叶和花的提取物具有驱虫效果[10,11]。【本研究切入点】我国杂草防治主要以化学除草剂为主,虽然除草效果显著,但也面临着一系列问题,如杂草种群演替频率加快,增强化学除草难度、长残效除草剂的使用给生产留下隐患、杂草抗药性上升、药害、污染环境及破坏生态平衡等。中国在“十三五”规划中提出“药肥双减”目标,其中除草剂在整个农药市场中占比超过50%,因此,大幅降低化学除草剂的用量有利于这个目标的实现[12]。植物是生物活性化合物的天然宝库,其产生的次生代谢产物超过400000种[13,14]。植物源除草剂因其来源丰富、高效低毒、可生物降解等特性,既能保护生态环境,又能合理利用自然资源,使得农田杂草“变害为宝”,成为了近年来研究最广泛的新型农药之一[15,16,17,18,19]。推动植物源除草剂的跨越式发展,加速新型农药的创制及改造,大力推进农药减量控害,积极探索出高效、产品安全、资源节约、环境友好的现代农业发展之路,对解决化学农药长期大量、不合理施用带来的抗性问题、残留问题、环境风险问题等有很重要的研究价值。【拟解决的关键问题】本实验以高原特色植物大麻为供试对象,探究其不同部位提取物的抑草活性,旨在发现植物组织中有除草作用的天然活性物质,为开发高效、安全、环境友好的新型除草剂奠定基础,为作物田间杂草的有效防治提供理论依据。
1材料和方法
1.1试验材料
1.1.1供试植物
供试植物野燕麦种子、小麦种子由青海省农林科学院植物保护研究所提供,大麻植株采于青海省大通县田间地头。
1.1.2仪器设备
N-1100旋转蒸发仪,OSB-2100EYELA油浴锅,HX1050恒温循环器,SHB-111循环水式多用真空泵,SHZ-82恒温振荡器,恒温光照培养箱,LDZX-50KB立式压力蒸汽灭菌锅,磁力搅拌器,无菌操作台。
1.2试验方法
1.2.1不同质量浓度大麻植株不同部位粗提物的制备
根据文献[20,21]方法,将采集的大麻全株置阴凉处干燥后,取根、茎、叶、种子及完整植株,分别进行剪碎处理;将大麻完整植株、根、茎、叶及种子干粉分别装到1000mL三角瓶中,用体积分数80%的甲醇在25℃下避光浸泡3d,用双层滤纸过滤;用相同方法进行二次浸泡提取,合并2次滤液,用旋转蒸发仪进行减压浓缩,得到大麻全株、根、茎、叶、种子的甲醇粗提物,置4℃冰箱中备用。称取300mg粗提物置于50mL烧杯中,加入3mL甲醇作为溶剂,再加入2mL蒸馏水充分搅拌,然后用超声波震荡10min,使其完全溶解,定容至30mL,即为10mg/mL浸提液。而后加蒸馏水分别稀释成10.000,5.000,2.500,1.250,0.625,0.313mg/mL,6个质量浓度梯度的浸提液备用,以无菌水的种子处理作为对照。
1.2.2大麻植株不同部位粗提物对野燕麦种子萌发及幼苗生长测定
选取大小一致、颗粒饱满的野燕麦种子,用2.5%的次氯酸钠溶液浸泡20min,同时用磁力搅拌器搅拌10min,再用无菌水搅拌冲洗3次,每次3min,用吸水纸将种子表面水分吸干,便于除去种子表面残留的次氯酸钠溶液,用无菌水泡在培养皿,放在25℃恒温培养箱中催芽24h。筛选露白一致的野燕麦种子用于生长测定。
取制备好的不同质量浓度稀释液(10.000,5.000,2.500,1.250,0.625,0.313mg/mL)5.00mL,加入经高压蒸汽灭菌后铺双层滤纸的培养皿(d=9cm)中,另取3个培养皿加5mL无菌水,作为对照组。选取12粒催芽露白一致的野燕麦种子,均匀摆放于培养皿中,重复3次。将培养皿置于25℃恒温培养箱中,无光照培养3d,第4天开始光照培养,每天保持种子光照时间1h。培养期间为保持种子及幼苗生长所需的水分可加适量无菌水[22]。第3天开始测定种子发芽率,种子发芽的标准为胚根突破种皮2mm[22,23]。第7天开始测定芽长、根长、鲜质量、干质量及计算发芽率(%)。公式如下:
发芽率=种子发芽数/供试种子数×100%(1)
抑制率=(空白对照处理-大麻植株粗提物水溶液处理)/空白对照处理×100%(2)
1.2.3大麻植株不同部位粗提物对小麦种子的安全性分析
考虑大麻植株不同部位甲醇粗提物的不同浓度(10.000,5.000,2.500,1.250,0.625,0.313mg/mL)对田间禾本科农作物有抑制作用,故以小麦为例,做农作物安全性分析试验,在不影响农作物正常生长的前提下,确定抑制杂草生长的粗提物浓度范围。安全性分析试验设计与野燕麦种子萌发及生长测定试验所用药液相同,设6个质量浓度梯度,3个重复,以无菌水CK作对照。测定小麦种子芽长、根长、鲜质量、干质量及计算发芽率(%)。
1.3数据处理
用Excel2010做数据处理;用SPSS20.0做方差显著性分析。
2结果与分析
2.1大麻植株各部位粗提物对野燕麦种子萌发的影响
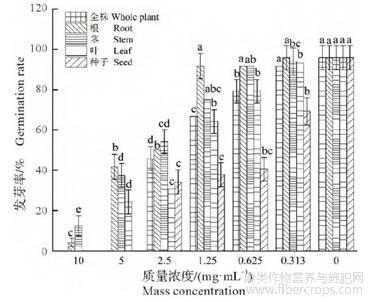
为验证大麻植株不同部位甲醇提取物的抑草活性,选取野燕麦为供试杂草进行除草活性测试。由图1可知,大麻植株不同部位提取物质量浓度与野燕麦种子的发芽率呈负相关。与对照相比,质量浓度为1.250,0.625,0.313mg/mL的大麻根的提取物对野燕麦种子的发芽率未出现显著抑制作用,种子提取物对野燕麦种子的发芽率出现显著抑制作用(P<0.05);质量浓度为10.000,5.000,2.500mg/mL的大麻植株不同部位提取物对野燕麦种子的发芽率出现显著抑制作用(P<0.05),且随着提取物质量浓度的增加,其抑制作用显著增强。质量浓度为10.000mg/mL、5.000mg/mL的大麻全株、种子提取物对野燕麦种子没有萌发的迹象。
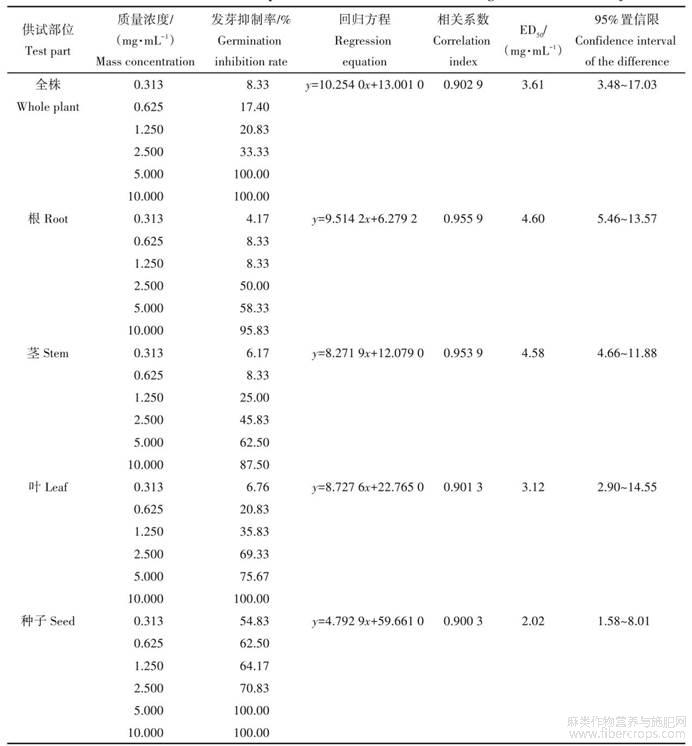
从表1可知,大麻全株、根、茎、叶、种子提取物对杂草野燕麦的50%杂草种子萌发受到抑制的浓度(ED50)分别为3.61,4.60,4.58,3.12,2.02mg/mL。由表1和图1结果可知:不同质量浓度间分析表明,大麻根、茎提取物对野燕麦种子萌发抑制效果最差,而大麻种子提取物对种子萌发抑制效果最好。
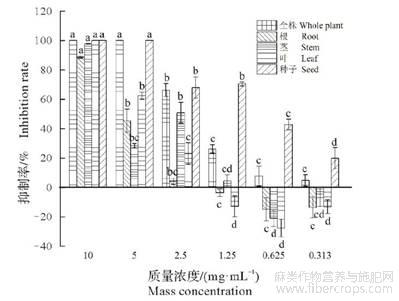
由图2可知,大麻5个部位的粗提物在不同浓度下对野燕麦种子芽长均有影响,其中大麻全株和种子粗提物对野燕麦种子芽长抑制效果最好,根、茎、叶的粗提物在一定浓度范围内对种子芽的生长起到促进作用。质量浓度在0.313~10.000mg/mL时,大麻全株和种子粗提物对野燕麦种子芽长抑制作用随着粗提物浓度的升高而加强,大麻全株粗提物的抑制率最高为100%,最低为4.67%,种子粗提物的抑制率最高为100%,最低为19.82%,而大麻根、茎、叶粗提物质量浓度在1.250,0.625,0.313mg/mL时,野燕麦种子芽长表现出一定的促进作用。在使用相同质量浓度不同部位的粗提物处理时,大麻种子粗提物对野燕麦表现出更强的抑制效果。
表1 大麻不同部位提取物对野燕麦种子萌发的影响
y代表粗提物对种子萌发的抑制率,x代表粗提物的质量浓度。
图1 大麻不同部位粗提物在不同浓度下对野燕麦种子发芽率的影响
不同小写字母表示差异显著(P<0.05)。
图2 大麻不同部位粗提物在不同浓度下对野燕麦种子芽长的影响
不同小写字母表示差异显著(P<0.05)。
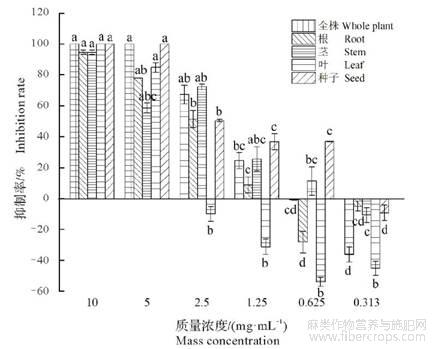
由图3可知,大麻5个部位粗提物在高浓度下对野燕麦种子根长抑制效果显著,低浓度时,不同部位粗提物对野燕麦的根生长均表现出促进作用。质量浓度在0.625~10.000mg/mL时,种子粗提物对野燕麦根长的抑制具有显著性的差异(P<0.05),在0.313mg/mL浓度时,表现为促进作用;质量浓度为0.313mg/mL时,各部位粗提物与高浓度相比,对根生长有显著促进作用;与高质量浓度相比,大麻叶的粗提物在0.313~2.500mg/mL时对野燕麦根的促进生长效果显著(P<0.05)。各部位粗提物在不同浓度下对野燕麦种子根长抑制作用由强到弱依次为:种子浸提液、全株浸提液、茎浸提液、根浸提液和叶浸提液。
图3 大麻不同部位粗提物在不同浓度下对野燕麦种子根长的影响
不同小写字母表示差异显著(P<0.05)
2.2大麻植株各部位粗提物对野燕麦幼苗生长的影响
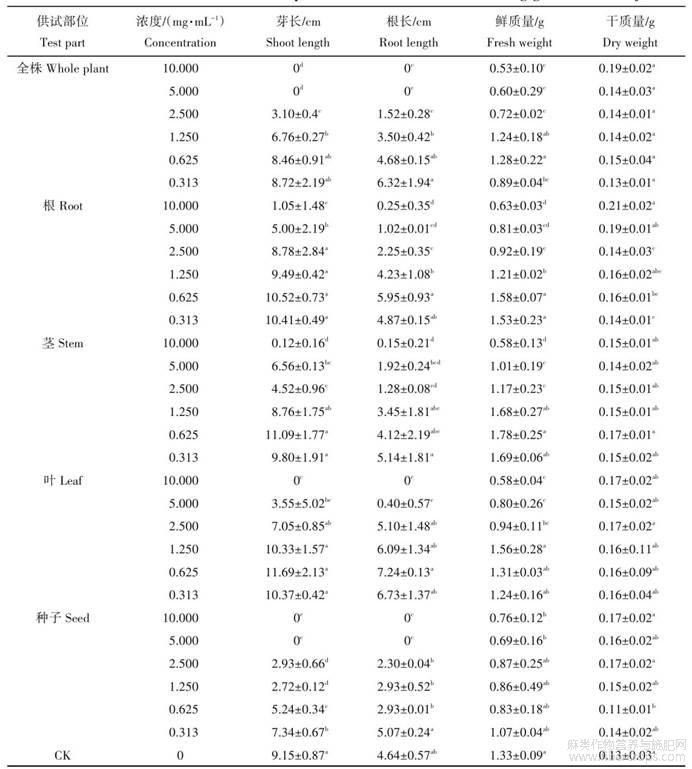
由表2可知,处理后7d,野燕麦幼苗生长与大麻植株各部位粗提物表现出一定的质量浓度效应,粗提物质量浓度低时,促进幼苗的生长,随着粗提物质量浓度的升高而抑制幼苗的生长。在质量浓度为10.000mg/mL时,野燕麦幼苗芽长、根长与对照组之间存在显著性差异(P<0.05),且大麻全株、叶、种子的粗提物对野燕麦幼苗芽长和根长生长抑制率为100%。与对照相比,各部位粗提物在5.000,2.500,1.250mg/mL质量浓度下,对幼苗根长、芽长均差异显著(P<0.05),抑制作用随质量浓度的升高而加强;质量浓度为0.625mg/mL、0.313mg/mL时,大麻种子粗提物对幼苗芽长、根长有显著抑制作用(P<0.05),全株粗提物对幼苗芽长、根长分别呈抑制、促进作用且不显著,大麻根、茎、叶粗提物对幼苗根长、芽长的抑制性明显下降(P<0.05),反而起到促进根、芽生长的作用。表明低浓度对野燕麦种子生长抑制作用不明显,存在对种子生长有促进作用的可能性。在大麻植株各部位不同质量浓度粗提物的处理下,其对野燕麦幼苗干质量与对照组相比无显著性差异(P<0.05)。结果表明:高质量浓度提取物对野燕麦有较好的防除效果,其中,大麻全株、种子粗提物在低质量浓度0.313~1.250mg/mL时对野燕麦仍然有抑制作用(P<0.05),是否对农作物有抑制作用需要进行下一步试验。
表2 大麻不同部位粗提取物对野燕麦幼苗生长的影响
同列数据后不同小写字母表示差异显著(P<0.05)。
2.3大麻植株不同部位甲醇粗提物对小麦种子的安全性分析
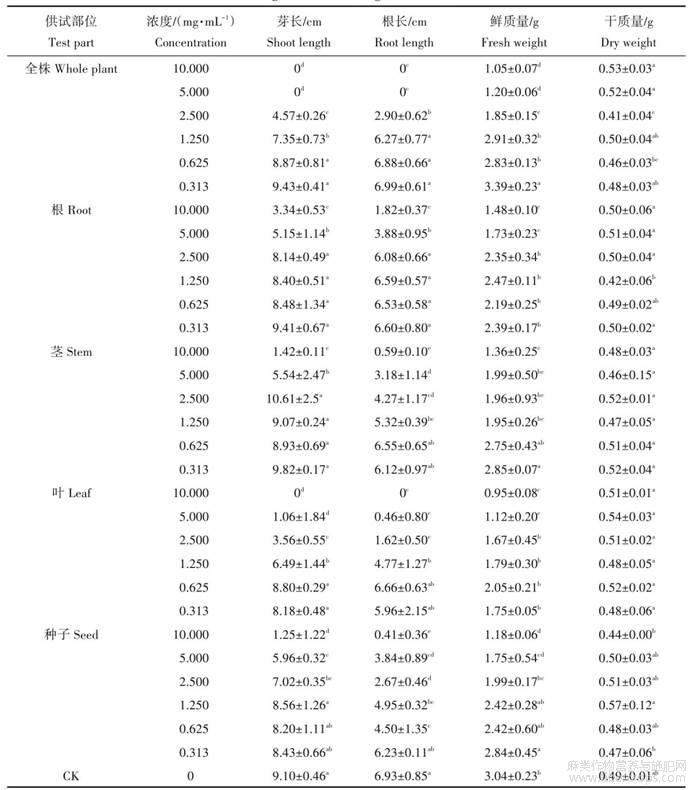
由表3可知,各粗提物在不同质量浓度下对小麦种子根长、芽长、鲜质量、干质量均有影响。大麻不同部位粗提物浓度与小麦安全性呈负相关,其在高浓度时对小麦根长、芽长抑制作用差异性显著(P<0.05)。与对照组相比,大麻全株、叶粗提物在0.625mg/mL、0.313mg/mL时,小麦根长、芽长均无显著性差异(P>0.05);根、茎粗提物在0.313~2.500mg/mL时,小麦根长、芽长均无显著性差异(P>0.05);种子粗提物在0.313mg/mL时,小麦根长、芽长均无显著性差异(P>0.05)。
表3大麻不同部位粗取物对小麦种子萌发及生长的影响
同列数据后不同小写字母表示差异显著(P<0.05)
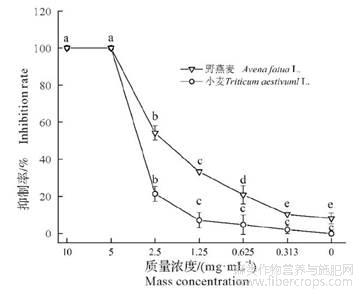
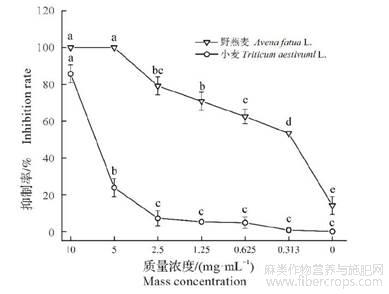
大麻植株各部位粗提物对野燕麦种子萌发及幼苗生长的影响比较分析,大麻全株及种子的粗提物对野燕麦的抑制效果较好,进而分别进行了大麻全株、种子粗提物在不同质量浓度时对野燕麦和小麦种子萌发抑制率的分析。由图4可知,大麻全株粗提物在10.000mg/mL、5.000mg/mL时,野燕麦、小麦种子均未萌发,而在2.500,1.250,0.625,0.313mg/mL时,对野燕麦种子萌发的抑制率均高于小麦种子萌发抑制率,说明大麻全株提取物中存在能够抑制野燕麦种子萌发及幼苗生长的活性物质;与对照相比,野燕麦种子在范围内有显著性差异(P<0.05),而小麦种子在其浓度范围内无显著性差异(P>0.05),说明大麻全株粗提物在1.250~0.313mg/mL时,既能抑制野燕麦种子萌发,又不限制小麦作物的生长。由图5可知,大麻种子提取物在6个浓度下对野燕麦种子萌发的抑制率均高于小麦种子萌发抑制率;与对照相比,野燕麦种子在各浓度下与其均有显著性差异(P<0.05),而小麦种子在2.500,1.250,0.625,0.313mg/mL质量浓度下无显著性差异(P>0.05),说明大麻种子粗提物在0.313~2.500mg/mL时对野燕麦杂草防治效果好,且对小麦种子萌发安全。
3结论与讨论
实验结果表明:大麻不同部位粗提物对野燕麦种子和幼苗的影响表现在抑制种子萌发和延缓幼苗生长,大麻种子提取物对野燕麦种子萌发抑制率在10.000mg/mL时最高为100%,0.313mg/mL时最低为33.33%,对小麦种子的抑制率在10.000mg/mL时最高为85.72%,0.313mg/mL时最低为0.71%;大麻种子粗提物在0.313~2.500mg/mL时能很好的抑制野燕麦的生长发育,并且对小麦生长无影响,为大麻在植物源除草剂中的开发利用提供科学依据,其除草活性成分值得进一步研究。
大量的实验结果[24,25,26,27]表明:同一供体植物不同部位的粗提物对同一受体的作用方向(促进或抑制)及作用强度可能存在差异。大麻不同部位提取物对野燕麦种子的萌发呈“低促高抑”趋势,这与假苍耳水浸提液、加拿大一枝黄花、蚕豆和胡麻秸秆浸提液等的研究结果一致[28,29]。大麻根、茎、叶的粗提物在0.313~1.250mg/mL时,对野燕麦种子芽长生长表现出促进作用,在高质量浓度2.500~10.000mg/mL时,呈抑制作用;大麻全株、根、茎、叶、种子的粗提物在0.313mg/mL时,对野燕麦种子根长生长呈促进作用,在10.000mg/mL时均表现为显著抑制作用。在研究中还发现,不同部位粗提物的抑草由强到弱依次为种子浸提液、全株浸提液、茎浸提液、根浸提液、叶浸提液,表明大麻种子可能是抑草活性物质产生的主要场所。
图4大麻全株粗提物在不同浓度下对野燕麦和小麦种子萌发率的影响
不同小写字母表示差异显著(P<0.05)。
图5大麻种子粗提物在不同浓度下对野燕麦和小麦种子萌发率的影响
不同小写字母表示差异显著(P<0.05)
目前,已经在30多个科的植物中发现近百种具有除草作用的天然化合物,其中一些已被开发成天然除草剂[30]。实验探究了高原特色植物大麻不同部位粗提物的抑草活性,以杂草野燕麦种子发芽率及幼苗的根长、芽长、鲜质量和干质量等为指标,比较青海省大麻植株不同供试部位提取物在不同浓度下各指标的差异。研究结果表明:从大麻不同部位中萃取到的活性物质对野燕麦种子萌发及幼苗生长都产生了一定的抑制作用,采用鲜质量和干质量较难全面地判断提取物中化合物的活性,比较繁琐,这与周丽娟等[31]报道的虎刺木、阔叶十大功劳、木槿等29种植物甲醇提取物除草活性的测定相一致。
弓佩含等[32]报道大麻中有黄酮及其苷类化合物、生物碱类化合物、香豆素类化合物、萜类及甾醇类化合物、脂肪酸类化合物、菲类化合物及其他化合物。杨柳秀等[6]报道大麻植株中除分离出植物大麻素外,已从大麻的根、叶、花及腺毛中检测到不同的萜类化合物;从大麻叶、花及花粉中分离得到多种黄酮类化合物;目前从大麻中发现生物碱类成分10种[33,34]。经边境等[35]报道大麻会产生多种无毒的植物大麻素,萜烯和酚类化合物,其中萜烯类化合物具有除草活性。也有研究[36]报道,应用加压热萃取(PHWE)技术从大麻种子中提取到大麻素化合物,大麻酚、大麻二酚、大麻环萜酚和大麻萜酚。大麻品种多样,高原大麻植株中是否有相关化合物及有关大麻中的提取物在植物源农药的应用上报道鲜少,尤其在植物源除草剂方面,都有待进一步研究。
大麻为桑科大麻属植物,葎草是桑科葎草属草本植物,两者为同科植物。高兴祥等[37]采用顺序提取法制备了泥胡菜等8种草本植物全草的石油醚、乙酸乙酯和乙醇提取物,并以高粱、黄瓜、小麦和油菜为供试对象,用种子萌发法对提取物的除草活性进行了生物测定。结果表明,葎草的乙酸乙酯提取物在低质量浓度(12.500g/L)条件下,葎草乙酸乙酯提取物对高粱幼苗根的生长及油菜幼苗根和茎的生长抑制作用最强[38]。实验研究对象大麻与高粱同为禾本科植物,大麻种子粗提物在0.313~2.500mg/mL浓度范围内能很好的抑制野燕麦的生长发育,并且对小麦生长无影响,与高兴祥葎草提取物的质量浓度(12.500g/L)相比,质量浓度过高时,对杂草及作物生长都会产生抑制作用。
植物源农药是具有特定生物活性功能的化学物质,兼有化学和生物学的两重性,既保留了先导化合物低毒、在环境中自然降解的特点,又大幅度地提高了生物活性、降低了成本、缩短了研究周期,适合绿色食品的生产与开发[9,39]。从植物中探求新的活性先导化合物或新的作用靶标,通过类推合成或生物合理设计新农药的开发已成为当前农药化学和农药毒理学研究的热点[9]。迄今为止,有关大麻的研究多集中在工业及药用领域,关于除草活性方面的尚未见报道,其植物提取物的除草作用还有待深入研究,以便从中发现有除草活性的先导化合物,进而开发出高效、安全与环境友好的新型除草剂。
参考文献
[1]翁华,魏有海,郭青云.不同除草剂对野燕麦和旱雀麦的防除效果[J].农药,2017,56(3):225-227.
[3]张奇,梁友谊,胡文文,等.从化感水稻根际土壤中筛选抑草细菌的研究[J].中国农学通报,2015,31(15):170-174.
[4]李俊,朱雪雯,万会花,等.大麻中大麻素类化学成分及其分析方法研究进展[J].中草药,2020,51(24):6414-6425.
[5]王秋月,卢芳,刘树民.大麻及大麻素药用价值的现代研究进展[J].中药药理与临床,2020,36(4):222-227.
[6]杨柳秀,李超然,高雯.大麻化学成分及其种属差异研究进展[J].中国中药杂志,2020,45(15):3556-3564.
[8]滕春红,陶波,吕志超,等.植物源除草剂研究进展[J].农药,2013,52(9):632-634.
[9]赵志英,雷彩霞,臧爱梅.植物源除草剂研究进展[J].山东农业科学,2010(6):91-93.
[10]AHMED M,QIN P W,GU Z M,et al.Insecticidal activity and biochemical composition of Citrullus colocynthis,Cannabis indica and Artemisia argyi extracts against cabbage aphid(Brevicoryne brassicae L.)[J].Scientific Reports,2020,10(1):522.
[11]MCPARTLAND J M.Cannabis as repellent and pesticide[J].Journal of the international hemp association,1997(4):89-94.
[12]陈世国,强胜.生物除草剂研究与开发的现状及未来的发展趋势[J].中国生物防治学报,2015,31(5):770-779.
[13]SWAIN T.Secondary compounds as protective agents[J].Annual review of plant physiology,1977,28:479-501.
[14]吴娇,刘博,邝芷琪,等.38种植物甲醇提取物除草活性的测定[J].江西农业大学学报,2016,38(3):492-498.]
[15]徐士超,曾小静,董欢欢,等.萜类植物源除草活性物开发及应用研究进展[J].林产化学与工业,2019,39(2):1-8.
[16]HAZRATI H,SAHARKHIZA M J,MOEIN M,et al.Phytotoxic effects of several essential oils on two weed species and tomato[J].Biocatalysis and agricultural biotechnology,2018,13:204-212.
[17]XU S C,ZHU S J,WANG J,et al.Design,synthesis and evauation of novel cis-p-menthane type Schiff base compounds as effective herbicides[J].Chinese chemical letters,2017,28(7):1509-1513.
[18]ZHU S J,XU S C,ZHAO Z D.An efficient synthesis method targeted to a novel aziridine derivative of p-menthane from turpentine and its herbicidal activity[J].Natural product research,2017,31(13):1536-1543.
[19]王宏生.利用化感物质防除杂草研究现状及应用前景[J].杂草科学,2007(4):3-5.
[20]冯彬,何云核,赵爽,等.香蒲不同部位水浸提液对4种水生植物种子的化感作用[J].浙江农林大学学报,2017,34(3):427-436.
[21]陈林,杨新国,李学斌,等.中间锦鸡儿茎叶水浸提液对4种农作物种子萌发和幼苗生长的化感作用[J].浙江大学学报(农业与生命科学版),2014,40(1):41-48.
[22]李玮,沈硕,郭青云.青稞白酒糟醅粗提物抑草活性研究[J].西北农业学报,2017,26(6):916-925.
[23]曾任森.化感作用研究中的生物测定方法综述[J].应用生态学报,1999(1):125-128.
[24]李春英,关佳晶,李玉正,等.南方红豆杉水浸提液对喜树种子发芽和幼苗生长的化感作用[J].生态学报,2021,41(4):1564-1570.
[25]李欣欣,赖金莉,岳建华,等.毛竹各器官和根际土浸提液对杉木种子萌发的化感作用[J].生态学报,2018,38(22):8149-8157.
[26]沈硕.青藏高原地区马铃薯主栽品种水浸提液的化感抑草作用[J].江西农业大学学报,2021,43(3):511-521.
[27]MERTOGLU K , ILERI O , ALTAY Y.Aqueous leaf extracts effect of some apple cultivars on growth characteristics of the green manure legumes via allelopathy[J].Fresenius environmental bulletin,2018,27(6):4052-4060.
[28]李凤兰,武佳文,姚树宽,等.假苍耳不同部位水浸提液对5种土著植物化感作用的研究[J].草业学报,2020,29(9):169-178.
[29]叶小齐,吴明,邵学新,等.加拿大一枝黄花水提液对玉米幼苗生长的化感作用及其机理[J].草业学报,2014,23(6):217-224.
[30]李效飞.治理杂草的天然化合物[J].世界农药,2000(3):20-24.
[31]周利娟,黄继光,孙永艳,等.29种植物甲醇提取物除草活性的测定[J].华中农业大学学报,2011,30(2):200-205.
[32]弓佩含,杨洋,刘玉婷,等.大麻化学成分及药理作用的研究进展[J].中国实验方剂学杂志,2017,23(13):212-219.
[33]常丽,李建军,黄思齐,等.植物大麻活性成分及其药用研究概况[J].生命的化学,2018,38(2):273-280.
[34]ELSOHLY M A,RADWAN M M,GUL W,et al.Phytochemistry of Cannabis sativa L.[J].Progress in the Chemistry of Organic Natural Products,2017,103:1-36.
[35]边境,田玉杰,高宇,等.大麻扦插生根影响因素研究[J].特种经济动植物,2020,23(10):27-30.
[36]NUAPIA Y,TUTU H,CHIMUKA L,et al.Selective extraction of cannabinoid compounds from Cannabis seed using pressurized hot water extraction[J].Molecules,2020,25(6):1335.
[37]高兴祥,李美,高宗军,等.泥胡菜等8种草本植物提取物除草活性的生物测定[J].植物资源与环境学报,2008,17(4):31-36.
[38]李南南,谭洪鹤,滕春红.植物源除草活性物质研究进展[J].现代农业研究,2016(3):63-64.
[39]林永熙,罗雅利,胡利锋.14种植物的除草活性初步研究[J].湖南农业科学,2019(11):72-74.
文章摘自:惠向娟,高慧,李玮.高原特色植物大麻提取物抑草活性初探[J].江西农业大学学报,2021,43(06):1305-1315.DOI:10.13836/j.jjau.2021140.