摘 要:目的:基于叶绿体psbA-trnH基因间隔区序列,建立一种PCR-RFLP(聚合酶链式反应-限制性片段长度多态性)方法鉴别罗布麻(Apocynum venetum L.)及其混淆品白麻(Apocynum pictum),并验证psbA-trnH序列酶切位点种间特异性和种内保守性。方法:将罗布麻和白麻提取总DNA,扩增psbA-trnH序列,扩增产物双向测序。序列分析发现,罗布麻含有特异性酶切位点SspⅠ。结果:扩增产物psbA-trnH为300~400bp。罗布麻psbA-trnH产物均可以被SspⅠ酶切成两条条带,白麻却不能被SspⅠ酶切。生物信息分析结果表明,在罗布麻属中,罗布麻psbA-trnH序列的SspⅠ酶切位点具有种间特异性和种内保守性,在夹竹桃族进化树中,罗布麻与白麻距离最近。结论:本实验建立的PCR-RFLP方法可以有效鉴别罗布麻和白麻。
关键词:罗布麻;白麻;聚合酶链式反应-限制性片段长度多态性;psbA-trnH;分子鉴定;酶切位点特异性
中药罗布麻叶为《中国药典》[1]一部收录,为夹竹桃科植物罗布麻Apocynum venetum L.的干燥叶,具有平肝安神、清热利水的功效,用于肝阳眩晕、心悸失眠、浮肿尿少等症。近年来,发现市售样品由白麻(A.pictum)叶混充罗布麻叶的情况较为普遍,两者成分和功效均有差异[2,3]。《新疆维吾尔自治区维吾尔药材标准》[4]中收录的大花罗布麻Poacynum hendersonii(Hook.f.)Woodson.的干燥叶即白麻(A.pictum);但是原则上地方药材不适用于无此标准的其他省区。因此罗布麻叶和白麻叶应严格区分。
在《中国药典》[1]中,对罗布麻叶的性状鉴别描述与《新疆维吾尔自治区维吾尔药材标准》[4]对白麻叶的性状鉴别描述基本一致,且罗布麻叶多皱缩卷曲、有的破碎,给外观鉴别带来困难[5];同时,两文献的显微鉴别描述也缺少显著特征差异;两种药材主要成分的种类是类似的,仅含量差异,且因为生长环境与采收季节的关系,含量会发生变化,采用薄层色谱和高效液相色谱检测主要化学成分的含量不能有效区分罗布麻与白麻[2,6]。故按现行质量标准用性状、显微、理化鉴定等传统方法难以区分罗布麻和白麻,因此有必要开发新的方法用于区分两种药材。
《中国药典》一部应用分子生物学方法鉴定川贝母、霍山石斛、蕲蛇、乌梢蛇、金钱白花蛇,其中川贝母和霍山石斛鉴定方法为PCR-RFLP,即聚合酶链式反应-限制性内切酶长度多态性方法。
多个研究表明,ITS2和psb A-trn H序列可以作为植物通用DNA条形码,可有效鉴别植物中药材[7]。本实验扩增并测序了罗布麻和白麻的ITS2和psb A-trn H序列,去除测序引物端不可靠序列,序列分析结果显示,两者ITS2序列仅2bp碱基差异,而psb A-trn H序列有一段22bp的差异。psb A-trn H位于植物叶绿体基因组的psb A基因和trn H基因的间隔区,起着重要的调控作用,有一定的变异率和相对的保守性,在多个物种的进化研究中扮演重要角色。
本实验选择在psb A-trn H序列的基础上,利用22bp的差异序列,建立一个可行的分子生物学方法,鉴别罗布麻和白麻;并对亲缘关系相近物种的psb A-trn H序列进行分析,确认此方法具有特异性。
1材料
1.1仪器
Simpli Amp PCR测序仪(Thermo Scientific公司);超微量分光光度计One Drop OD1000+(南京五义科技有限公司);电泳仪Tanon EPS 300(上海天能科技有限公司)。
1.2药品与试剂
植物基因组DNA小量纯化试剂盒(批号A-JG2100A)、SspⅠ(批号AK11181A)Ta Ka Ra公司;2XTaq PCR Master MixⅡ(批号S7812)、Gene Green核酸染料(批号S8121)、DNA MarkerⅠ(批号R7109)天根生化科技北京有限公司;TAE Buffer Premixed Powder(1X,批号F701KA2248)、琼脂糖B低电渗(批号F520BA0015)生工生物工程上海股份有限公司。
1.3药材
抽检标示罗布麻样品21批,经本文通讯作者鉴定,其中7批为罗布麻,14批为白麻。样本信息见表1。
表1罗布麻和白麻样本信息
2方法
2.1总DNA提取
取样品叶片约0.1g于陶瓷研钵(洗净经165℃,4h高温烘烤),加液氮快速研磨至极细粉末,取20~50mg粉末,按照Mini BEST Plant Genomic DNA Extraction Kit试剂盒说明(ProtocolⅡ)提取总DNA,其中56℃水浴时间延长至20min,提取产物用TE缓冲液溶解之前放置室温15min,使乙醇挥发完全,TE缓冲液加热至65℃以提高洗脱效率。以微量分光光度计检测浓度和纯度,21批样本的总DNA浓度为2~10 ng·μL-1,A260/A280为1.6~1.8。
2.2psb A-trn H扩增
引物序列来源于《中国药典》四部[8]。正向引物psb AF(5'-GTTATGCATGAACGTAATGCTC-3'),反向引物trn HR (5'-CGCGCATGGTGGATTCACAATCC-3')。引物短暂离心,按照管壁上的说明加适量TE缓冲液溶解成100μmol·L-1的贮备液,并取部分稀释成2.5μmol·L-1的工作溶液。
25μL扩增体系包含:2X Taq PCR Master MixⅡ12.5μL(说明:此Mix中的DNA聚合酶为高保真酶,以确保测序结果的准确性),上游引物psb AF(2.5μM)1μL,下游引物trn HR (2.5μM)1μL,灭菌dd H2O 8.5μL,DNA模板2μL。psb A-trn H扩增程序参考《岭南中草药DNA条形码序列》[9]并作适当调整:95℃预变性5min;95℃变性30s,56℃退火30 s,72℃延伸40s,35个循环;72℃充分延伸5min。PCR扩增产物于Gene Green染色的1.5%琼脂糖凝胶电泳、成像,观察条带是否明亮清晰、无杂带且空白对照无条带。一共21个样本的PCR产物电泳确认合格,送生工双向测序,测序引物为扩增引物psb AF和trn HR。
2.3酶切位点分析
测序结果用软件Chromas2.6.6 (Technelysium Pty Ltd)和软件Codon Code Aligner 9.0.1(CodonCode Corporation)得到可信序列,然后进行Nucleotide BLAST比对,确认测序结果可靠后进行酶切位点分析,查找特异性酶切位点。
2.psb A-trn H扩增并酶切
21批样本进行psb A-trn H扩增,扩增过程同“2.2”。扩增后电泳检测,确定条带明亮清晰无杂带,大小为300~400bp。PCR产物直接酶切,20μL酶切体系:SspⅠ内切酶1μL,10X buffer 2μL,dd H2O 12μL,PCR产物5μL。37℃水浴进行酶切反应,1.5h后每个体系加10X loading buffer 2μL终止酶切反应。电泳观察结果。
2.5psb A-trn H序列分析
2.5.1酶切位点种间特异性分析
获取NCBI核酸数据库中罗布麻近缘物种psb A-trn H序列,分析本方法采用的酶切位点是否具有特异性,即在其他物种中没有此酶切位点。如果在其他物种中有此酶切位点,观察酶切后的条带大小是否与罗布麻有区别。
2.5.2酶切位点种内保守性分析
考察本实验测序的7条罗布麻psb A-trn H序列以及NCBI中的所有罗布麻psb A-trn H序列,分析本方法采用的酶切位点是否保守,即是否都在相同位置有相同酶切位点。
2.5.3分子进化分析
基于NCBI核酸数据库psb A-trn H序列,构建夹竹桃族各种属的进化树,考察与罗布麻亲缘关系近的种属。
2.5.4其它实验条件考察
对DNA提取量、试剂盒、退火温度等实验条件进行考察。
3结果与分析
3.1酶切位点分析
用软件Chromas2.6.6(Technelysium Pty Ltd)查看测序得到的.ab1文件,确认峰形正常;对42条序列Trim Low Quality,显示除两端引物区外的其余部分结果可信。软件Codon Code Aligner9.0.1(CodonCode Corporation)将同一个样本的两条序列的峰图拼接起来,去除两端不可信区域,得到21条psb A-trn H序列。将这21条psb A-trn H序列在NCBI进行Nucleotide BLAST:AV1~AV7最高分结果为A.venetum chloroplast,complete genome (Gen Bank:MT313688.1),为罗布麻的序列;AP1~AP14最高分结果为A.pictum voucher 65230438 Psb A(psb A)gene,partial cds(Gen Bank:KP152531.1),为白麻的序列;psb A-trn H序列Nucleotide BLAST结果与表1鉴定的结果相符。
用软件MEGA X[10]进行多序列比对(MUSCL法),结果显示(表2,“.”表示碱基与首行一致,“-”表示碱基缺失),与罗布麻组相比,白麻组有一段22bp的序列缺失(gap),序列为5’-AGAATAG-TAAATATTCTAAATA-3’。
表2psbA-trnH序列比对结果
用软件DNAMAN进行酶切位点分析,此段gap序列包含一个特异性的SspⅠ酶切位点AAT/ATT,psb A-trn H其他部分不含此酶切位点。即罗布麻psb A-trn H含有特异性酶切位点SspⅠ,白麻psb A-trn H不含此酶切位点。
3.2PCR-RFLP结果
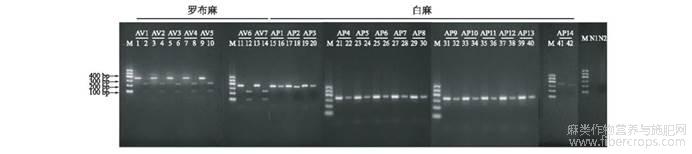
21个样本进行psb A-trn H扩增,SspⅠ酶切,以电泳观察结果。琼脂糖凝胶浓度为1.5%且用Gene Green染色,每个样本先点一个扩增产物,再点一个酶切产物,进行对比,如孔1为AV1扩增产物,孔2为AV1酶切产物。Marker上样量为3μL,扩增产物上样量为3μL,酶切产物上样量为8μL。电泳条件为105V,45min。结果显示,罗布麻均可以酶切为228bp和108bp两个片段,白麻均不能酶切,见图1。本实验建立的扩增psb A-trn H片段并用SspⅠ酶切的方法可以有效鉴别罗布麻和白麻。
图1罗布麻和白麻SspI酶切验证
4 psb A-trn H序列分析
4.1 酶切位点种间特异性分析
在NCBI分类学数据库Taxonomy中,夹竹桃族(Apocyneae)收录了7个亚族、35个属,其中12个属有psb A-trn H序列信息。罗布麻属有6个种,包括罗布麻和白麻,其中有5个种有psb A-trn H序列,金平藤缺少psb A-trn H序列信息。下载夹竹桃族的所有相关序列,有的为叶绿体基因组序列,有的为包含psb A-trn H的短序列,分别与引物psb AF/trn HR进行序列比对,得到各个物种的psb A-trn H序列,并进行SspⅠ酶切位点分析,包含SspⅠ酶切位点的序列一共5条。信息见表3。
表3夹竹桃族psb A-trn H序列SspⅠ酶切位点信息
由分析可见,有5个物种的psb A-trn H序列含有SspⅠ酶切位点。在罗布麻属中,罗布麻psb A-trn H序列含有SspⅠ位点,金平藤信息未知,包括白麻在内的其余5个种均不含SspⅠ位点,由此可见罗布麻psb A-trn H序列的SspⅠ酶切位点在罗布麻属中具有较高的种间特异性。
罗布麻属以外的其它属中,目前已知4个属的物种中含有SspⅠ位点,但PCR产物长度和酶切后片段长度均与罗布麻种差别较大,可以由电泳区分。但其它属种有很多种目前没有测序数据,因此在整个夹竹桃族中,罗布麻psb A-trn H的SspⅠ酶切位点的特异性暂时未知。
4.2酶切位点种内保守性分析
在NCBI核酸数据库中,获得4条罗布麻psb A-trn H序列,分别为KP152526.1、KP152527.1、KP152528.1、KT365818.1。本实验获得7条罗布麻psb A-trn H序列,一共有11条序列,多序列比对结果表明,序列相似度高,长度基本一致且均在约228bp位置有SspⅠ酶切位点,可见psb A-trn H序列的SspⅠ酶切位点在罗布麻种内具有较高的保守性。
4.3分子进化分析
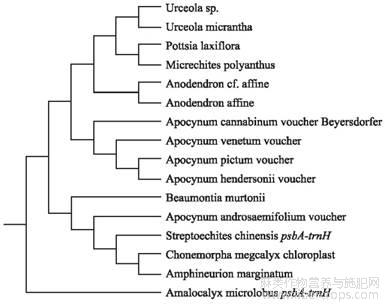
用软件MEGA X[10]将“4.1”获得的16条夹竹桃族不同种属psb A-trn H序列构建进化树(邻接法),见图2。从进化树看出,大花罗布麻A.hendersonii voucher和白麻A.pictum voucher在进化树上处于同一位置,与《中国植物志》中将大花罗布麻和白麻合并统一为白麻的情况相一致。另外进化树也表明,与罗布麻属最近缘,易于混淆的品种为白麻,与市场上的混淆情况也相一致。
图2夹竹桃族进化树
4.4其它实验条件考察
本实验尝试了用20mg或者50mg液氮研磨的粉末均可以提取出总DNA,作为扩增模板时都可以得到明亮的条带,后续实验时为了保证药材在液氮研磨后尽快加入Buffer HSⅡ,便不再称量,用小量勺估计20~50mg的粉末直接加入准备好Buffer HSⅡ的EP管中,均可以成功提取总DNA。PCR扩增程序的退火温度设置在56℃、57℃、58℃时均可以有效扩增。所有批次样本扩增做了3次重复,一次使用含普通Taq酶的Mix,两次使用含高保真Taq酶的Mix,一共扩增63批次,扩增成功率为100%。所有样本测序做了两次重复,一次为单向测序(测序引物为psb AF),一次为双向测序(测序引物为psb AF/trn HR),一共测序42批次,全部得到合格的测序结果,测序的成功率为100%。
5讨论
在干燥植物中,中药材DNA提取难度较大,有的研究采用改良CTAB法[11],先去除多糖类成分,得到质量较高的DNA。本实验采用的Ta Ka Ra植物基因组DNA小量纯化试剂盒,用ProtocolⅠ提取的DNA无法成功进行PCR扩增,用ProtocolⅡ提取的DNA均能成功扩增。液氮研磨需要尽量得到非常细致的粉末,56℃水浴时间可以稍延长,以提高DNA得率。本实验的难点在于DNA提取,高质量的DNA是后续实验成功的保障。
基于罗布麻和白麻psb A-trn H序列的22bp差异,曾尝试设计特异性引物,预期能扩增出罗布麻片段,不能扩增白麻片段;但试验了多对引物,均没有成功,于是改用PCR-RFLP方法。
对于PCR-RFLP法,由于其最终判定依据在于是否被酶切和酶切条带大小,因而考察的重点应该是酶切条件的种属特异性和种内保守性等。而对于扩增结果的影响因素如反应轮数、退火温度、酶、扩增仪器和试剂等的考察则不是那么重要[12]。本研究结合NCBI核酸数据库中的测序数据和对本实验数据进行分析,罗布麻psb A-trn H序列的种间特异性高,种内保守性高,理论上罗布麻与罗布麻属中的绝大部分物种都可以采用此法区分。在罗布麻属中,金平藤的序列信息未知,可以对金平藤的psb A-trn H区域进行测序分析,以进一步考察此方法的特异性。
目前,使用psb A-trn H序列作为中药材DNA条形码的研究越来越多,例如绵马贯众[13]、鼠曲草属植物[14]等,psb A-trn H是否能够作为罗布麻的DNA条形码仍有待研究。DNA条形码鉴定方法需要进行测序,而大多数药品检验机构还不具备测序条件;如果只需要区分罗布麻和白麻,本实验建立的PCR-RFLP法比较快捷。
分子生物学方法是传统鉴定方法的有效补充[15],除了DNA条形码、PCR-RFLP方法外,还有特异性荧光定量PCR,位点特异性PCR,snp分子标记,HRM技术[16,17,18]等。除了中药材,有研究表明很多的中药饮片也能够使用分子生物学方法进行有效鉴定[17],对于中药粉末和含原粉的中成药进行鉴定也是可行的[18],因为其检验的是物种的遗传物质,不会随药材的部位、状态的改变而改变;但要注意高温炮制等过程可能会破坏DNA。对于罗布麻叶片、复方罗布麻片等含有罗布麻叶原粉的中成药,可以进一步研究此PCR-RFLP鉴别方法是否适用。
参考文献
[1]国家药典委员会.中华人民共和国药典:一部[S].中国医药科技出版社,2020:220-1.
[2]李慕春,王苗苗,韩飞,等.罗布麻和白麻叶中主要化学成分的统计分析[J].中国实验方剂学杂志,2018,24(2):62-8.
[3]谢思敏,侯惠婵,顾利红,等.真伪罗布麻叶的薄层色谱鉴别研究[J].今日药学,2019,29(5):318-20+343.
[4]苏来曼·哈力克.新疆维吾尔自治区维吾尔药材标准[M].新疆人民卫生出版社,第一册,2010:8.
[5]魏锋,马双成.中药材饮片质量安全概况及监管思考[J].中国食品药品监管,2019(3):22-9.
[6]王立军,黎莎莎,孟庆艳,等.不同采收期大花罗布麻叶中黄酮类成分含量的测定[J].中国酿造,2016,35(6):179-81.
[7]陈士林.中国药典中药材DNA条形码标准序列[M].科学出版社,2015:14.
[8]国家药典委员会.中华人民共和国药典:四部[S].中国医药科技出版社,2020:491.
[9]黄志海.岭南中草药DNA条形码序列[M].中国医药科技出版社,2017:10.
[10]Kumar S,Stecher G,Li M,et al.MEGA X:molecular evolutionary genetics analysis across computing platforms[J].Mol Biol Evol, 2018,35(6):1547-9.
[11]胡冲,张亚中,袁媛,等.霍山石斛的PCR-RFLP鉴别研究[J].药物分析杂志,2020,40(12):2109-15.
[12]张文娟,魏锋,马双成.中药DNA分子鉴定法标准研究有关问题探讨及建议[J].药物分析杂志,2020,40(12):2250-5.
[13]蔡振娇,吴亚男,许亮,等.基于psbA-trnH序列DNA条形码技术的绵马贯众鉴定研究[J].中国中药杂志,2016,41(22):4183-7.
[14]郑梦迪,刘静,张寒,等.基于psbA-trnH分子标记的鼠曲草属植物鉴定[J].时珍国医国药,2020,31(6):1383-6.
[15]夏召弟,刘霞,冯玛莉,等.基于ITS2条形码鉴定藏柴胡及其易混品[J].中草药,2020,51(23):6062-9.
[16]刘杰,过立农,马双成,等.基于DNA条形码和HRM技术鉴别肉苁蓉疑似伪品[J].药物分析杂志,2020,40(6):1032-8.
[17]辛天怡,娄千,郝利军,等.市售中药饮片DNA条形码鉴定研究[J].药学学报,2021,56(3):879-89.
[18]王丽,金艳,蒋超,等.猪胆粉及其中成药的特异性PCR鉴别方法[J].中国实验方剂学杂志,2019,25(17):136-41.
文章摘自:刘流,邰顺章,支荣荣.PCR-RFLP法鉴别罗布麻与混淆品白麻及其psbA-trnH序列分析[J].药学与临床研究,2021,29(06):411-415.DOI:10.13664/j.cnki.pcr.2021.06.003.