作者:董斌等
来源:
发布时间:2021-11-03
Tag:
点击:
[麻进展]剑麻种质资源DNA条形码遗传多样性分析
摘 要:剑麻是重要的国防和工业战略物资,准确和快速鉴别剑麻种质对于剑麻品种选育具有重要意义。本研究对82份剑麻种质资源中的rbcL和matK的DNA条形码编码区进行测序,分析了rbcL和matK的NJ聚类图、条形码序列多样性以及碱基替换概率。结果显示,rbcL序列GC含量为42.97%,matK序列GC含量为30.55%;matKDNA条形码差异位点数和位点变异率明显高于rbcLDNA;NJ聚类图显示,rbcL序列可将82个剑麻种质分为6个亚群,而matK序列可将82个剑麻种质分为8个亚群,群内每种剑麻种质与其他种质之间均存在一定的遗传距离;差异位点数、位点变异率、核苷酸多样性、中性检验统计等序列多样性结果表明,matK序列的差异性明显高于rbcL序列;rbcL序列和matK序列的碱基发生了不同程度的转换和颠换,碱基转换主要发生在T与C之间,而C和G碱基之间比较保守,发生的颠换概率最低。综上所述,matK序列在剑麻种质中遗传多样性更高,更适用于剑麻种质鉴别。
关键词:剑麻;遗传多样性;DNA条形码;matK基因;rbcL基因
剑麻为龙舌兰科(Agavaceae)多年生热带优质纤维经济植物,农业种植面积大部分在广东、广西、海南三省,主要选用来自龙舌兰属、丝兰属和巨兰属的广义剑麻种质。剑麻具有较高的经济价值,是重要的战略性经济作物。剑麻纤维具有坚韧耐磨、质地刚柔、低温下不会硬化脆断、不霉变、耐腐蚀、防静电等特点,是制作电梯和航海专用缆绳的优质材料(Corbin et al.,2015;Hernández et al.,2016),另外,剑麻纤维与树脂、橡胶等物质混合能制造出新型纤维复合材料(Sahu and Gupta,2017;赵鑫和孙占英,2021)。剑麻的茎心含有大量的淀粉和糖分,是制作生物酒精和酿造龙舌兰酒的主要原料(Palomo et al.,2018)。剑麻叶片纤维提取后剩余的液汁和麻渣也具有开发价值,叶片液汁含有的剑麻皂苷元具有杀菌抗炎、解热镇痛、增强免疫、降脂降压、减低血糖、抗击肿瘤等作用,提取物常用于开发成药物(Sidana et al.,2016),而剑麻渣发酵后,可以作为湖羊或其他反刍动物的辅助粗饲料用于动物饲养(郑继昌等,2018)。由此可见,剑麻纤维制品在各行各业均有广泛运用,随着国内外对剑麻纤维的总需求量日益增加,剑麻呈现出供不应求的局面。
DNA条形码(DNA barcoding)技术是一种基于DNA基因序列进行物种区分的常用方法,通过对物种中具有高度保守和足够变异的DNA条形码鉴别不同的分类群。rbcL位于叶绿体基因组,属于核酮糖1,5-二磷酸羧化酶/加氧酶的大亚基基因,在进化上较为保守;matK基因是在叶绿体基因组中进化速率最快的基因,在植物科级、属级、种间和种内水平均有广泛的应用,常用于探讨类群的系统进化研究(毕毓芳等,2020。鉴于叶绿体基因组不同程度的保守性,rbcL和matK这两种叶绿体基因DNA核心条形码片段广泛用于研究高等级植物间的系统发育关系(Liu et al.,2019;熊瑶等,2020,rbcL位于叶绿体基因组较大的单拷贝区,具有通用性好、易扩增和易序列比对等优点(代培红等,2020,而matK基因位于叶绿体trnK基因的内含子中(熊哲铭等,2020,具有分子质量小,多拷贝和结构简单等特点(吴育鹏等,2016,在植物科级、属级水平,该序列为研究类群内部的系统重建提供了较多的信息和较高的支持率(马丽等,2020。))))))
为了有效地分析国家农业农村部剑麻种质资源圃内种质资源的系统发育、亲缘关系,本研究以不同国家来源的82份剑麻种质资源为研究对象,对叶绿体上的2个DNA条形码rbcL和matK进行测序,分析了rbcL和matK的NJ聚类图、条形码序列多样性以及碱基替换概率。以期为剑麻类种质资源的保存、评价、创新和利用提供重要的分子依据,并为剑麻产业的升级发展提供良好的种质资源基础。
1结果与分析
1.1DNA条形码扩增和测序
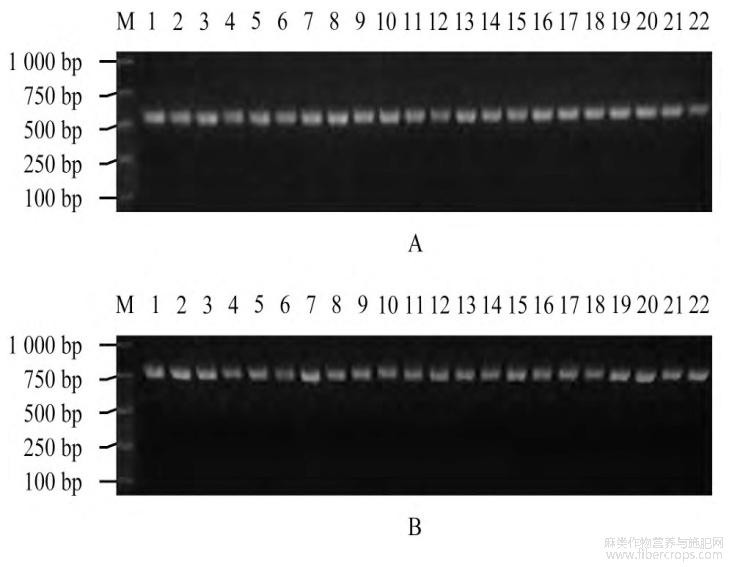
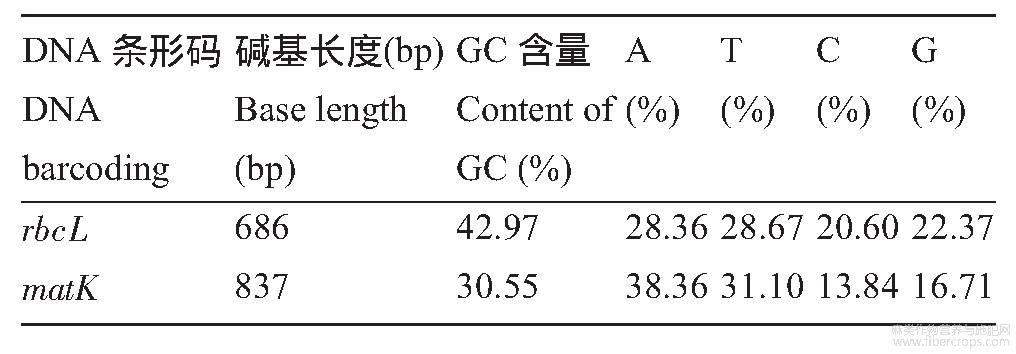
对82份剑麻的rbcL和matK片段PCR扩增后进行电泳检测,其中,rbcL条形码长度约为700bp,matK条形码长度约为800bp(图1),扩增片段长度准确,条带清晰明亮,能够用于测序分析。剑麻DNA条形码测序结果显示(表1),在叶绿体rbcL序列扩增长度为686bp,其GC含量为42.97%;matK序列长度为837bp,GC含量为30.55%。
图1部分剑麻种质的rbcL和matK琼脂糖电泳检测
表1剑麻DNA条形码测序产出数据
1.2DNA条形码序列多样性和碱基替换概率
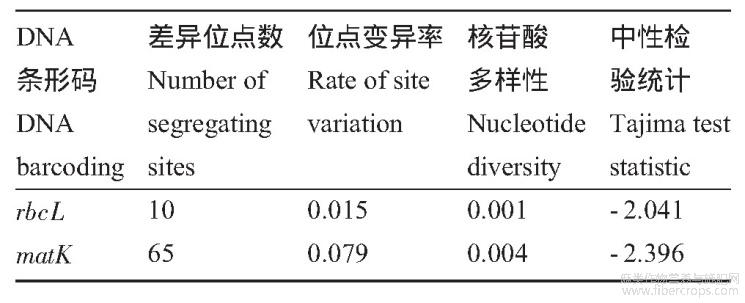
对剑麻DNA条形码序列多样性进行了分析(表2),结果显示rbcL和matK两个序列多样性有较大差别,mat KDNA条形码差异位点数65,位点变异率0.079,明显大于rbc LDNA条形码差异位点数和位点变异率。通过中性检验可以推断种群的历史动态,当Tajima's D值呈现较大负值时,可以认为其序列多样性更加显著。rbcL和mat KDNA条形码中性检验统计值分别为-2.041和-2.396,mat KDNA条形码D值高于rbc LDNA条形码。总的来看,matK序列的多样性明显高于rbcL序列。
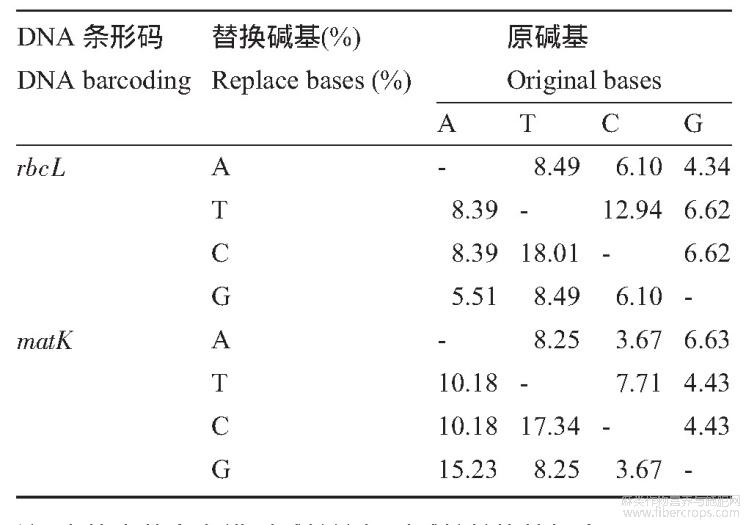
DNA条形码碱基替换概率可以看出(表3),rbcL序列和matK序列的碱基发生了不同程度的转换和颠换。转换主要发生在T与C之间,rbcL序列和matK序列的T和C碱基转换概率分别达到18.01%和17.34%;在rbcL序列和matK序列中,C和G碱基之间比较保守,在序列中发生的颠换概率最低,分别为6.10%和3.67%。DNA条形码碱基替换率的结果表明,不同的碱基类型的转换和颠换的发生概率不同。
表2剑麻DNA条形码序列多样性分析
表3剑麻DNA条形码碱基替换概率
1.3DNA条形码系统聚类分析
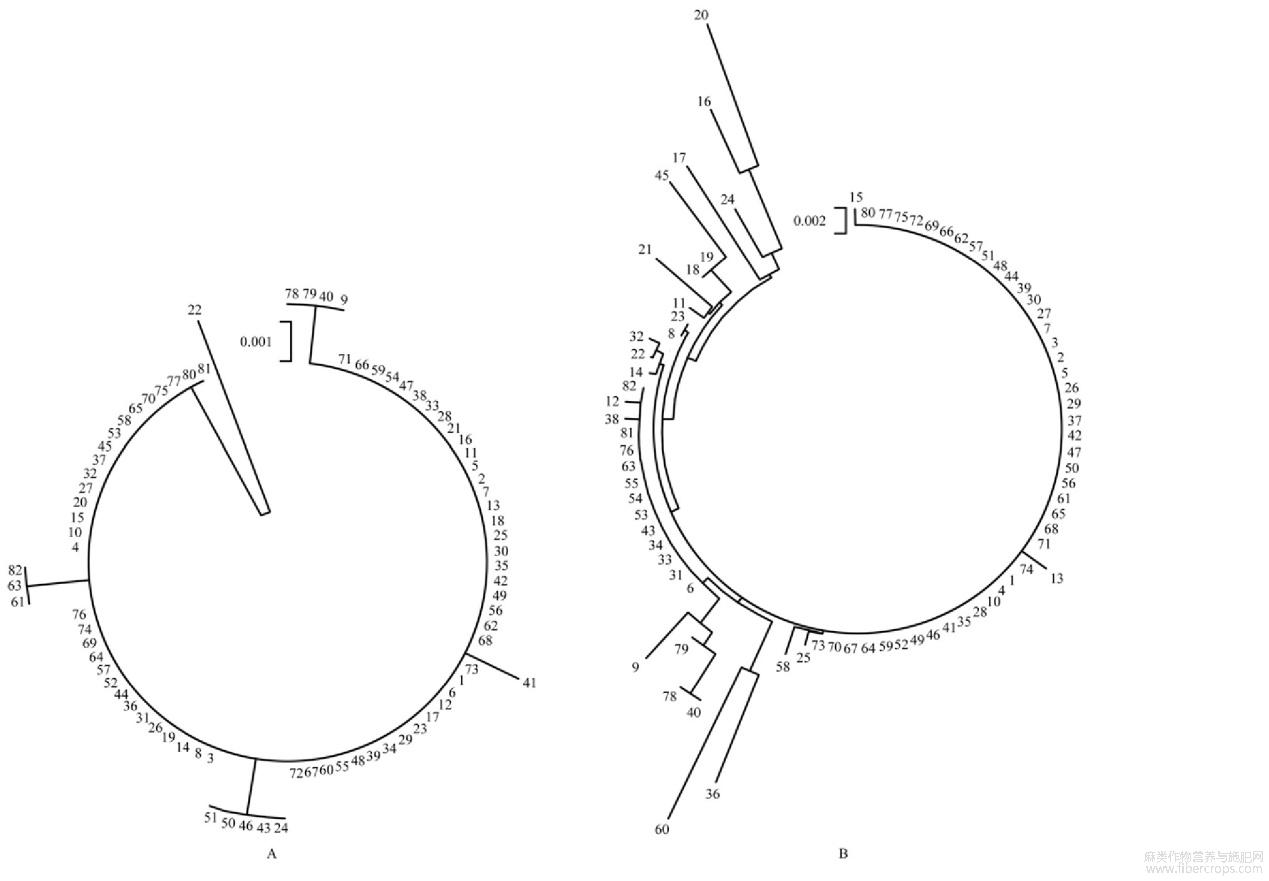
基于DNA条形码差异性构建剑麻NJ系统聚类图,rbcL序列的系统聚类图显示,82个剑麻种质可聚类为6类,其中78、79、40、9为同一个进化支,41为单独一个进化支,24、43、50、51为一个进化支,61、63、82是一个进化支,22为独立进化支且遗传距离较远,其余的为同一进化支聚为一类(图2A)。由于试材rbcL序列的变异位点较少,在多数剑麻种质中几乎不存在遗传距离或遗传差异极小,鉴别不同剑麻种质范围有限,因此不适用于鉴别不同的剑麻种质。根据matK的系统聚类图显示,82个剑麻种质可聚类为8个亚群,而且群内每种剑麻种质与其他种质之间均存在一定的遗传距离(图2B),以上结果表明,mat KDNA能够更好的区分剑麻种间相近的物种,具有较高的多样性,能清晰划分剑麻种质之间的亲缘关系,适合用于剑麻遗传多样性的分析和不同剑麻种质的鉴别。
2讨论
国家农业农村部剑麻种质资源圃是中国乃至全世界收集剑麻种质资源数量最大、类型最多的资源圃,主要开展了表型多样性的研究,在DNA条形码水平上的遗传多样性研究尚未开展(刘文等,2020;田夏红等,2020。目前,形态性状、分子标记、DNA条形码和基因组学等方法均可以进行植物遗传多样性分析(刘文等,2012。由于形态性状易受自然环境和人为因素影响(李冬波等,2020,而且剑麻开花通常需要10年以上,能用于形态性状调查的数量有限,从而在一定程度上限制了剑麻形态遗传多样性的研究。在剑麻分子标记分析遗传多样性方面,剑麻尚未开发出有效的SSR标记,一般采用ISSR和RAPD方法,虽然有研究利用ISSR方法构建剑麻种质资源的反应体系(陈河龙等,2015。但是,普遍认为ISSR和RAPD方法存在一定的稳定性问题。另外,基因组学分析物种遗传多样性是较为准确的方法,但该方法成本较大,周期长,且需要参考基因组,难以进行大规模地种质资源测序分析(Liuetal.,2015。因此,DNA条形码用于剑麻遗传多样性分析,是一种较为稳定和成本较低的方法。)))))
图2基于DNA条形码构建剑麻NJ系统聚类分析
叶绿体DNA条形码在高等植物上应用较广,叶绿体DNA条形码中含有rbcL和matK基因、psbA-trnH间隔区等,不同的DNA条形码保守性不同,序列差异较大(陈亚辉等,2013;马丽,2020。本研究成功扩增了82份剑麻种质资源的rbcL和matK序列,鉴定了82份剑麻种质资源的序列差异和构建了亲缘关系,并比较了rbcL和matK基因序列多样性差异,发现mat KDNA条形码差异位点数65,位点变异率0.079,明显大于rbcL的差异位点数和位点变异率。因此,本研究结果显示matK序列的变异位点较多,遗传差异较大,更适用于鉴别不同的剑麻种质。)
DNA条形码常应用于亲缘关系和遗传多样性研究(Leeetal.,2019。本研究比较rbcL和matK序列的NJ系统聚类图,发现rbcL和matK分别可将82个剑麻种质分为6个和8个亚群,中性检验统计值显示matK的D值高出rbcL,matK的序列多样性明显高于rbcL序列,matK具有较高的多样性,能够更好的区分剑麻种间形态相近的物种。)
3材料与方法
3.1材料
研究用的剑麻种质来源于国家农业农村部剑麻种质资源圃(广东省湛江市),该资源圃是目前全世界剑麻种质资源种类最丰富、数量最多的剑麻专类保存机构(田夏红等,2020图3)。研究选取了龙舌兰科中具有形态差异和潜在经济利用价值的龙舌兰属(AgaveL.)为主的高产高抗剑麻种质共82份材料,采集剑麻幼嫩叶片后标记序号和名称(表4),用冰袋运回实验室用于DNA提取。)(
图3剑麻种质资源圃部分材料
表4剑麻种质资源圃采样信息
3.2DNA提取及DNA条形码扩增
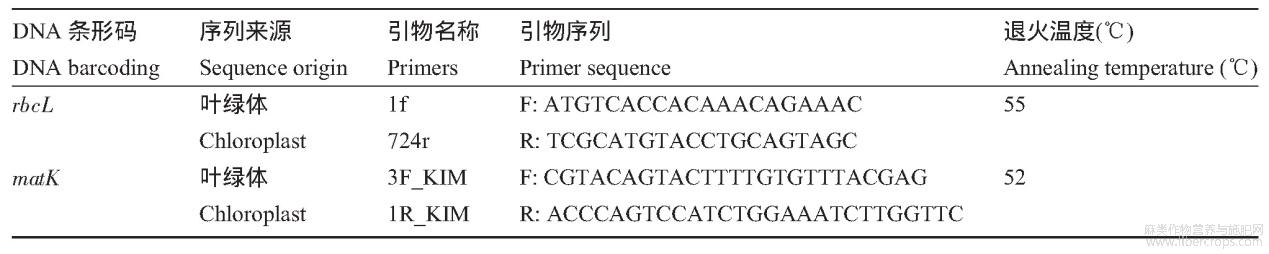
基因组DNA提取方法采用CTAB法(祁建民等,2013。DNA提取后,采用剑麻近缘物种百合科百合属(Lilium)的rbcL和matK条形码引物进行筛选和扩增(表5)(郑司浩等,2014。rbcL和matK条形码PCR反应使用的是上海生工生物工程有限公司的Taq DNA聚合酶试剂盒(5000UTaqDNAPolymerase,10×PCR Buffer,25mmol/LMgCl2),PCR反应体系:DNA模板1.0μL,上下游引物0.2μL,dNTPs0.5μL,PCRBu-ffer5.0μL,Taq酶0.5μL,用42.6μlddH2O补齐反应体系至50μL。PCR扩增程序:94℃预变性5min;后按94℃变性30s、52℃~55℃退火45s、72℃延伸50s;扩增循环35次;最后于72℃延伸5min。1.2%琼脂糖凝胶电泳检测扩增产物,检测后送上海生工生物工程有限公司测序。))
表5剑麻DNA条形码引物信息
3.3DNA条形码多样性分析
用MEGA6.0软件进行ClustalW序列匹配,去除序列两端不稳定信号的碱基和对齐序列,计算碱基百分比含量,以邻接算法(neighbor-joining,NJ)构建其系NJ统进化树,并分析序列多样性和碱基替换概率。
文章摘自董斌,田夏红,谢月亮,刘文,贺立红,张祥会,李荣喜,叶子龙.剑麻种质资源DNA条形码遗传多样性分析[J].分子植物育种,2021,19(16):5546-5554.
更多阅读
Copyright by Ramie Research Institute of Hunan Agricultural University
湖南农业大学农学院/苎麻研究所 版权所有 2009-2016 湘ICP备10006838号-1