作者:徐莉莉等
来源:
发布时间:2021-11-03
Tag:
点击:
[麻进展]基于网络药理学和分子对接研究罗布麻抗抑郁机制
摘 要:目的基于网络药理学和分子对接研究罗布麻抗抑郁机制。方法通过数据库检索文献获取罗布麻活性成分、作用靶点、抑郁相关靶点,采用STRING数据库构建蛋白互作用网络,Cytoscape3.8.1软件构建成分-靶点-疾病网络,Bioconductor生物信息软件包进行GO功能富集和KEGG通路分析,DockVina分子对接软件对活性成分与关键抗抑郁靶点进行结果验证。结果共得到8个主要活性成分和34个关键靶点,INS、VEGFA、AKT1、TP53、IL-6、CAT、JUN、TNF等可能是罗布麻抗抑郁的最重要的潜在靶点。GO功能富集分析得到70个分子功能条目,主要涉及细胞因子受体结合、受体配体活性、细胞因子活性、生长因子受体结合、血红素结合、四吡咯结合、氧化还原酶活性、磷酸酶结合;KEGG通路富集分析得到162条信号通路,与糖尿病并发症AGE-RAGE信号通路、C-型凝集素受体信号通路、IL-17信号通路、胰岛素抵抗、Toll样受体信号通路、T细胞受体信号通路等关系最密切;分子对接验证发现木犀草素,尤其是芸香苷与关键抗抑郁靶点能够形成最佳复合体。结论罗布麻抗抑郁作用与其对炎症因子活性及其功能调节有关。
关键词:罗布麻;抗抑郁;作用机制;网络药理学;分子对接
抑郁症是以心情低落为主要症状的疾病,影响人体的认知、行为和社会功能。据统计全球约有3.5亿抑郁症患者,造成严重的社会和经济负担[1]。抑郁症和患病率和复发率均高,有预测到2030年抑郁症可能成为我国负担排名首位的疾病[2]。目前治疗药物主要基于经典的单胺类递质学说,具有一定的局限性。因此,越来越多的研究者,将目光投向天然药物[3-4]。
罗布麻Apocynum venetum L.属夹竹桃科植物,以干燥叶入药,味甘、苦,性凉,归肝经,具有平抑肝阳、清热利水等功效[5]。近年来,国内外学者在动物模型中发现罗布麻具有较好的抗抑郁作用[6-7],但对其活性成分、作用靶点等尚不十分明确,因此本研究拟通过网络药理学方法分析罗布麻的抗抑郁的潜在机制,为进一步研究提供参考。
1方法
1.1罗布麻成分收集和筛选利用
利用在线数据库TCMSP(http://ibts.hkbu.edu.hk/LSP/tcmsp.php)、TCMID(http://www.megabionet.org/tcmid/)结合文献检索收集罗布麻主要活性成分,并根据毒药物动力学(ADME)参数对所得成分进行进一步筛选,包括药物口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18。
1.2罗布麻成分靶点预测
利用中药成分靶点数据库、靶点预测数据库TCMSP、TCMID、文献检索进行验证靶点和预测靶点的垂钓,进而获取活性成分的作用靶点。
1.3抑郁疾病靶点预测
采用疾病靶点数据库GeneCard(http//www.genecards.org/)、DisGeNET(https://www.disgenet.org/)、TTD(http://db.idrblab.net/ttd/)、OMIM(https://omim.org/),输入关键词“depression”,获得抑郁的相关基因。
1.4蛋白-蛋白相互作用网络
利用Venny2.1获得成分与疾病的靶点的交集,导入STRING(http://stringdb.org/)进行蛋白互作分析,结果保存为TSV格式文件,并将其导入Cytoscape3.8.1(http://www.cytoscape.org/)软件进行网络拓扑结构分析,构建蛋白-蛋白相互作用网络。
1.5成分-靶点-疾病网络构建
利用“1.1”“1.2”“1.3”项下所得结果构建成分-靶点关系,Cytoscape3.8.1(http://www.cytoscape.org/)软件进行网络拓扑结构分析,构建成分-靶点-疾病网络。
1.6靶点功能和通路富集分析
利用基因本体(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia ofgenes andgenomes,KEGG)数据库,以及R3.6.3软件运行的Bioconductor生物信息软件包(http://www.bioconductor.org/)对靶点功能和通路进行富集分析,P<0.05表示差异具有统计学意义。
1.7分子对接
Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载小分子数据,采用openbabel将其转化为mol2格式,并用autodocktools程序提供的脚本prepare_ligand4.py为小分子添加电荷,分配原子类型,所有可旋转键均设置为柔性,保存为pdbqt格式,用于分子对接。RCSB蛋白晶体数据库下载受体蛋白数据,在pymol1.7程序中删除受体蛋白结构中的结晶水和其他小分子,添加氢原子后保存。载入autodocktool1.5.6程序,添加电荷,分配原子类型,保存为pdbqt格式,作为分子对接受体,采用vina1.1.2软件进行分子对接。对接盒子大小设置为能够恰好包含蛋白的结合位点,选取对接最佳构象作为分子对接结果,提取结合能(affinity)评分并进行排序。结合力数值越低,表明结合越好。
2结果
2.1罗布麻活性成分及其靶点
数据库中获得56种罗布麻活性成分,经筛选后得到6种,包括山柰酚、右旋儿茶精、表儿茶素、花青素B1、木犀草素、谷甾醇,另外金丝桃苷、芸香苷OB值虽然较低,但大量文献报道两者抗抑郁作用[8-11],故也将其纳入,最终获得8种,表1。利用数据库查询上述活性成分的靶点信息,筛选去重后得到118个作用靶点。
2.2罗布麻抗抑郁潜在靶点
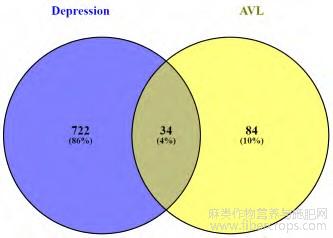
共筛选出756个与抑郁相关的靶点,采用Venny2.1软件取其与罗布麻活性成分靶点的交集,最终得到34个共同靶点,见图1。
图1 罗布麻活性成分靶点与抑郁靶点交集Venny图
2.3成分-靶点-疾病网络
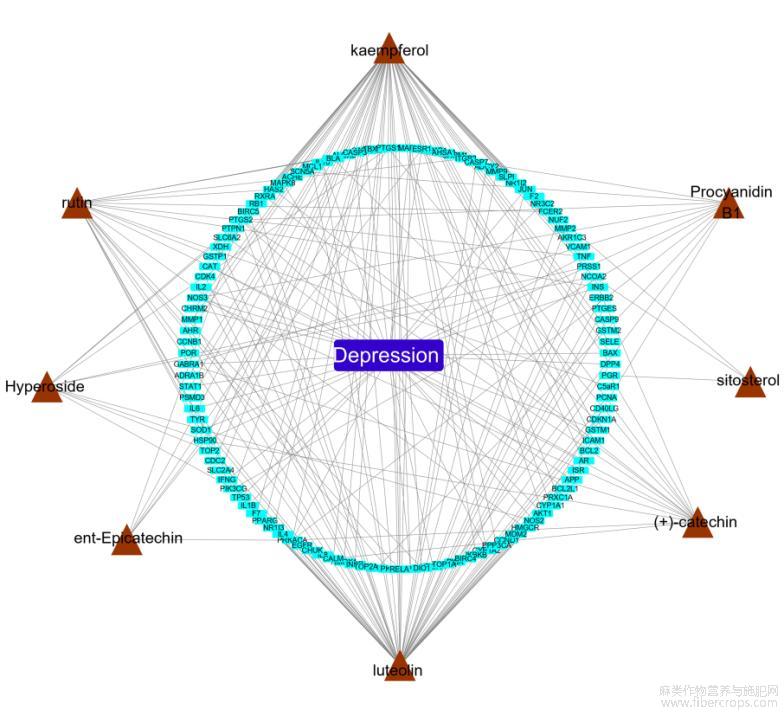
网络中共有113个节点及其相互联系的184条边,与疾病靶点作用最广泛的成分是山柰酚、木犀草素、右旋儿茶精、芸香苷,见图2。
图2 成分-靶点-疾病网络
注:棕色三角形节点代表罗布麻活性成分,绿色长条形节点代疾病靶点,蓝色长条形节点代表疾病。
2.4潜在靶点蛋白-蛋白互作网络
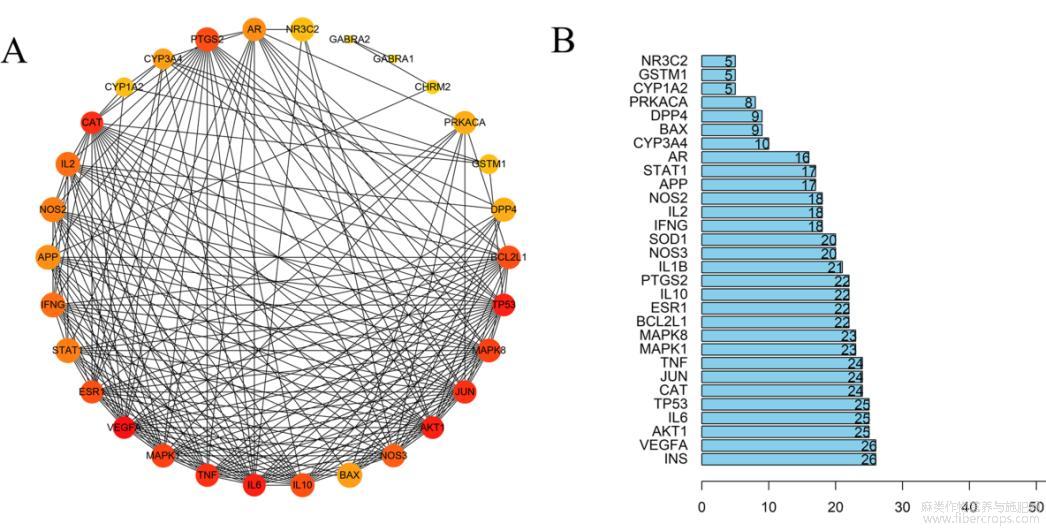
如图3A所示,网络中共有33个节点及其相互联系的277条边。Degree值排名前20位的靶点见图3B,可知INS、VEGFA、AKT1、TP53、IL-6、CAT、JUN、TNF等可能是抗抑郁的重要潜在靶点。
图3 潜在靶点蛋白-蛋白互作网络
注:节点越大,颜色越深,表明该节点与其他节点之间的相互作用越广泛密切。
2.5GO分子功能富集分析
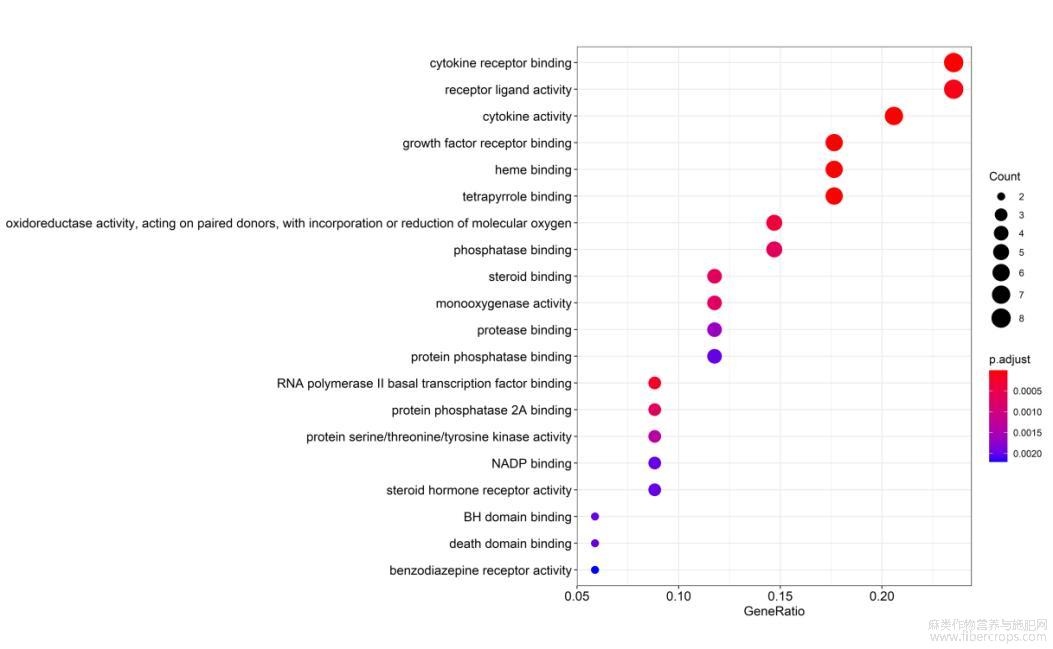
34个靶点通过GO富集分析,筛选出70个分子功能条目(P<0.05),关系最密切的20条分子功能见图4,包括细胞因子受体结合(cytokinereceptor binding)、受体配体活性(receptorligand activity)、细胞因子活性(cytokine activity)、生长因子受体结合(growth factorreceptorbinding)、血红素结合(hemebinding)、四吡咯结合(tetrapyrrolebinding)、氧化还原酶活性(oxidoreductaseactivity)、磷酸酶结合(phosphatasebinding)等。
图4 GO功能富集分析气泡图
2.6KEGG通路富集分析
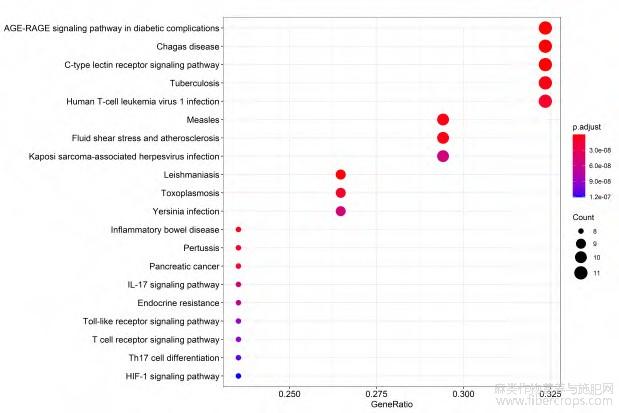
34个靶点通过KEGG通路富集分析筛选出162条信号通路,关系最密切的20条信号通路见图5,包括糖尿病并发症AGE-RAGE信号通路(AGE-RAGE signalingpathway in diabetic complications)、C-型凝集素受体信号通路(C-type lectins receptorsignalingpathway)、IL-17信号通路(IL-17signalingpathway)、胰岛素抵抗(Endocrineresistance)、Toll样受体信号通路(Toll-likereceptorsignalingpathway)、T细胞受体信号通路(Tcellreceptor signalingpathway)等。
图5 KEGG 通路富集分析气泡图
2.7分子对接
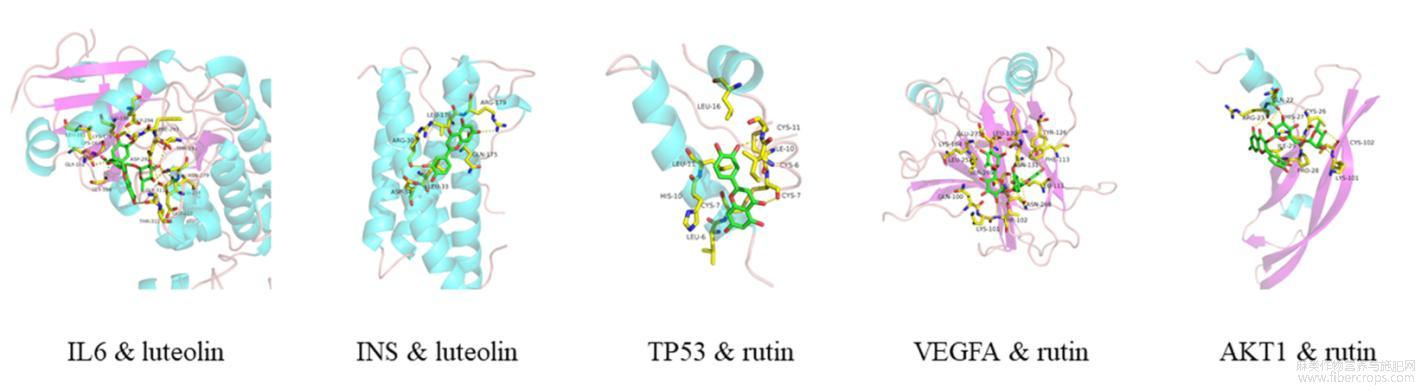
将罗布麻4种主要活性成分与5个关键抗抑郁靶点蛋白采用Vina1.1.2软件进行分子对接,选取对接最佳构象作为分子对接结果,提取对接结合能(affinity)评分并进行排序,affinity值越低,表明结合越好。如表2所示,芸香苷(rutin)与TP53、VEGFA、AKT1的结合评分最优,而木犀草素(luteolin)与IL-6、INS的结合评分最优,上述活性成分的与抗抑郁靶点的最佳复合结构见图6。
|
靶点
|
结合能评分/(kcal·mol-1)
|
|||
|
kaempferol
|
luteolin
|
catechin
|
rutin
|
|
|
IL-6
|
-6.5
|
-7.1
|
-6.3
|
-6.5
|
|
INS
|
-5.5
|
-6
|
-5.6
|
-5.3
|
|
TP53
|
-6.8
|
-6.9
|
-6.6
|
-7.6
|
|
VEGFA
|
-5.6
|
-5.6
|
-5.6
|
-6.3
|
|
AKT1
|
-7.7
|
-8.4
|
-7.7
|
-9.4
|
图6 关键抗抑郁靶点与活性成分的最佳嵌合结构
3讨论
抑郁症是一个涉及多种神经递质、脑区及环路、多种机制的病理过程,包括单胺类递质理论、GABA和其受体相互作用改变、神经生化机制、脑内谷氨酸浓度异常升高、脑内神经肽及受体改变、细胞因子水平改变、海马神经元营养/再生学说、星形胶质细胞功能障碍、细胞信号机制异常等[12-14]。
为了探讨罗布麻抗抑郁机制,我们首先通过文献和网络数据库筛选出罗布麻8个活性成分,包括山柰酚、儿茶素、表儿茶素、花青素B1、木犀草素、谷甾醇、金丝桃苷、芸香苷,及其与抑郁相关的34个作用靶点。随后通过整合这34个靶点构建蛋白相互作用网络,发现INS、VEGFA、AKT1、TP53、IL-6、CAT、JUN、TNF等可能是罗布麻抗抑郁最重要的潜在靶点。通过GO功能富集分析发现细胞因子受体结合、细胞因子活性、受体配体活性、生长因子受体结合、氧化还原酶活性、泛素蛋白连接酶结合、磷酸酶结合、蛋白磷酸酶结合等功能相密切相关。KEGG通路富集分析发现与糖尿病并发症AGE-RAGE信号通路、C-型凝集素受体信号通路、IL-17信号通路、胰岛素抵抗、Toll样受体信号通路、T细胞受体信号通路等密切相关。采用分子对接方法对关键抑郁靶点进行验证,木犀草素、芸香苷与关键抗抑郁靶点能够最佳结合。
综合抑郁症的病理生理学研究进展以及罗布麻的网络药理学分析结果,我们认为罗布麻抗抑郁机制可归纳为神经炎症、细胞凋亡两个方面。其中神经炎症主要涉及炎性因子靶点IL-6、VEGFA、IL-2、IL-10、TNF、NOS3、NOS2等及其介导的T细胞受体信号通路、IL-17信号通路;细胞凋亡靶点AKT1、TP53、JUN、STAT1、BCL2、MAPK1、MAPK8、BAX等及其介导的凋亡信号通路。由于神经炎症与细胞凋亡之间的交叉重叠,且凋亡多为炎症的下游反应,因此我们认为罗布麻抗抑郁作用与其调控炎性因子介导的神经炎症与细胞凋亡有关。
炎性因子是参与炎症反应的各类细胞因子的总称,被认为是抑郁症的发病机制中重要的环节之一[12]。1991年Smith首次提出抑郁症与巨噬细胞过度分泌细胞因子有关[15],随后越来越多的抑郁症患者被发现免疫系统基因调节异常、免疫功能失调[16-18]。深入研究发现炎性因子可影响神经递质代谢、神经内分泌以及神经可塑性[12-14],进一步证实炎性因子介导的病理过程与抑郁症关系密切。根据的效应不同,炎性因子可分为促炎性因子和抗炎性因子。促炎性因子包括IL-1β、IL-2、IL-6、IFN-γ、TNF-α等,在炎症反应过程中加强炎症反应并且诱导生成了更多的炎症因子,协助人体完成免疫反应过程;抗炎性因子包括IL-4、IL-10、IL-13、TGF-β等,则抑制免疫系统过度的产生炎症反应[16-18]。研究发现抑郁症病理过程中IL-10、IL-1受体拮抗剂、IL-4、IL-13、TGF-β和脂联素等抗炎性因子的表达是下降的,若补充外源抗炎性因子则具有一定的抗抑郁作用,同时药物的抗抑郁作用也可能与其对抗炎性因子表达的上调有关[17-18]。因此,抗炎策略被认为在抑郁症治疗中有重要的应用前景。
已有研究发现罗布麻提取物或水煎剂在心血管系统、骨关节系统的抗炎作用以及对TNF-α、PGE2等炎症因子的调节作用[19-20]。在中枢神经系统,罗布麻的主要活性成分也表现出较好的抗炎和神经保护作用。木犀草素可抑制脂多糖诱导的小胶质细胞活化及其释放的多种促炎性因子如TNF-α、IL-1β、NO等[21];芸香苷可抑制三甲基锡诱导的小胶质细胞的活化及其释放的促炎性因子,减轻海马椎体细胞损伤[22]。因此,我们认为罗布麻通过调控炎症因子及其介导的神经炎症是其抗抑郁的重要机制,后续研究中可借助细胞因子芯片等高通量检测手段,筛选罗布麻相关的细胞因子表达谱,进一步明确其作用靶点和信号转导通路。
参考文献
[1]Whiteford H A,Degenhardt L,Rehm J,et al.Global burden of disease attributable to mental and substance use disorders: findings from the global burden of disease study 2010[J]. Lancet,2013,382(9904):1575-1586.
[2]Huang Y Q,Wang Y,Wang H,et al.Prevalence of mental disorders in China: a cross-sectional epidemiological study[J].Lancet Psychiatry,2019,6(3):211-224.
[3]Martins J,Brijesh S.Phytochemistry and pharmacology of anti-depressant medicinal plants: a review[J].BiomedPharmacother,2018,104:343-365.
[4]Chen G,Guo X Y.Neurobiology of Chinese herbal medicine on major depressive disorder[J].Int Rev Neurobiol,2017,135:77-95.
[5]国家药典委员会.中华人民共和国药典:2020 年版一部[S].北京:中国医药科技出版社,2020:327.
[6]Li X T,Wu T,Yu Z H, et al.Apocynum venetum leaf extract reverses depressive-like behaviors in chronically stressed rats by inhibiting oxidative stress and apoptosis[J].Biomed Pharmacother,2018,100:394-406.
[7]Wu T,Li X T,Li T T,et al.Apocynum venetum leaf extract exerts antidepressant-like effects and inhibits hippocampal and cortical apoptosis of rats exposed to chronic unpredictable mild stress[J].Evid Based Complement AlternatMed,2018,2018:5916451.
[8]张彦,祝晨蔯.金丝桃苷对慢性不可预知温和刺激大鼠抑郁行为的影响[J].中国新药与临床杂志,2017,36(3):150-156.
[9]Zheng M Z,Liu C M,Pan F G,et al.Antidepressant-like effect of hyperoside isolated from Apocynum venetum leaves: possible cellular mechanisms[J].Phytomedicine,2012,19(2): 145-149.
[10]Anjomshoa M,Boroujeni S N,Ghasemi S,et al.Rutin via increase in the CA3 diameter of the hippocampus exerted antidepressant-like effect in mouse model of maternal separation stress: possible involvement of NMDA receptors[J].BehavNeurol,2020,2020:4813616.
[11]Parashar A, Mehta V,Udayabanu M.Rutin alleviates chronic unpredictable stress-induced behavioral alterations and hippocampal damage in mice[J].Neurosci Lett,2017,656:65-71.
[12]Wohleb E S,Franklin T,Iwata M,et al.Integrating neuroimmune systems in the neurobiology of depression[J].Nat RevNeurosci,2016,17(8):497-511.
[13]Himmerich H,Patsalos O,Lichtblau N,et al.Cytokine research in depression:principles,challenges,and open questions[J].Front Psychiatry,2019,10:30.
[14]徐说,林文娟.抗炎性细胞因子与抑郁症[J].生物化学与生物物理进展,2014,41(11):1099-1108.
[15]Smith R S.The macrophage theory of depression[J].MedHypotheses,1991,35(4):298-306.
[16]Lee S T H.Inflammation, depression, and anxiety disorder: a population-based study examining the association between Interleukin-6 and the experiencing of depressive and anxiety symptoms[J].PsychiatryRes,2020,285:112809.
[17]Kim Y K,Na K S,Myint A M,et al.The role of pro-inflammatory cytokines in neuroinflammation, neurogenesis and the neuroendocrine system in major depression[J].Prog Neuropsychopharmacol BiolPsychiatry,2016,64:277-284.
[18]Köhler C A,F reitas T H,Stubbs B,et al.Peripheral alterations in cytokine and chemokine levels after antidepressant drug treatment for major depressive disorder:systematic review and meta-analysis [J].MolNeurobiol,2018,55(5):4195-4206.
[19]巨名飞,贾立立,黄贤胜,等.罗布麻提取物对动脉粥样硬化早期 TNF-α表达的影响[J].重庆医学,2014,43(25):3314-3316.
[20]武炜,聂姬锋.罗布麻叶水煎剂抗炎作用的研究[J].安徽农业科学,2013,41(11):4789-4790;4851.
[21]Kao T K,Ou Y C,Lin S Y,et al.Luteolin inhibits cytokine expression in endotoxin/cytokine-stimulated microglia[J].J NutrBiochem,2011,22(7):612-624.
[22]Koda T,Kuroda Y,Imai H.Rutin supplementation in the diet has protective effects against toxicant-induced hippocampal injury by suppression of microglial activation and pro-inflammatory cytokines[J].Cell MolNeurobiol,2009,29(4):523-531.
文章摘自:徐莉莉,李祥婷,张雯,蔡定芳,王飞,向军.基于网络药理学和分子对接研究罗布麻抗抑郁机制[J/OL].中成药:1-4[2021-10-19].
更多阅读
Copyright by Ramie Research Institute of Hunan Agricultural University
湖南农业大学农学院/苎麻研究所 版权所有 2009-2016 湘ICP备10006838号-1