摘 要:DNA甲基化是植物重要的表观遗传修饰方式之一,在响应逆境胁迫中具有重要作用,但是有关镉胁迫下植物DNA甲基化水平变化的报道甚少。本研究以红麻P3A为材料,采用水培法对幼苗进行300μmolL-1的CdCl2处理,测定幼苗农艺性状及镉含量;利用甲基化敏感扩增多态性技术分析镉胁迫下根系DNA甲基化水平变化;回收甲基化差异片段并克隆测序,采用qRT-PCR技术对DNA甲基化差异基因的表达量进行分析。结果表明,CdCl2胁迫显著抑制红麻幼苗的株高、茎粗、根长、根表面积以及全鲜重。对照及镉处理下幼苗根系的DNA甲基化率分别为62.78%、68.23%,其中全甲基化率分别为37.50%、36.36%,半甲基化率分别为25.28%、31.87%,表明镉胁迫显著提高红麻幼苗根系的DNA甲基化水平。qRT-PCR分析表明,7个与抗性密切相关的DNA甲基化差异基因也存在表达量的差异,推测DNA甲基化水平变化在响应红麻镉胁迫中发挥重要作用。本结果为深入探索DNA甲基化响应植物镉胁迫的潜在机制提供了理论基础。
关键词:红麻;镉胁迫;DNA甲基化;甲基化敏感扩增多态性(MSAP);实时荧光定量PCR(qRT-PCR)
镉是植物生长发育过程中的非必需微量元素,不仅影响植物生长发育,过量的镉还会造成植物死亡,并且通过在植物体内积累被食用后会威胁人类的生命健康。因此,植物对重金属镉的吸收是环境污染研究领域的一个热点问题[1]。红麻是世界上重要的韧皮纤维作物,主要用于纺织、造纸、建材和饲料等方面,是一种多用途作物[2]。红麻生长速度快、生物量大、对重金属具有极强的吸附力和耐受性,是重金属污染土壤良好的替代种植材料[3]。
DNA甲基化在维持基因组稳定性、调控基因表达和响应生物及非生物胁迫等方面具有重要作用[4,5]。甲基化敏感扩增多态性)技术是在扩增片段长度多态性技术的基础上发展而来的,它与AFLP同样基于PCR扩增多态性,不同的是MSAP技术利用2种识别CCGG序列的同裂酶HpaII和MspI,替换了AFLP分析中识别4碱基的内切酶MseI,并且MSAP技术操作简单、多态性高,已成功应用于检测多种植物基因组DNA甲基化水平变化中[6,7]。张凯凯等[8]利用MSAP技术检测不同浓度镉胁迫对孔雀草基因组DNA甲基化水平的变化发现,其甲基化水平随着镉浓度的提高而上升,甲基化模式变化主要以重新甲基化为主,并推测孔雀草受到环境中重金属胁迫时,植物体通过改变DNA甲基化来调控基因的表达,以应对不良环境对自身的影响,从而达到抵御重金属胁迫的作用。李照令等[9]运用MSAP技术发现,随着镉胁迫浓度的升高,拟南芥基因组DNA甲基化水平逐渐降低,但均高于对照,且基因组去甲基化位点增多。有研究表明,镉胁迫能够引起DNA总甲基化水平提高[10],也有研究发现镉胁迫处理后DNA甲基化水平降低[11]。上述研究结果表明DNA甲基化水平变化和响应非生物胁迫机制的复杂性。
红麻响应镉胁迫的相关研究报道主要集中在农艺性状及多组学研究上,但有关DNA甲基化响应红麻镉胁迫的研究尚未见报道。本试验前期对红麻幼苗P3A进行不同浓度(0、100、200、300、600μmolL-1)的CdCl2胁迫表明,幼苗在300μmolL-1浓度下的株高和生物量显著降低,但其生长发育无显著影响,结合红麻修复重金属土壤的目的,因此本研究选用300μmolL-1的CdCl2对红麻材料P3A幼苗进行胁迫处理并详细分析,测定幼苗的生理生化指标,利用MSAP技术分析镉胁迫下基因组DNA甲基化水平变化,对甲基化差异片段进行测序比对,并对响应逆境的甲基化差异基因进行qRT-PCR分析,系统分析镉胁迫下红麻幼苗的生理生化响应、基因组DNA甲基化水平变化以及响应镉胁迫相关基因的DNA甲基化变化与表达量的关系,旨在为进一步研究DNA甲基化响应红麻镉胁迫的潜在机制提供重要参考。
1材料与方法
1.1试验材料及处理
红麻材料P3A由广西大学农学院周瑞阳教授提供。挑选籽粒饱满且均匀一致的种子,37℃蒸馏水浸泡1h,3%过氧化氢(成都金山化学试剂有限公司,20170616)消毒10min,蒸馏水冲洗3~5次,之后将种子均匀地摆放在铺有2层纸巾的保鲜盒(27cm×18cm×9cm)中,添加100mL蒸馏水,放置于恒温光照培养箱(光/暗周期为10h/14h,温度为白天27℃/夜晚25℃,下同)中培养(注意定期定量地添加蒸馏水,始终保持纸巾湿润)。培养4d后,挑选长势一致的幼苗210株,随机分成6组,每组35株,即为2个处理,每个处理3次生物学重复,移栽于6个底部含有托盘的育苗盘(35孔花卉育苗盘)中。向托盘中分别添加含有不同CdCl2浓度(0、300μmolL-1)的1/4Hoagland处理液,注意每天定时定量地更换处理液。
1.2农艺性状及相对抑制率的测定
胁迫处理7d后,使用直尺测量红麻各单株的株高,使用游标卡尺测量各单株的茎粗,使用电子天平称量各组全鲜重。将根部用蒸馏水清洗干净并用吸水纸吸干水分,利用根系扫描分析仪(EPSONEXPRESSION 11000XL)对根系进行扫描分析。之后将材料用液氮速冻后保存于-80℃冰箱,用于后续试验。采用相对抑制率表示红麻耐镉性的强弱,相对抑制率的公式为;相对抑制率(%)=(目标性状对照值-目标性状处理值)/目标性状对照值×100[12]。
1.3镉含量的测定
将根系用20mmolL-1EDTA-Na2浸泡1h,去除表面的镉离子,再用去离子水洗涤3次,并将根、茎、叶置于烘箱150℃杀青30min,之后70℃烘干至恒重,称取各部分组织干重后再用粉碎机将其粉碎用于Cd2+含量测定。本次试验采用微波消解法处理样品,使用PerkinElmer PinAAcle900石墨炉原子吸收分光光度计测定Cd2+含量[13]。各部分组织粉碎成粉末后进行消解、赶酸、过滤、定容、制作标准曲线,最后测定样品的镉含量。
1.4甲基化敏感扩增多态性(MSAP)分析
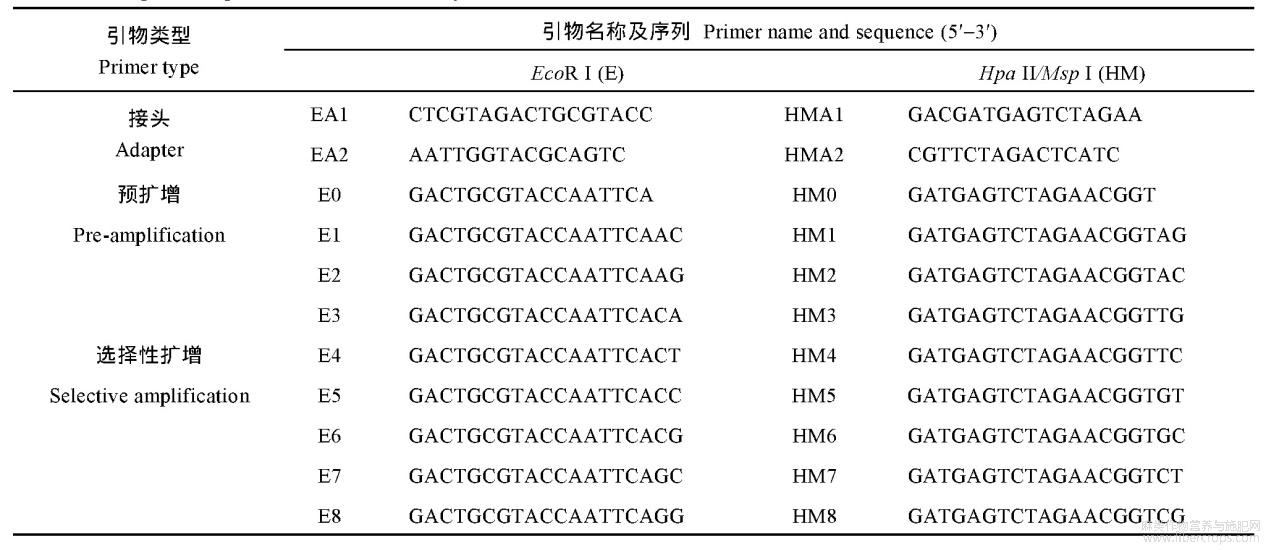
首先采用改良的CTAB法[14]提取上述材料根系的基因组DNA,之后进行1%琼脂糖凝胶电泳检测DNA的质量,利用超微量紫外线分光光度计测定DNA的浓度,保存于-20℃冰箱备用。参照李增强等[15]报道的方法并加以改良,对2个处理的(0、300μmolL-1)根系进行MSAP分析。选用EcoRI+HpaII和EcoRI+MspI两种酶组合分别对基因组DNA进行双酶切,之后进行连接、预扩增、选择性扩增。酶切体系为:CutSmart buffer2μL、HpaII或MspI(NEB公司)0.5μL、EcoRI0.5μL、模板DNA(100ngμL-1)5μL、ddH2O12μL;反应程序为:37℃6h,80℃(EcoRI/HpaII)或65℃(EcoRI/MspI)20min。连接体系为:T4 DNA Ligase(350UμL-1,TaKaRa公司)2μL、10×T4 DNA Ligase buffer2μL、正反向引物(10μmolL-1)各1μL、酶切产物14μL;反应程序为:16℃14h,65℃20min。预扩增体系为:连接产物5μL(将连接产物稀释20倍)、正反向引物(10μmolL-1)各1μL、2×Rapid Taq Master Mix(南京诺唯赞生物科技有限公司,下同)10μL、ddH2O3μL;反应程序为:94℃预变性3min;94℃15s,58℃15s,72℃30s,32个循环;72℃延伸5min,12℃保存。选择性扩增体系为:预扩增产物5μL(预扩增产物稀释25倍)、正反向引物(10μmolL-1)各1μL、2×Rapid Taq Master Mix10μL、ddH2O3μL;反应程序同预扩增PCR。选择性扩增产物经95℃变性10min后,进行6%聚丙烯酰胺凝胶电泳,银染、显色,照相保存并统计MSAP多态性片段。接头序列、预扩增和选择性扩增引物序列见表1。
表1接头和引物序列
1.5差异片段的回收、克隆和测序分析
将6%聚丙烯酰胺凝胶中的差异性片段用刀片切下,放入1.5mLEP管中,用吸头捣碎,加入25μL无菌水,95℃水浴10min,离心30s后取5μL上清用相应的选择性扩增引物进行PCR扩增。扩增体系为DNA模板5μL、正反向引物(10μmolL-1)2.5μL、2×Rapid Taq Master Mix25μL、ddH2O15μL;反应程序同选择性扩增。利用1%琼脂糖凝胶电泳检测扩增产物,并进行回收纯化(南京诺唯赞生物科技有限公司)。将回收产物连入pEASY-T1载体(北京全式金生物技术有限公司),之后转入DH5α感受态细胞中,挑选阳性单克隆,进行菌液PCR检测,之后送广州华大基因科技服务有限公司测序。测序所得序列在NCBI(http://www.ncbi.nlm.nih.gov/)及红麻基因组数据库[16](https://bigd.big.ac.cn/gwh)中比对分析。
1.6实时荧光定量PCR(qRT-PCR)分析
使用异硫氰酸胍法[17]并稍作改良提取相应根系材料(0、300μmolL-1)的RNA,并检测RNA的质量和浓度,使用诺唯赞反转录试剂盒(货号R223-01)逆转录成cDNA,并以此为模板进行qRT-PCR分析。以组蛋白基因His3为内参基因,采用2-ΔΔCT方法[2]计算基因的相对表达量。qRT-PCR引物序列见表2。
表2实时荧光定量PCR引物序列
2结果与分析
2.1镉胁迫对红麻幼苗农艺性状的影响
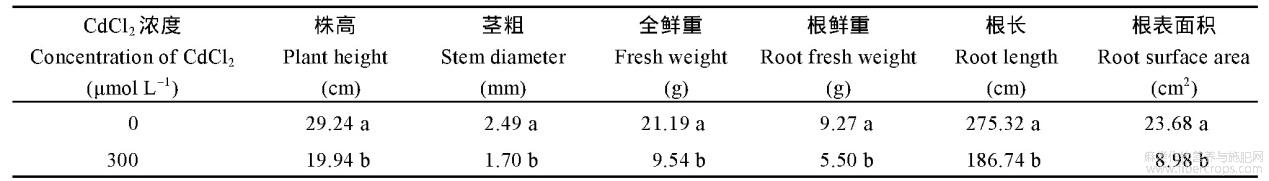
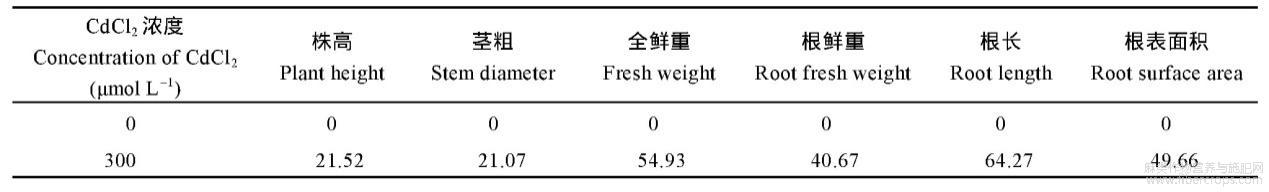
由表3和表4可知,300μmolL-1的CdCl2胁迫显著抑制红麻幼苗的株高、茎粗、全鲜重、根鲜重、根长和根表面积,抑制率分别为21.52%、21.07%、54.93%、40.67%、64.27%和49.66%。表明300μmolL-1的CdCl2胁迫显著抑制了红麻幼苗的生长。
表3 CdCl2胁迫对红麻幼苗农艺性状的影响
表4 CdCl2胁迫对红麻幼苗农艺性状的相对抑制率
2.2红麻幼苗不同部位镉含量的比较
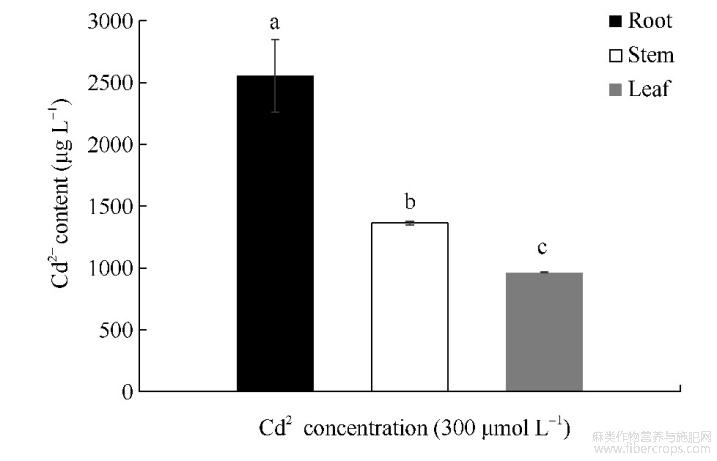
由图1可知,红麻幼苗在300μmolL-1的CdCl2胁迫下,根系的镉含量最高,为2555.47μgL-1;茎部的镉含量次之,为1363.41μgL-1;叶片的镉含量最低,为963.06μgL-1;并且各部位的镉含量均存在显著性差异。结合对红麻幼苗农艺性状的测定结果得出,300μmolL-1的CdCl2胁迫显著抑制了红麻幼苗的生长,且植株体内尤其是根系积累了大量的镉元素。
图1 CdCl2胁迫对红麻不同部位镉含量的影响
2.3镉胁迫对红麻幼苗根系DNA甲基化水平的影响
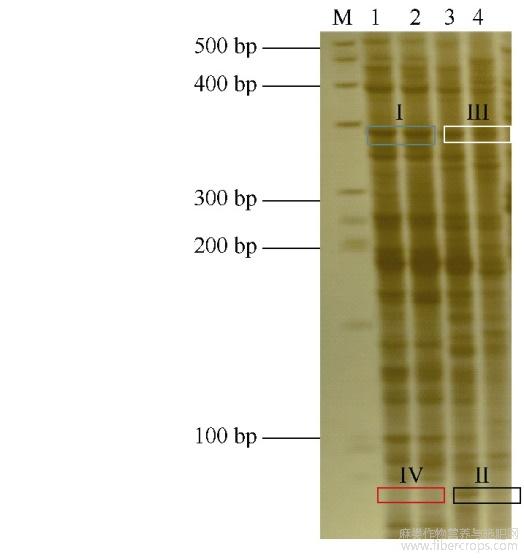
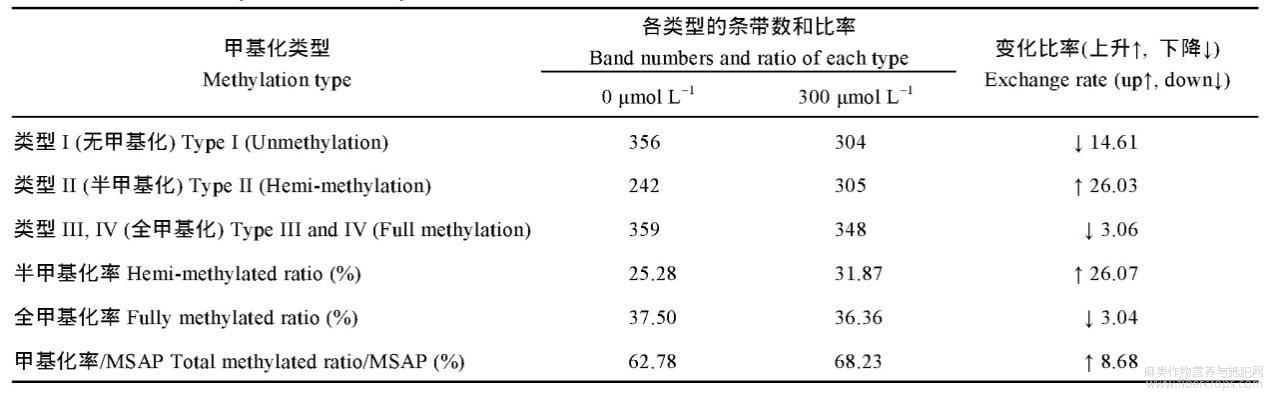
运用MSAP技术分析300μmolL-1CdCl2胁迫下红麻幼苗根系的DNA甲基化水平变化情况,部分代表性聚丙烯酰胺凝胶电泳结果见图2,统计结果见表5。对照条件下,幼苗根系的甲基化率、全甲基化率和半甲基化率分别为62.78%、37.5%和25.28%;300μmolL-1的CdCl2胁迫下幼苗根系的甲基化率、全甲基化率和半甲基化率分别为68.19%、36.37%和31.82%,即该浓度的CdCl2胁迫使幼苗根系的甲基化率和半甲基化率升高,全甲基化率变化较小。表明在整体水平上,300μmolL-1的CdCl2胁迫提高了红麻幼苗根系的DNA甲基化水平。
图2 MSAP聚丙烯酰胺凝胶电泳图
泳道M代表BM50DNAmarker;泳道1和3代表EcoRI/HpaII酶切;泳道2和4代表EcoRI/MspI酶切。1和2:0μmolL-1CdCl2;3和4:300μmolL-1CdCl2。蓝色方框;I型(无甲基化);黑色方框;II型(半甲基化);白色方框;III型(全甲基化);红色方框;IV型(全甲基化)。
表5DNA甲基化水平统计分析
2.4甲基化差异片段的测序及功能注释
本试验回收到157条甲基化差异条带,测序比对到40条具有功能的DNA甲基化差异序列,与植物抗逆性相关的甲基化差异序列见表6。其中16条DNA甲基化差异片段与响应植物抗逆性密切相关,例如GH3.1(Gretchen Hagen)基因通过调节植物体内激素的动态平衡,参与调控植物的生长发育过程[18],NADP-ME(NADP-dependent malic enzyme)通过碳代谢来平衡细胞内的pH来防御生物和非生物胁迫[19],ABCG26(ABC transporter G family member26)基因在八仙花根尖发生铝胁迫后,参与响应铝胁迫[20],L-AAOh(L-ascorbate oxidase homolog)基因在调节植物发育过程和应激反应方面发挥重要作用[21],LRR-RLK(leucine-rich repeat receptor-like kinases)家族基因、GaTPPD(trehalose phosphate phosphatase D)等在植物生长和胁迫反应中均起着重要作用[22]。
表6甲基化差异片段比对分析
2.5甲基化差异基因qRT-PCR分析
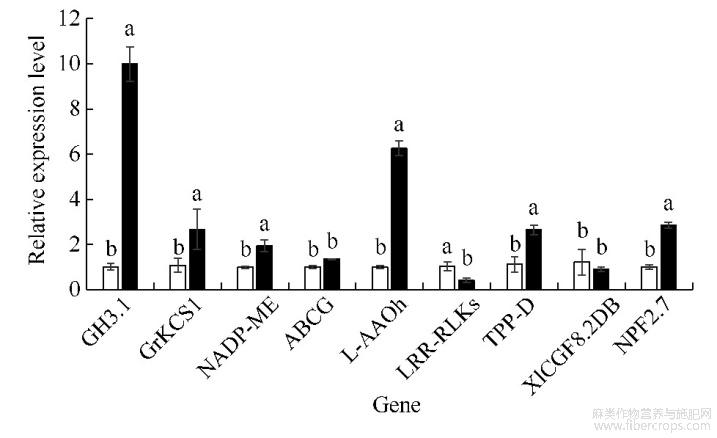
为分析DNA甲基化变化对基因表达的影响,挑选9个响应植物非生物胁迫的甲基化差异基因进行qRT-PCR分析。由图3可知,7个基因在镉胁迫下的表达量与对照呈显著性差异,其中基因GH3.1、GrKCS1、NADP-ME、L-AAOh、TPP-D、NPF2.7的表达量在CdCl2胁迫下分别显著升高8.80、1.46、0.94、5.22、1.37、1.85倍,LRR-RLKs的表达量显著降低0.59倍。说明DNA甲基化的变化与基因表达水平的改变密切相关。
图3甲基化差异基因的qRT-PCR分析
3讨论
3.1红麻可以作为修复镉污染土壤的潜在作物
本研究结果表明,300μmolL-1镉胁迫虽然显著抑制了红麻幼苗的生长,但是并不致死[32],而且镉积累能力远超水稻、玉米、木薯[33,34,35]等其他作物。根据本试验中测得的红麻对镉的吸附量,以及本课题组之前对国内外众多常规品种研究得出,每公顷红麻对镉吸附量为102.9~125.8g,并且对其生长无显著影响。Sarra等[36]在镉和锌含量高的淤泥里进行红麻和玉米的修复试验发现,红麻茎中镉和锌的含量分别2.49mg kg-1和82.50mg kg-1,玉米茎中镉和锌的含量分别为2.10mg kg-1和10.19mg kg-1,两者都积累了可观的镉和锌,红麻中的锌含量是玉米的8倍多,并且对其产量影响更小,说明红麻具有更强的重金属修复和安全利用价值。栗原宏幸等[37]发现,红麻对镉污染土壤具有明显的修复效果,并且对红麻的产量无显著影响。因此可以在生产上利用红麻极强的镉耐性及吸附能力改良重金属污染土壤。
3.2300µmolL-1的CdCl2胁迫使红麻幼苗的DNA甲基化水平提高
植物遭受非生物胁迫后,通过激活胁迫响应机制或终止某些转录因子的表达来调控植物的生长,DNA甲基化在植物的整个生命周期中起着非常重要的作用,例如参与逆境胁迫的响应,应对不良环境带来的影响,抵御非生物胁迫的毒害等[38]。在重金属、高盐和干旱等逆境胁迫中,植物都能通过DNA甲基化的水平变化来参与调控相关基因的表达,提高植物抗逆性,维持植物的正常生长[39]。
本结果表明,红麻幼苗在300μmolL-1的CdCl2胁迫下根系的DNA甲基化率、半甲基化率较对照分别提高8.68%和26.07%,全甲基化率降低3.04%,在整体水平上,300μmolL-1的CdCl2胁迫提高了红麻幼苗根系的DNA甲基化水平,这与何玲莉等[40]和王丙莲等[41]研究结果一致。殷欣[42]研究发现,大豆DNA甲基化水平变化在镉胁迫下升高,并且与镉胁迫浓度正相关,某些功能蛋白还广泛参与大豆响应逆境胁迫的过程。
3.3DNA甲基化参与响应逆境胁迫相关基因的表达
本研究对与植物抗逆性密切相关的基因进行qRT-PCR分析发现,在镉胁迫下有7个甲基化差异基因的表达水平存在显著差异,推测植物受到镉胁迫后,DNA甲基化水平变化参与调控基因的表达,从而参与红麻对逆境的响应。
NADP-ME酶通过苹果酸代谢平衡细胞内的pH来防御生物和非生物胁迫[19]。Fu等[43]研究发现,小麦植株中的NADP-ME酶在NaCl和PEG胁迫处理下的酶活性升高,表达量下降,并且该参与了对逆境胁迫的响应。本研究中NADP-ME酶在镉胁迫下基因表达量升高了0.94倍,并且甲基化水平发生了改变。推测甲基化水平的变化参与到了该基因的表达量变化中,并最终在响应镉胁迫中起到了重要的作用。吲哚-3醋酸-酰胺合成酶家族能够维持植物内源激素的动态平衡,参与调控植物的生长发育过程[18]。Park等[44]研究中发现,GH3基因在低温胁迫中基因表达量降低,但仍被强烈诱导,抑制自由态的生长素含量增加,提高拟南芥抗逆性。本研究中本吲哚-3醋酸-酰胺合成酶基因GH3.1在镉胁迫下发生了去甲基化,基因表达量显著升高了8.8倍,因此推测其通过甲基化模式的变化参与调控基因表达、维持激素动态平衡,并最终在响应镉胁迫中起到重要作用。抗坏血酸氧化酶)在植物生长发育过程和调节应激反应方面具有重要作用[21]。Parihar等[45]研究发现,在多种逆境胁迫下,抗坏血酸含量升高,可以提高抗逆性。本研究中抗坏血酸氧化酶家族L-AAOh基因在镉胁迫下基因表达量显著升高了5.2倍,并且甲基化水平发生了变化。推测甲基化水平的变化参与到了该基因的表达量变化中,并最终在响应镉胁迫中起到了重要作用。
NRT1/PTR家族蛋白在植物转运硝酸盐、氨基酸和植物激素过程中起重要的作用[46]。在本研究中,甲基化差异NRT1/PTR家族基因NPF2.7的表达量在镉胁迫下显著升高了1.8倍,推测该基因可能参与到了植物的逆境胁迫响应中。海藻糖在逆境胁迫中可以起到抵抗保护作用,提高植物的抗逆性[47]。丁泽红等[48]研究发现,木薯在干旱胁迫下,MeTPP6基因的表达量显著上升,并参与了对干旱胁迫的响应。本研究中GaTPPD基因在镉胁迫下的表达量显著升高了1.35倍,并且其甲基化水平发生了变化,推测DNA甲基化调控该基因表达水平,并最终在响应镉胁迫中起到了重要作用。
4结论
红麻对镉胁迫具有较强的耐受性,在300μmolL-1的镉胁迫下,红麻幼苗的长势受到抑制,但并没有严重影响其生长,并且镉富集量大,说明红麻具有较强的土壤修复潜力,因此可以利用红麻来修复重金属镉污染农田。红麻幼苗在300μmolL-1CdCl2胁迫下,根系DNA甲基化水平升高,与响应逆境胁迫相关的GH3.1基因、ABC转运蛋白家族基因、NADP-ME基因、结合转运蛋白G家族基因、抗坏血酸氧化酶基因、LRR-RLKs家族基因、海藻糖磷酸磷酸酶基因、NRT1/PTR家族蛋白的DNA甲基化和基因表达水平都发生了显著变化。DNA甲基化水平变化可能参与了响应逆境胁迫相关基因的表达调控,并最终在红麻响应镉胁迫中起到了重要的作用。
文章摘自:卢海,李增强,唐美琼,罗登杰,曹珊,岳娇,胡亚丽,黄震,陈涛,陈鹏.红麻DNA甲基化响应镉胁迫及甲基化差异基因的表达分析[J].作物学报,2021,47(12):2324-2334.