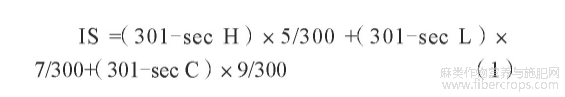摘 要:研究大麻二酚(CBD)缓解由于表面活性剂、机械损伤、防腐剂导致的肌肤红肿、热胀、发麻的功效。通过十二烷基硫酸钠(SDS)刺激模型、胶带撕拉模型测定经皮水分流失TEWL值、血红素EI值、皮肤红度a*值的变化程度,评价不同浓度CBD的抗炎和舒缓抗刺激功效。用苯氧乙醇刺激模型评价CBD即时舒缓刺痛、发烫感的效果;用鸡胚绒毛尿囊膜模型(HET-CAM)评价CBD抗刺激性能力。结果表明,质量分数0.05%和0.1%的CBD在胶带黏贴试验中于7天后能达到81.05%和87.35%的损伤修复率。0.05%和0.1%的CBD能够降低皮肤受到外界刺激因素后的TEWL值、EI值和a*值,并且修复皮肤屏障功能,同时改善皮肤红斑情况,对受损皮肤具有一定的舒缓修复功效。
关键词:大麻二酚;SDS刺激模型;胶带撕拉模型;皮肤屏障;舒缓修复
大麻属于木兰纲(Magnoliopsida)荨麻目(Urticales)大麻科(Cannabinaceae)大麻属(Cannabis)大麻种(Cannabis sativa L.)的一年生草本植物。大麻叶中含有多酚、黄酮和植物碱等活性成分[1]。凌年等[2]研究发现,大麻叶中普遍含有大麻酚类化合物(Cannabinoid),从大麻叶提取物中分离出超过525种物质,其中大麻酚类化合物至少有86种。大麻酚包括大麻二酚(CBD)、四氢大麻酚(THC)、六氢大麻酚(CBN)、大麻环萜酚(CBC)、大麻萜酚(CBGB)等。研究表明,CBD在医学上具有减轻惊厥、炎症、焦虑和呕吐的作用,可治疗神经性皮炎。CBD是皮肤中具有的内源性大麻素系统的元素,即内源性大麻素化合物(AEA和2-AG)、代谢型(CB1R和CB2R)和大麻素的离子型(TRPV-1)受体以及参与内源性大麻素合成的代谢酶(例如FAAH和MAGL)[3-5]。内源性大麻素系统中的各种元素均是参与皮肤调节的关键机制,如控制表皮和皮肤附件的生长、细胞存活、免疫和炎症反应、传递感觉到中枢神经系统(例如疼痛、瘙痒等)以及脂质的合成等[6]。大麻提取物的活性成分大麻素具有重要药理和生理活性,目前对于大麻素类物质,尤其是大麻素中含量较多的大麻二酚的应用主要集中在消炎和对损伤细胞的修复方面,在皮肤舒缓及抗刺激应用方面的研究极少[7-8]。
在日常所用到的化妆品中,有些人使用过后往往会有发热、刺痛、瘙痒感。如使用洗面奶后会刺痛,这种不良感觉往往是由于洗面奶等化妆品中的表面活性剂、防腐剂、多元醇类的物质给皮肤带来红肿、热胀和发麻瘙痒的感觉[9]。
十二烷基硫酸钠(SDS)是一种阴离子表面活性剂,其作用于皮肤能影响角质层脂质和蛋白质合成进而破坏皮肤屏障功能,引起刺激性接触性皮炎的发生[10-11]。SDS刺激试验已成为研究刺激性接触性皮炎的一个经典的模型。据国内外大量文献报道,使用SDS刺激后,皮肤的生理参数如经皮水分流失量(TEWL)、血红素(EI)以及皮肤颜色红度(a*值)将发生改变。胶带黏贴模型原理是胶带黏贴皮肤后会移去部分角质细胞及细胞间脂质,造成皮肤屏障功能的损伤,因此胶带黏贴试验常被用作皮肤物理性刺激的模型[12-15]。
本文将通过CK仪器研究大麻二酚缓解肌肤由于表面活性剂、机械损伤、防腐剂导致的肌肤红肿、热胀和发麻。通过SDS刺激模型、胶带撕拉模型测定经皮水分流失TEWL值、血红素EI值、皮肤红度a*值的变化程度,评价不同浓度CBD的抗炎、舒缓抗刺激功效。用苯氧乙醇刺激模型评价CBD即时舒缓刺痛、发烫感的效果;用鸡胚绒毛尿囊膜模型(HET-CAM)评价CBD抗刺激性能力。本次研究采用主观评分和仪器检测相结合的方法来评价CBD的功效,为CBD在舒缓抗刺激护肤品领域的应用提供理论依据,并为舒缓功效类的化妆品原料及成品的评价、应用开发提供测试方法参考。
1试验部分
1.1试剂与仪器
大麻二酚(纯度99%,乐尔福);十二烷基硫酸钠([Sodium Dodecyl Sulfate,SDS),德国巴斯夫];用去离子水配制质量分数1%SDS水溶液;斑贴器(Finn Chambers,SmartPractice R);固定胶带MicroscopeTM(低致敏外用胶布,3M)。样品组配制:不同质量分数的大麻二酚(0.01%、0.05%和0.1%)+2%丁二醇+0.1%卡波姆U10+0.1%三乙醇胺+0.4%苯氧乙醇+离子水(加至100%)。基质组配制:质量分数2%丁二醇+0.1%卡波姆U10+0.1%三乙醇胺+0.4%苯氧乙醇+离子水(加至100%)。仪器:Mexameter MX18皮肤黑色素和血红素测试仪、Colormeter CL400皮肤颜色测试仪,德国CK公司;VISIA-CR面部图像分析系统,美国Canfield公司;1260高效液相色谱仪(包括真空在线脱气机、二元泵系统、自动进样器、柱温箱、DAD检测器、ChemStation工作站),美国安捷伦公司;电子天平,梅特勒公司。鸡胚:SPF级鸡蛋,购于新兴大华农禽蛋有限公司(温氏集团),购回后置RcomMAX孵化箱中气室端朝上,在温度为(37.6±0.1)℃、相对湿度为(46%±1%)的条件下孵化,每小时水平方向倾斜45度自动翻蛋一次,自动换气,孵化至第10天时用于试验[6]。
1.2试验方法
1.2.1大麻二酚含量测定
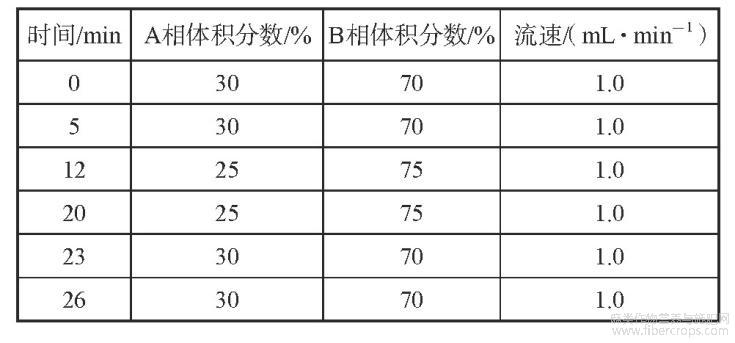
使用安捷伦1260高效液相色谱仪;C18色谱柱(4.6mm×250mm×5μm);流动相A:质量分数0.1%甲酸-水,流动相B:质量分数0.1%甲酸-乙腈;进样量10μL;柱温为30℃;波长220nm;洗脱梯度如表1所示。
表1梯度洗脱表
1.2.2苯氧乙醇模型刺激性试验
通过临床半主观试验评价大麻二酚“即时舒缓”功效。使用1%苯氧乙醇面膜刺激志愿者面部后进行单次涂样,对比研究志愿者使用样品前后对刺痛、发烫感的评分变化,评价大麻二酚即时舒缓的效果[16]。
试验流程:整个试验均在恒温(20±2)℃、恒湿(50%±5%)环境下进行,10名志愿者全脸贴敷含质量分数1%苯氧乙醇面膜5min,并在敷贴30s、2.5min和5min时,针对受试者有不同程度的泛红、刺痛、发热症状,询问受试者的自觉症状。按10分法进行评分(0分为没有感觉,10分为重度)。揭掉面膜后用柔软的干纸巾轻轻将脸部液体粘干。单次定量随机半脸涂抹基质以及含质量分数0.01%、0.05%和0.1%大麻二酚的样品,分别在30s、2.5min和5min时询问受试者的自觉症状,并做好记录。
1.2.3胶带黏贴试验
每位受试者双前臂屈侧随机反复多次进行胶带黏贴试验(Tape Stripping,TAP),15名受试者左手前臂屈侧区划分4个边长为2cm×2cm的正方形试验区,试验区域随机分布在左手前臂屈侧[17]。
D0:测量4个试验区未进行胶带黏贴时的TEWL值,测量后在4个试验区进行胶带黏贴处理,直至TEWL值增加50%后停止黏贴。测量损伤后区域的经皮失水TEWL值为初始值。
受试者于D0损伤后8h开始连续7天在试验区域(1~4)每天2次涂抹基质以及含质量分数0.01%、0.05%和0.1%大麻二酚的样品,并于D1、D2、D3和D7回访测试。
1.2.4质量分数1%SDS表面活性剂刺激模型
抗刺激模型:分别将不同浓度的大麻提取液与质量分数1%SDS混合后,在16名志愿者手背内侧进行24h斑贴测试,对比基质组与不同浓度大麻二酚的样品组区域皮肤经皮水分流失TEWL值、血红素EI值、皮肤红度a*值的变化程度,敷贴24h后,移开斑试器。分别在撕斑贴后24h及第1~7天评价其抗炎、抗刺激功效。
舒缓刺激模型:在16名志愿者手前臂屈侧用质量分数1%SDS进行24h斑贴诱导皮肤损伤产生炎症后每天两次使用基质以及含质量分数0.01%、0.05%和0.1%大麻二酚的试样,记录皮肤经皮水分流失TEWL值、血红素EI值、皮肤红度a*值的变化程度,在第1~7天评价其舒缓、修复皮肤屏障功效。
1.2.5HET-CAM试验
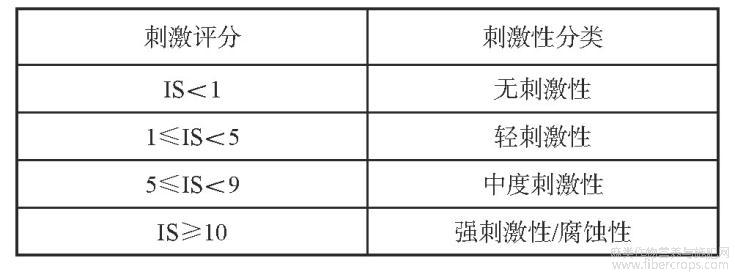
以生理盐水(质量分数0.9%Nacl水溶液)作为空白对照,阴性组用质量分数1%SDS溶液。将鸡胚自孵化箱中取出,置于自制的蛋架上,气室端朝上,用有齿镊头部轻轻敲破蛋壳后,小心夹除气室端蛋壳,完整暴露蛋壳膜,加2mL生理盐水于蛋壳膜上使其润湿,吸去生理盐水,用弯镊小心剥去蛋壳膜,暴露出绒毛尿囊膜(CAM),肉眼观察其完整性,如有破损则不用于试验。分别吸取0.3mL的样品,滴加在绒毛尿囊膜表面,5min后加入质量分数1%SDS,观察开始出现血管融解、凝血的时间,其间进行拍照录影,根据式(1)计算刺激评分(Irritation Score,IS)值[8]。按表2进行结果评价。
式中:sec H(出血时间)——CAM膜上观察到开始发生出血的平均时间,s;
sec L(血管融解时间)——CAM膜上观察到开始发生血管融解的平均时间,s;
sec C(凝血时间)——CAM膜上观察到开始出现凝血的平均时间,s。
表2 刺激评分法结果评价
每个样品均用6个鸡胚进行试验,计算6个鸡胚的刺激评分总和,根据每个鸡胚所得的IS值计算平均刺激评分。
1.2.6统计学处理
所有试验结果均为3次以上试验的平均值,试验数据以平均值±标准差表示,采用SPSS13.0软件,利用Dunnett’s检验和ANOVA检验进行统计学处理,P<0.05即具有统计学显著意义。
2结果与讨论
2.1大麻二酚含量测定
精密吸取样品10μL,按前述色谱条件进样测定,记录峰面积,以样品质量浓度为横坐标,峰面积为纵坐标。经过内标法测试得知,大麻二酚的含量为质量分数99.88%。
2.2苯氧乙醇模型刺激性试验
苯氧乙醇可以对人体皮肤细胞的“TRPV1传感器”(人体细胞用来感知外界的某一神经通道)产生影响,使人产生“热感”或者轻微“痛感”,10名志愿者使用质量分数1%苯氧乙醇涂抹之后马上产生灼热感甚至是刺痛感,持续时间为5min左右。掀开面膜后使用样品,使用基质组样品后并不能舒缓苯氧乙醇带来的刺痛感,5min后刺激评分为6.12。使用中、高浓度CBD处理5min后刺激评分为1.5和1.3。说明中高浓度组的CBD能够快速舒缓苯氧乙醇带来的刺痛感和灼热感。表3列出了具体试验结果。
表3苯氧乙醇模型刺激评分
2.3胶带黏贴试验
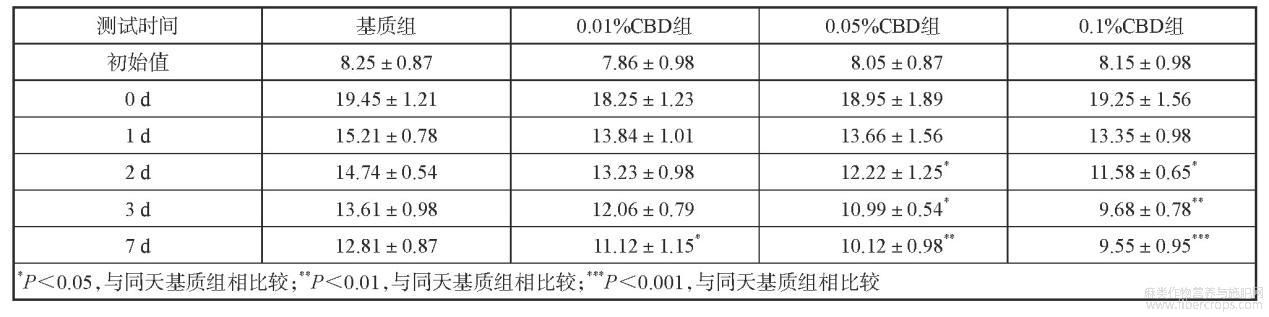
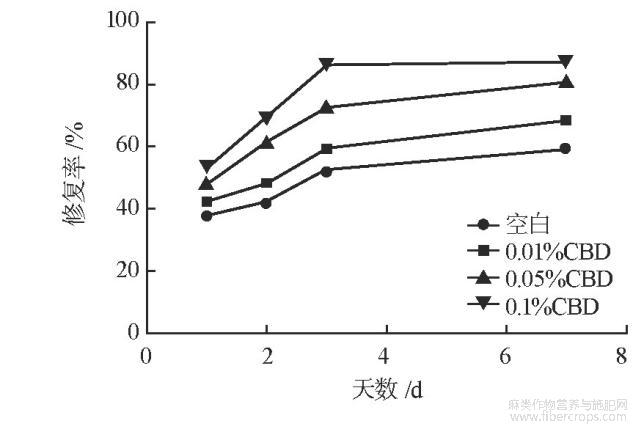
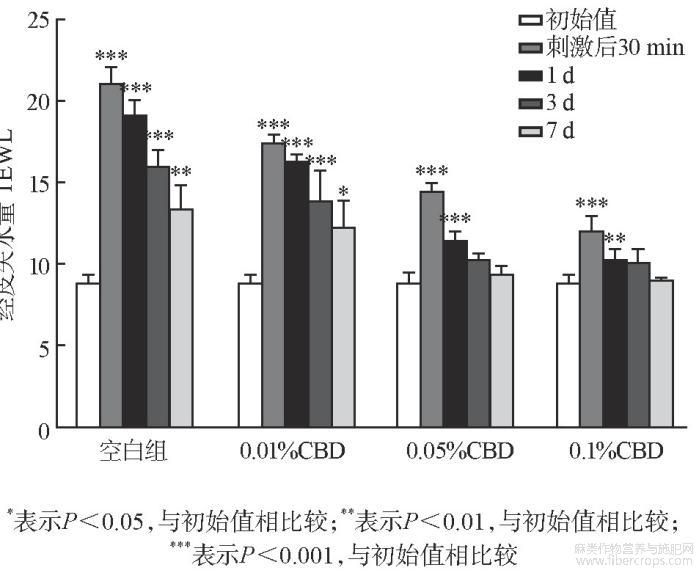
胶带黏贴会去除角质层及细胞间脂质,引起刺激性接触性皮炎的发生。因而胶带黏贴试验常被作为机械性刺激模型。随着角质层被胶带逐渐黏贴去除,角质层受到破坏,TEWL值会升高。基质组到第7天时TEWL值为12.81,修复率是59.24%,低、中、高浓度CBD组皮肤损伤后TEWL值是分别是18.25、18.95和19.25,经过7天的修复后,TEWL值降至11.12、10.12和9.55,修复率为68.57%、81.04%和87.35%。表4列出了测得TEWL的值,图1列出了相应的皮肤修复率变化趋势。
表4 不同组别TEWL测得值
图1 胶带黏贴试验中皮肤修复率变化趋势
2.4表面活性剂SDS试验
2.4.1抗炎抗刺激试验
分别将不同浓度的CBD与质量分数1%SDS混合后进行24h斑贴,其中经皮失水TEWL值越低,表示皮肤的保水性能越好,血红素EI值和皮肤红度a*值越低,表示皮肤的抗炎抗刺激性越好。
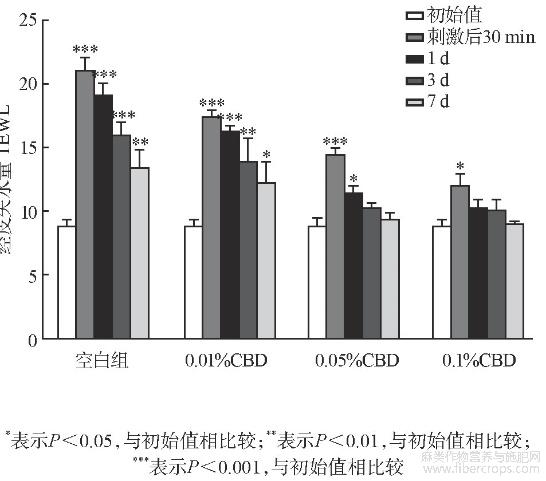
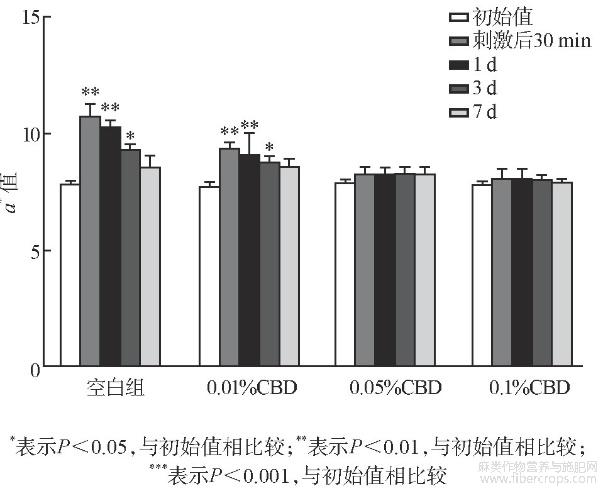
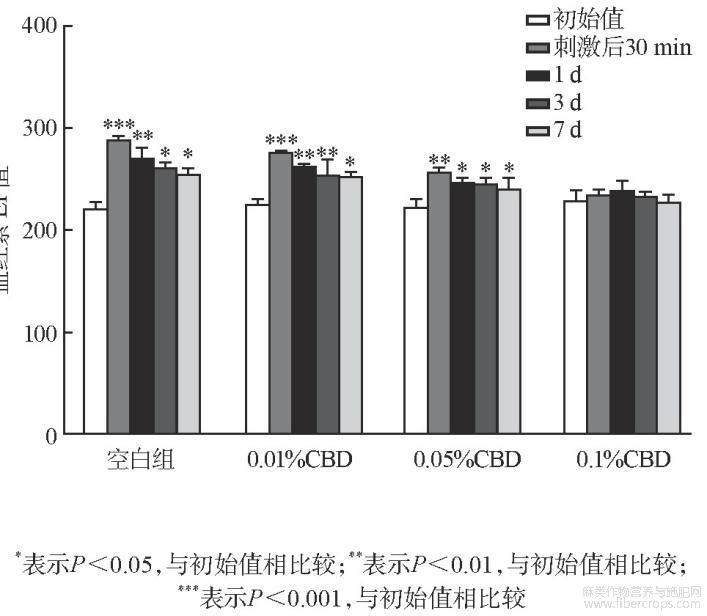
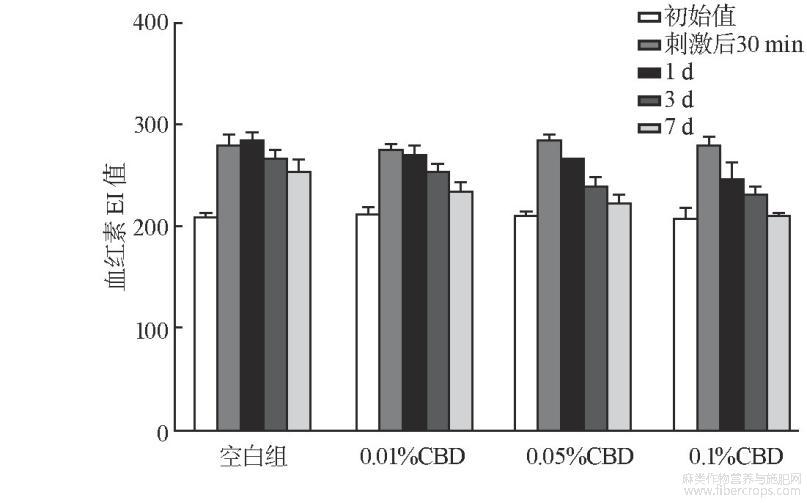
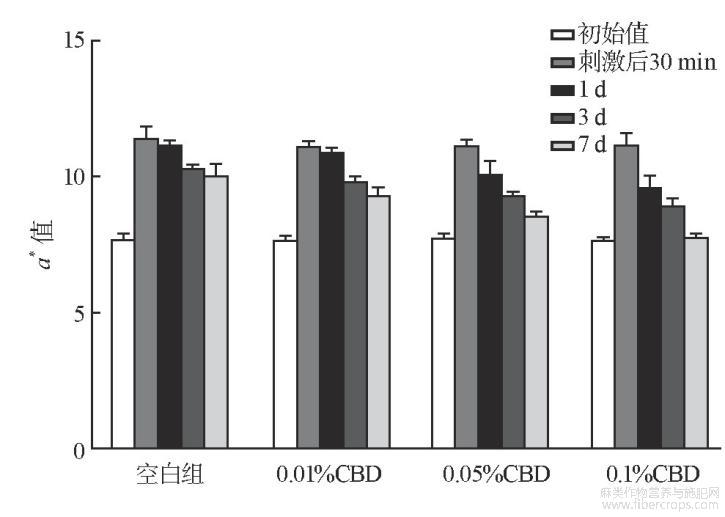
测试结果如图2~图4所列。CBD与SDS混合后,移走斑试器30min后,基质组以及低、中和高浓度组TEWL值、血红素EI值和皮肤红度a*值均有不同程度的上升,TEWL值分别为21.09、17.37、14.50、12.00(见图2),EI值分别为286、273、256、234(见图3),a*值为11.50、9.31、8.22、8.01(见图4),中、高浓度组TWEL值、EI值和a*值上升的幅度明显低于基质组,且第3、7天测试结果与初始值没有显著性差别。说明中、高浓度的CBD能够减少SDS带来的刺激性,能够很好地起到抗刺激作用。
图2 抗刺激试验TEWL值测定结果
图4 抗刺激试验皮肤红度结果
2.4.2舒缓刺激试验
先用质量分数1%SDS进行24h斑贴,随后分别涂抹不同浓度的CBD样品,分别在第1、3和7天对受试者进行回访,测试样品组区域的皮肤经皮水分流失TEWL值、血红素EI值、皮肤红度a*值的变化程度,评价其舒缓刺激功效。图5~图7分别列出了相应的试验结果。
2.5HET-CAM试验
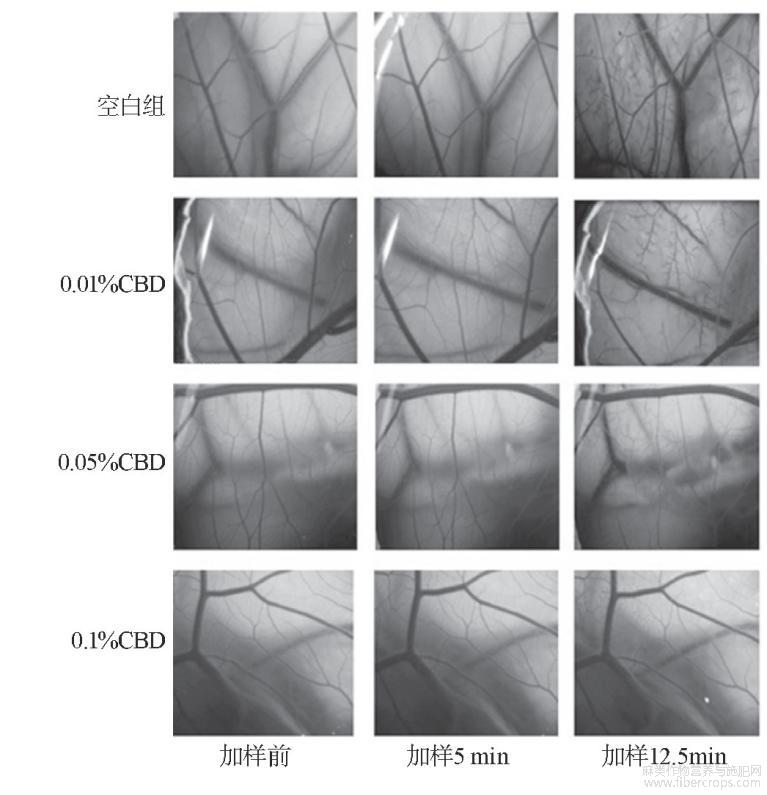
图8列出了HET-CAM刺激性评价试验结果。从图8的照片可明显看出,基质组添加质量分数0.9%NaCl溶液的鸡胚在5min内整个血管网形态结构及轮廓清晰,无出血、血管融解、凝血现象,添加质量分数1%SDS后,平均出血时间是16s,血管溶解时间是137s,没有凝血现象。小血管、中等血管出现出血和融解,出血现象被血管融解掩盖,无凝血现象,IS值为7.49,属于中度刺激性。
图3 抗刺激试验血红素测定结果
图5 舒缓刺激试验TEWL值测定结果
添加不同浓度CBD后,对SDS造成的刺激性症状有一定的缓解,质量分数0.01%CBD组IS值为5.24,而0.05%CBD组、0.1%CBD组IS值分别为3.95和2.58,由中度刺激缓解为轻度刺激,说明CBD具有一定的缓解刺激能力。
3结论
对因表面活性剂、机械损伤、防腐剂等所导致的肌肤刺激,包括肌肤的红肿、热胀、发麻和瘙痒,通过质量分数0.05%和1%CBD的作用,可以有效降低皮肤经皮水分流失,同时降低血红素值,减轻皮肤红度,从而实现良好的舒缓抗刺激功效。
图6 舒缓刺激试验的血红素EI值测定结果
图7 舒缓刺激试验的皮肤红度a*值测定结果
图8 HET-CAM刺激性评价试验结果
参考文献
[1]RUCH D G,TORKE B G,HESS B R,et al.The vascular flora and plant communities of the bennett wetland complex in henry county[J].Indiana Academy of Science,2009,118(1):51-56.
[2]QUINN H R,MATSUMOTO I,CALLAGHAN P D,et al.Adolescent rats find repeated delta(9)-THC less aversive than adult rats but display greater residual cognitive deficits and changes in hippocampal protein expression following exposure[J].Neuropsycho pharmacology,2008,33(5):1113-1126.
[3]AKOPIAN A N,RUPAREL N B,JEKE N A,et al.Role of ionotropic cannabinoid receptors inperipheral antinociception and antihyperalgesia[J].Trends Pharmacol Sci,2009,30:79-84.
[4]JHAVERI M D,SAGAR D R,ELMES S J R ,et al.Cannabinoid CB2 receptor-mediated anti-nociception in models of acute and chronic pain[J].Molecular Neurobiology,2007,36(1):26-35.
[5]SCHRADER N H B,DUIPMANS J C,MOLENBUUR B,et al.Combined tetrahydrocannabinol and cannabidiol to treat pain in epidermolysis bullosa:a report of three cases[J].British Journal of Dermatology,2019,180(4):922–924.
[6]ALMEIDA I F,PATRICIA Valentão,ANDRADE P B,et al. In vivo skin Irritation potential of a Castanea sativa(Chestnut)Leaf extract,a putative natural antioxidant for topical application[J].Basic & Clinical Pharmacology & Toxicology,2008,45:450- 458.
[7]GILLERON L,COECKE S,SYSMANS M,et al.Evaluation of a modified HET-CAM assay as a screening test for eye irritancy[J].Toxicology in Vitro,1996,10(4):1-446.
[8]HANS T,LINDBERG M,BENE B.Skin barrier disruption by sodium lauryl sulfate-exposure alters the expressions of involucrin, transglutaminase 1,profilaggrin, and kallikreins during the repair phase in human skin in vivo[J].Journal of Investigative Dermatology,2008,15:158-160.
[9]PERTWEE R G,ROSS R A,CRAIB S J,et al.Cannabidiol antagonizes cannabinoid receptor agonists and noradrenaline in the mouse vas deferens[J].European Journal of Pharmacology,2002,456(1):99-106.
[10]ELOSHLY M A,SLADE D.Chemical constituents of marijuana:The complexmixture of natural cannabionoids[J].Life sci,2005,78(5):539-548.
[11]MECHOULAM R,HANUS L,Cannabidiol:all overview of some chemical and phannacol ogical aspects Part I:chemical aspects[J].Chem Phys Lip,2002,121(1):35-43.
[12]MATSUDA L A,LOLAIT S J,BROWNSTEIN M J,et a1.Structure of a cannabinoid recept or and a functional expression of the cloned cDNA[J].Nature,1990,346(6284):561-564.
[13]MUNRO S,THOMAS K L,ABU-SHAA M,et a1.Molecular characterization of a peripheral recept or for cannabinoids[J].Nature,1993,365(6441):61-65.
[14]JUKNAT A,PIETR M,KOZELA E,et al.Differential transcriptional profiles mediated by exposure to the cannabinoids cannabidiol and Delta9-tetrahydrocannabinol in BV-2 microglial cells[J].Br J Pharmacol,2012,165(8):2512-2518.
[15]KLIGMAN A.Human models for characterizing ‘Sensitive Skin’[J].Cosm Derm,2001,14:15-19.
[16]GABARD B,CHATELAIN E,BIEDI E,et al.Surfactant irritation :in vitro corneosurfometry and in vivo bioengineering[J].Skin Res Technol,2011,7:49–55.
[17]DOGE N,AVETISYAN A,HADAM S,et al.Assessment of skin barrier function and biochemical changes of ex vivo human skin in response to physical and chemical barrier disruption[J].Eur J Pharm Biopharm,2017,116(7):138-148.
文章摘自 招敏聪,郭文姣,孙美娟,蔡慧珍,杨悬,贺锐.大麻二酚舒缓抗刺激功效的研究及应用[J].香料香精化妆品,2021(04):88-93+87.