作者:陈文涛等
来源:
发布时间:2021-10-13
Tag:
点击:
[麻进展]红麻HcMS1基因的克隆、表达与功能分析
摘 要:为挖掘红麻雄性不育核基因,解释红麻花蕾败育的分子机理,通过分析转录组数据,利用同源克隆的方法从红麻花药中克隆出拟南芥MALE STERILITY1(MS1)的同源不育基因,并命名为HcMS1基因。利用生物信息学方法对HcMS1蛋白进行结构、理化性质及亲缘关系等分析,并通过qRT-PCR分析HcMS1基因在红麻不育系、保持系不同时期的表达水平;构建过表达载体,利用叶盘法转化本氏烟草并对转基因烟草进行表型观察。HcMS1基因序列开放阅读框(ORF)为1 950bp,编码649个氨基酸。生物信息学分析显示,HcMS1蛋白为亲水蛋白,定位在细胞核上且含有典型PHD-finger结构域,没有信号肽和跨膜区结构,与陆地棉MS1蛋白亲缘关系最近,其次为木槿MS1蛋白。qRT-PCR结果表明,HcMS1基因的表达量在保持系和不育系中均呈现先上升、后下降的趋势,且在红麻花蕾的四分体至单核期表达量最高,这与拟南芥中MS1基因表达模式一致;另外在保持系中基因的表达水平显著高于不育系,推测红麻败育与HcMS1基因的低量表达相关。通过遗传转化试验发现,HcMS1转基因烟草株型较矮,花萼大小不一,花筒长度缩短,并出现自交不结实的现象,说明红麻HcMS1基因的异源表达有影响本氏烟草正常育性的功能。从红麻花药中成功克隆出核不育相关基因HcMS1,并对其进行功能分析,为后续红麻雄性不育育种工作提供了一定的理论依据与基础。
关键词:红麻雄性不育;HcMS1基因;生物信息学分析;表达分析;烟草转化
红麻(Hibiscus cannabinus L.)是锦葵科木槿属一年生纤维作物,具有抗旱、耐盐碱、适应性广、生物量大等特性,在造纸、纺织、建筑材料、复合材料、水土保持、吸附剂、饲料、栽培基质等方面有良好的应用价值,还可有效地缓解土壤重金属污染问题。
红麻有明显的杂种优势,杂交红麻的韧皮纤维或生物产量可提高40%左右。雄性不育是利用杂种优势的一条有效途径,利用细胞质雄性不育(Cytoplas-mic male sterility)构建三系配套进行杂交制种可以免去人工去雄,同时提高杂交种子的纯度。目前,国内关于红麻雄性不育分子机理的研究工作已陆续开展。赵艳红构建红麻线粒体atp9基因过表达载体转化烟草,发现在阳性植株出现叶形、株高、花冠性状异常且花药不正常的现象,另外对线粒体基因atp9、atp6和atpA的RNA编辑研究发现转变的氨基酸大多以非极性氨基酸取代极性氨基酸。史奇奇以红麻不育系UG93A和保持系UG93B花药为样品,分别建立smallRNA文库,并使用高通量测序技术鉴定42个保守miRNA和41个新的miRNA。韦范通过乙酰化蛋白质组学分析在UG93A和UG93B花药中鉴定到56个乙酰化修饰差异蛋白,并发现乙酰化正向调控GAPDH酶活力以及组蛋白乙酰化调控了细胞质雄性不育的发生。李增强等通过研究红麻不育系UG93A和保持系UG93B叶片和不同时期花药基因组DNA甲基化情况,发现甲基化变化的基因在不育系和保持系之间的表达差异显著,推测这些甲基化变化在雄性不育中发挥了重要的作用。钱景华、陈励虹等分别克隆红麻转录因子MYB21基因和编码生长素受体的TIR1基因,分析基因表达模式并构建了过表达载体和沉默载体。Chen等通过对红麻不育系、保持系的转录组测序检测到838个显著上调基因和528个显著下调基因,并将其注释到155个GO和74条KEGG代谢通路上。随着对红麻不育机理的研究增多,更多的不育基因得到挖掘,复杂的作用机制和调控网络逐渐清晰,将在红麻生产实践发挥重要的作用。
绒毡层参与花粉壁物质合成,为小孢子发育提供营养并适时地分泌胼胝质酶以释放小孢子,其在花药发育中发挥着重要的作用。DYT1-TDF1-AMS-MS188-MS1遗传途径被证实调控拟南芥绒毡层发育,其中DYT1、TDF1和AMS在绒毡层早期发育中起作用,而MS188和MS1在绒毡层晚期发育中起重要作用。MS1是MS188的直接靶点,在调控拟南芥孢子体花粉外壳蛋白基因的表达起关键作用。MS1在拟南芥中编码 PHD-finger蛋白,在四分体期的绒毡层中表达,其突变体不能产生有活力的花粉,花粉在四分体释放小孢子后不久退化,绒毡层也出现异常空泡化。本试验在前期红麻不育系LC0301A和保持系LC0301B的花药转录本中,发现一个显著差异表达的基因,其编码蛋白序列与澳洲棉MS1蛋白有90%一致性、与拟南芥MS1蛋白有50%一致性,命名其为HcMS1基因。通过同源克隆的方法获得了红麻HcMS1基因,利用生物信息学预测该基因编码蛋白的结构、保守域和亲缘进化关系等,通过qRT-PCR对红麻不育系、保持系不同时期的花药进行表达量分析,并构建过表达载体对本氏烟草进行遗传转化试验,以验证HcMS1基因可能在红麻不育中发挥一定的作用。
1材料和方法
1.1试验材料
1.1.1植物材料
试验所用红麻品种不育系LC0301A和保持系LC0301B由中国农业科学院麻类所一年生创新育种团队提供,种植于麻类所长沙创新试验基地。根据李建军等划分红麻花粉发育时期的标准,按照花蕾的大小分为4个时期:造孢细胞和小孢子母细胞至减数分裂时期为花蕾一期,四分体到单核期为花蕾二期,双核期为花蕾三期,花粉成熟期为花蕾四期;取各时期花药于-80℃冰箱保存。
1.1.2试剂、载体与菌株
TRIzol液,DNAaseI,反转录试剂盒,TaKaRa Ex Taq® DNA Polymerase,DNA回收试剂盒,pBLUE-T载体、Pcambia2301-ky过表达载体,T4DNA连接酶,各种相关限制性内切酶购于武汉金开瑞生物工程有限公司。SteadyPure植物RNA提取试剂盒,Evo M-MLV反转录试剂,SYBR Green qPCR试剂盒购于湖南艾科瑞生物工程有限公司。大肠杆菌感受态细胞DH5α,农杆菌菌株GV3101购于长沙天楚生物科技有限公司。
1.2试验方法
1.2.1总RNA提取及cDNA合成
以不育系LC0301A和保持系LC0301B的花药为材料,采用T-Izol法提取红麻总RNA,利用琼脂糖凝胶电泳检测RNA完整性;采用TOYOBO公司的逆转录试剂盒(Re-verTra Ace qPCR RT Kit)进行反转录合成cDNA以用于基因克隆。使用SteadyPure植物RNA提取试剂盒提取4个时期的不育系、保持系红麻花药RNA,使用EvoM-MLV反转录试剂合成cDNA用于qRT-PCR。
1.2.2红麻HcMS1基因的PCR扩增及克隆
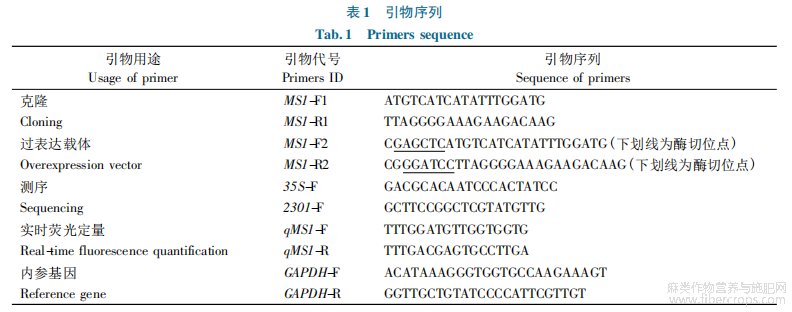
根据RNA-seq数据,分析鉴定红麻HcMS1基因转录本,利用NCBI(https://www.ncbi.nlm.nih.gov/orffind-er/)的Open Reading Frame Finder找出红麻HcMS1的开放阅读框。用此序列在Primer6.0软件中设计特异性克隆引物(表1),以红麻花蕾cDNA为模板,使用Taq酶扩增HcMS1基因的CDS序列,扩增程序:94℃预变性3min;94℃30s,55℃30s,72℃2min,30个循环;72℃延伸5min。PCR产物经1%琼脂糖凝胶电泳后回收目的条带连接到pBLUE-T载体,转化到大肠杆菌感受态DH5α中,37℃,100mg/L氨苄青霉素LB培养基上抗性筛选,挑取阳性克隆进行测序验证。
1.2.3生物信息学分析
Prot Param(https://web.expasy.org/protparam/)分析蛋白质理化性质ProtScale(https://web.expasy.org/protscal;www.cbs.dtu.dk/services/TMHMM/)分析蛋白质的跨膜结构域;SignalP-5.0Server(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白质是否含有信号肽;ProtComp9.0进行亚细胞定位进行分析;Inter-Pro(http://www.ebi.ac.uk/interpro/)分析蛋白质结构域;SOPMA分析和预测蛋白质的二级结构;Phyre2分析预测蛋白质的三级结构;MEGA7.0软件构建分子进化树。
1.2.4实时荧光定量
PCR根据HcMS1序列设计荧光定量引物(表1),以红麻GAPDH基因为内参基因(表1),以不同样品反转录cDNA为模板。反应体系为20μL,包含1μL模板,10μL2×SYBRPremix、10μmol/L上游引物和下游引物各0.4μL、灭菌水补足20μL。定量在BioRadCFX96qPCR仪进行,程序设置为:95℃预变性2min;95℃5s,60℃30s,40个循环后进行熔解曲线分析,以确定引物的特异性。基因相对表达量采用公式2-ΔΔCt计算,使用SPSS21进行单因素方差分析,利用Origin9进行绘图。
1.2.5HcMS1基因过表达载体构建和遗传转化
根据HcMS1基因的ORF序列信息,选用SacⅠ/BamHⅠ内切酶为酶切位点并设计扩增引物,引物序列为MS1-F2/R2(表1),以TA克隆为模板进行HcMS1基因的PCR扩增克隆。SacⅠ/BamHⅠ双酶切pcam-bia2301-ky载体和HcMS1目的基因,回收HcMS1片段和pcambia2301-ky载体,进行连接反应。反应产物转化大肠杆菌并在50mg/L卡那霉素(Kana)和50mg/L利福平(Rif)抗性平板上进行筛选,挑取单克隆菌落过夜摇菌并进行菌落PCR验证,将PCR阳性菌落提取质粒后进行测序,测序引物为35S-F/2301-F(表1)。将测序后比对成功的过表达载体质粒,采用冻融法转入GV3101农杆菌并在50mg/L卡那霉素和50mg/L利福平抗性平板上28℃进行筛选,挑取单克隆菌落180r/min过夜摇菌15h,加入等量60%甘油于-80℃超低温保存待用。
本氏烟草转化试验参考王会强叶盘法转化烟草的方法。切取无菌培养的烟草叶片预培养2d;农杆菌侵染液浓度(OD600)为0.5,侵染时间为5~8min;烟草叶片与农杆菌共培养最佳时间为2d。各时期培养基配方为:预培养、共培养培养基(MS+1mg/L6-BA+0.1mg/LNAA),分生培养基(MS+1mg/L6-BA+0.1mg/LNAA+50mg/LKana+500mg/LCef),生根培养基(MS+0.25mg/LNAA+50mg/LKana+500mg/LCef)。
2结果与分析
2.1HcMS1基因的克隆
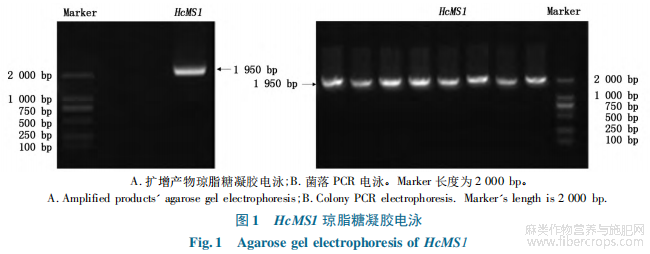
TRIzol法提取RNA后取500ng进行逆转录得到cDNA用于后续试验。以上述cDNA为模板扩增目的基因HcMS1,扩增产物琼脂糖凝胶电泳检测结果(图1-A),扩增产物与目的片段大小一致且无杂带。将扩增PCR产物切胶回收后克隆到T载体上,蓝白斑筛选后进行菌落PCR扩增,扩增产物琼脂糖凝胶电泳检测结果(图1-B)显示,在2 000bp处有明显的目的条带,且无特异性扩增。分别取2个菌落PCR检测为阳性的转化子进行测序验证,将测序结果与原始参考序列进行比对,HcMS1基因比对结果(图2)显示,测序结果和参考序列比对结果一致,克隆成功。
2.2HcMS1基因的生物信息学分析
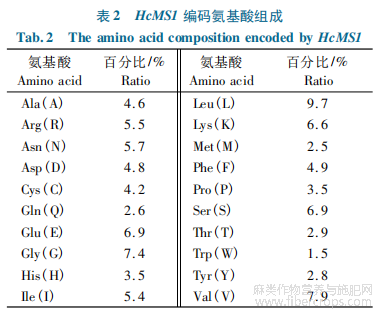
利用Prot Param网站,对红麻HcMS1基因编码蛋白的理化性质进行分析。结果显示:HcMS1基因序列开放阅读框(ORF)为1 950bp,共编码氨基酸数649,包含20种常见氨基酸(表2),原子总数10 279,分子量73.566 72ku,分子式为C3270H5118N910O938S43,由于含有43个硫原子,故蛋白中可能存在二硫键。带负电荷的残基总数(Asp+Glu)为76,带正电荷的残基总数(Arg+Lys)为79,理论pI为7.89。HcMS1蛋白的不稳定性指数为30.80,属于稳定蛋白质;脂肪指数为86.30,亲水性指数平均值(GRAVY)为-0.221,更偏向为亲水蛋白。
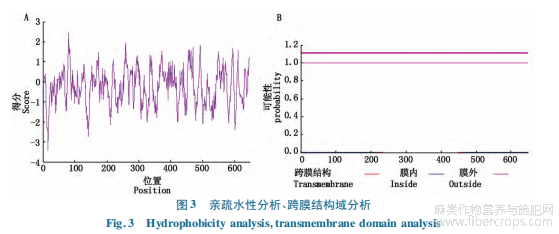
第16位氨基酸出现最低值-3.411,亲水性最强,在第80位氨基酸出现最高值2.444,疏水性最强。整体看疏水氨基酸和亲水氨基酸分布较均匀,偏向为亲水蛋白。利用TMHMM在线分析HcMS1蛋白跨膜结构域(图3-B),HcMS1蛋白没有跨膜结构域,推测为膜外蛋白。
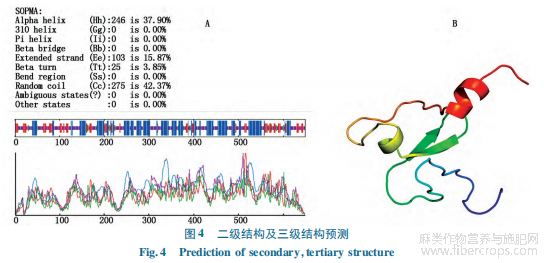
利用SOPMA预测HcMS1蛋白二级结构(图4-A),HcMS1蛋白由α-螺旋、延伸链、β转角和无规则卷曲组成,分别占整个肽链的37.90%,15.87%,3.85%,42.37%。利用Phyre2模拟HcMS1蛋白三级结构。建模过程中共搜索1 000条序列与目的蛋白序列进行比对,报告单按照置信度大小列出前120条序列模型,并以99.0%置信度,10%序列长度覆盖度的d1weea(FYVE/PHD zincfinger)蛋白为参考建立模型(图4-B)。
2.2.2信号肽、结构域、亚细胞定位分析
通过SignalP-5.0Server分析(图5-A),N端前70位氨基酸残基,存在信号肽的概率几乎为零,故推测Hc-MS1蛋白没有信号肽,属于非分泌蛋白。利用Inter-Pro在线分析(图5-B),HcMS1蛋白预测到多个结构域(591-641位Znf-PHD-finger、594-640位PHD、593-639位Znf-PHD),同源性超家族(590-644位Znf-FYVE-PHD、576-643位Znf-RING/FYVE/PHD)和保守序列(594-638位Zinc-finger-PHD-type-CS)。ProtComp9.0分析HcMS1蛋白亚细胞定位于细胞核。
2.2.3进化树分析
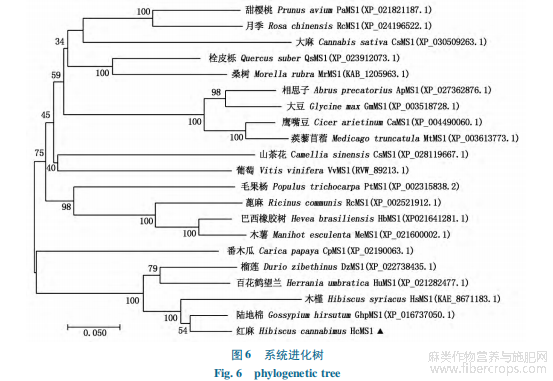
在NCBI的BlastP中输入HcMS1蛋白序列,在non-redundant protein sequences库中搜索,获得多个物种的同源蛋白并下载靠前的20个物种MS1蛋白序列,其中包括:陆地棉(Gos-sypium hirsutum)、榴莲(Durio zibethinus)、木槿(Hi-biscus syriacus)、百花鹤望兰(Herrania umbratica)、栓皮栎(Quercus suber)、蓖麻(Ricinus communis)、巴西橡胶树(Hevea brasiliensis)、番木瓜(Carica papaya)、毛果杨(Populus trichocarpa)、山茶花(Camelliasinensis)、桑树(Morella rubra)、木薯(Manihot escu-lenta)、大麻(Cannabis sativa)、甜樱桃(Prunus avi-um)、葡萄(Vitis vinifera)、相思子(Abrus precatori-us)、鹰嘴豆(Cicer arietinum)、月季(Rosa chinensis)、蒺藜苜蓿(Medicago truncatula)、大豆(Glycinemax)。利用MEGA7.0软件,采用邻近法构建系统进化树。分析构建结果(图6),其中陆地棉MS1蛋白与红麻HcMS1蛋白进化关系最近,其次为木槿。
2.3HcMS1表达模式分析
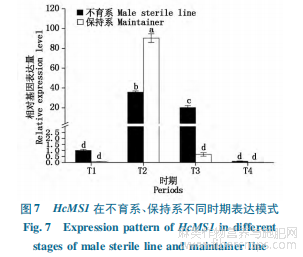
不同时期HcMS1表达模式分析显示(图7),在不育系和保持系的红麻花药中,HcMS1的表达随着花蕾的发育均呈现先升高、后下降的趋势,其在二期表达量最高,其次是三期,在四期的表达量最低,相对表达量仅为0.1,0.01。比较不育系与保持系发现,保持系二期相对表达量为90.35,是不育系二期表达量的2.5倍,在P值0.05水平下呈现显著差异。在保持系中,HcMS1于二期表达量超高,而在其他时期均为极低的表达水平,这与拟南芥MS1仅在小孢子释放期表达事实相吻合;相比保持系,不育系HcMS1表达周期较长,在二期、三期均有相对较高的表达量,且在一期、四期表达水平均高于保持系。
2.4HcMS1基因过表达载体构建和烟草转化
2.4.1过表达载体构建
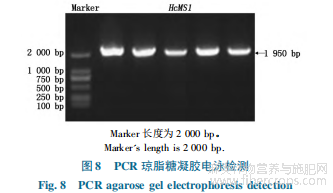
将转化的大肠杆菌进行PCR扩增,琼脂糖凝胶电泳结果显示,在2000bp处有明显目的条带(图8)。取PCR阳性菌落提取质粒后进行测序,比对结果显示目的基因序列与参考序列一致,表示过表达载体构建成功(图9)。
2.4.2遗传转化
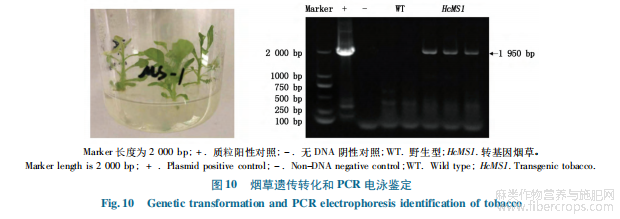
图中培养基无污染、苗状态健康(图10-A)。将生根的烟草组培苗经炼苗后移植到灭菌土中继续培养,提取野生型烟草和转化烟草的新鲜叶片DNA,使用测序引物35S-F/2301-F(表1)进行PCR扩增片段,电泳后对比野生型发现转化烟草在2000bp处有目的条带,证明HcMS1转化成功(图10-B),对烟草成熟期观察发现:野生型烟草株型较高,可以正常结实,6片花萼大小均匀,花柱较长,果实大且饱满;而转基因烟草株型较矮,无法正常结实,6片花萼大小不一,花柱短小,两者对比有明显的差异(图11)。表明通过叶盘法转化获得的HcMS1过表达转基因本氏烟草无法正常自交结实,存在不育现象。
3讨论与结论
红麻不育机理研究目前主要在细胞生物学、分子生物学方面开展工作。在细胞生物学方面,主要通过研究花药不同发育时期绒毡层和各组织化学成分变化,来确定花S药败育时期。大量研究表明,花药绒毡层发育异常是花粉败育的重要细胞学原因。朱丽梅等对红麻细胞质雄性不育系L23A和K03A的小孢子败育过程进行了细胞学观察,发现其败育发生在四分体及单核小孢子时期。一年生麻类作物创新团队在前期已通过对不育系LC0301A和保持系LC0301B不同时期的花药细胞学观察发现,不育系发生败育的主要时期为单核期,单核期不育系的绒毡层退化严重,小孢子出现畸形,不能形成正常的花粉粒。
MS1基因编码PHD转录因子并参与调控花粉和绒毡层发育。目前MS1基因的功能在拟南芥中研究比较详细,水稻、小麦等其他作物也相继开展MS1基因的挖掘与分析工作。关于拟南芥的MS1基因的研究,早在21世纪初始便积极展开。Wilson等在2001年报道:拟南芥MS1突变体的花粉在四分体释放小孢子后不久即发生退化,绒毡层也出现空泡化;MS1在小孢子释放期的绒毡层部位低水平表达,缺失基因会导致其编码蛋白的提前终止和PHD-finger基序的丢失。Ito等通过转座子敲除拟南芥MS1基因,小孢子在四分体中分离出来即发生外层缺失;MS1基因仅在四分体的很短时期内于绒毡层表达,并将MS1定位在细胞核上。2007年,Ito等通过构建MS1-SRDX融合结构转化拟南芥揭示了MS1具有转录激活因子的功能,参与花粉外壁、花粉胞质和绒毡层的发育。2006年,Vizcay-Barrena等通过TUNEL染色和超微结构分析,野生型绒毡层在小孢子有丝分裂Ⅰ后发生程序性细胞死亡(PCD),而MS1突变体的绒毡层中未观察到PCD的迹象。随着人们认识到MS1基因对调控拟南芥雄性不育的重要性,该基因的挖掘开发也在别的作物上相继展开。2011年,Li等在水稻中的报道了一个拟南芥MS1同源基因PTC1,该基因编码PHD-finger蛋白,控制绒毡层程序化发育和功能性花粉的形成,其突变体的绒毡层发生增殖失控和坏死样死亡。2017年,Wang等在小麦中克隆并鉴定MS1基因,其在小孢子母细胞中特异性表达,编码的蛋白定位于质体和线粒体膜,具有磷脂酶结合活性;Tucker等发现小麦ms1可完全恢复了ms1d突变体的育性,编码一种花粉外壁发育所必需的糖基磷脂酰肌醇锚定的脂质转移蛋白。本试验从红麻不育系和保持系的花药中克隆出一个与拟南芥MS1基因相似度较大的同源基因HcMS1,前期通过细胞生物学的手段发现导致不育系花粉败育的原因在于绒毡层PCD异常,绒毡层退化严重且提前,这与拟南芥中报道的MS1调控绒毡层PCD发育相似;同时通过qRT-PCR发现HcMS1花蕾二期的表达量在保持系中显著高于不育系,且在保持系中该基因几乎只在花蕾二期高度表达,这又与拟南芥MS1表达模式相符合,另外相比保持系,不育系在较长时间都保持着较高水平的表达,推测HcMS1表达时期的紊乱也可能是导致红麻不育的原因之一。综合以上,推测HcMS1基因在调控红麻雄性不育的过程中亦发挥着一定的作用。
唐文武等以拟南芥花粉发育关键基因MS1为参考序列,通过Blast比对获得芸薹属作物同源基因序列,运用生物信息学方法对其编码氨基酸序列进行预测分析,为作物杂种优势利用提供理论参考。高嵩等同源克隆玉米ZmUdtl基因并利用生物信息学分析预测蛋白性质、结构等,为后期的克隆和功能鉴定奠定基础。为了预测HcMS1基因的结构功能,挖掘基因潜在信息,本试验通过生物信息学方法对HcMS1蛋白进行预测分析。结果显示,该蛋白为亲水蛋白,没有信号肽和跨膜结构,存在典型的PHD-finger结构域,该结构域广泛存在于雄性不育基因MS1编码蛋白中;其亚细胞定位在细胞核上,推断HcMS1蛋白可能作为转录因子,作用于细胞核上,调控与育性相关的基因表达。进化树分析结果显示,红麻HcMS1蛋白与陆地棉MS1蛋白亲缘关系最近。
烟草作为一种模式植物,其转基因体系已相当成熟,目前有很多在烟草上进行异源表达的研究,且大都获得了与研究目的有关联的价值性状。试验通过本氏烟草遗传转化发现,35S强启动子过表达HcMS1基因在阳性转基因烟草中表现为植株矮化、花萼变小且大小不均、花柱缩短、无法结实,说明过表达HcMS1基因有影响本氏烟草正常育性的功能,为验证HcMS1是调控红麻雄性不育的关键基因提供了有力的支撑。总之,本研究利用同源克隆方法在红麻花药中克隆出HcMS1基因,通过生物信息学分析发现HcMS1蛋白有显著的PHD结构保守域,其亚细胞定位于细胞核上,很有可能以转录因子的形式调控育性基因的表达。此外,qRT-PCR结果显示,HcMS1基因在红麻保持系花蕾的四分体至单核期高量表达,符合拟南芥MS1基因表达模式。最后,通过本氏烟草遗传转化试验,在获得的HcMS1过表达本氏烟草上发现了显著的不结实现象。本研究克隆出红麻HcMS1基因,并结合生物信息学、基因表达和烟草转化对其进行分析,为挖掘红麻不育调控基因提供了一定信息资源,为日后该基因的深度功能解析做好了铺垫。
文章摘自 陈文涛,潘根,唐慧娟,常丽,李德芳,赵立宁,陈安国,李建军.红麻HcMS1基因的克隆、表达与功能分析[J].华北农学报,2021,36(04):64-74.
更多阅读
Copyright by Ramie Research Institute of Hunan Agricultural University
湖南农业大学农学院/苎麻研究所 版权所有 2009-2016 湘ICP备10006838号-1