摘 要:研究储存时间、温度等条件对罗布麻叶黄酮类成分稳定性的影响,为提取和贮存提供科学依据。方法通过紫外分光光度法测定在光照、储存时间、温度、pH、氧化物、还原物、金属离子及食品添加剂各条件下总黄酮的吸光度值,分析各条件对总黄酮稳定性的影响。结果总黄酮在避光下,贮藏10天无明显变化;60℃~80℃温度提取较完全并在弱酸条件下稳定;H2O2、蔗糖、苯甲酸对罗布麻叶中总黄酮稳定性无影响;Na2SO3、柠檬酸、抗坏血酸可能会破坏黄酮结构影响稳定性;当罗布麻叶黄酮类成分遇到Fe3+时会不稳定。结论罗布麻叶黄酮类成分在提取和贮藏过程中,避免接触过碱性物质、Na2SO3和铁类容器,食品添加剂可选择蔗糖。
关键词:罗布麻叶;黄酮;稳定性;紫外分光光度
罗布麻叶来源于夹竹桃科植物罗布麻Apocynum venetum L.的干燥叶,又名野麻、野茶等,是一味药食同源中药,具有平肝阳、安心神、清热利尿之功效。研究发现,罗布麻叶主要活性成分为黄酮类化合物,具有降血压、抗氧化、抗抑郁、抗焦虑和降低胆固醇等多种药理活性[1]。作为盐生植物,罗布麻主要分布于滩涂湿地及河流湖泊沿岸的黄河三角洲一带,是该地区典型的具有较高经济价值的药用盐生植物资源。
近年来,许多学者对不同中药、食品中黄酮类化合物的稳定性开始研究。稳定性研究作为药品质量控制研究的主要内容之一,其与药品的质量研究及质量标准的建立有着密切的联系,并且具有持久性特点,在药物临床研究期间和上市后,需要继续进行稳定性相关考察。因此,对罗布麻中黄酮类物质稳定性开展研究,一方面可以提高黄酮类有效成分的利用率,另一方面也会为后期药材提取及储存提供科学参考。
1 材料与方法
1.1 材料与试剂
罗布麻叶,购于通化医药大厦,经秦汝兰副教授鉴定为罗布麻正品;乙醇、盐酸、亚硫酸钠、蔗糖、氯化钠、氯化钾、氯化镁、氯化铝、氯化铁、硝酸铝、双氧水、亚硝酸钠、氢氧化钠、抗坏血酸、苯甲酸钠、柠檬酸,分析纯,均购于天津市康科德科技有限公司。
1.2 仪器与设备
电子天平(FA1004,上海友声衡器有限公司);超声仪器(KQ5200DE,昆山市超声仪器有限公司);酸度计(pHS-25,广州力辰邦西仪器科技有限公司);紫外可见分光光度计(UV-1200,广州精科仪器有限公司)。
1.3 实验方法
1.3.1 罗布麻叶总黄酮的提取方法
罗布麻叶粉碎至粉末,过三号筛。取约为0.5g的粉末,称重,放入具塞的100mL锥形瓶中,再精密加入50%甲醇50mL,称重并记录数据,超声40min,冷却后补足重量。弃去前几滴滤液,取续滤液,即为黄酮粗提取液,待用[2]。
1.3.2 罗布麻叶总黄酮的检测方法
用移液管吸取0.3mL黄酮粗提液加入干燥洁净的2mL容量瓶中,并用70%乙醇定容。再将定容后的2mL溶液移至干燥洁净的试管中,加入0.3mL的5%NaNO2,摇匀,静置充分反应6min,再加入0.3mL的10%Al(NO3)3,摇匀,静置充分反应6min,最后加入3mL10%NaOH,摇匀,充分反应15min后取适量液体至比色皿中,放入已校准基线的紫外分光光度计中,在510nm处的波长下测量吸光度值,记录数据[3]。
1.3.3 罗布麻叶总黄酮的稳定性影响因素考察
1.3.3.1 以光照为实验影响因素
取干燥洁净的试管,并标记为光照组和避光组,之后向其中加入等量总黄酮粗提液,光照组置于阳光下开始光照,避光组放置在阴暗避光条件下,每隔1h开始取样(实验时间5h,共取样5次),使用紫外分光光度计测定样品吸光度值,记录数值,整理并绘图[4,5]。
1.3.3.2 以储存时间为实验影响因素
按“1.3.1”项下方法制备样品溶液并置于冰箱中冷藏保存10天,每天取粗提液少许,按“1.3.2”项下方法测定粗提液中总黄酮的吸光度值,记录数值,整理并绘图[6]。
1.3.3.3 以温度为影响因素
取0.5g罗布麻叶粉末5份,按“1.3.1”项下方法在20℃~100℃5个不同温度下制备样品溶液,按“1.3.2”项下方法测定粗提液中总黄酮的吸光度值,记录数值,整理并绘图[7]。
1.3.3.4 以pH值为影响因素
用稀释后的酸、碱试剂配置1~12个不同pH值的蒸馏水,再向不同pH值蒸馏水中加入等量的总黄酮粗提液,将12支试管置于室温下静置0.5h,然后各取0.3mL作为待测液,按检测方法测定吸光度值,记录数值,整理并绘图[8]。
1.3.3.5 以氧化物为影响因素
为保证安全,H2O2的浓度在食品中用量限制在2%以内,因此,以30%的H2O2配制浓度梯度为0.2%~1.6%的8组含相同浓度总黄酮粗提液的H2O2溶液。摇匀后静置0.5h,依据总黄酮检测方法开始检测,记录数值,整理并绘图,以70%的H2O2为空白试剂[9,10]。
1.3.3.6 以还原物为影响因素
为保证安全,Na2SO3的浓度在食品中的用量限制在0.05%以内,因此,该实验配制等浓度梯度的6组Na2SO3溶液(0%~0.05%),且各组加入等浓度总黄酮粗提液,摇匀后在室温下静置0.5h,依据总黄酮检测方法开始检测,记录数值,整理并绘图[11]。
1.3.3.7 以金属离子为影响因素
分别取含K+、Na+、Mg2+、Al3+、Fe3+5种不同的金属离子试剂,向总黄酮粗提取液中加入配制完成的不同质量分数的金属离子试剂,其浓度梯度设置为0.01%、0.02%、0.03%、0.04%、0.05%,各浓度下金属离子溶液静置0.5h,再依据总黄酮检测方法开始检测,记录数值,整理并绘图[13]。
1.3.3.8 以食品添加剂为影响因素
取蔗糖、抗坏血酸、柠檬酸食品添加剂及苯甲酸钠防腐剂,向总黄酮粗提液中分别加入上述不同质量分数的4种食品添加剂,其浓度梯度设置为0、0.05%、0.1%、0.15%、0.2%、0.25%,各浓度下的溶液静置0.5h,按总黄酮检测方法开始检测,记录数值,整理并绘图[13]。
2 结果与分析
2.1 光照条件对罗布麻叶总黄酮稳定性的影响
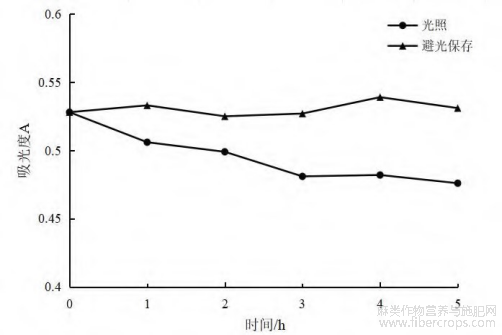
图1 光照和避光条件下总黄酮吸光度值变化
由图1可知,在光照环境下,粗提液中总黄酮吸光度值有降低趋势,并且光照条件下的总黄酮吸光度值均低于避光保存下总黄酮吸光度值,其原因可能是光照环境会促进黄酮类化合物发生降解或氧化,稳定性变差。因此,为保证罗布麻叶黄酮的稳定存放,建议在贮存时避免阳光直晒[14]。
2.2 储存时间对罗布麻叶总黄酮稳定性影响
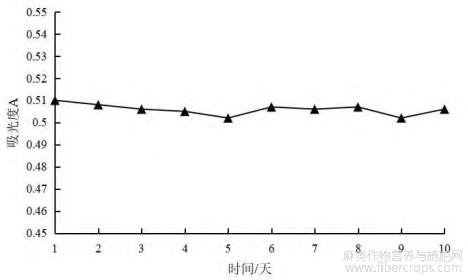
图2 不同储存时间总黄酮吸光度值
从图2可以看出,总黄酮吸光度值在储存10天内无明显变化,但为了避免黄酮类化合物由于储存时间过久而发生分解或转化,建议实验过程中随配随用,不宜放置时间较长[15]。
2.3 不同温度对罗布麻叶总黄酮稳定性影响
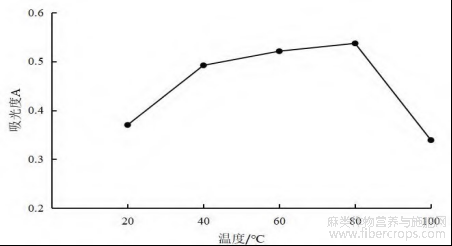
图3 不同温度总黄酮吸光度值
图3表明,不同温度对总黄酮吸光度值影响较明显,提取温度为20℃时,总黄酮吸光度值较低,可能在此温度下,药材中的黄酮类物质未完全从细胞壁中溶出,随着提取温度的升高,总黄酮吸光度值不断上升且80℃时总黄酮吸光度值最高,说明此温度下药材中的黄酮类物质提取最完全,当温度不断上升时总黄酮吸光度值迅速降低,其原因可能为高温时黄酮类化合物不稳定,结构发生变化。因此,罗布麻叶总黄酮在提取时,温度宜在80℃时进行,温度过低或过高都会对提取效率产生影响[16,17]。
2.4 不同pH值对罗布麻叶总黄酮稳定性影响
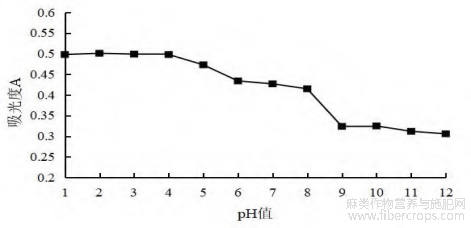
图4 不同pH值总黄酮吸光度值
由图4可知,当pH≤4.0时,即溶液处于酸性条件下黄酮类成分较稳定,随着溶液pH增大,总黄酮吸光度值开始降低,其原因可能是黄酮类化合物结构中含有酚羟基呈现酸性,在酸性溶液条件下结构更稳定,随pH上升黄酮类化合物结构变得不稳定,当pH≥8时,吸光度值降低幅度最明显,这也说明在碱性环境下罗布麻叶中的黄酮类成分破坏最严重。因此,在提取或储存过程中应避免碱性条件[18]。
2.5 不同浓度氧化物对罗布麻叶总黄酮稳定性影响
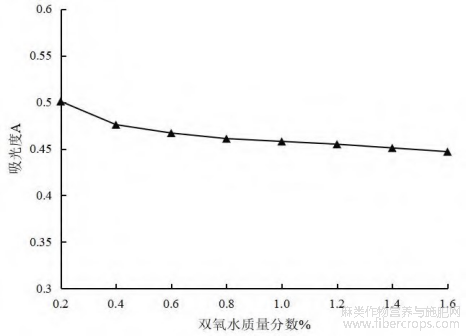
图5 不同浓度的氧化物总黄酮吸光度值
由图5可知,随着氧化剂双氧水浓度的增加,总黄酮的吸光度值也随之降低,但当双氧水浓度不断增加时,总黄酮的吸光值降低不明显,说明黄酮类化合物的结构基本不受双氧水浓度的影响,这也进一步表明了罗布麻叶黄酮类成分具备较好的抗氧化作用。
2.6 不同浓度还原剂对罗布麻叶总黄酮稳定性影响
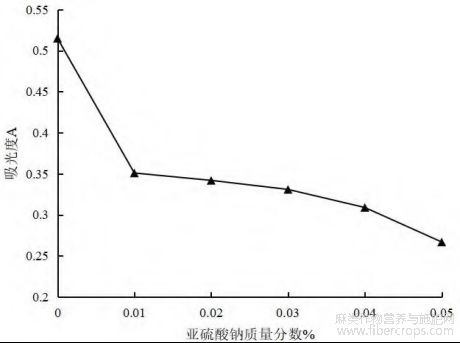
图6 不同浓度的还原物总黄酮吸光度值
图6表明,还原剂Na2SO3的加入对罗布麻叶中黄酮类成分破坏较严重,总黄酮吸光度值急剧下降,且随着还原物质量分数增加,总黄酮吸光度值越低。表明Na2SO3对罗布麻叶黄酮稳定性有很大的影响,因此罗布麻叶中黄酮成分在生产、储存过程中都要避免与还原剂接触[19]。
2.7 不同浓度5种金属离子对罗布麻叶总黄酮稳定性影响
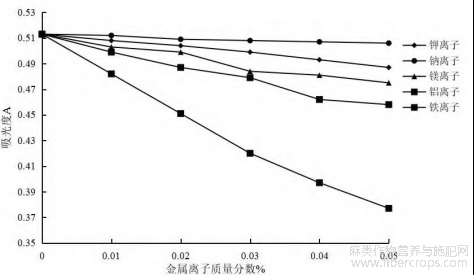
图7 不同质量分数金属离子总黄酮吸光度值
图7显示,随着5种金属离子质量浓度的增加,Na+、K+、Mg2+、Al3+离子对总黄酮吸光度值基本没有影响,表明这些金属离子对黄酮类成分的稳定性影响不大,当实验中添加了Fe3+金属离子时,提取液中出现大量沉淀其吸光度迅速降低。推测其主要原因可能是由于Fe3+为过渡金属离子,并且过渡金属离子是许多自由基产生的诱导剂,催化脂质过氧化的产生。然而黄酮类成分作为一种天然抗氧化剂,通过螯合金属离子能够起到较好的抗氧化作用。通过构效关系研究发现Fe3+能与黄酮化合物结构中的邻二酚羟基官能团结合,形成不溶性络合物。因此,Fe3+对罗布麻叶中黄酮类物质稳定性影响最大,在提取和贮存黄酮成分时尽量避免铁质容器[20-22]。
2.8 不同食品添加剂对罗布麻叶总黄酮稳定性影响
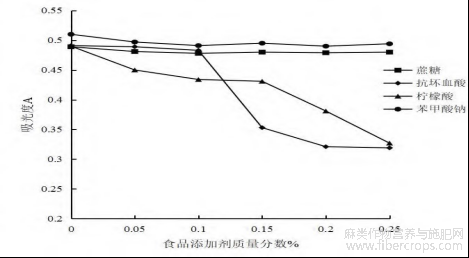
图8 不同食品添加剂总黄酮吸光度值
图8所示为4种添加剂对总黄酮吸光度值的影响,不同浓度苯甲酸钠的加入对总黄酮的稳定性影响不明显,波动很小;蔗糖的加入与苯甲酸钠加入后对总黄酮的稳定性影响相同,未有明显变化;抗坏血酸加入后,当质量分数低于0.10%时,影响不明显,但质量分数高于0.10%时,总黄酮吸光度值下降趋势明显,推测原因可能是抗坏血酸对黄酮类成分起到双重作用。浓度低时,对黄酮类成分起到稳定作用,但浓度高时,则会破坏黄酮类的结构,导致黄酮成分降解;柠檬酸的加入对黄酮成分有增色效应,在低浓度时现象不明显,当柠檬酸浓度高于0.15%时,增色效应越明显,总黄酮吸光度值呈现快速下降趋势,这也进一步表明当柠檬酸浓度过高时,黄酮成分稳定性较差。因此,不同调味剂在中药中应适量添加,过量则会对罗布麻叶中黄酮类成分起到反作用[23]。
3 结论与讨论
本文利用超声法提取罗布麻叶中总黄酮,并通过紫外分光光度法测定各种实验条件下总黄酮的吸光度值,探讨储存时间、温度等条件对黄酮类成分稳定性的影响。结果显示,罗布麻叶中黄酮类成分在提取、储存过程中应放置在阴凉避光处,尽量避免接触碱性物质、Na2SO3和铁类器皿,食品添加剂蔗糖及防腐剂苯甲酸钠的加入,对黄酮类化合物稳定性几乎没有影响,但抗坏血酸及柠檬酸的使用要注意浓度[24],本文为罗布麻叶黄酮类成分的开发利用提供了参考和科学依据。
参考文献
[1]陈小露,刘起棠,张洁帅,等.罗布麻叶的化学成分及药理作用研究进展 [J]. 时珍国医国药 ,2022,33(11):2739-2742.
[2]朱嘉杰,林捷,刘军,等.慈竹总黄酮提取工艺优化及抗氧化活性分析 [J]. 食品科技,2024,49(10):247-256.
[3]竹娟,王译晗,陈立莉,等.芍药花提取物中黄酮的测定及其体外抗氧化和降脂活性研究[J].天然产物研究与开发,2024,36(11):1838-1844+1899.
[4]冯靖,彭效明,李翠清,等.银杏叶黄酮的抗氧化性及其稳定性研究 [J]. 食品科技,2019,44(04):244-249.
[5]何思宜,蒋新元,杨迎舟,等.莓茶叶黄酮的抗氧化活性及其稳定性 [J]. 现代食品科技,2024,40(07):177-183.
[6]黄佳婷,余美珍,陈虹,等.枇杷花黄酮纳米颗粒的制备工艺优化及其稳定性研究[J].食品工业科技,2024,45(15):223-232.
[7]张瑞博,闫小娟,张海悦.基于星点设计-响应面法研制黄精益智仁复合固体饮料及抗疲劳作用研究[J].中国食品添加剂,2024,35(11):153-161.
[8]黄琼,谢向机,林嘉丽,等.洛神花总黄酮提取工艺及其稳定性研究[J].保鲜与加工,2021,21(02):102-108.
[9]庞振国,崔炳群.葛根皮中总黄酮的提取工艺及其稳定性研究[J].食品科技,2009,34(4):210-213.
[10]官德莲.党参黄酮的稳定性研究[J].食品安全导刊,2018,(33):158.
[11]刘尧,谢嘉馨,王磊.稻壳中总黄酮的提取工艺及其稳定性研究[J].粮食与油脂,2019,32(5):7-10.
[12]吴春,孟雪.玉米苞叶总黄酮的抑菌效应及抑菌稳定性研究[J].哈尔滨商业大学学报,2018,34(2):221-224.
[13]周婧琦,秦令祥,崔胜文,等.秋葵黄酮的稳定性研究[J].农产品加工,2021,(05):32-34+39.
[14]何洁钰,李敬芬.无刺枸骨果实总黄酮的提取及稳定性研究 [J]. 湖州职业技术学院学报 ,2018,16(1):84-87.
[15]王磊,刘长姣,吴婕.黑米中黄酮类化合物的稳定性分析[J].食品研究与开发,2018,39(3):14-17.
[16]葛水莲,陈建中,刘娜.太行菊总黄酮抗氧化活性及稳定性研究[J].食品科技,2019,44(10):241-245.
[17]李可心,张玉,周冉冉,等.麻城黄金菊总黄酮提取工艺优化及稳定性分析 [J]. 酿酒,2021,48(03):44-50.
[18]吴玲.生姜中总黄酮的提取工艺及稳定性研究[J].中国调味品,2017,42(12):71-74.
[19]欧秋月,李瑞源,何丽芳,等.龙须草根部总黄酮抑菌作用及稳定性研究[J].现代食品,2022,28(01):192-196.
[20]张兆英,赵慧慧,张宇航,等.金丝小枣中黄酮抗氧化性和稳定性的研究 [J]. 中国园艺文摘,2018,(2):56-57.
[21]郑丽,李和生,金洋,等.黄秋葵黄酮的稳定性研究[J].中国蔬菜,2017,(8):67-71.
[22]段宙位,方宗壮,何艾,等.沉香叶黄酮稳定性及对 H2O2 诱导 HepG2 细胞氧化损伤的保护作用[J].热带作物学报,2021,42(06):1661-1667.
[23]倪良旭,孙艳辉,苗文娟.滁菊茶汤中黄酮类化合物稳定性研究 [J]. 滁州学院学报,2016,2(18):80-84.
[24]何莉萍,严碧云,黄亚,等.荷叶总黄酮稳定性的研究[J].粮食与油脂,2017,30(2):80-82.
文章摘自:王爽,王欣雨,吕重宁,等.罗布麻叶中黄酮的稳定性研究[J].人参研究,2025,37(01):47-51.