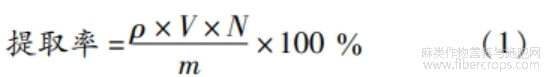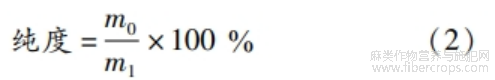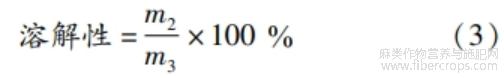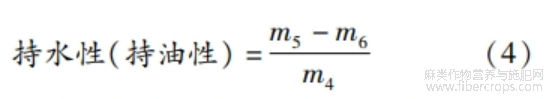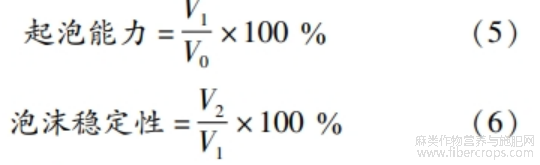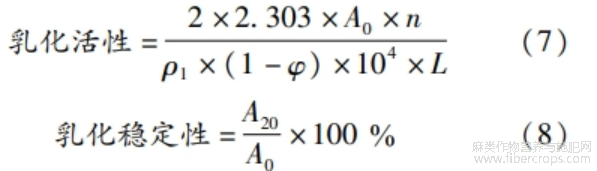摘 要: 以亚麻籽全籽和亚麻籽饼为原料,采用超声-碱溶工艺提取蛋白质。以蛋白质提取率为指标,在单因素试验的基础上通过响应面法优化提取工艺,并对2种蛋白质品质进行对比分析。结果表明:亚麻籽全籽蛋白最佳提取工艺为超声时间60min、超声功率400W、超声温度45℃,在此条件下亚麻籽全籽蛋白的提取率为53.47%;亚麻籽饼蛋白最佳提取工艺为超声时间60min、超声功率480W、超声温度40℃,在此条件下亚麻籽饼蛋白的提取率为56.47%。亚麻籽全籽蛋白的纯度和表面疏水性指数均显著高于亚麻籽饼蛋白(P<0.05),2种亚麻籽蛋白的必需氨基酸含量均占总氨基酸含量的40%以上。亚麻籽饼蛋白较亚麻籽全籽蛋白二级构象更稳定、更有序。亚麻籽全籽蛋白具备较高的泡沫稳定性、持油性、起泡能力、乳化活性和乳化稳定性,而亚麻籽饼蛋白具有较高的溶解性和持水性。
关键词:亚麻籽全籽蛋白;亚麻籽饼蛋白;超声-碱溶提取;品质分析
?
亚麻籽外形小而扁平,其颜色呈现金黄色或者红棕色,质地酥脆,呈坚果味,在食品和纺织纤维领域中的应用已有5000多年历史[1]。亚麻籽全籽(flaxseed whole seed, FW)主要由脂肪(30%~40%)、膳食纤维(20%~25%)和蛋白质(18%~30%)等组成[2]。亚麻籽饼(flaxseed cake, FC)为亚麻籽经机械压榨去油后得到的副产物。亚麻籽饼中蛋白质含量为35%~40%,其氨基酸组成及营养价值与大豆蛋白相似,具有高持油性、起泡性、乳化活性和良好的热稳定性[3-4],但其大都作为动物饲料,造成植物蛋白资源的浪费。因此,加大对亚麻籽蛋白资源的利用具有积极的意义。
目前,碱溶酸沉法是提取亚麻籽蛋白的常见工艺,但该法提取率较低[5]。超声辅助技术通过超声波机械作用促进细胞中蛋白质溶出,提取效率较高。目前鲜少有关于FC和FW蛋白的系统性对比研究。因此,本文通过超声-碱溶法分别从FW和FC中提取亚麻籽蛋白,对其提取工艺进行优化,并对2种亚麻籽蛋白产品品质进行对比分析,以期为亚麻籽全籽和亚麻籽饼充分利用提供参考。
1 材料与方法
1.1 材料与试剂
亚麻籽,产自青海海东;无水乙醇、氢氧化钠、盐酸、磷酸二氢钾、石油醚(30~60℃)、8-苯胺-1-萘磺酸(ANS)、考马斯亮蓝G-250、十二烷基硫酸钠(SDS),分析纯;牛血清白蛋白标准品(纯度≥96%),上海源叶生物科技有限公司。
1.2 仪器与设备
SOX406脂肪测定仪、K9840凯式定氮仪,山东海能科学仪器有限公司;RF-530荧光分光光度仪、UV-1780紫外-可见分光光度计、Nicolet-6700傅里叶红外光谱仪,岛津仪器有限公司;JSM-6610LV电镜扫描仪,日本Hitachi公司;FJ300-SH数显高速分散均质机,上海标本模型厂;XZ-YZ200液压榨油机,广州旭众食品机械有限公司。
1.3 实验方法
1.3.1 亚麻籽全籽粉和亚麻籽饼粉的制备
亚麻籽脱胶:称取亚麻籽,按料液比1:30(g/mL)加入蒸馏水,于90℃水浴锅磁力搅拌(500r/min)40min进行脱胶处理,重复脱胶2次,过0.3mm筛,得脱胶亚麻籽,于60℃烘箱干燥2~3h,收集备用。
亚麻全籽粉制备:称取100g脱胶亚麻籽,粉碎过0.3mm筛,取脱胶亚麻籽粉末用石油醚索氏抽提5h(温度70℃),然后于60℃烘箱干燥0.5h,常温储存备用。
亚麻籽饼粉制备:将脱胶亚麻籽于液压榨油机中脱脂,并收集亚麻籽饼。参数设置为温度90~120℃、压力55Mpa、时间20min。将亚麻籽饼用高速粉碎机粉碎,过0.3mm筛,密封备用。
1.3.2 超声-碱溶法提取工艺优化
1.3.2.1 蛋白质提取工艺
称取5.0g亚麻籽全籽粉或亚麻籽饼粉,按照料液比1:30(g/mL)与蒸馏水混合,用0.1mol/L NaOH调PH至9.0,设定超声时间、功率和温度置于超声设备中浸提,然后以4000r/min离心20min。沉淀物重复提取2次,合并上清液,用0.1mol/L HCl溶液调PH至4.0,再以8000r/min离心10min,收集蛋白质沉淀,洗涤至中性后,以-80℃真空冷冻干燥,即得到亚麻籽全籽蛋白和亚麻籽饼蛋白。
1.3.2.2 单因素试验
在超声时间60min、超声功率400W、超声温度40℃的基础上进行单因素试验,分别研究超声功率、超声时间、超声温度对亚麻籽全籽蛋白和亚麻籽饼蛋白提取率的影响。
1.3.2.3 响应面试验
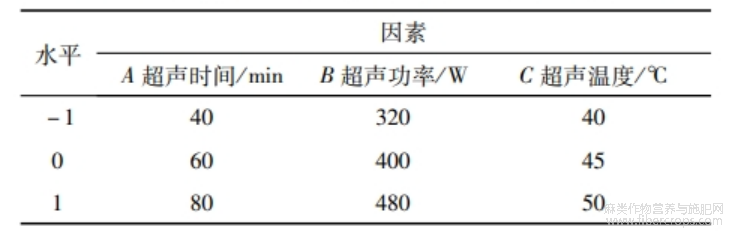
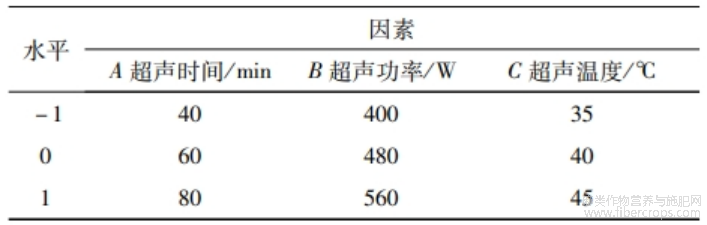
在单因素试验基础上,选择超声时间(A)、超声功率(B)、超声温度(C)为自变量,以蛋白质提取率为考察值,进行响应面优化试验。因素水平见表1~表2。
表1 亚麻籽全籽蛋白提取响应面试验因素与水平表
表2 亚麻籽饼蛋白提取响应面试验因素与水平表
1.3.3 提取率测定
亚麻全籽粉和亚麻籽饼粉中蛋白质质量根据GB5009.5—2016《食品安全国家标准食品中蛋白质的测定》中凯氏定氮法进行测定。
标准曲线绘制:在6个离心管中分别加入0、0.2、0.4、0.6、0.8、1.0mg/mL牛血清白蛋白标准液1mL,分别加入5mL考马斯亮蓝溶液,混匀避光5min,于波长595nm处测定吸光度,以牛血清白蛋白质量浓度为横坐标x,吸光度为纵坐标y,绘制标准曲线,得到回归方程为y=8.935x+0.5723,R2=0.9993。
样品测定:吸取1.0mL亚麻籽全籽和亚麻籽饼蛋白质提取液,按照上述操作测定吸光度,根据标准曲线计算蛋白质质量浓度。蛋白质提取率计算见式(1)。
式中:p为提取液蛋白质质量浓度,mg/mL;V为提取液体积,mL;N为稀释倍数;m为亚麻全籽或亚麻籽饼中蛋白质质量,mg。
1.3.4 理化指标测定
1.3.4.1 纯度
称取亚麻籽饼蛋白或亚麻籽全籽蛋白样品质量m1,根据GB5009.5—2016中凯氏定氮法测定样品中蛋白质质量m0。蛋白质纯度计算见式(2)。
1.3.4.2 等电点
取5组蛋白质提取液各10mL,用0.1mol/L HCl调PH至3.6、4.0、4.4、4.8、5.2,离心(8000r/min,10min),采用1.3.3中考马斯亮蓝法测定上清液中蛋白质质量浓度,蛋白质质量浓度最小的PH为蛋白质等电点。
1.3.4.3 表面疏水性指数(H0)
根据PAROLIA等[6]的方法,略作修改。用8.0mmol/L ANS溶液作为荧光探针,用PBS溶液(1mmol/L,PH 7.4)配制质量浓度为0.01-0.05mg/mL蛋白质样品。取各质量浓度蛋白质溶液5mL加入50μL ANS溶液作为待测液测定荧光强度。荧光分光光度计的激发波长和发射波长分别为390nm和470nm,狭缝宽度为5nm。以荧光强度与蛋白质质量浓度(mg/mL)之间初始斜率H0作为蛋白质表面疏水性指数。
1.3.5 氨基酸测定
按照GB5009.124—2016《食品安全国家标准食品中氨基酸的测定》中茆三酮柱后衍生离子交换色谱法进行测定。
1.3.6 结构表征
1.3.6.1 傅里叶红外光谱
参考XIE等[7]的方法,略作修改。取适量KBr于研钵中,在钨光灯照射下将其研磨至无可见晶体。将100mg KBr和1mg蛋白质样品粉末于研钵中混合后,制成压片后于红外光谱仪全波段(400~4000cm-1)扫描,扫描次数32次。
1.3.6.2 内源荧光光谱
参考SHENG等[8]的方法,略作修改。用PBS溶液(PH 7.2)配制质量浓度为1.0mg/mL的蛋白质样品溶液,用荧光分光光度仪测定。荧光分光光度仪参数为激发波长280 nm,发射光谱300~500 nm,狭缝宽度5 nm,电压500 V,扫描速度600 nm/min。
1.3.6.3 紫外-可见吸收光谱
参考NASCIMENTO等[9]的方法,略作修改。用PBS溶液(PH 7.4)配制质量浓度为1.0 mg/mL的蛋白质样品溶液,用紫外-可见分光光度计测定。参数设置为扫描波长范围220~4000 nm,重复扫描3次,扫描速度600 nm/min。
1.3.6.4 扫描电镜
取少量蛋白质样品用导电胶粘附,用离子溅射仪镀金,电压5 kV,分别在200、500、1000倍下利用扫描电子显微镜观察和拍照。
1.3.7 蛋白质加工功能测定
1.3.7.1 溶解性
称取蛋白质样品10 mg,溶解在PH 9.0的碱液中,配制质量浓度为0.1 mg/mL的蛋白质样品溶液,以8000 r/min离心10 min,然后用1.3.3中考马斯亮蓝法测定上清液中蛋白质质量。蛋白质溶解性计算见式(3)。
式中:m2为上清液中蛋白质质量,g;m3为样品中蛋白质质量,g。
1.3.7.2 持水性与持油性
参考邹子爵[10]的方法,略作修改。称取10 mg蛋白质样品于离心管中,加入5.0g蒸馏水,以2500 r/min涡旋振荡5min,静置30 min。以5000 r/min离心10min,称量沉淀物和离心管。称取0.5 g蛋白质样品于离心管中,加入5.0 g大豆油,按照同样的方法处理。持水性、持油性计算见式(4)。
式中:m5为沉淀物和离心管总质量,g;m6为蛋白质样品和离心管总质量,g;m4为蛋白质总质量,go
1.3.7.3 起泡性
配制质量浓度为1.0 mg/mL的蛋白质溶液,取15 mL(V0)蛋白质溶液以12000 r/min高速均质2 min,将蛋白质溶液连同泡沫立即倒入量筒中,读泡沫初始体积V1,静置0.5h后再次读泡沫体积V2。蛋白质起泡能力和泡沫稳定性计算见式(5)~(6)o
1.3.7.4 乳化性
参考TIRGAR等[11]的方法,略作修改o配制质量浓度为1.0 mg/mL的蛋白质溶液,将大豆油与蛋白质溶液(体积比1:3)以10000 r/min高压均质乳化1 min,抽取底部乳液100μL,加入5.0 mL SDS溶液(质量分数0.1%、PH 7.0),混匀后立即于波长500 nm处测定吸光度A0,20 min后,重复操作,测定吸光度A20。蛋白质乳化活性和乳化稳定性计算见式(7)~(8)。
式中:2为固定系数;2.303为反应速率常数;ρ1为蛋白质质量浓度,g/mL;φ为油相占比,0.25;n为稀释倍数,50;L为比色皿厚度,0.01m。
1.4 数据处理
所有指标平行测定3次,结果取平均值;使用Excle软件进行统计分析,以P<0.05作为差异显著判断标准;使用origin 2021绘制试验结果图;傅里叶红外光谱数据,利用 Nicolet Omnic软件和 peakFitv 4.12软件进行处理。
2 结果与分析
2.1 单因素试验
2.1.1 超声时间对蛋白质提取率的影响
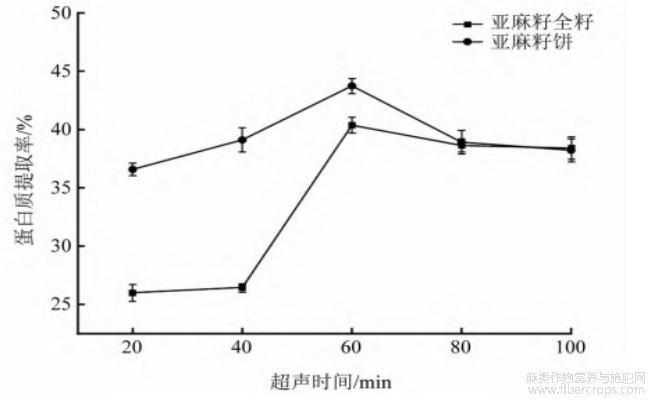
由图1可知:蛋白质提取率随着超声时间增加呈现先上升后下降的趋势,在超声60 min时,亚麻籽全籽和亚麻籽饼的蛋白质提取率均达到最大值,分别为40.38%、44.11%。超声时间过短细胞内部蛋白质溶出不充分,但超声时间过长,蛋白质在碱液中过度水解引发部分变性[12]。因此,亚麻籽全籽蛋白和亚麻籽饼蛋白均选择超声时间40、60、80 min进行响应面试验。
图1 超声时间对蛋白质提取率的影响
2.1.2 超声功率对蛋白质提取率的影响
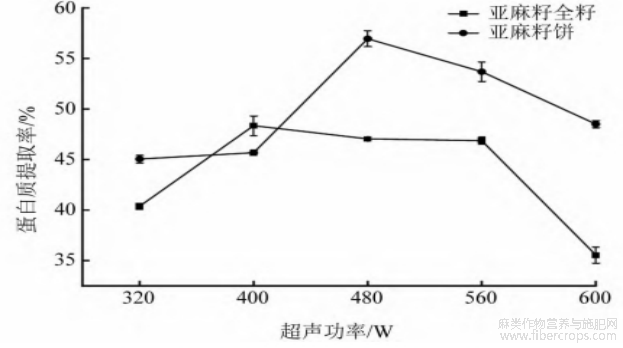
由图2可知:随着超声功率的增加,亚麻籽全籽和亚麻籽饼的蛋白质提取率都呈现先上升后下降的趋势,亚麻籽全籽在超声功率为400 W时,蛋白质提取率最大,为48.35%;亚麻籽饼在超声功率为480 W时,蛋白质提取率最大,为56.95%。超声功率过大,可能暴露更多疏水基团,致使蛋白质提取率下降[13]。因此,亚麻籽全籽选择超声功率320、400、480 W进行响应面试验,亚麻籽饼选择超声功率400、480、560 W进行响应面试验。
图2 超声功率对蛋白质提取率的影响
2.1.3 超声温度对蛋白质提取率的影响
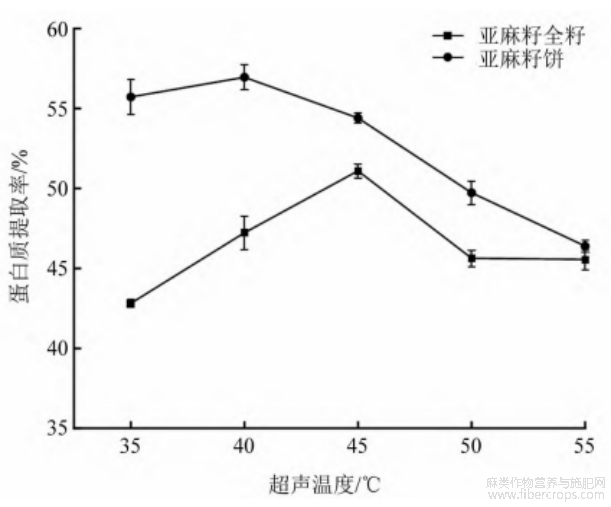
由图3可知:随着超声温度的升高,亚麻籽全籽和亚麻籽饼的蛋白质提取率均呈现先上升后下降的趋势,亚麻籽全籽在超声温度为45℃时,蛋白质提取率最大,为51.1%;亚麻籽饼在超声温度为40℃时,蛋白质提取率达到最大,为56.95%。随着温度逐渐升高,蛋白质分子间运动加剧,但温度过高会破坏蛋白质的空间构象,致使蛋白质提取率下降[14]。因此,亚麻籽全籽选择超声温度40、45、50℃进行响应面试验,亚麻籽饼选择超声功率35、40、45℃进行响应面试验。
图3 超声温度对蛋白质提取率的影响
2.2 响应面试验
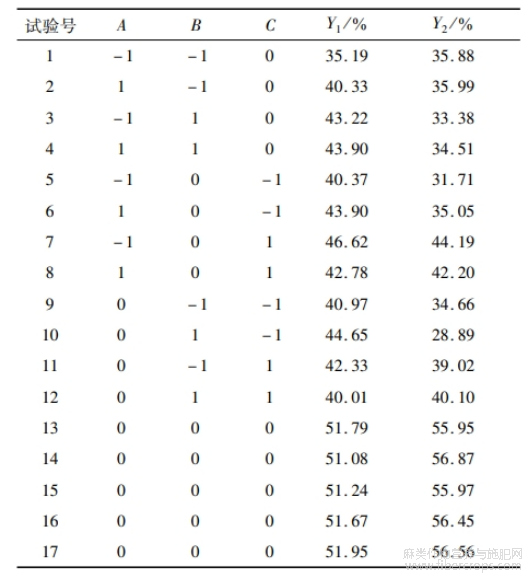
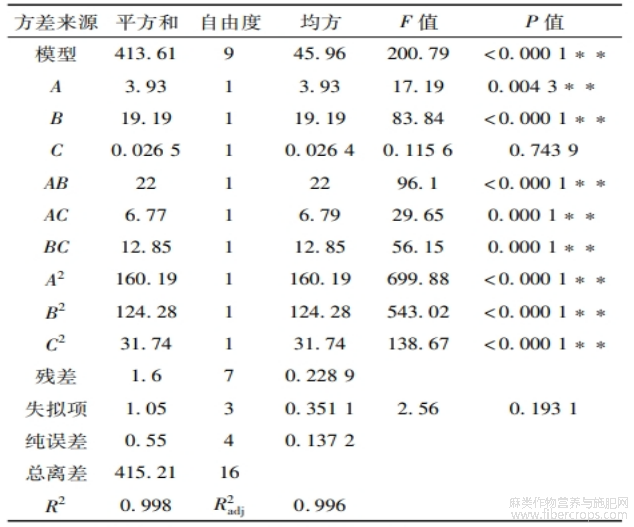
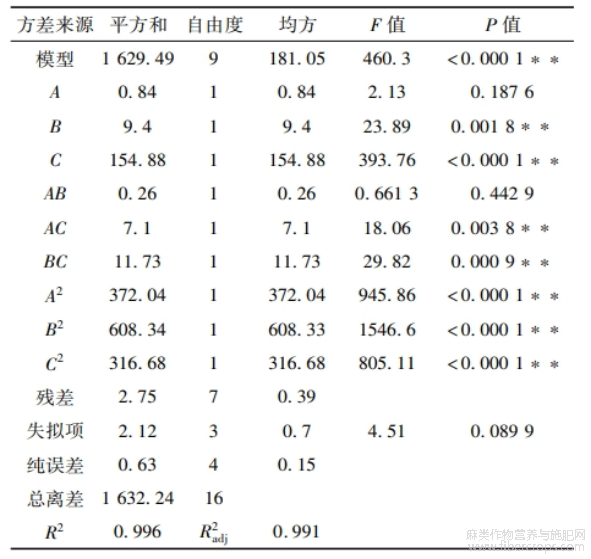
亚麻籽全籽和亚麻籽饼蛋白提取的响应面试验设计及结果见表3,方差分析结果见表4~5。
根据软件分析得到以亚麻籽全籽蛋白提取率(Y1)和亚麻籽饼蛋白提取率(Y2)为目标函数的二次多元回归方程:Y1=51.63-0.67A-1.61B-0.03C-2.12AB-1.30AC-1.84BC-6.20A2-5.41B2-2.8C2;Y2=56.36+0.32A-1.08B+4.40C+0.26AB-1.33AC+1.71BC-9.40A2-12.02B2-8.67C2。
表3 响应面试验设计及结果
表4 亚麻籽全籽蛋白响应面试验方差分析
注:**表示差异极显著(P<0.01),下同。
由表4可知:亚麻籽全籽蛋白提取模型P<0.0001,极显著,失拟项不显著,R2=0.998,R2adj =0.996,表明模型拟合效果好、误差小。一次项A、B,交互项AB、AC、BC和二次项A2、B2、C2均影响极显著。由F值可知,各因素对亚麻籽全籽蛋白提取率的影响大小依次为B>A>C,即超声功率>超声时间>超声温度。
表5 亚麻籽饼蛋白响应面试验方差分析
由表5可知:亚麻籽饼蛋白提取模型P<0.0001,极显著,失拟项不显著,R2=0.996,R2adj=0.991,说明模型拟合效果好、误差小。一次项B、C,交互项AC、BC和二次项A2、B2、C2均影响极限著(P<0.01)。由F值可知,各因素对亚麻籽饼蛋白提取率的影响大小依次为C>B>A,即超声温度>超声功率>超声时间。
通过模型拟合得到亚麻籽全籽蛋白提取工艺参数为超声时间58.20 min、超声功率396.50 W、超声温度45.98℃,此时蛋白质提取率为51.66%。为便于操作,修正工艺参数为超声时间60 min、超声功率400 W、超声温度45℃,在此条件下进行3次平行验证实验,得到亚麻籽全籽蛋白提取率平均为53.47%,与理论值较接近,表明该响应面模型可靠。通过模型拟合得到亚麻籽饼蛋白提取工艺参数为超声时间62.40 min、超声功率478.06 W、超声温度40.98℃,此时蛋白质提取率为54.06%。为便于操作,修正工艺参数为超声时间60 min、超声功率480 W、超声温度40℃,在此条件下进行3次平行验证实验,得亚麻籽饼蛋白提取率为56.47%,与理论值较接近,表明该响应面模型可靠。
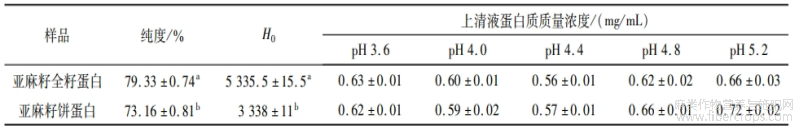
2.3 理化指标分析
由表6可知:亚麻籽全籽蛋白纯度显著高于亚麻籽饼蛋白,可能是亚麻籽饼蛋白中脂肪、灰分含量等占比更高所致。等电点测定结果显示,亚麻籽全籽蛋白和亚麻籽饼蛋白分别在PH 4.4时上清液蛋白质质量浓度最低,表明PH 4.4为亚麻籽全籽蛋白和亚麻籽饼蛋白等电点,这与胡爱军等[13]和吴兴雨等[15]通过碱溶酸沉法提取的亚麻籽蛋白的等电点结果一致。表面疏水性测定结果反映埋藏在蛋白质分子内部疏水基团的暴露情况,表面疏水性越高,说明疏水基团暴露越多[16-17]。亚麻籽全籽蛋白的表面疏水性指数显著高于亚麻籽饼蛋白,表明亚麻籽全籽蛋白空间疏水基团暴露更多。这可能是因为超声过程的空化效应,使蛋白质肽链伸展暴露更多的疏水基团[18]。
表6 亚麻籽全籽蛋白和亚麻籽饼蛋白理化指标
注:同列不同字母表示差异显著(P<0.05),下同。
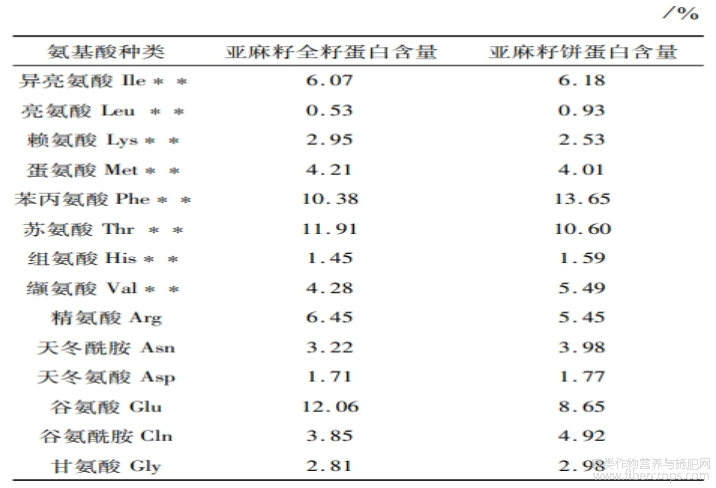
2.4 氨基酸组成分析
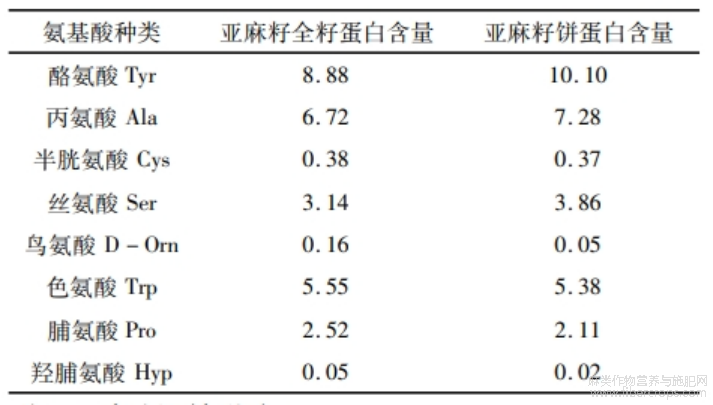
表7 亚麻籽全籽蛋白和亚麻籽饼蛋白氨基酸组成
注:**表示必需氨基酸。
由表7可知:亚麻籽全籽蛋白和亚麻籽饼蛋白中共检测出22种氨基酸,必需氨基酸8种,必需氨基酸含量均占总氨基酸含量的40%以上,表明亚麻籽全籽蛋白和亚麻籽饼蛋白都具备成为优质蛋白质的潜力[4]。此外,2种亚麻籽蛋白中必需氨基酸含量均高于联合国粮食及农业组织/世界卫生组织(FAO/WHO)儿童和成人推荐必需氨基酸总量(12.2%、33.1%)[15]。亚麻籽全籽蛋白和亚麻籽饼蛋白中富含谷氨酸(12.06%、8.65%),谷氨酸可通过自身所带的负电荷螯合金属铁离子,抑制脂质氧化。亚麻籽全籽蛋白和亚麻籽饼蛋白的精氨酸/赖氨酸比率分别为2.19:1、2.15:1,有助于降低血液胆固醇水平和增强心血管功能[4]。
2.5 结构表征分析
2.5.1 傅立叶红外光谱分析
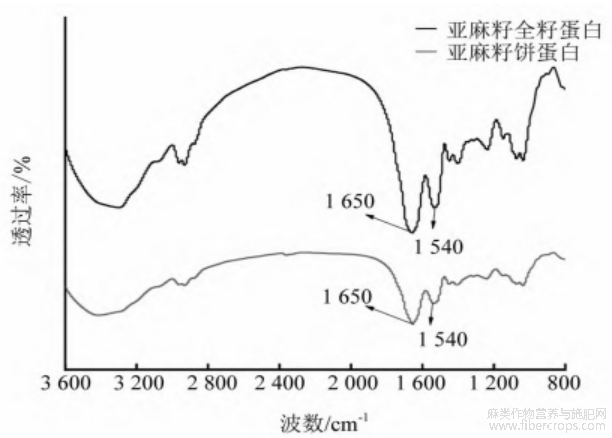
由图4可知:亚麻籽蛋白二级结构主要分布在![]() 酰胺I带(1600~1700cm-1),酰胺Ⅱ带(1500~1600cm-1)[19]。在酰胺I带上1650cm-1处有特征峰,与C—O伸缩振动有关[20]。在酰胺I带处,亚麻籽全籽蛋白峰强度更大,表明2种蛋白质在二级结构上存在差异。酰胺I谱带提供蛋白质不同二级结构信息:1600~1639cm-1为β-折叠,1640~1650cm-1为无规则卷曲,1651~1660cm-1为α-螺旋,1661~1700cm-1为β-转角[20]。
酰胺I带(1600~1700cm-1),酰胺Ⅱ带(1500~1600cm-1)[19]。在酰胺I带上1650cm-1处有特征峰,与C—O伸缩振动有关[20]。在酰胺I带处,亚麻籽全籽蛋白峰强度更大,表明2种蛋白质在二级结构上存在差异。酰胺I谱带提供蛋白质不同二级结构信息:1600~1639cm-1为β-折叠,1640~1650cm-1为无规则卷曲,1651~1660cm-1为α-螺旋,1661~1700cm-1为β-转角[20]。
图4 亚麻籽全籽蛋白和亚麻籽饼蛋白傅里叶红外光谱图
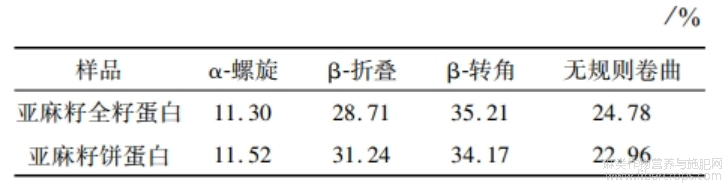
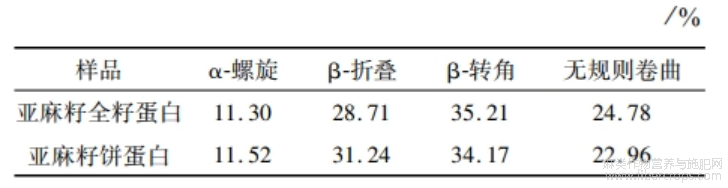
酰胺I带经 peakfit软件处理,得到二级结构含量。由表8可知:亚麻籽饼蛋白的α-螺旋和β-折叠总含量比亚麻籽全籽蛋白多2.75%,亚麻籽全籽蛋白无规则卷曲含量较亚麻籽饼蛋白高。这可能是亚麻籽全籽蛋白更高的提取温度致使蛋白质的二级结构打开,导致无规则卷曲含量增加[21]。而α-螺旋和β-折叠能够形成紧密的无空腔结构,其相比于无规则卷曲构象更稳定[4],因此亚麻籽饼蛋白较亚麻籽全籽蛋白二级构象更稳定,更有序。
表8 亚麻籽全籽蛋白和亚麻籽饼蛋白二级结构含量
2.5.2 荧光光谱与紫外-可见吸收光谱分析
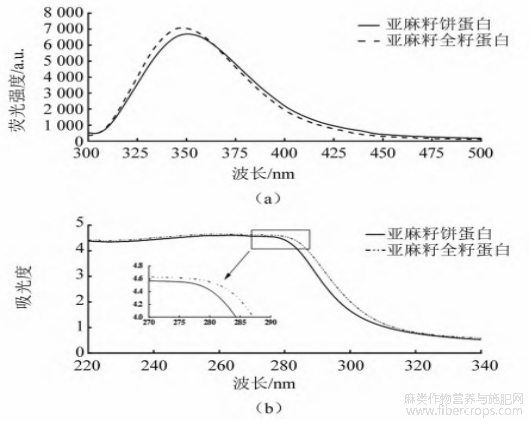
荧光光谱的荧光值主要是由蛋白质分子侧链中的芳香族氨基酸发射产生,可以反映蛋白质空间构象的变化[22]。由图5(a)可知:亚麻籽全籽蛋白和亚麻籽饼蛋白在350 nm附近有最大吸收峰,但亚麻籽全籽蛋白最大峰值高于亚麻籽饼蛋白,表明亚麻籽全籽蛋白肽链舒张程度高,暴露更多的游离芳香族氨基酸;亚麻籽饼蛋白的肽链卷曲程度高。此外,亚麻籽饼蛋白最大发射波长较亚麻籽全籽蛋白发生红移,表明亚麻籽饼蛋白色氨酸和酪氨酸残基微环境极性更强[23]。由图5(b)可知,2种亚麻籽蛋白在280 nm处有最大吸光度,主要是由蛋白酪氨酸和色氨酸残基的芳香杂环引起的,且亚麻籽全籽蛋白吸光度大于亚麻籽饼蛋白,表明亚麻籽全籽蛋白更多的酪氨酸残基暴露在周围环境中[24]。
图5 亚麻籽全籽蛋白和亚麻籽饼蛋白荧光光谱(a)与紫外-可见吸收光谱图(b)
2.5.3 扫描电镜分析
由图6可知:在200倍和500倍下观察到亚麻籽全籽蛋白整体粒度较亚麻籽饼蛋白小且更均匀。在1000倍下观察到2种蛋白质表面粗糙,稀松多孔,呈现片层、块状的面包屑结构。可能是2种蛋白质分子经较长时间碱性和超声处理后,破坏了蛋白质表面结构,但这种松散多孔的结构有利于提升蛋白质的持水性、保味性能[5]。
图6 亚麻籽全籽蛋白和亚麻籽饼蛋白扫描电镜图
注:A为亚麻籽全籽蛋白;B为亚麻籽饼蛋白;X200/500/1000为200倍、500倍、
1000倍。
2.6 加工功能特性分析
由表9可知:亚麻籽全籽蛋白溶解性和持水性显著低于亚麻籽饼蛋白(P<0.05),这可能是亚麻籽全籽蛋白内部暴露更多疏水基团,降低了蛋白质自身的溶解性和持水性[25]。亚麻籽全籽蛋白的起泡能力和泡沫稳定性均显著高于亚麻籽饼蛋白(P<0.05),可能是因为亚麻籽全籽蛋白肽链展开程度高有利于蛋白质分子在气-液界面形成泡沫,并增强泡沫稳定性。亚麻全籽蛋白持油性高于亚麻籽饼蛋白,这可能归因于亚麻籽全籽蛋白暴露更多的非极性氨基酸[4]。乳化性能是蛋白质在油-水界面被吸收的能力,取决于蛋白质结构和表面疏水性[26]。亚麻全籽蛋白乳化稳定性较亚麻籽饼蛋白高,可能是亚麻籽全籽蛋白较高的表面疏水性使得油-水界面蛋白质浓度增加,减少界面张力,最终提升乳液稳定性。
表9 亚麻籽全籽蛋白和亚麻籽饼蛋白加工功能特性
3 结论
本研究以亚麻籽全籽和亚麻籽饼为原料,采用超声-碱溶工艺提取蛋白质。以蛋白质提取率为指标,在单因素试验的基础上通过响应面法优化提取工艺,并对2种蛋白质品质进行对比分析。结果表明,亚麻籽全籽蛋白最佳提取工艺为超声时间60min、超声功率400 W、超声温度45℃,在此条件下亚麻籽全籽蛋白的提取率为53.47%;亚麻籽饼蛋白最佳提取工艺为超声时间60 min、超声功率480 W、超声温度40℃,在此条件下亚麻籽饼蛋白的提取率为56.47%。亚麻籽全籽蛋白的纯度和表面疏水性指数(H0)均显著高于亚麻籽饼蛋白(P<0.05),2种亚麻籽蛋白的必需氨基酸含量均占总氨基酸含量的40%以上。亚麻籽饼蛋白较亚麻籽全籽蛋白二级构象更稳定、更有序。亚麻籽全籽蛋白具备较高的泡沫稳定性、持油性、起泡能力、乳化活性和乳化稳定性,而亚麻籽饼蛋白具有较高的溶解性和持水性。
综上所述,从亚麻籽全籽和亚麻籽饼中提取的2种蛋白质在理化、氨基酸组成、结构、加工功能性上都存在一定差异,但2种蛋白质都是优质的蛋白质来源,在食品加工和应用上有着巨大潜力。
参考文献
[1] KAIJA P, SHARMA A, SOOD D R. Flaxseed-a potential functional food source[J].Journal of Food Science and Technology,2015,52(4):1857-1871.
[2] GANORKAR P M, JAIN R K. Flaxeed-A nutritional punch[J].InternationalFood Research Journal,2013,20(2):519-525.
[3] WU S F, WANG X C, QI W, et al. Bioactive protein/peptides of flaxseed: A review[J]. Trends in Food Sci-ence&Technology,2019,92:184-193.
[4] 马德坤,王汝华,吕筱,等.亚麻籽蛋白特性及营养价值分析[J].食品科学,2022,43(6):257-264.
[5] KAUSHIK P, DOWLING K, BARROWC J, et al. Com-plex coacervation between flaxseed protein isolate and flax-seed gum[J]. Food Research International,2015,72:91-97.
[6] PAROLIA S, MALEY J, SAMMYNAIKEN R, et al. Structure-functionality oflentil protein-polyphenol conju-gates[J]. Food Chemistry,2022,367:130603.
[7] XIE D F, DENG F H, SHU J X, et al. Impact of the fry-ing temperatureon protein structures and physico-chemical characteristics of fried surimi[J]. International Journal of Food Science and Technology,2022,57(7):4211-4221.
[8] SHENG L, HUANG M J, WANG J, et al. A study of storage impact on ovalbumin structure of chicken egg[J]. Journal of Food Engineering,2018,219:1-7.
[9] NASCIMENTO L G L, QUEIROZ L S, PETERSEN H O, et al. High-intensity ultrasound treatment on casein: Pea mixed systems: Effect on gelling properties[J]. Food Chemistry,2023,422:136178.
[10] 邹子爵.美藤果饼粕的挤出工艺及对蛋白质的影响[D].广州:华南农业大学,2018.
[11] TIRGAR M, SILCOCK P, CARNE A, et al. Effect of ex-traction method on functional properties of flaxseed proteincon centrates[J]. Food chemistry,2017,215:417-424.
[12] 廖灿杰,杨宏,王玉栋,等.响应面法优化番木瓜籽蛋白质提取工艺[J].食品研究与开发,2020,41(1):147-154.
[13] 胡爱军,田方园,卢秀丽,等.超声辅助提取亚麻籽粕分离蛋白工艺研究[J].粮食与油脂,2013,26(8):32-34.
[14] 陈紫红,黄茂坤.斑点叉尾蛔鱼下脚料蛋白提取工艺的响应面法优化研究[J].通化师范学院学报,2021,42(2):70-75.
[15] 吴兴雨,孙凯杨,姚玥,等.2种方法提取的亚麻籽蛋白持水性?持油性?溶解性和氨基酸组成比较[J].中国油脂,2021,46(4):43-46,51.
[16] YAN M Y, LI B F,ZHAO X, et al. Physicochemical prp-perties of gelation gels from walleye pollock(Theragrachal-cogramma)skin cross-linked by gallic acid and rutin[J].Food Hydrocolloids,2011,25(5):907-914.
[17] ZHU Y, FU S Y, WU C L, et al. The investigation of protein flexibility of various soybean cultivars in relation to physicochemical and conformational properties[J]. Food Hydrocolloids,2020,103:105709.
[18] TANG C H. Emulsifying properties of soy proteins: A critical reviewwith emphasis on the role of conformational flexibility[J].critical Reviews in Food Science and Nu-trition,2017,57(12):2636-2679.
[19] BARTHA. Infrared spectroscopy of proteins[J]. Bio-chimica et Biophysica Acta(BBA)-Bioenergetics,2007,1767(9):1073-1101.
[20] SADAT A, JOYE I J. Peak fitting applied to fourier transform infraredand raman spectroscopic analysis of proteins[J]. Applied Science,2020,10(17):5918.
[21] 陈静,王立博,任艳娟,等.热处理对荞麦麸皮蛋白结构与理化特性的影响[J].食品科学,2024,45(4):239-246.
[22] XIAO L, YE L Y, HE K, et al. A new method to reduce allergenicity by improving the functional properties of soy-bean7S protein through covalent modification with poly-phenols[J]. Food chemistry,2022,373:131589.
[23] LIU H T, HAN G, ZHANG H, et al. Improving the phys-ical and oxidative stability of emulsions based on the inter-facial electrostatic effects between porcine bone protein hy-drolysates and porcine bone protein hydrolysate-rutincon-jugates[J]. Food Hydrocolloids,2019,94:418-427.
[24] KARBASI M, ASKARI G. Modification of whey proteinmicrogel particleswith mono-oligo-and polysaccharides through the Maillard reaction: Effects on structural and techno-functional properties[J]. Food Structure,2021,28:100184.
[25] 马天怡,郭凤仙,何振东,等.L-精氨酸/L-赖氨酸改性大豆分离蛋白乳化性[J].精细化工,2022,39(1):150-157,163.
[26] JAMBRAK A R, LELAS V, MASON T J. physical prop-erties of ultrasoundtreated soy proteins[J]. Journal of Food Engineering,2009,93(4):386-393.
文章摘自:杨芙蓉,王进英,甘生睿,等.亚麻籽全籽蛋白和亚麻籽饼蛋白提取工艺优化及其品质研究[J].粮食与油脂,2024,37(12):40-48。