摘 要:在国内,麻类作物是一种被广泛种植的经济作物,除纺织、食品、建筑材料等常见用途,其活性功能成分在生物医药、农业等领域亦有广泛研究和应用。文章综述了常见麻类作物(如亚麻、大麻、苎麻等)活性成分的抗炎效果与机理,及其在医药与畜牧领域的研究、应用现状,展望了其作为新抗炎药物的潜力,旨在为今后麻类作物活性成分在大健康领域的深度开发提供科学参考。
关键词:麻类作物;活性成分;抗炎
麻类作物是全球重要的经济作物,也是我国最古老的农作物之一,在国民经济中占据重要地位。麻类作物的传统用途主要是纺织,人们利用其茎秆韧皮部、叶片或叶鞘中的纤维作为纺织行业的原料[1]。麻类作物在纺织业、农业、机械等行业均有一定应用,随着科学技术的发展,在医药、食品工业、饲料行业等方面的开发利用也产生了巨大的经济价值,现已广泛用于各种动物功能性饲料、食品、食品添加剂以及治疗药物[2-3]。
我国麻类作物的种类较多,大面积栽培的主要有苎麻、亚麻、黄麻、红麻、工业大麻、剑麻、罗布麻等。近年来人们开展大量研究,发现这些作物的种子、花和叶中富含粗蛋白质、不饱和脂肪酸和多种对人体健康有益的活性功能成分[4-6]。据文献记载,麻类作物的药理作用研究已经有几千年的历史:《神农本草经》中记载,麻子,味甘,平,主补中益气[7];明李时珍在《本草纲目》中就部分麻类作物的药理作用也作了详细的阐述和记载等[8]。麻类作物(如亚麻、大麻等)在现代医学中被广泛应用于抗炎和免疫调节。本文对麻类作物的抗炎作用进行了综述,包括其抗炎机制、抗炎成分及应用等方面,以期为今后麻类作物提取物抗炎作用的相关研究及应用提供参考。
1麻类作物提取物抗炎作用研究进展
1.1亚麻(Linum usitatissimum L.)
亚麻是亚麻科亚麻属一年生草本植物,是人类最早使用的天然植物纤维之一,可分为油用亚麻、纤维用亚麻和油纤兼用亚麻3种类型。亚麻籽是亚麻的籽实,亚麻籽中含有的亚麻木酚素、α-亚麻酸、亚麻籽蛋白等成分[9]均具有抗炎作用。
1.1.1亚麻木酚素
亚麻木酚素是一种多酚类化合物,含有多种生物活性成分,具有抗氧化、抗炎、抗癌等作用。Bowers等[10]发现在三阴性乳腺癌E0771模型中,亚麻籽木酚素可能通过抑制NF-κB活性来缓解肿瘤生长。NF-κB是经典的炎症信号通路,当其表达下调时可抑制炎症反应。Pietrofesa等[11]测试了亚麻籽木酚素(FLC)在多发性骨髓瘤小鼠中预防由石棉急性诱导的炎症的能力,与对照组相比,FLC喂养后小鼠腹膜灌洗液中白细胞和促炎、促纤维化细胞因子水平显著降低,细胞因子白细胞介素-1β(IL-1β)、IL-6、肿瘤坏死因子-α(TNF-α)、高迁移率族蛋白B1(HMGB1)和转化生长因子-β1(TGF-β1)和细胞因子受体TNFαR1和TGFß R1的基因表达也下调,表明FLC减少急性石棉引起的腹膜炎症、亚硝化和氧化应激。
1.1.2 α-亚麻酸
α-亚麻酸(α-linolenic acid ALA)是一种ω-3脂肪酸,具有潜在的免疫调节和抗炎作用。任杰等[12-13]在小鼠巨噬细胞RAW264.7中研究了ALA对脂多糖(LPS)诱导的一氧化氮(NO)和前列腺素E2(PGE2)产生的影响,结果表明,ALA可阻断NF-κB和MAPKs的激活,下调炎症诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)和TNF-R基因的表达,对NO和PEG2的产生有很强的抑制作用。Hassan等[14]对大鼠注射2-4-6-三硝基苯磺酸(TNBS)诱导结肠炎模型后饲喂富含ALA的饲粮,发现与TNBS组相比,富含ALA饲粮组降低了结肠中iNOS表达、TNF-α分泌及其mRNA水平,证明了ALA通过抑制氧化应激和炎症应激,缓解TNBS诱导的大鼠结肠炎。
1.1.3亚麻籽蛋白
亚麻籽蛋白是从亚麻籽中提取的一种优质的植物蛋白,含有人体必需的八种氨基酸,其氨基酸模式与大豆蛋白相当。其水解产物具有抗高血压、降血糖和抗氧化等功能活性。Karama?等[15]评价了用5种不同酶解获得的亚麻籽蛋白水解物的抗氧化活性,结果表明,碱性蛋白酶和胰酶的水解产物具有最高的抗氧化活性,相比之下风味蛋白酶水解产物的O-?清除活性和螯合Fe2+的能力较低,而木瓜蛋白酶释放抗氧化肽的效果最差。洪理杰等[16]研究表明,亚麻籽蛋白的木瓜蛋白酶酶解产物能减轻DSS小鼠的DAI评分、结肠病理损伤、结肠长度缩短等情况,促进双歧杆菌和乳酸杆菌增长,提高过氧化氢酶(CAT)活力,降低丙二醛(MDA)、髓过氧化物酶(MPO)、前列腺素E2(PGE2)和促炎细胞因子TNFα、IL-1β和IL-6水平来改善结肠组织,证明了亚麻籽蛋白酶解物可干预DSS引起的急性结肠炎。
1.2大麻(Cannabis sativa L.)
大麻又名火麻、汉麻,属于大麻科大麻属一年生草本植物。现代药理研究表明,大麻具有镇痛、抗肿瘤、抗菌、抗炎等作用[17],因大麻中含具较强精神活性的四氢大麻酚(THC),可能导致成瘾和依赖,目前国际上普遍将大麻列为受管制的麻醉药品。除THC外,大麻中还包含多种不具精神活性的大麻素类化合物,其中较为重要的有大麻酚(CBN)、大麻二酚(CBD)、大麻双色烯(CBC)、大麻萜酚(CBG)等,是大麻的重要活性成分[18]。
1.2.1大麻酚(cannabinol CBN)
大麻酚与其他大麻素不同,其不是植物天然合成的,更多是THC的分解、降解产物或代谢产物,有镇静助眠、缓解疼痛等作用,也具有抗菌抗炎特性。在Gojani等[19]的LPS诱导NLRP3炎症小体激活的试验中发现,CBN可能通过减少泛连接蛋白1(PANX1)的断裂来抑制NLRP3炎症小体的组装,通过抑制P-NF-κB来下调促炎基因转录,从而发挥抗炎作用。Gu等[20]也发现CBN抑制了牙龈假单胞菌诱导的IL-12p40、IL-6、IL-8和TNF的释放,同时增加抗炎细胞因子IL-10的表达,CBN可能通过CB2/PI3K信号谱系抑制对牙周病原体的固有反应。
1.2.2大麻二酚(cannabidiolCBD)
与THC相比,CBD不具备精神活性且对神经系统有保护作用,这种大麻素对健康有许多潜在的益处。Sun等[21]发现CBD能够保护结肠结构并促进受损组织修复,其通过激活细胞外信号调节激酶(ERK)和腺苷酸激活蛋白激酶(AMPK)信号通路,来改善巨噬细胞在结肠组织中的浸润,此外,CBD还能抑制NLRP3炎症小体的激活以及相关促炎标记物的分泌。Krzy?ewska等[22]研究表明,在野百合碱(MCT)诱导的肺动脉高压中给予CBD,可增强总抗氧化能力和谷胱甘肽水平、谷胱甘肽还原酶活性,并降低炎症介质如TNF-α、IL-1β、NF-κB、单核细胞趋化蛋白-1(MCP-1)和CD68的水平,表明CBD在MCT诱导的肺动脉高压中具有抗氧化和抗炎作用。
1.2.3大麻环萜酚(cannabichromene CBC)
大麻环萜酚也称为大麻色烯,是大麻植物中仅次于THC和CBD的第三大大麻素。与CBD或THC相比其活性稍低,有关研究较少,但已发现其具有抗炎和止痛等特性。在Hong等[23]评估CBC对RAW264.7巨噬细胞和λ-角叉菜胶诱导的小鼠模型的抗炎作用中发现,CBC在20μM的浓度下没有细胞毒性,而且能抑制大约50%的NO产生。经CBC治疗后能显著抑制iNOS、IL-1β、IL-6和TNF-α的mRNA和蛋白质的表达,其次其能通过下调NF-κB和MAPK来抑制LPS刺激的RAW264.7细胞炎症,也能抑制λ-角叉菜胶诱导的细胞因子iNOS、IL-1β和IL-6水平上升。Tortolani等[24]用LPS建立HaCaT细胞炎症模型来研究CBC等大麻素的抗炎作用,结果表明,其能显著减少IL-1β、IL-8、IL-12、IL-31的表达,从而阻断炎症。
1.2.4大麻萜酚(cannabigerol CBG)
大麻萜酚是与CBD有相似的抗炎、抗氧化和抗微生物功效的一种大麻素,其能抑制大脑中的神经递质GABA的吸收,当GABA被抑制时,可以放松肌肉,并具有抗焦虑作用。Borrelli等[25]使用二硝基苯磺酸(DNBS)诱导构造小鼠结肠炎模型,结果发现CBG降低了结肠重量/结肠长度比、髓过氧化物酶活性和iNOS表达,增加了SOD活性,使IL-1β、IL-10和INF-γ的表达正常化。Aljobaily等[26]用蛋氨酸/胆碱缺乏饮食(MCD)造成小鼠非酒精性脂肪性肝炎(NASH)模型,通过CBG给药发现低剂量给药能减轻MCD诱导的NASH中的肝纤维化和炎症,而高剂量的CBG治疗则显示出肝损伤的加重。
1.3苎麻(Boehmeria nivea L.)
苎麻是荨麻科苎麻属多年生草本植物,其茎皮是重要的纺织原料,根是传统中药。《本草纲目》草部第十五卷中记载:苎性破血,将苎麻与产妇枕之,止血晕。产后腹痛,以苎安腹上即止也。又蚕咬人毒入肉,取苎汁饮之。说明苎麻有止血、止痛和解毒的作用[27]。近年来,许多国内外学者采用各种分离技术,从苎麻的根、茎、叶中分离并鉴定出多种化学成分,并确定其药理作用[28]。
1.3.1三萜类
苎麻根中化学成分报道最多的是三萜类化合物,这类化合物在植物中分布广泛,其中许多在民间医学中被用作抗炎药物[29],是苎麻具有广泛药用价值的基础,但苎麻中的三萜类化合物在抗炎方面的研究较少。
1.3.2绿原酸
与根相比苎麻叶中的绿原酸含量更高,是苎麻叶中的主要药用成分[30]。研究[31]表明,绿原酸可以通过抑制炎症相关酶的活性、减少炎症介质的释放、调节免疫细胞的功能等方式发挥抗炎作用。廖暑杰等[32]的研究表明,苎麻叶片干粉绿原酸提取液具有替代抗生素的潜力。Sung等[33]试验表明,绿原酸含量为1.96mg/100g的苎麻叶70%乙醇提取物能抑制LPS诱导的NO、TNF-α和IL-6的分泌,降低iNOS的蛋白水平,且显著抑制p38丝裂原激活蛋白激酶(p38)和应激活化蛋白激酶(JNK)的磷酸化,但不影响ERK的磷酸化。
1.3.3黄酮类
苎麻属植物叶、茎、根都含有黄酮类化合物,其研究较多,在许多植物中都有抗炎活性[34]。在赵振[35]的研究中,苎麻籽总黄酮粗提物有清除DPPH、羟基、超氧阴离子自由基的能力。
1.4 罗布麻(Apocynum venetum L.)
罗布麻为夹竹桃科植物,分为罗布麻属和白麻属。在我国罗布麻属仅有罗布红麻一个种,白麻属根据花的大小和叶子形状不同又分为白麻和大叶白麻两个种。我国具有生产价值的仅有罗布红麻和白麻两种,而在《中华人民共和国药典》和其他医药类文献中的“罗布麻”实指罗布红麻[36]。近年来的化学成分及药理研究表明,罗布麻中除了常见的黄酮、有机酸等具有抗炎作用外,一些具有生物活性的提取物也具有抗炎活性。
1.4.1乌发醇
杜世云[37]通过各种分离技术对罗布麻甲醇提取物的乙酸乙酯部位化学成分进行分离纯化,并且用提取物进行抗炎活性检测,结果表明,乌发醇具有良好的抗炎活性,并对DSS诱导的试验性结肠炎和LPS刺激的RWA264.7巨噬细胞具有抗炎作用。
1.4.2桦木醇
Du等[38]从罗布麻醇提物中分离得到了桦木醇,并证明了桦木醇通过抑制炎症结肠组织和巨噬细胞中的促炎ERK/STAT3轴来体现桦木醇对DSS诱导的试验性结肠炎和LPS刺激的RAW264.7巨噬细胞的抗炎作用。
1.5剑麻(Agave sisalana Perr.ex Engelm.)
剑麻为龙舌兰科龙舌兰属多年生草本植物。剑麻含有多种皂苷元、多糖类等化学成分,其叶具抗炎、抗肿瘤、降胆固醇及神经-肌肉阻滞等药理作用。
剑麻皂素是剑麻主要的活性成分之一,在剑麻的抗炎作用中发挥重要作用。剑麻的叶汁常作为防腐剂应用,也可口服用于治疗不同的疾病。废弃麻汁和麻渣中含有大量剑麻皂素,经济利用价值高。李燕婧等[39]研究表明,大剂量剑麻皂素能明显抑制二甲苯引起的小鼠耳肿胀,提示其具有抗炎作用。Costa等[40]研究表明,剑麻酸水解提取物中因含有高浓度的甾体皂苷,从而表现出比吲哚美辛更强的抗炎作用。
1.6其他
1.6.1黄麻(Corchorus capsularis L.)
黄麻为锦葵科黄麻属一年生草本植物。黄麻的性味苦、寒,以根叶及种子入药可清热解暑、拔毒消肿等[41]。Mokgalaboni等[42]研究也表明黄麻在肥胖和2型糖尿病大鼠模型中对基本代谢参数、血脂谱、炎症和氧化应激的潜在益处。
1.6.2红麻(Hibiscus cannabinus L.)
红麻也称洋麻,是锦葵科的一种草本植物。红麻作为传统民间药物常用于治疗各种疾病,包括贫血和疲劳。现代药理学研究证实,红麻具有广泛的药理作用,包括抗菌、抗肿瘤、抗炎、抗溃疡、抗氧化等活性[43]。Hanumegowda等[44]探索红麻籽乙醇提取物对亚硝酸钠和双氯芬酸诱导的氧化应激的保护作用以及抗血栓形成活性,结果发现,该提取物能显著减轻亚硝酸钠和双氯芬酸诱导的红细胞、血小板、肝脏、肾脏和小肠中的氧化应激,使脂质过氧化、蛋白质羰基含量、超氧化物歧化酶和过氧化氢酶等应激标记物水平正常化。除此之外还有青麻、玫瑰麻等麻类作物,其提取物也具有一定功效。
2 展望
炎症是指机体对外界刺激或内部病理过程产生的一种防御为主的自我保护反应,通常是有益的,但当炎症反应过度或持续时间过长,就会对机体产生不同程度的危害。因此,炎症的治疗与管理十分重要。
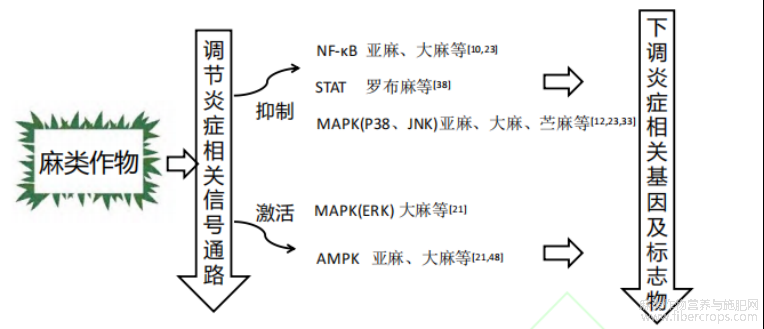
抗炎药物可通过抑制炎症介质的合成与释放来减轻炎症反应,从而缓解疼痛、肿胀、发热等症状。但一些传统的抗炎药物长期使用时会出现某些副作用:如布洛芬、吲哚美辛等长期使用可能会对肝肾造成损伤;阿司匹林等长期服用可能会增加心血管疾病的风险;糖皮质激素类药物可能会导致骨质疏松、免疫抑制等。而一些天然的抗炎药物,如某些植物提取物中的活性成分,也具有一定的抗炎作用,可以用于预防和治疗一些与炎症相关的疾病,且因其是从天然植物中提取的,含多种活性成分,通常具有较低的毒性和副作用,比化学合成的药物更安全、作用更广泛。以麻类作物为例,其可通过调节炎症相关信号通路,下调炎症标志物及相关基因来起到抗炎作用(图1)。植物提取物可以提供与抗炎药相似的效果,且不会引起严重的副作用,因此将有活性的天然产物开发成具有市场价值的工业产品是一项有益于机体健康的工程。
图1麻类作物抗炎机制示意图
(1)与其他天然植物相比,麻类作物在抗炎方面因其独特的活性成分而展现出各自的优势,但同时也存在局限性。例如,大麻中的大麻素可以与人体的内源性大麻素系统相互作用,有效减轻神经性疼痛、肌肉疼痛和关节炎等炎症反应。相较于非甾体抗炎药,大麻素展现出更为广泛的抗炎和镇痛效果,但由于可能具有精神活性或其他副作用,其使用仍然存在争议;而剑麻含有的剑麻皂素可以作为药物合成的原料,通过化学反应转化为单烯醇酮醋酸酯,这是一种关键的甾体中间体,进而用于合成包括糖皮质激素在内的多种甾体激素类药物[47]。
尽管麻类作物中的许多活性成分,如绿原酸和黄酮,在其他天然植物中也普遍存在,但麻类作物仍然展现出其独特的药效特性。例如,苎麻被认为具有凉血止血、清热安胎以及利尿解毒的功效,由苎麻开发制成的苎麻根注射液,常用于治疗咽喉肿痛、肾炎水肿等疾病;罗布麻的主要功效包括平抑肝阳、安神定志、清热利水、清泻肝热等,对高血压、眩晕、头痛、心悸、失眠、肝炎、肾炎和浮肿等疾病具有良好的治疗作用。
(2)麻类作物在不同领域都有广泛的应用。现有研究表明,麻类提取物不仅可应用于结肠炎、牙周炎、腹膜炎、NLRP3炎症、皮肤炎症、非酒精性脂肪性肝炎等炎症性疾病,而且还能抑制肺动脉高压、三阴性乳腺癌、脓毒症等相关疾病引起的炎症,部分麻类提取物能够在无毒的前提下,对机体的抗氧化能力、抗炎能力、免疫功能等有所改善,这也奠定了麻类提取物在医药、保健品、动物营养健康等行业中的作用。因此,麻类作物提取物或可作为新的抗炎药物应用于各种炎症的治疗,随着科学技术的不断进步和人们对健康的重视程度不断提高,相信未来会更深入探究麻类作物提取物有效活性成分的抗炎效果、机理及其应用价值,以期为其在炎症的临床治疗上提供科学参考。
参考文献
[1] 陶爱芬,祁建民,林荔辉,等.中国主要麻类作物的起源与演化概述[J].中国麻业科学,2016,38(3):136-142.
[2] 谭龙涛,喻春明,陈平,等.麻类作物多用途研究现状与发展趋势[J].中国麻业科学,2012,34(2):94-99.
[3] 李学姣,阮培英,刘光泽,等.主要麻类作物综合利用研究现状[J].中国麻业科学,2023,45(3):136-143.
[4] 傅正良,赵连兴,孔增科,等.罗布麻不同药用部位有效成分的含量考察[J].中国民族民间医药,2010,19(12):45-46.
[5] 陈翠花,周永逸,薛佳,等.基于HPLC的罗布麻与白麻不同部位活性成分比较
分析[J].中国现代中药,2023,25(5):1010-1019.
[6] 欧文静,喻春明,朱爱国,等.苎麻新品种(系)原麻不同部位化学成分测定[J].中国麻业科学,2019,41(6):265-269.
[7] 祝庆明,周胜建,张德鸿,等.《神农本草经》药物解读——麻子[J].中国中医
药现代远程教育,2017,15(23):75-77.
[8] 谭志坚,王朝云,易永健,等.麻类作物中主要药用活性成分提取研究进展[J].化工技术与开发,2015,44(1):23-28.
[9] Singh K K,Mridula D,Rehal J,et al.Flaxseed:a potential source of food,feed and fiber[J].Critical Reviews in Food Science and Nutrition,2011,51(3):210-222.
[10] Bowers L W,Lineberger C G,Ford N A,et al.The flaxseed lignan secoisolariciresinol diglucoside decreases local inflammation,suppresses NFκB signaling,and inhibits mammary tumor growth[J].Breast CancerResearch and Treatment,2019,173(3):545-557.
[11] Pietrofesa R A,Velalopoulou A,Arguiri E,et al.Flaxseed lignans enriched in secoisolariciresinol diglucoside prevent acute asbestos-induced peritoneal inflammation in mice[J].Carcinogenesis, 2016,37(2):177-187.
[12] 任杰,杨泽华,郑圣顕,等.α-亚麻酸的体外抗炎作用机制研究[J].云南大学学报(自然科学版),2009,31(增刊1):419-426.
[13] REN J, CHUNG S H.Anti-inflammatory effect of alpha-linolenic acid and its mode of action through the inhibition of nitric oxide production and inducible nitric oxide synthase gene expression via NF-kappaB and mitogen-activated protein kinase pathways[J].Journal of Agricultural and Food Chemistry,2007,55(13):5073-5080.
[14] Hassan A,Ibrahim A,Mbodji K,et al.An α-linolenic acid-rich formula reduces oxidative stress and inflammation by regulating NF-κB in rats with TNBS-induced colitis[J].The Journal of Nutrition,2010,140(10):1714-1721.
[15] Karama? M,Kosińska-Cagnazzo A,Kulczyk A.Use of different proteases to obtain flaxseed protein hydrolysates with antioxidant activity[J].International Journal of Molecular Sciences,2016,17(7):1027.
[16] 洪理杰,李莉蓉.亚麻籽蛋白酶解物可减轻硫酸葡聚糖钠诱导的急性结肠炎中国食品科学技术学会第十七届年会.[2024-07-15].
[17] 王椿清,张圆圆,李倩,等.常见大麻素类化合物药理作用及构效关系研究进
展[J].中国药物警戒,2022,19(12):1388-1392.
[18] 李俊,朱雪雯,万会花,等.大麻中大麻素类化学成分及其分析方法研究进展
[J].中草药,2020,51(24):6414-6425.
[19] Gojani E G,WANG B,LI D P,et al.Anti-Inflammatory effects of minor cannabinoids CBC,THCV,and CBN in human macrophages[J].Molecules,2023,28(18):6487.
[20] GU Z, Singh S,Niyogi RG,et al.Marijuana-derived cannabinoids trigger a CB2/PI3K axis of suppression of the Innate response to oralpathogens[J].Frontiers in Immunology,2019,10:2288.
[21] SUN Q, Bravo I A,TIAN Q,et al.Dietary cannabidiol activates PKA/AMPK signaling and attenuates chronic inflammation and leaky gut in DSS-induced colitis mice[J].Molecular Nutrition & Food Research,2024,68(4):e2300446.
[22] Krzy?ewska A,Baranowska-Kuczko M,Jastrz?b A,et al.Cannabidiol improves antioxidant capacity and reduces inflammation in the lungs of rats with monocrotaline-induced pulmonary hypertension[J].Molecules,2022,27(10):3327.
[23] HONG M,Kim J H,HAN J H,et al.In vitro and in vivo anti-inflammatory potential of cannabichromene isolated from hemp[J].Plants (Basel),2023,12(23):3966.
[24] Tortolani D,Di Meo C,Standoli S,et al.Rare phytocannabinoids exert anti-inflammatory effects on human keratinocytes via the endocannabinoid system and MAPK signaling pathway[J].International Journal of Molecular Sciences,2023,24(3):2721.
[25] Borrelli F,Fasolino I,Romano B,et al.Beneficial effect of the non-psychotropic plant cannabinoid cannabigerol on experimental inflammatory bowel disease[J].Biochem Pharmacol,2013,85(9):1306-1316.
[26] Aljobaily N,Krutsinger K,Viereckl M J,et al.Low-dose administration of cannabigerol attenuates inflammation and fibrosis associated with methionine/choline deficient diet-induced NASH model via modulation of cannabinoid receptor[J].Nutrients,2022,15(1):178.
[27] 陈保锋,陈建华,母波,等.苎麻药用研究进展[J].中国麻业科学,2016,38(5):237-241.
[28] 李慧洁,白易灵,汪芳,等.苎麻叶生物活性成分及其应用研究进展[J].生物
化工,2022,8(5):180-182.
[29] Safayhi H,Sailer E R.Anti-inflammatory actions of pentacyclic triterpenes[J].Planta Medica,1997,63(6):487-493.
[30] 张勇,鄢勇气.苎麻化学成分的药用价值及其提取方法[J].化学研究,2021,
32(6):536-540.
[31王庆华,杜婷婷,张智慧,等.绿原酸的药理作用及机制研究进展[J].药学学报,2020,55(10):2273-2280.
[32] 廖暑杰,王丹,张昆朋,等.苎麻干粉绿原酸提取液体外替代抗生素研究[J].湖南农业科学,2022(4):75-79.
[33] Sung M J,Davaatseren M,Kim S H,et al.Boehmeria nivea attenuates LPS-induced inflammatory markers by inhibiting p38 and JNK phosphorylations in RAW264.7 macrophages[J].Pharmaceutical Biology,2013,51(9):1131-1136.
[34] 唐春丽,魏江存,滕红丽,等.黄酮类成分抗炎活性及其作用机制研究进展[J].中华中医药学刊,2021,39(4):154-159.
[35] 赵振.苎麻籽总黄酮的提取?鉴定及初步生物活性研究[D].长沙:湖南农业大学,2023.
[36] 张卫明,肖正春,顾龚平,等.罗布麻资源利用与罗布麻植物分类问题[J].中国野生植物资源,2006(2):15-19.
[37] 杜世云.罗布麻化学成分及抗炎活性研究[D].深圳:深圳大学,2021.
[38] DU S Y,HUANG H F,LI X Q,et al.Anti-inflammatory properties of uvaol on DSS-induced colitis and LPS-stimulated macrophages[J].Chinese Medicine,2020,15:43.
[39] 李燕婧,周桂芬,韦善新,等.剑麻皂素药理作用的实验研究[J].时珍国医国药,2006(10):1958-1959.
[40] Costa L T S D,Fracasso J A R,Guarnier L P,et al.Toxicity and anti-inflammatory effects of agave sisalana extract derived from agroindustrial residue[J].Plants (Basel),2023,12(7):1523.
[41] 陈基权,杨泽茂,邓灿辉,等.食用黄麻主要药用成分及其药理功能研究进展[J].中国麻业科学,2022,44(2):126-132.
[42] Mokgalaboni K,Phoswa W N.Corchorus olitorius extract exhibit anti-hyperglycemic and anti-inflammatory properties in rodent models of obesity and diabetes mellitus[J].Frontiers in Nutrition,2023,10:1099880.
[43] Sim Y Y,Nyam K L.Hibiscus cannabinus L.(kenaf) studies:Nutritional composition,phytochemistry,pharmacology,and potential applications[J].Food Chemistry,2021,344:128582.
[44] Hanumegowda S M,Srinivasa C,Shivaiah A,et al.Antioxidant and antithrombotic activities of kenaf seed (Hibiscus cannabinus) coat ethanol extract in sprague dawley rats[J].Applied Biochemistry and Biotechnology,2023,195(2):772-800.
[45]王俊,覃佑康,曹志恒,等.剑麻皂素工业化制备技术研究进展[J].广西科学,2020,27(2):182-187.
文章摘自:雷鑫宇,张静梦,靳可,等. 麻类作物活性成分的抗炎作用研究进展 [J/OL]. 中国麻业科学, 1-11[2024-09-10]. http://kns.cnki.net/kcms/detail/43.1467.S.20240719.0821.002.html.