摘 要:为获得简单、高效和低污染的工业大麻种子消毒方法,分别选取纤用型(晋麻1号)、药用型(晋麻4号)、籽用型(汾麻3号)工业大麻品种种子为试验材料,设置2个次氯酸钠浓度(5%、10%)和5个处理时间(5、10、15、20、25 min),以发芽率、发芽势、污染率为指标,研究次氯酸钠对工业大麻种子萌发的影响以及确定次氯酸钠最佳处理浓度和时间,进而为工业大麻无菌苗培育奠定基础。结果表明,当次氯酸钠浓度为5%时,晋麻1号和汾麻3号的种子发芽率和发芽势随时间延长呈先升高后降低的变化趋势;而晋麻4号的发芽率和发芽势最开始随次氯酸钠的处理时间延长和处理浓度的增加缓慢上升,各处理间差异不显著,当次氯酸钠浓度和处理时间达到一定程度后,其发芽率和发芽势开始快速升高。次氯酸钠处理后的3个工业大麻品种的污染率随次氯酸浓度升高和处理时间延长呈现逐渐降低的变化趋势。因此,晋麻1号的最佳处理为5%的次氯酸钠处理15~20min,晋麻4号最佳处理为10%的次氯酸钠处理25min,汾麻3号则以5%的次氯酸钠处理15min为最佳。
关键词:工业大麻;次氯酸钠;发芽率;发芽势;污染率
工业大麻(Cannabis sativa L.)又称火麻、汉麻等,是大麻科大麻属1年生直立草本植物[1],根据其用途分为纤维型、籽用型和药用型3种类型,目前纤维型和籽用型工业大麻应用较为广泛。工业大麻纤维具有坚硬、细长,吸湿性和透气性良好等特点,是一种商业价值极高的纺织原料。大麻种子生产的大麻油中富含不饱和脂肪酸[2](亚油酸、亚麻酸、油酸等)、人体易吸收的麻仁球蛋白和白蛋白以及人体8种必需氨基酸[3],具有较高的食用价值。药用型工业大麻的茎、叶、花序都可作生产催眠剂和镇静剂的原料,特别是花序中的大麻二酚(CBD)在抗癫痫、治疗精神紊乱、镇痛等方面具有重要作用[4,5]。当前,由于工业大麻存在幼芽顶土能力弱、种子出苗时间不一致且大小不均匀等问题,因此,严重限制其在工业中的生产应用。基于此,通过组织培养和快速繁殖技术培育工业大麻幼苗,有助于解决大麻育种中难出苗、出苗弱等问题,进而加快工业大麻高产、高效和优质的步伐。
次氯酸钠作为一种低毒高效的消毒剂,既保持了消毒杀菌功效,又因其低毒害性不影响植物组织的正常生长。经过前人的不断摸索实践,乙醇和次氯酸钠的组合灭菌方式在水稻[6,7,8,9]、马铃薯[10]、玉米[11]、谷子[12]、大豆[13,14,15]等作物中均有运用,根据不同物种和组织的差异,组合搭配适宜浓度和处理时间。杨文军等[16]对粘两优4011中籼迟熟两系杂交水稻种子进行消毒处理发现,10%的次氯酸钠溶液消毒效果最好,最佳浸泡时间为1~5min。王朝君等[6]研究发现,次氯酸钠对水稻不育系乐3A种子的消毒效果最好,而且用浓度为5.5%的次氯酸钠溶液对水稻种子进行消毒处理15s时,对水稻内生菌破坏最小。陈冰[12]利用20%次氯酸钠对谷子种子进行消毒处理时发现,谷子Ci846的染菌率和发芽率随着处理时间的增加而降低,并确定了最优灭菌条件为70%的乙醇处理1min与20%的次氯酸钠处理5min,在此条件下谷子Ci846种子的染菌率为0.52%,发芽率为99.83%。杨琳[14]将吉大豆5号用75%酒精处理30s,10%的次氯酸钠浸泡20min后种子萌发率最高,芽诱导率显著升高。赵恢[10]对马铃薯种子进行灭菌处理时发现,75%乙醇处理30s和1%的次氯酸钠处理20min能对种子进行彻底消毒,并且发芽率最高。
目前,对工业大麻种子进行消毒处理在不少文献中已有报道。姜颖等[17]研究发现,用5%的次氯酸钠处理15min时,龙麻一号种子的灭菌效果最好,且出苗率高达91.97%。程超华等[18]对尤纱31、皖大麻、山西本地麻2号、汾麻3号的种子进行灭菌时发现,三重处理法(硫酸处理20min,75%乙醇处理2min,3%次氯酸钠处理20min)的灭菌效果为佳,同时也发现,不同品种间污染率和发芽率有明显差异。张利国等[19]研究发现,龙麻一号的种子用10%的次氯酸钠处理18 min以上杀菌效果最好,且发芽率达91%。上述报道中,同一处理后不同大麻品种的消毒效果差异显著,缺乏普适性的消毒处理方法可供选择,因此,针对不同的大麻品种类型需要探索其最适宜的次氯酸钠灭菌方法。
本研究选取3种不同类型的工业大麻品种的籽粒为研究对象,在前人研究基础上,设计了不同次氯酸钠浓度及处理时间组合,通过发芽率及污染程度比较,得出3个品种工业大麻种子消毒处理的最佳条件。
1 材料和方法
1.1 试验材料
供试材料晋麻1号(纤用型)、晋麻4号(药用型)、汾麻3号(籽用型)等工业大麻种子由山西农业大学经济作物研究所提供。次氯酸钠和乙醇由天津市北辰方正试剂厂生产。
1.2 试验方法
选取大小相近、饱满、色泽一致的工业大麻种子进行揉搓冲洗,将种子平铺于干燥通风处晾干,各品种取3300粒于玻璃瓶中避光保存。将选好的种子按品种分别置于3个烧杯中,加入适量的75%乙醇消毒2~3min后冲洗干净备用。然后将各品种工业大麻种子进行消毒(表1)。
表1 不同次氯酸钠浓度及处理时间
消毒试验设置2个次氯酸钠浓度(5%、10%)和5个处理时间(5、10、15、20、25 min),每个处理100粒种子,3次重复。待消毒完成后用无菌水冲洗3~4次,洗净种子表面的次氯酸钠。将消毒后的种子均匀放置在铺有3层湿润滤纸的带盖发芽盒中(滤纸和发芽盒已消毒),在种子上方盖上一层湿润滤纸,然后将发芽盒置于25℃、光强1000lx、12h光照/12h黑暗的恒温光照培养箱中。培养期间每天记录种子发芽数及污染粒数,保持滤纸湿润,并将污染种子及时剔除掉。每3d更换一次滤纸。
1.3 测定指标及方法
播种后,每天观察种子籽粒发芽情况和污染程度,统计种子萌发数和污染数。发芽标准为种子萌发出胚根、长度为种子自身长度的2倍。发芽率达到50%的天数第3天作为初次计数时间;种子发芽率达到最高,且再无种子萌发出现的天数第7天为末次计数时间。
发芽率(Gr)=n/N×100%(1)
发芽势(Ge)=m/N×100%(2)
污染率(Cr)=s/N×100%(3)
式中,n为最终达到发芽标准的发芽粒数,一般为7 d内正常发芽的种子数;m为3 d内的正常发芽种子数;s为试验中出现污染的种子数;N为供试种子数。
1.4 数据分析
所有数据均使用SPSS 12.0、Excel 2010软件进行统计分析。
2 结果与分析
2.1 不同次氯酸钠浓度及处理时间对晋麻1号种子萌发的影响
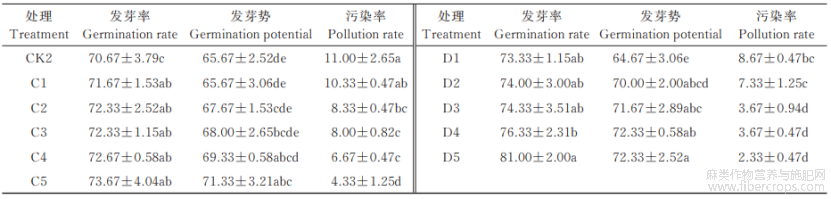
由表2可知,不同次氯酸钠浓度及处理时间对晋麻1号种子发芽率、发芽势及污染率均有影响。在5%次氯酸钠浓度下,种子发芽率、发芽势总体上随着处理时间的延长呈先升高后降低的趋势;在10%次氯酸钠浓度下,种子发芽率和发芽势随处理时间的延长呈逐渐降低的趋势。在相同的处理时间下,10%的次氯酸钠对种子萌发的影响较5%的次氯酸钠更明显。A3处理的发芽率最高,达到89.33%,A4处理次之。A4处理的发芽势最高,达到88.00%,A3处理略低,为86.00%。10个处理组合按污染率显著性水平大致分为2组,A1、A2、B1、B2处理组的污染比较严重,A3、A4、A5、B3、B4、B5处理为一组,污染率较低(约为3.33%~5.67%)。因此,本试验中A3、A4处理综合效果较优,即5%的次氯酸钠处理15~20 min时,晋麻1号的种子发芽率较高,且污染率较低。
表2 不同次氯酸钠浓度及处理时间对晋麻1号种子萌发的影响 %
注:表中同列小写字母为0.05水平上的显著性差异。下表同。
2.2 不同次氯酸钠浓度及处理时间对晋麻4号种子萌发的影响
从表3可以看出,晋麻4号种子的发芽率和发芽势随次氯酸钠浓度的升高和处理时间的延长呈逐渐升高的趋势;而污染率则相反,次氯酸钠浓度越高,处理时间越长,污染率越低。当10%的次氯酸钠处理25min(D5处理)时,晋麻4号种子的发芽率和发芽势最高(分别为81.00%、72.33%),分别较CK2高出14.62%、10.14%,污染率最低(2.33%),比CK2低78.82%,此时的发芽率、发芽势以及污染率与对照相比,均呈现显著性差异(P<0.05)。由此可见,晋麻4号种子消毒用10%的次氯酸钠处理25min为宜。
2.3 不同次氯酸钠浓度及处理时间对汾麻3号种子萌发的影响
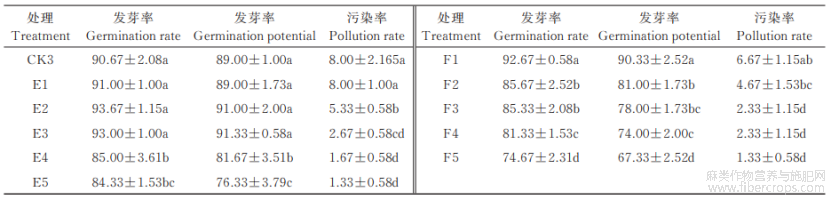
从表4可以看出,当次氯酸钠浓度为5%时,汾麻3号种子的发芽率和发芽势随处理时间的延长呈先升后降的趋势;当次氯酸钠浓度为10%时,发芽率和发芽势均呈逐渐降低的趋势。污染率在5%和10%的次氯酸钠浓度下,均随处理时间的延长缓慢降低。将10个处理组合的发芽率、发芽势和污染率作综合比较发现,当次氯酸钠浓度为5%,处理时间为15min(E3处理)时,汾麻3号的种子发芽率和发芽势最高,分别达93.0%、91.33%,污染率为2.67%,因此,该处理下的种子萌发和消毒效果最好。
表3 不同次氯酸钠浓度及处理时间对晋麻4号种子萌发的影响 %
表4 不同次氯酸钠浓度及处理时间对汾麻3号种子萌发的影响 %
3 结论与讨论
种子萌发是一个复杂有序的生理和形态发生过程,不仅受种子大小[20]等自身结构的影响,而且受生长环境和外界物理刺激影响[21,22,23,24,25]。次氯酸钠作为重要的消毒剂,其对种子的处理既是消毒处理过程,也是种子受到外界刺激的过程,该过程势必对种子萌发及后续无菌苗生长产生重要影响,而无菌苗的生长状况直接影响外源基因转化。因此,研究次氯酸钠对种子萌发及无菌苗生长的影响就显得十分必要。一般来说,较长的消毒时间可以降低污染率,但会对种子造成一定程度的破坏,影响种子的生存能力。因此,选择适宜的次氯酸钠浓度和处理时间,一方面降低染菌率,另一方面防止次氯酸钠消毒时间过长,抑制种子萌发,降低发芽率。在染菌率和发芽率之间选取适中的灭菌条件尤为重要。已有研究表明,纤用型工业大麻品种晋麻1号的种子千粒质量25.1~28g[26],药用型工业大麻品种晋麻4号种子千粒质量约16g左右,籽用型工业大麻品种汾麻3号的千粒质量为28~30g[27]。刘飞虎等[28]等指出种子发芽率与种子的色泽和千粒质量有关。本研究发现,籽用型汾麻3号种子的发芽率最高,药用型品种晋麻4号最低,晋麻1号居中,因此,分析造成该结果的原因可能与大麻种子自身的特性有关。
经次氯酸钠处理后,晋麻1号和汾麻3号种子在5%次氯酸浓度下发芽率和发芽势随处理时间延长呈现先升高后降低的明显变化,即低浓度短时间的次氯酸钠处理对晋麻1号和汾麻3号种子的萌发具有积极的促进作用,随着浓度的升高和处理时间的延长,种子萌发逐渐受到抑制,该结果可能是由于低浓度短时间的次氯酸钠能有效减少萌发过程中由于细菌感染而导致的萌发受阻,同时次氯酸钠轻微的腐蚀性对大麻种子的种皮具有一定的刺激作用,使得种皮角质化结构得到改善,种皮透性增加[29]。随着次氯酸钠浓度和处理时间达到一定程度后,次氯酸钠对种子的毒害作用开始显现,此时种子发芽率和发芽势均受到抑制。当利用次氯酸钠处理种子萌发时,低浓度短时间的次氯酸钠对种子萌发无显著影响,而长时间高浓度的次氯酸钠处理通常会抑制种子萌发。本研究发现,长时间高浓度的次氯酸钠促进晋麻4号萌发,或者说是晋麻4号的种子对高浓度长时间的次氯酸钠外界刺激表现出了明显不同于汾麻3号和晋麻1号的抗性,出现该抗性的原因有待进一步研究。在此过程中,3个不同类型的工业大麻种子均出现了种皮颜色变淡的情况,其中药用品种晋麻4号尤其明显,这可能是由于次氯酸钠对种皮的褪色作用所导致,该结果与KASSELAKI等[30]、吴华等[31]、刘昊等[32]的研究结果一致。
参考文献
[1] ODUOLA A A,BRUCE R M,SHAFIEKHANI S,et al. Impacts of industrial microwave and infrared drying approaches on hemp(Cannabis sativa L.)quality and chemical components[J].Food and Bioproducts Processing,2023,137:20-27.
[2] CALLAWAY J C. Hempseed as a nutritional resource:An overview[J]. Euphytica,2004,140(1):65-72.
[3] ANWAR F,LATIF S,ASHRAF M. Analytical characterization of hemp(Cannabis sativa)seed oil from different agroecological zones of Pakistan[J]. Journal of the American Oil Chemists'Society,2006,83(4):323-329.
[4] ORRIN D,HELEN J C,LINDA L,et al. Trial of cannabidiol for drug-resistant seizures in the dravet syndrome[J]. The New England Journal of Medicine,2017,376(21):2011-2020.
[5] 张静,粟建光,唐蜻,等.工业大麻腺毛研究进展[J].河南农业科学,2022,51(2):10-17.ZHANG J,SU J G,TANG Q,et al. Research progress on glandular hairs in Cannabis sativa L.[J]. Journal of Henan Agricultural Sciences,2022,51(2):10-17.
[6] 王朝君,李乐,张旭梅,等.水稻种子表面消毒方法的比较研究[J].乐山师范学院学报,2022,37(4):33-37,140.WANG C J,LI L,ZHANG X M,et al. Comparative study on methods of disinfection for rice seed surface[J]. Journal of Leshan Normal University,2022,37(4):33-37,140.
[7] 张晓磊,韦永贵,董卓娅,等.粳型恢复系C418转基因再生体系的建立[J].贵州农业科学,2019,47(12):4-7.ZHANG X L,WEI Y G,DONG Z Y,et al. Establishment of transgenic regeneration system for Japonica restorer line C418[J]. Guizhou Agricultural Sciences,2019,47(12):4-7.
[8] 史怀宇. LcAPX基因对植物镉耐受的影响及水稻组织培养条件的优化[D].天津:天津大学,2018.SHI H Y. Effects of LcAPX on plant cadmium resistance and optimizing of rice callus culture condition[D]. Tianjin:Tianjin University,2018.
[9] SUTRADHAR M,SAMANTA S,SINGH K B,et al. The effect of sodium hypochlorite(NaClO)and heat treatments on seed germination of rice:an approach to restore seed viability[J].Journal of Experimental Agriculture International,2021,43(5):49-53.
[10] 赵恢.马铃薯种子实生苗培育体系建立及茎尖脱毒培养条件优化[D].秦皇岛:河北科技师范学院,2018.ZHAO H. Establishment of seedling cultivation system for potato ture seeds and optimization system for virus-free culture conditions at stem tip[D]. Qinhuangdao:Hebei Normal University of Science&Technology,2018.
[11] 王洪振,陈徐,黄二冲,等.玉米种子消毒条件的优化及成熟胚愈伤组织诱导的研究[J].吉林师范大学学报(自然科学版),2014,35(4):91-94.WANG H Z,CHEN X,HUANG E C,et al. Study on optimization of disinfection condition of maize seeds and callus induction of maize mature embryos[J]. Journal of Jilin Normal University(Natural Science Edition),2014,35(4):91-94.
[12] 陈冰.谷子基因编辑体系的建立及香味基因SiBADH2突变体的获得[D].北京:中国农业科学院,2020.CHEN B. Establishment of gene editing system of millet and acquisition of SiBADH2 mutant of flavor gene[D]. Beijing:Chinese Academy of Agricultural Sciences,2020.
[13] 鲁中爽,史安迪,刘思言,等.大豆子叶节遗传转化受体体系的优化[J].吉林农业大学学报,2021,43(6):657-663.LU Z S,SHI A D,LIU S Y,et al. Optimization of genetic transformation system of soybean cotyledonary node[J]. Journal of Jilin Agricultural University,2021,43(6):657-663.
[14] 杨琳.吉大豆5号子叶节遗传转化体系的优化及GmPEPC4基因的功能分析[D].长春:吉林大学,2019.YANG L. Optimization of cotyledon node gene transformation system in Jidadou 5 and functional analysis of GmPEPC4 gene[D]. Changchun:Jilin University,2019.
[15] GALLI J A,PANIZI R,VIEIRA R D. Soybean seed health after six months of storage[J]. Revista Brasileira De Sementes,2007,29(2):205-213.
[16] 杨文军,李尚书,杨建国,等.水稻种子表面消毒的相关技术比较研究[J].种子科技,2023,41(1):18-20.YANG W J,LI S S,YANG J G,et al. Comparative study on related techniques of rice seed surface disinfection[J]. Seed Science&Technology,2023,41(1):18-20.
[17] 姜颖,夏尊民,韩承伟,等.工业大麻高效再生体系的初步研究[J].中国麻业科学,2015,37(3):126-129,147.JIANG Y,XIA Z M,HAN C W,et al. Preliminary study on efficient regeneration system of industrial hemp(Cannabis sativa L.)[J]. Plant Fiber Sciences in China,2015,37(3):126-129,147.
[18] 程超华,李育君,赵立宁,等.三重处理法获得大麻种子无菌苗研究[J].中国麻业科学,2011,33(1):24-26,38.CHENG C H,LI Y J,ZHAO L N,et al. Study on germfree hemp seedlings by three-step treatment[J]. Plant Fiber Sciences in China,2011,33(1):24-26,38.
[19] 张利国,宋宪友,房郁妍,等.大麻新品种龙大麻一号再生体系初探[J].中国麻业科学,2012,34(3):112-114,124.ZHANG L G,SONG X Y,FANG Y Y,et al. Preliminary study on establishing regeneration system of new hemp cultivarlongdama 1[J]. Plant Fiber Sciences in China,2012,34(3):112-114,124.
[20] ADJI B I,AKAFFOU D S,DE REFFYE P,et al. Maternal environment and seed size are important for successful germination and seedling establishment of Pterocarpus erinaceus(Fabaceae)[J]. Journal of Forestry Research,2022,33(3):977-990.
[21] 李静,蒋舒蕊,赵威,等.外源萘乙酸对高温胁迫下番茄种子萌发的影响[J].长江蔬菜,2022(12):55-57.LI J,JIANG S R,ZHAO W,et al. Effects of exogenous naphthylacetic acid on tomato seed germination under high temperature stress[J]. Journal of Changjiang Vegetables,2022(12):55-57.
[22] 秦尧,刘畅,刘大军,等.外源水杨酸对高温胁迫下菜豆种子萌发的影响[J].中国农学通报,2022,38(18):79-85.QIN Y,LIU C,LIU D J,et al. Exogenous salicylic acid:effects on seed germination of snap bean under high temperature stress[J]. Chinese Agricultural Science Bulletin,2022,38(18):79-85.
[23] 郝西,崔亚男,张俊,等.过氧化氢浸种对花生种子发芽及生理代谢的影响[J].作物学报,2021,47(9):1834-1840.HAO X,CUI Y N,ZHANG J,et al. Effects of hydrogen peroxide soaking on germination and physiological metabolism of seeds in peanut[J]. Acta Agronomica Sinica,2021,47(9):1834-1840.
[24] 朱利君,闫秋洁,陈光升,等.外源H2O2通过介导抗氧化酶、ABA和GA促进高盐胁迫下黄瓜种子的萌发[J].植物生理学报,2019,55(3):342-348.ZHU L J,YAN Q J,CHEN G S,et al. Exogenous H2O2 promotes seed germination under high salinity by regulating antioxidant enzymes,ABA and GA interaction in cucumber(Cucumis sativus)[J]. Plant Physiology Journal,2019,55(3):342-348.
[25] 郑蔚虹,冷建梅.青霉素、过氧化氢和高锰酸钾浸种对沙棘种子萌发及幼苗生长的影响[J].种子,2003,22(6):21-22,29.ZHENG W H,LENG J M. Effect on germination of seed and growth of seeding by penicillin,hydrogen peroxide and potassium permanganate to Hippohae rhamnoides[J]. Seed,2003,22(6):21-22,29.
[26] 孔佳茜,康红梅,赵铭森,等.大麻新品种“晋麻1号”选育报告[J].中国麻业科学,2011,33(5):217-219.KONG J Q,KANG H M,ZHAO M S,et al. Breeding of a new hemp variety"Jinma 1"[J]. Plant Fiber Sciences in China,2011,33(5):217-219.
[27] 康红梅,赵铭森,孔佳茜,等.工业大麻新品种汾麻3号的选育[J].种子,2017,36(6):114-116.KANG H M,ZHAO M S,KONG J Q,et al. Breeding of a new hemp variety Fenma 3[J]. Seed,2017,36(6):114-116.
[28] 刘飞虎,杨明.工业大麻的基础与应用[M].北京:科学出版社,2015:36,68.LIU F H,YANG M. Foundation and application of industrial hemp[M]. Beijing:Science Press,2015:36,68.
[29] 颜妙珍,李兰兰,冯名开,等.不同处理方法对百香果种子萌发的影响[J].广东农业科学,2022,49(2):37-44.YAN M Z,LI L L,FENG M K,et al. Effects of different treatments on seed germination of passion fruit[J]. Guangdong Agricultural Sciences,2022,49(2):37-44.
[30] KASSELAKI A M,GOUMAS D,TAMM L,et al. Effect of alternative strategies for the disinfection of tomato seed infected with bacterial canker(Clavibacter michiganensis subsp.michiganensis)[J]. NJAS-Wageningen Journal of Life Sciences,2011,58(3/4):145-147.
[31] 吴华,高志鹏,陈高,等.不同消毒处理对豇豆种子无菌培养的效应[J].江汉大学学报(自然科学版),2015,43(5):389-392.WU H,GAO Z P,CHEN G,et al. Effects of different disinfectant on cowpea seeds'sterilization culture[J]. Journal of Jianghan University(Natural Science Edition),2015,43(5):389-392.
[32] 刘昊,杨雨晴,邵一飞,等.番茄种子消毒方法探究[J].山东农业大学学报(自然科学版),2019,50(3):393-398.LIU H,YANG Y Q,SHAO Y F,et al. Exploration for the disinfectant method of tomato seed[J]. Journal of Shandong Agricultural University(Natural Science Edition),2019,50(3):393-398.
文章摘自:薛红丽,赵铭森,孔佳茜,等.不同类型工业大麻品种对次氯酸钠的适应性分析[J].山西农业科学,2024,52(03):15-20.