摘 要:红麻(Hibiscus cannabinus L.)是我国重要的经济作物,主要分布在安徽、福建、河南等地区,其纤维和茎秆具有丰富的应用价值。随着红麻种植区域向干旱山坡地转移,其抗逆性研究变得尤为关键。研究通过称重法控制水分,模拟干旱环境,选取“红优2号”作为试验品种,通过盆栽试验进行干旱处理,设置3个硅浓度(0.2、0.5、0.8g/L,标记为Si0.2、Si0.5、Si0.8),探究不同硅浓度对不同生长期红麻在干旱胁迫条件下的生理响应和生长状况的影响,以及硅对红麻抗旱性能的潜在调控机制。结果显示,喷施0.5g/L硅溶液对株高和茎粗的效果最佳,分别较干旱处理增加50.00%和22.76%。综合对叶片结构和生理指标的影响,以0.5g/L的硅溶液喷施效果最佳。试验证实了硅在提高红麻抗旱性方面的积极作用,为提升红麻在全生育期的抗旱能力提供了实践指导和理论依据。
关键词:红麻;干旱胁迫;硅;生长发育
红麻(Hibiscus cannabinus L.)作为我国重要的经济作物[1],其种植主要集中在安徽、福建、河南等地区。由于红麻具有广泛的工业用途[2],因此对于提高其产量和品质的研究具有重要意义。红麻的生长周期大约为145~180d,分为苗期、旺长期、稳长期和生殖生长期4个阶段[3],生殖生长阶段的现蕾期是收获纤维的最佳时期,原麻产量可达7500kg/hm2。红麻茎由外部的韧皮部和内部木质部以及中心的髓部的不同类型细胞组成[4],致密的茎秆结构使得红麻在工业上有着广泛的应用。
然而,红麻的种植区域普遍面临水资源短缺或季节性降水不均的挑战。随着全球气候变化的加剧,干旱对农业生产的压力日益增大,尤其是在红麻这类对水分敏感的作物上。干旱胁迫不仅影响红麻的生长和发育,还严重影响其产量和纤维品质的形成,给红麻的生产带来严重的威胁[5]。因此,研究和开发适应干旱环境的种植技术,对于保障红麻产业的可持续发展具有重要的战略意义。
硅作为一种在地壳中含量丰富的元素,约占27.6%[6],主要以二氧化硅和硅酸盐的形式存在。近年来,硅在植物生长和环境适应性方面的作用受到了广泛关注。硅不仅能够改变植物叶片的水势、调节气孔导度和蒸腾作用,还能参与渗透调节和改善根系的水分吸收,从而提高植物的抗旱能力[7]。尽管硅肥在提高其他作物抗旱性方面的积极作用已被证实,但关于硅对红麻抗旱机理的深入研究仍然不足。因此,本研究旨在探讨硅肥对红麻在干旱胁迫条件下生长状况的影响,以及其潜在的作用机制,为红麻的抗旱栽培提供理论依据和技术支持。
1 材料与方法
1.1 试验材料
本试验红麻品种为红优2号,该品种由福建农林大学选育。
1.2 试验设计
试验地点位于华中农业大学植物科学技术学院三田试验基地,2022年4-12月进行红麻种植试验,筛选形态完整、大小均一的种子,以确保试验材料的一致性。每盆套袋装土13kg,播种12粒种子,5月20日定苗,每盆保留长势相近的植株4株,确保试验结果的可靠性。
种植土为农田土,全部肥料作为基肥,每盆肥料用量为:N 0.25g/kg、P2O50.03g/kg、K2O 0.15g/kg,氮肥用尿素(含46%),磷肥用过磷酸钙(含P2O5 12%),钾肥用氯化钾(含K2O 52%)。土壤基本信息如下:田间最大持水量250 g/kg,碱解氮382.2mg/kg,速效磷71.61mg/kg,速效钾919.75mg/kg,有机质含量为2.16%,总氮4.78g/kg,总磷1.04g/kg,总钾1.52mg/kg,pH=7.48。
试验共设置5种处理条件:常规水分处理(W,维持田间持水量为60%~70%)、干旱处理(D,田间持水量控制为40%~50%),以及3种不同浓度的硅溶液喷施处理(Si0.2、Si0.5、Si0.8,均在干旱条件下进行,即田间持水量维持在40%~50%),每个处理重复10次。硅源选用分析纯的K2SiO3·9H2O,以确保硅元素的纯度和生物利用性。在红麻的关键生长发育阶段,即苗期、旺长期、稳长期和现蕾期,使用硅溶液进行喷施处理,每隔3 d喷施1次,共计4次。
1.3 测定项目与方法
在苗期、旺长期、稳长期和现蕾期每个重复选取有代表性红麻植株10株,分别用卷尺、游标卡尺测定株高、茎粗。
叶片结构在播种150 d取红麻叶片,用50% FAA固定液预处理叶片,由武汉市洪山区博衍生物试剂公司采用常规石蜡切片法对红麻叶片进行脱水、透明、包埋等处理,采用光学显微镜观察叶片组织结构,用ImageJ测量各结构形态。
叶片电导率值采用电导率仪DDS-12DW(上海般特仪器有限公司)测定。
丙二醛(MDA)、脯氨酸(Pro)、可溶性糖(SS)含量、超氧化物歧化酶活性(SOD)、过氧化氢酶(POD)活性分别采用硫代巴比妥酸法、酸性茚三酮法、蒽酮比色法、氮兰四唑光化还原法、愈创木酚法,均参照《植物生理生化实验原理与技术(第3版)》[8]。过氧化氢酶(CAT)采用北京索莱宝科技有限公司试剂盒(货号:BC0205)按照说明书测定并计算结果。
1.4 数据处理与分析
使用Excel 2016进行数据处理,Origin 2021软件做图。使用SPSS 26统计并进行数据分析,采用Ducan法进行多重比较,显著性水平设为0.05。
2 结果与分析
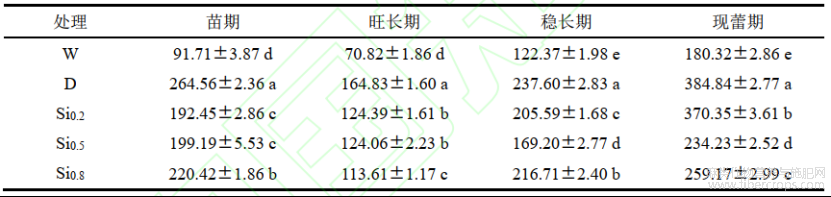
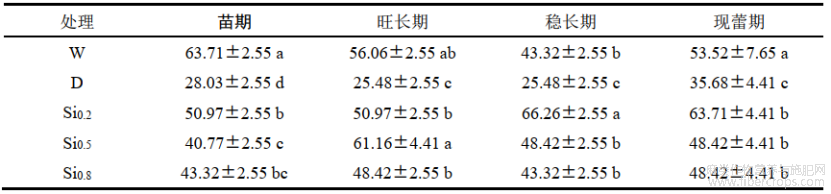
2.1 不同处理对红麻株高、茎粗的影响
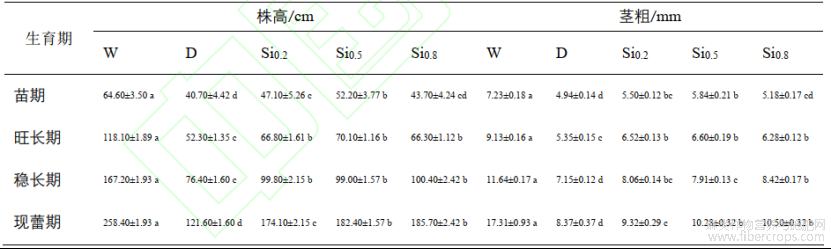
株高、茎粗是判断生长状况的重要指标之一。由表1可知,干旱胁迫后,株高、茎粗的生长受到显著抑制,各时期D处理株高分别较W降低了37.00%、55.72%、54.31%和52.94%;各时期D处理茎粗分别较W降低了31.67%、41.40%、38.57%和51.65%。施硅后在各时期株高、茎粗均显著高于D处理。Si0.8处理稳长期和现蕾期株高、茎粗略高于其余硅处理,现蕾期的不同硅处理株高分别较D处理增加了43.17%、50.00%和52.71%;现蕾期不同硅处理的茎粗分别较D处理增加了11.35%、22.82%和25.45%。
表1不同处理对红麻株高、茎粗的影响
注:同列不同小写字母表示5%显著水平差异。下同
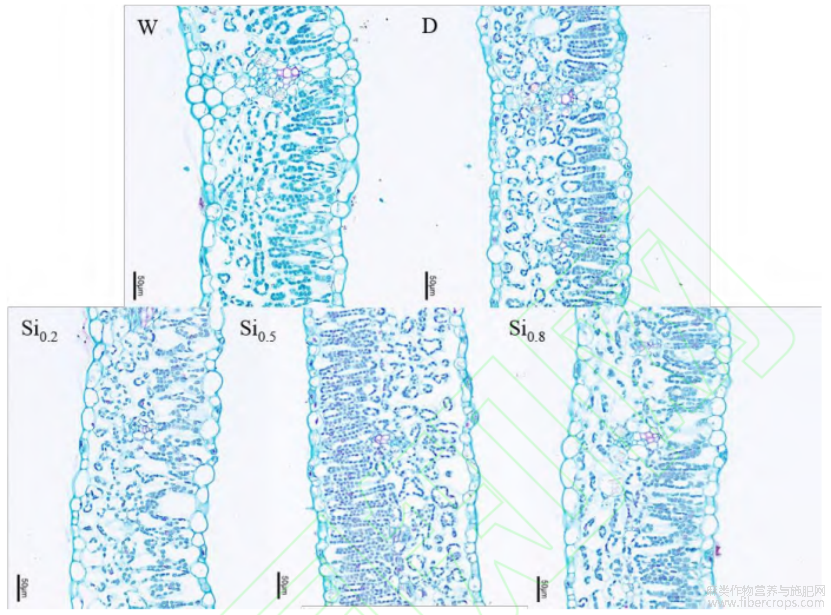
2.2 不同处理对红麻稳长期叶片结构的影响
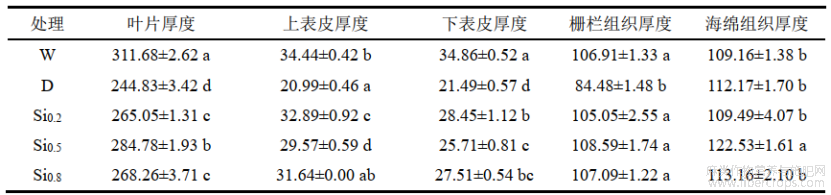
由表 2可知,随着硅浓度的增加,叶片厚度、栅栏组织厚度和海绵组织厚度呈先增加后降低的趋势,其中Si0.5在叶片厚度、栅栏组织厚度和海绵组织厚度与其他浓度硅处理相比,较D处理增加,分别增加了16.32%、28.54%和9.24%。Si0.2处理后上表皮和下表皮厚度均显著高于D处理,分别较D处理增加了56.69%和32.39%。硅浓度增加到0.8g/L时,虽较D处理有显著性差异,但各组织结构厚度与其他浓度处理相比均在中等水平。说明植物通过施硅显著增加了各组织结构的厚度,利于内含物质进出,提高光合作用及气体交换能力。
表2不同处理对红麻稳长期叶片结构的影响 单位:μm
图1 不同处理对红麻稳长期叶片结构的影响
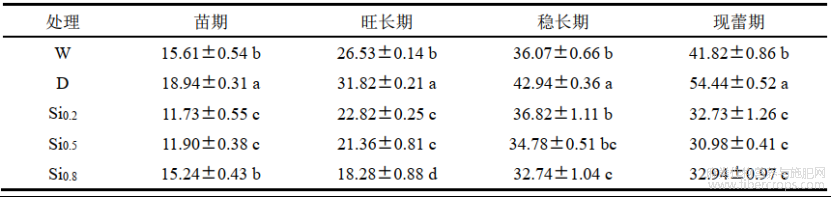
2.3 不同处理对红麻叶片电导率的影响
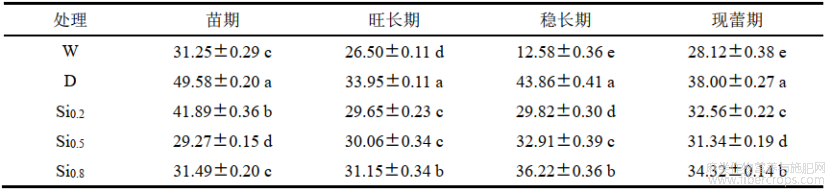
由表 3可知,在红麻生长各时期,D处理较W处理电导率显著升高,分别增加了58.66%、28.11%、248.65%和35.14%,说明红麻干旱胁迫后破坏了细胞膜结构,导致细胞液外渗,电导率增大。Si0.2在旺长期、稳长期的电导率最低,分别较D处理降低了12.67%和32.01%;Si0.5在苗期、现蕾期的电导率最低,分别较D处理降低了40.96%和17.53%。Si0.8在不同时期较D处理均有降低趋势,但不是最佳效果。说明施硅可以增加红麻细胞膜稳定性,减少内含物质渗出,降低红麻电导率。
表3不同处理对红麻叶片电导率的影响 单位:%
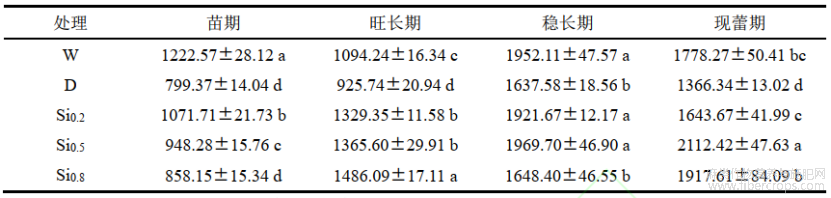
2.4 不同处理对红麻叶片丙二醛含量的影响
丙二醛是反应细胞膜脂过氧化程度的重要指标。由表4可知,D处理较W处理MDA含量显著增加,各时期分别增加了84.75%、74.30%、91.02和110.14%。随硅溶液喷施浓度的增加,丙二醛含量基本上呈先降低后上升的趋势,与D处理相比均显著降低,苗期、旺长期、稳长期以Si0.5效果最佳,分别较D处理减少了60.63%、48.48%、37.30%;现蕾期以Si0.2效果最佳,较D处理减少了49.75%。说明适量的硅可以减缓膜脂过氧化,减轻红麻受胁迫的程度。
表4不同处理对红麻叶片丙二醛含量的影响 单位:nmol/g
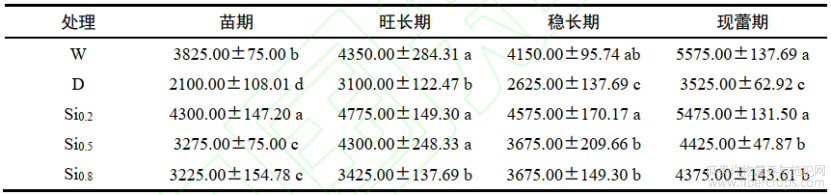
2.5 不同处理对红麻叶片脯氨酸含量的影响
脯氨酸可以稳定原生质体,防止细胞脱水。由表5可知,在红麻生长的全生育期,D处理后脯氨酸含量较W处理显著上升,分别增加了188.47%、132.74%、94.17%和113.42%。从苗期开始,红麻脯氨酸含量呈现先降低后增加的趋势。不同硅处理脯氨酸含量与D处理相比均显著性降低,苗期以Si0.2处理效果最佳,较D处理降低了27.26%;旺长期以Si0.8处理效果最佳,较D处理降低了31.07%;稳长期和现蕾期以Si0.5处理效果最佳,分别较D处理降低了28.79%和39.14%。
表5不同处理对红麻叶片脯氨酸含量的影响 单位:mg/g
2.6 不同处理对红麻叶片可溶性糖含量的影响
植物在逆境下会增加可溶性糖以维持细胞渗透压。由表6可知,D处理后各时期的可溶性糖含量均显著上升,分别较W处理增加了21.33%、19.94%、19.05%和30.18%。随着干旱胁迫时间的延长,红麻体内的可溶性糖含量出现上升的趋势。苗期以Si0.2效果最佳,较D处理降低了38.07%;Si0.8处理在旺长期、稳长期的可溶性糖含量最低,较D处理降低了42.55%和23.75%;现蕾期的可溶性糖含量为Si0.5最低,较D处理降低了43.09%,故受胁迫程度最小。
表6不同处理对红麻叶片可溶性糖含量的影响 单位:%
2.7 不同处理对红麻叶片超氧化物歧化酶活性的影响
超氧化物歧化酶能够催化超氧阴离子分解为过氧化氢和氧气,平衡细胞内的氧化平衡反应,植株体内的SOD水平反映了抗氧化能力水平的高低。由表 7可以得出,D处理后各时期SOD活性显著降低,说明干旱处理受胁迫影响较大,分别较W处理降低了34.62%、15.40%、16.11%和23.16%。喷施硅溶液后,苗期以Si0.2处理效果最佳,较D处理显著增加了34.07%;旺长期Si0.8处理效果最佳,较D处理显著增加了60.53%;稳长期和现蕾期Si0.5处理SOD活性最高,分别较D处理增加了20.28%和54.60%。
表7不同处理对红麻叶片超氧化物歧化酶活性的影响 单位:U/g
2.8 不同处理对红麻叶片过氧化物酶活性的影响
过氧化物歧化酶可以催化并还原过氧化氢转化为水。由表8可知,全生育期D处理受干旱胁迫的影响,POD活性分别较W处理降低了45.10%、28.74%、36.75%和36.77%;苗期、旺长期、稳长期、现蕾期POD活性均以Si0.2处理最高,分别较D处理提高了104.76%、54.03%、74.29%、55.32%。说明硅在适当干旱的条件下,可以提高POD活性,增强红麻抗逆性。
表8不同处理对红麻叶片过氧化物酶活性的影响 单位:U/g
2.9 不同处理对红麻叶片过氧化氢酶活性的影响
过氧化氢酶可以催化过氧化氢分解。由表9可知,与SOD、POD趋势一致,全生育期D处理CAT活性受到显著抑制,各时期较W处理降低了56.00%、54.55%、41.18%和33.33%;Si0.2处理在苗期、稳长期、现蕾期的CAT活性高于其余两个硅处理,较D处理增加了45.45%、160.05%、78.56%。旺长期以Si0.5效果最佳,较D处理增加了140.00%。从旺长期开始,Si0.2处理CAT活性随着干旱时间的延长而升高,而Si0.5处理的CAT活性呈先升高后降低并在稳长期趋于稳定,Si0.8处理的CAT活性变化幅度不大,但均对干旱胁迫起到缓解作用。
表9不同处理对红麻叶片过氧化氢酶活性的影响 单位:U/g
3.讨论
喷施硅可以提高小麦的抗旱性,在叶片表面形成保护层,降低蒸腾作用[9]。硅的施用可以改变农艺性状的基因功能从而增强干旱胁迫条件下小麦的产量[10]。刘娇等[11]研究结果表明,适量硅可以显著增加烟草幼苗的株高。本试验研究结果显示,干旱条件下,喷施硅溶液后红麻株高与茎粗显著高于干旱处理,较D处理相比,苗期和旺长期的株高与茎粗在Si0.5处理后达到最大值,而稳长期和现蕾期在Si0.8处理后对红麻株高、茎粗促进效果最佳,说明硅可以增加红麻根系对水分与养分的吸收,从而促进植株的生长发育,这与秦岭韵等[12]的研究结果相似。
植物体内靠酶促反应与非酶促反应的共同作用,缓解活性氧与渗透调节的过量积累和维持渗透压平衡等,以维持植株内环境稳态[13]。硅可以在干旱胁迫下提高抗氧化能力、维持养分平衡从而抵抗胁迫、促进生长、提高产量和品质[14]。张环玮等[15]研究结果显示,外源硅显著提高了干旱胁迫下烟草幼苗中SOD、POD以及CAT的活性。本研究中,D处理较W处理抗氧化酶活性显著降低,不同浓度硅喷施后均可显著提高SOD、POD与CAT的活性,其中SOD以Si0.5处理后效果最佳,POD与CAT以Si0.2效果最佳,但浓度达到0.8 g/L时,酶活性受到抑制。这与张杰等[16]通过施用硅缓解干旱胁迫下燕麦的研究结果相似。
电导率的变化可以反映植物细胞的结构和功能的完整性[17],在旺长期和稳长期Si0.2处理的电导率显著低于D处理。这与刘海莉等[18]通过施硅提高Lsi基因转录进而提高平邑甜茶幼苗体内硅的含量,缓解干旱胁迫对幼苗的氧化伤害,促进生长的研究结果相似。喷施硅可以提高小麦的抗旱性,在叶片表面形成保护层,蒸腾作用减少,抗旱能力增强[9]。刘球等[19]研究发现,控水后红椿叶片结构变化显著,其叶片厚度、表皮厚度、栅栏组织厚度与海绵组织厚度均呈现下降趋势。周秀杰等[20]发现,硅可以通过改变黄瓜叶片结构降低蒸腾速率,提高叶片保水能力。
本研究中,干旱处理后的红麻叶片结构指标均有不同程度的降低,施硅后显著提高叶片结构厚度,这与上述研究结果一致。郑世英等[21]通过根施K2SiO3缓解干旱胁迫下小麦幼苗的研究发现,施用硅可以降低MDA与Pro的含量。本试验研究表明,红麻叶片受到干旱胁迫后,MDA含量显著上升,喷施硅溶液后,各时期MDA含量均显著降低;在生长后期,Si0.5处理的Pro含量达到最低,是缓解干旱胁迫的最佳处理;在植物生长中期,Si0.8处理可溶性糖含量在施硅处理中最低,说明其受胁迫程度最小,而生长后期为Si0.5处理最佳,这与范小玉等[22]对茄子幼苗的研究结果一致。
4.结论
目前,硅虽未被证实是植物的必需元素,但已被广泛研究且证实其能够缓解生物及非生物胁迫。本研究首次证实了外源硅对红麻干旱胁迫的缓解效应,研究发现:干旱胁迫下施硅可以改善红麻的农艺性状;加厚薄壁组织,增加气体交换面积的同时提高叶片的保水能力;维持细胞稳态,减少渗透物质的积累及内含物渗出,降低因胁迫升高的MDA、SS、Pro含量,从而降低叶片电导率;提高抗氧化物酶SOD、POD、CAT活性,增强活性氧清除能力。综上,从不同处理的生长指标、生理指标和叶片结构等指标综合来看,0.5 g/L的硅溶液喷施效果最佳。说明硅激发了红麻耐旱防御机制,实现增产增效,为硅在红麻抗逆研究中提供理论基础和技术指导。
参考文献
[1]熊和平. 2014-2015国家麻类产业技术发展报告[M]. 北京: 中国农业科学技术出版社, 2016: 4-5.
[2]李学姣, 阮培英, 刘光泽, 等. 主要麻类作物综合利用研究现状[J]. 中国麻业科学, 2023, 45(3): 136-143.
[3]胡立勇, 丁艳锋. 作物栽培学[M]. 北京: 高等教育出版社, 2019: 454-455.
[4]Karimi S, Tahir P M, Karimi A, et al. Kenaf bast cellulosic fibers hierarchy: A comprehensive approach from micro to nano[J]. Carbohydrate Polymers, 2014, 101: 878-885.
[5]赵信林, 韦秀叶, 邱化蛟, 等. 红麻抗逆栽培利用研究进展[J]. 中国麻业科学, 2020, 42(2): 91-96.
[6]Coskun D, Britto D T, Huynh W Q, et al. The role of silicon in higher plants under salinity and drought stress[J]. Frontiers in Plant Science, 2016: 7.
[7]苏素苗, 杨春雷, 饶雄飞, 等. 硅对植物抗逆性影响的研究进展[J]. 华中农业大学学报, 2022, 41(6): 160-168.
[8]王学奎, 黄见良. 植物生理生化试验原理与技术[M]. 北京: 高等教育出版社, 2015: 171-286.
[9]耿若飞, 程志杰, 王二伟, 等. 叶面喷施硅肥对干旱胁迫下冬小麦生理特性和产量的影响[J]. 江苏农业科学, 2024, 52(1): 112-116.
[10]Christian M M, Shimelis H, Laing M D, et al. The effect of silicon fertilizers on agronomic performance of bread wheat under drought stress and non-stress conditions[J]. Journal of Agronomy and Crop Science, 2023, 209(6): 827-840.
[11]刘娇, 姜永雷, 蔺璟煜, 等. 外源硅对干旱胁迫下烟草生长及生理特性的影响[J]. 云南农业大学学报(自然科学), 2023, 38(2): 306-313.
[12]秦岭韵, 翟玉莹. 硅肥对干旱胁迫下曲麻菜生长及生理特性的影响[J]. 现代园艺, 2024, 47(5): 62-63.
[13]Pommerrenig B, Ludewig F, Cvetkovic J, et al. In concert: Orchestrated changes in carbohydrate homeostasis are critical for plant abiotic stress tolerance[J]. Plant and Cell Physiology, 2018.
[14]Ahanger M A, Bhat J A, Siddiqui M H, et al. Integration of silicon and secondary metabolites in plants: a significant association in stress tolerance[J]. Journal of Experimental Botany, 2020, 71(21): 6758-6774.
[15]张环纬, 陈彪, 温心怡, 等. 外源硅对干旱胁迫下烟草幼苗生长、叶片光合及生理指标的影响[J]. 生物技术通报, 2019, 35(1): 17-26.
[16]张杰, 闫志坚, 尹强, 等. 硅对干旱胁迫下燕麦幼苗光合和生理特性的影响[J]. 中国草地学报, 2020, 42(4): 50-55.
[17]马村艺, 郝春磊, 张黎. 聚乙二醇模拟干旱胁迫对矾根组培苗生理特性的影响[J]. 分子植物育种, 2023, 21(22): 7524-7530.
[18]刘海莉, 杨蕾蕾, 辛苗苗, 等. 硅对平邑甜茶幼苗干旱胁迫伤害的缓解[J]. 江苏农业学报, 2019, 35(4): 904-910.
[19]刘球, 吴际友, 杨硕知, 等. 叶面喷施外源多胺对干旱胁迫下红椿叶片解剖结构的修复效果[J]. 中南林业科技大学学报, 2019, 39(3): 16-22.
[20]周秀杰, 赵红波, 马成仓, 等. 外源硅对黄瓜叶片组织结构和保水能力的影响[J]. 生态学杂志, 2009, 28(3): 556-559.
[21]郑世英, 郑建峰, 徐建, 等. 外源硅对PEG胁迫下小麦幼苗生长及抗氧化酶活性的影响[J]. 干旱地区农业研究, 2017, 35(2): 74-78.
[22]范小玉, 赵跃锋, 张清华. 硅肥对干旱胁迫下茄子幼苗生长及生理特性的影响[J]. 江苏农业科学, 2022, 50(9): 122-127.
文章摘自:王婧,王雨千,刘立军.不同浓度硅提高红麻抗旱机理研究[J/OL].中国麻业科学:1-8[2024-06-12].http://kns.cnki.net/kcms/detail/43.1467.S.20240523.1940.014.html.