摘 要:【目的】对工业大麻ZF-HD(Zincfinger-homeodomain)转录因子进行鉴定和表达模式分析,为ZF-HD功能研究及工业大麻遗传性状的改良提供理论参考。【方法】对5个工业大麻ZF-HD转录因子的基因结构、蛋白理化性质、蛋白系统进化关系和启动子顺式作用元件进行生物信息学分析,通过实时荧光定量PCR(qRT-PCR)对基因表达量进行检测。【结果】5个CsZF-HD基因分布于大麻基因组的2条染色体上,其编码序列长度为783~1185bp,编码260~394个氨基酸残基,蛋白分子量27.95~43.33ku,理论等电点为7.46~8.87。它们编码的蛋白均含有1个保守的ZF-HD_dimer结构域,均为不稳定的亲水性蛋白且定位于细胞核中。ZF-HD蛋白家族分为3个亚族(A、B和C),CsZF-HD1和CsZF-HD2属于A亚族,CsZF-HD3属于C亚族,CsZF-HD4和CsZF-HD5属于B亚族。CsZF-HD1和CsZF-HD2在茎和叶中的表达量相差不明显,在根中表达量最低;CsZF-HD3在茎中的表达量最高,叶中表达量最低;CsZF-HD4在叶中的表达量最高,根中表达量最低;CsZF-HD5在根中表达量最高,茎中表达量最低。5个CsZF-HD基因均对盐和干旱胁迫响应,其中CsZF-HD1和CsZF-HD3在盐和干旱胁迫下表达量升高最明显。5个CsZF-HD基因启动子序列中均含有不同种类和数量的逆境相关顺式作用元件。【结论】ZF-HD转录因子可能在工业大麻应对盐和干旱胁迫时发挥转录调控作用。
关键词:工业大麻;ZF-HD转录因子;生物信息学分析;干旱胁迫;盐胁迫
【研究意义】大麻(CannabissativaL.)是大麻科(Cannabinaceae)大麻属(Cannabis)一年生草本植物,通常为雌雄异株,异花授粉。一般将四氢大麻酚(Tetrahydrocannabinol,THC)含量低于0.3%的大麻称为工业大麻[1]。工业大麻是一种可持续的多功能经济作物,其种子营养丰富,茎秆可生产高质量的纤维,花叶中提取的大麻素能够应用于多个领域[2]。但是,干旱和盐胁迫会严重影响大麻的品质和产量,是限制大麻生长的主要环境因素。植物的生长由基因网络通过编码各种蛋白质系统地控制。在这些蛋白质中,转录因子蛋白能够与特定的核苷酸序列结合进而调控靶基因的表达,在植物的生长发育及防御和胁迫响应过程中发挥着重要的作用[3]。因此,工业大麻中抗逆相关转录因子基因的筛选和鉴定对工业大麻抗性品种的选育具有重要意义。【前人研究进展】锌指同源异型结构域(Zincfinger-homeodomain,ZF-HD或ZHD)蛋白是广泛存在于植物中的一类转录因子,首次在黄菊属植物中被发现,它们能够调控C4磷酸烯醇丙酮酸羧化酶基因的表达[4]。ZF-HD转录因子的氨基酸序列中含有保守的HD结构域(Homeodomain)和C2H2型ZF结构域(C2H2-typezincfingermotif)[4]。高度保守的HD结构域编码60个氨基酸的同源异形盒结构域,负责与DNA序列特异性结合[5]。典型的ZF结构域包含两对保守的半胱氨酸和/或组氨酸残基,能够与单个Zn2+结合形成稳定的环状结构[6-7]。ZF结构域并不能够直接与DNA序列的结合,但其可以通过HD结构域调节蛋白与DNA的互作[4]。ZF-HD转录因子在植物生长发育及应对各种胁迫过程中发挥重要的转录调控作用[8]。拟南芥ZF-HD转录因子家族有14个成员,它们主要在花中表达,在花发育过程中可能起调节作用[5]。其中,AtZFHD1能够与拟南芥脱水胁迫早期响应基因ERD1启动子特异性结合,且AtZFHD1能够被干旱、盐胁迫和脱落酸处理诱导表达,其过表达增强了拟南芥对干旱胁迫的耐受性[9]。在玉米的24个ZF-HD基因中,ZmZHD11和ZmZHD12在ABA、干旱和高盐胁迫诱导下表达量显著升高,它们可能通过ABA信号传导途径调控玉米的胁迫耐受性[10]。大豆GmZF-HD1和GmZF-HD2可以对病原菌的攻击做出响应,并激活参与防御反应的GmCAM4基因的表达[11]。大白菜的24个ZF-HD成员大部分在花中优先表达,并且能够被光周期、春化及非生物胁迫显著诱导表达,意味着它们在控制开花和胁迫响应中发挥重要作用[12]。番茄SlZHD13的表达能够被干旱和盐胁迫诱导,但该基因沉默后植株的耐旱性和耐盐性均下降[13-15]。【本研究切入点】目前为止,工业大麻中ZF-HD转录因子的功能鉴定尚未开展。【拟解决的关键问题】本研究对工业大麻中的5个ZF-HD基因进行生物信息学分析,并对它们在根、茎和叶以及盐和干旱胁迫下的表达量进行检测,为后续利用ZF-HD转录因子调控大麻抗逆性的研究提供理论依据。
1材料与方法
1.1材料与处理
工业大麻品种为‘庆大麻3号’。在光周期为8h光照26℃/16h黑暗16℃,湿度为55%的光照培养箱中,对生长6周且长势一致的工业大麻幼苗浇灌500mmol/LNaCl水溶液进行盐胁迫处理。在盐胁迫处理前(0d)及盐胁迫处理的0.5、1、2、4和6d分别剪取0.1g叶片。对同样的工业大麻幼苗停止浇水进行干旱胁迫处理。在停止浇水前(0d)以及干旱胁迫处理的1、4、8、12和16d分别剪取0.1g叶片。同时取未处理的工业大麻根和茎0.1g。所有样本均于液氮中迅速冷冻后转移至-80℃冰箱中保存。
1.2生物信息学分析
在植物转录因子数据库PlantTFDB(http://planttfdb.gao-lab.org/index.php?sp=Csa)中获取大麻ZF-HD转录因子的基因和蛋白序列。利用SMART(http://smart.embl-heidelberg.de/)网站分析蛋白的保守结构域,用DNAMAN软件进行蛋白多重序列比对分析。ProtParam(https://web.expasy.org/protparam/)分析蛋白的基本理化性质。ProtScale(https://web.expasy.org/protscale/)分析蛋白的亲疏水性。GenScript(https://www.genscript.com/psort.html?src=leftbar)预测蛋白的细胞内定位。MEME(https://meme-suite.org/meme/tools/meme)预测蛋白的保守基序(Motif),使用TBtools软件对预测结果进行可视化整理。在NCBI数据库中下载已鉴定的拟南芥、番茄、葡萄和苹果ZF-HD蛋白序列,使用MEGA7.0软件邻接法构建蛋白系统进化树。从大麻基因组数据库CannabisGDB(https://gdb.supercann.net/)获取CsZF-HD基因起始密码子上游2000bp的启动子序列并提交到PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线数据库进行顺式作用元件预测分析,借助TBtools软件进行可视化整理。
1.3 RNA提取及反转录cDNA
按照说明书步骤操作,使用RNAisoPlus试剂(TaKaRa公司)提取“1.1材料与处理”中的样本总RNA,再通过琼脂糖凝胶电泳和OD260/280值检测提取的RNA质量。随后使用cDNA合成试剂盒(GeneCopoeia公司),按照说明书步骤操作来合成第一链cDNA。
1.4实时荧光定量RT-PCR(qRT-PCR)
根据CsZF-HD基因开放阅读框(Openreadingframe,ORF)序列设计qRT-PCR引物。
选择大麻CsEF1a基因(Genebank登录号:JP452083)作为qRT-PCR的内参基因[16]。qRT-PCR所需引物序列见表1。以“1.2RNA提取及反转录cDNA”中获得的cDNA作为qRT-PCR的模板。qRT-PCR反应体系:cDNA2µL,上下游引物各2μL,5×BlazeTaqqPCRMix(GeneCopoeia公司)4μL,去离子水10µL。在BIO-RADCFX96实时荧光定量PCR仪上设置参数:95℃30s;95℃10s和58℃30s,共循环40次。qRT-PCR反应均进行3次重复,利用2−ΔΔCT法计算CsZF-HD基因在盐和干旱胁迫处理下以及在大麻根、茎和叶中的相对表达量。
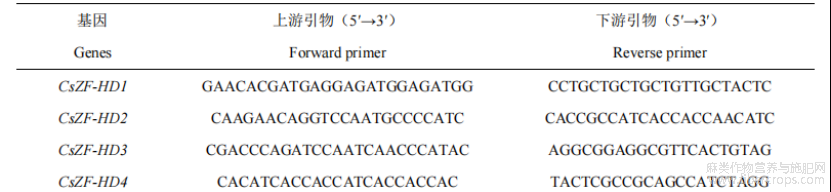
表1 qRT-PCR引物序列
2结果与分析
2.1CsZF-HD基因及蛋白序列分析
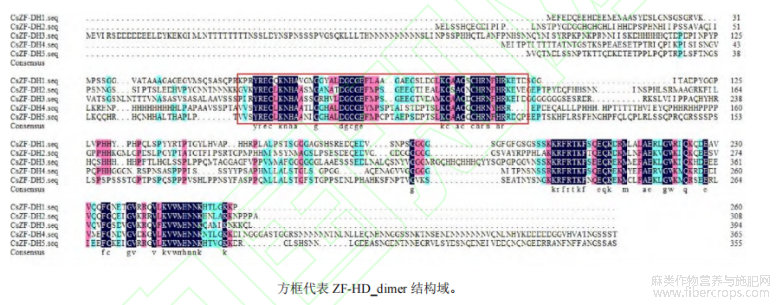
在大麻转录因子数据库中筛选到5条完整的编码ZF-HD转录因子蛋白的基因,分别命名为CsZF-HD1(GenBank登录号:XM030640188)、CsZF-HD2(GenBank登录号:XM030644161)、CsZF-HD3(GenBank登录号:XM030643135)、CsZF-HD4(GenBank登录号:XM030628006)和CsZF-HD5(GenBank登录号:XM030625937)。其中CsZF-HD1、CsZF-HD2和CsZF-HD3位于大麻基因组4号染色体,CsZF-HD4和CsZF-HD5位于大麻基因组8号染色体。蛋白序列分析结果显示(图1),5个CsZF-HD蛋白序列中均含有1个保守的ZF-HD_dimer结构域。
图1 大麻CsZF-HD蛋白序列比对
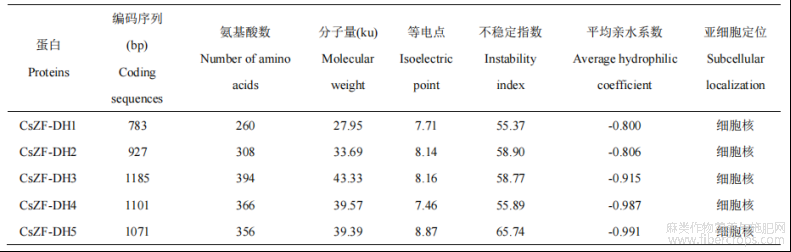
CsZF-HD基因及蛋白理化性质分析结果如表2所示,5个CsZF-HD基因编码序列长度为783~1185bp。不同CsZF-HD蛋白的氨基酸序列长度差异较大,CsZF-DH3蛋白的氨基酸序列最长(由394个氨基酸残基组成),CsZF-DH1蛋白的氨基酸序列最短(由260个氨基酸残基组成)。5个CsZF-HD蛋白分子量范围为27.95~43.33ku,等电点7.46~8.87。5个CsZF-HD蛋白的不稳定系数均大于40(55.37~65.74),平均亲水系数均小于0(-0.991~-0.800),表明CsZF-HD家族蛋白均为不稳定的亲水性蛋白。亚细胞定位预测结果显示5个CsZF-HD蛋白均定位在细胞核中。
表2 CsZF-HD基因及蛋白的鉴定及特性
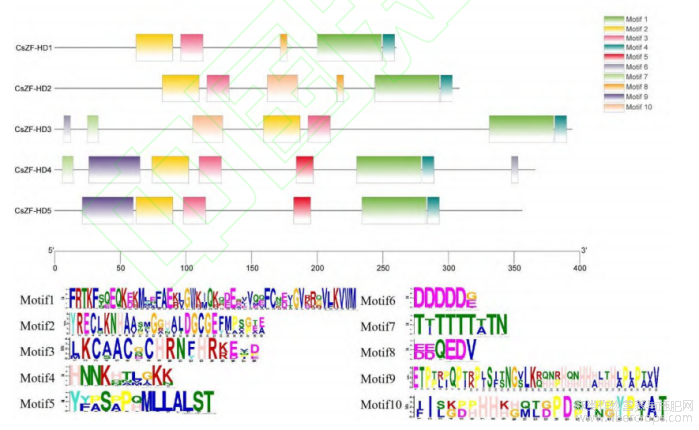
大麻ZF-HD蛋白保守基序(Motif)预测结果如图2所示,CsZF-HD4含有的Motif数量最多(8个),CsZF-HD1含有的Motif数量最少(5个)。5个CsZF-HD蛋白均含有Motif1~4。Motif5和Motif9为CsZF-HD4和CsZF-HD5独有,Motif6和Motif7为CsZF-HD3和CsZF-HD4独有,Motif8为CsZF-HD1和CsZF-HD2独有,Motif10为CsZF-HD2和CsZF-HD3独有。
图2 CsZF-HD蛋白motif预测
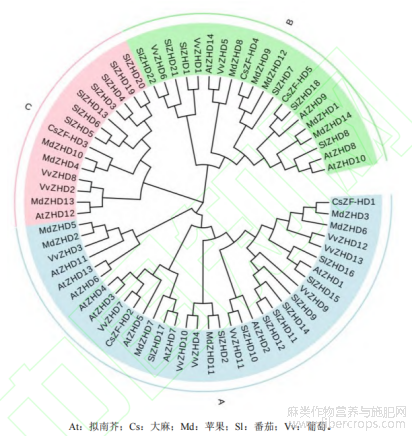
2.2 ZF-HD蛋白系统进化分析
为探究ZF-HD家族蛋白的亲缘进化关系,将5个CsZF-HD蛋白与已鉴定的14个拟南芥ZF-HD蛋白、22个番茄ZF-HD蛋白、13个葡萄ZF-HD蛋白和14个苹果ZF-HD蛋白构建蛋白系统进化树。结果显示(图3),ZF-HD蛋白家族分为3个亚族(A、B和C),不同植物的ZF-HD蛋白交叉排列,其中CsZF-HD1和CsZF-HD2属于A亚族,CsZF-HD3属于C亚族,CsZF-HD4和CsZF-HD5属于B亚族。CsZF-HD1和苹果MdZHD3的亲缘关系最近,CsZF-HD2和葡萄VvZHD7的亲缘关系最近,CsZF-HD3和苹果MdZHD4和MdZHD10的亲缘关系最近,CsZF-HD4和苹果MdZHD9的亲缘关系最近,CsZF-HD5和番茄SlZHD18亲缘关系最近。
图3 植物ZF-HD蛋白系统进化树
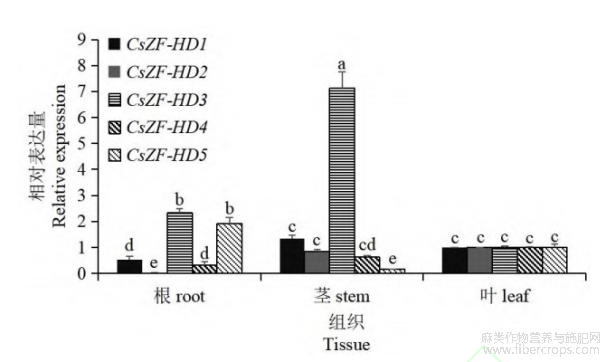
2.3 CsZF-HD基因组织表达分析
通过qRT-PCR检测CsZF-HD基因在工业大麻根、茎和叶中的表达情况。结果显示(图4),CsZF-HD1和CsZF-HD2在茎和叶中的表达量相差不明显,在根中表达量最低;CsZF-HD3在茎中的表达量最高,叶中表达量最低,茎中表达量是叶中表达量的7倍;CsZF-HD4在叶中的表达量最高,根中表达量最低;CsZF-HD5在根中表达量最高,茎中表达量最低。
不同小写字母表示差异显著(P<0.05),下同。
图4 CsZF-HD基因在工业大麻根、茎和叶中的表达
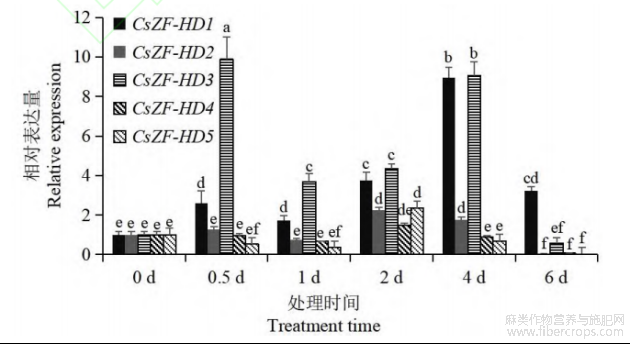
2.4 CsZF-HD基因盐胁迫表达分析
为探明工业大麻ZF-HD基因对盐胁迫的应答情况,通过qRT-PCR检测CsZF-HD基因在盐胁迫下的表达动态。结果显示(图5),CsZF-HD1和CsZF-HD3在盐胁迫下表达量明显上调,CsZF-HD1表达量峰值出现在处理后4d,是对照组(0d)的9.0倍,CsZF-HD3表达量峰值出现在处理后0.5d,是对照组的9.9倍。CsZF-HD2的表达量在盐胁迫2和4d时高于对照组,6d时CsZF-HD2的表达量低于对照组,其他时间点表达量变化不明显。CsZF-HD4的表达量在盐胁迫6d时低于对照组,其他时间点表达量变化不明显。CsZF-HD5的表达量在盐胁迫2d时高于对照组,6d时CsZF-HD5的表达量低于对照组,其他时间点表达量变化不明显。以上结果表明工业大麻ZF-HD家族成员对盐胁迫均存在响应。
图5 CsZF-HD基因在盐胁迫下的表达
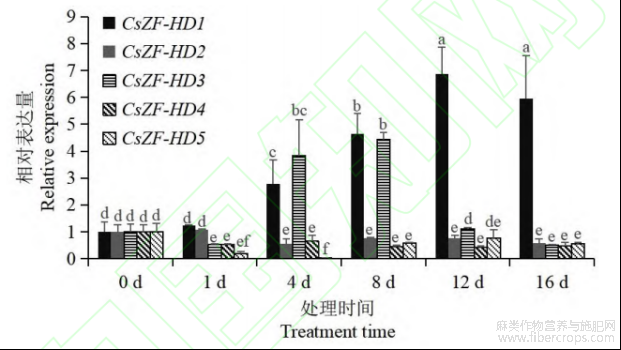
2.5 CsZF-HD基因干旱胁迫表达分析
为探明工业大麻ZF-HD基因对干旱胁迫的应答情况,通过qRT-PCR检测CsZF-HD基因在干旱胁迫下的表达动态。结果显示(图6),CsZF-HD1和CsZF-HD3在干旱胁迫下表达量明显上调,CsZF-HD1表达量峰值出现在处理后12d,是对照组(0d)的6.9倍,CsZF-HD3表达量峰值出现在处理后8d,是对照组的4.4倍。CsZF-HD2、CsZF-HD4和CsZF-HD5的表达量在干旱胁迫后与对照组相比均呈下降趋势。以上结果表明工业大麻ZF-HD家族成员对干旱盐胁均存在响应。干旱胁迫诱导CsZF-HD1和CsZF-HD3的表达,但抑制CsZF-HD2、CsZF-HD4和CsZF-HD5的表达。
图6 CsZF-HD 基因在干旱胁迫下的表达
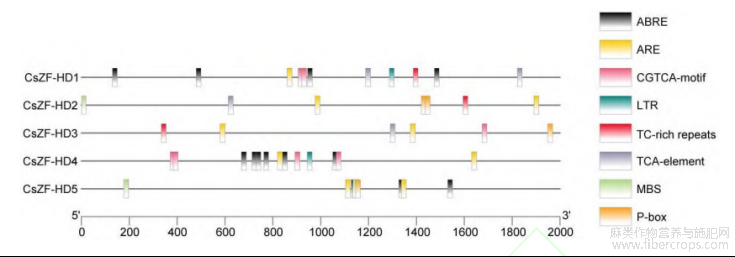
2.6 CsZF-HD基因启动子顺式作用元件预测分析
为解析CsZF-HD基因的逆境胁迫应答机制,利用在线软件对CsZF-HD基因启动子区域中的逆境相关顺式作用元件进行预测分析。如图7所示,5个CsZF-HD基因启动子中均含有数量不等的逆境相关顺式作用元件。CsZF-HD1启动子中含有4个脱落酸响应元件(ABRE)、1个厌氧诱导元件(ARE)、2个茉莉酸甲酯响应元件(CGTCA-motif)、1个低温响应元件(LTR)、1个防御和胁迫响应元件(TC-richrepeats)和2个水杨酸响应元件(TCA-element);CsZF-HD2启动子中含有2个ARE、1个干旱诱导的MYB转录因子结合位点(MBS)、2个赤霉素响应元件(P-box)、1个TC-richrepeats和1个TCA-element;CsZF-HD3启动子中含有2个ARE、1个CGTCA-motif、1个P-box、1个TC-richrepeats和1个TCA-element;CsZF-HD4启动子中含有6个ABRE、2个ARE、4个CGTCA-motif和1个LTR;CsZF-HD5启动子中含有3个ABRE、2个ARE、2个MBS和1个P-box。推测这些元件的存在应该是导致CsZF-HD能够应答盐和干旱胁迫的主要原因。
图7 CsZF-HD基因启动子顺式作用元件预测分析
3讨论
研究表明,ZF-HD转录因子参与植物生长发育、非生物胁迫和植物激素反应等多种生物学过程[17]。本研究在大麻中鉴定出5个ZF-HD转录因子基因,它们分布在大麻的2条染色体上(4和8号染色体)。结构域预测结果显示,5个CsZF-HD蛋白都含有ZF-HD_dimer结构域,同样的结果也出现在拟南芥和陆地棉的ZF-HD蛋白中[18]。ZF-HD转录因子蛋白一般定位于细胞核中对基因的表达进行调控[17,19],本研究中的5个CsZF-HD蛋白预测结果显示也定位于细胞核中。但也存在不同的结果,例如谷子的16个ZF-HD蛋白中有7个蛋白被预测定位到细胞质中[20]。本研究中的亚细胞定位结果仅为软件预测,在后续的基因功能研究中应选择合适的表达系统进行验证。在蛋白进化树分析中,不同植物的ZF-HD蛋白交叉分布,说明它们之间进化关系紧密。结合蛋白保守基序预测和蛋白系统进化分析结果发现,处于相同亚族中的大麻ZF-HD蛋白的Motif分布基本相似,而不同亚族成员之间则差异较大,这可能与亚族功能趋异有关[21]。
CsZF-HD基因在不同组织的qRT-PCR检测结果显示,除CsZF-HD1和CsZF-HD4在根、茎和叶中的表达量相差不明显,其他3个CsZF-HD基因在不同组织中呈差异表达。基因的差异表达往往与其功能密切相关,由此推测这些基因的生物学功能可能存在差异,或许与组织发育相关。例如茶树中的4个ZF-HD基因(CsZHD4、CsZHD9、CsZHD10和CsZHD11)在顶芽和嫩叶中高表达,它们可能参与茶树新梢芽叶的发育,而另外3个ZF-HD基因(CsZHD5、CsZHD9和CsZHD10)则在花中高表达,它们可能参与茶树花器官的发育[22]。
进一步的qRT-PCR检测结果显示,在5个CsZF-HD基因中,CsZF-HD1和CsZF-HD3在盐和干旱胁迫下均显示出相对较高的表达水平。鉴于5个CsZF-HD基因均能不同程度的响应盐和干旱胁迫,而基因的表达又与基因启动子中的顺式作用元件密切相关[23]。于是对5个CsZF-HD基因启动子中的逆境相关顺式作用元件进行了预测分析,结果显示这些启动子中除含有不同种类及数量的非生物胁迫相关顺式作用元件外,还含有脱落酸、水杨酸、茉莉酸和赤霉素等激素诱导相关的顺式作用元件。已有研究表明,逆境胁迫会改变植物体内激素的含量,并通过信号分子以及与关键转录因子的互作来提高植物的抗逆性[24-25]。这些元件的存在表明5个CsZF-HD基因及其启动子可能通过响应一种或多种激素参与大麻对逆境胁迫的应答。同样,在番茄和谷子ZF-HD基因的启动子中也存在大量逆境相关顺式作用元件,且这些基因也确实能够响应逆境胁迫[13,19]。尽管CsZF-HD1和CsZF-HD3对盐和干旱胁迫的应答最明显,但在它们的启动子中并未预测到明显的盐和干旱诱导相关顺式作用元件,所以还需进一步试验以确定启动子的关键区域及关键应答元件。综上,大麻ZF-HD转录因子在大麻应对逆境胁迫和调控抗逆基因表达方面存在潜在功能,后续应着重关注CsZF-HD1和CsZF-HD3的抗逆功能鉴定,因为它们对盐和干旱胁迫的应答最为明显。
4结论
本研究首次对工业大麻ZF-HD转录因子进行生物信息学鉴定及ZF-HD基因在不同组织、盐和干旱胁迫下的表达分析。5个CsZF-HD蛋白序列均含有1个保守的ZF-HD_dimer结构域,它们均为不稳定的亲水性蛋白且定位在细胞核中。ZF-HD蛋白家族分为3个亚族(A、B和C),CsZF-HD1和CsZF-HD2属于A亚族,CsZF-HD3属于C亚族,CsZF-HD4和CsZF-HD5属于B亚族。5个CsZF-HD基因在根、茎和叶中的表达量存在差异,且均对盐和干旱胁迫存在响应,CsZF-HD1和CsZF-HD3在盐和干旱胁迫下表达量明显上调。5个CsZF-HD基因启动子序列中均含有不同种类和数量的逆境相关顺式作用元件。以上结果表明,ZF-HD转录因子可能在工业大麻应对盐和干旱胁迫时发挥转录调控作用。
参考文献:
[1]赵浩含, 陈继康, 熊和平. 中国工业大麻种业创新发展策略研究[J]. 农业现代化研究, 2020, 41(5): 765-771.
[2]Salentijn E M J, Zhang Q Y, Amaducci S, et al. New developments infiber hemp (Cannabis sativa L.) breeding[J]. Industrial Crops & Products, 2015, 68: 32-41.
[3]Singh K B, Foley R C, Luis Oate-Sánchez. Transcription factors in plant defense and stress responses[J]. Current Opinion in Plant Biology, 2002, 5(5): 430-436.
[4]Windhövel A, Hein I, Dabrowa R, et al. Characterization of a novelclass of plant homeodomain proteins that bind to the C4 phosphoenolpyruvate carboxylase gene of Flaveria trinervia[J]. Plant Molecular Biology, 2001, 45(2): 201-214.
[5]Tan Q K, Irish V F. The Arabidopsis zinc finger-homeodomain genes encode proteins with unique biochemical properties that are coordinately expressed during floral development[J]. Plant Physiology,2006, 140(3): 1095-1108.
[6]Razin S V, Borunova V V, Maksimenko O G, et al. Cys2His2 zinc finger protein family:Classification, functions, and major members[J].Biochemistry(Moscow), 2012, 77(3):217-226.
[7]Klug A, Schwabe J W R. Protein motifs 5. Zinc fingers[J]. The FASEB Journal, 1995, 9(8):597-604.
[8]Hall T M. Multiple modes of RNA recognition by zinc finger proteins[J]. Current Opinion in Structural Biology, 2005, 15(3): 367-373.
[9]Tran L S, Nakashima K, Sakuma Y, et al. Co‐expression of the stress‐inducible zinc finger homeodomain ZFHD1 and NAC transcription factors enhances expression of the ERD1 gene in Arabidopsis[J]. The Plant Journal, 2007, 49(1): 46-63.
[10]李春艳. 玉米 ZF-HD 转录因子家族耐盐、抗旱相关基因的鉴定及特性分析[D]. 重庆: 西南大学, 2018: 35-53.
[11]Park H C, Kim M L, Lee S M, et al. Pathogen-induced binding of the soybean zinc finger homeodomain proteins GmZF-HD1 and GmZF-HD2 to two repeats of ATTA homeodomain binding site in the calmodulin isoform 4 (GmCaM4) promoter[J]. Nucleic Acids Research,2007, 35(11): 3612-3623.
[12]Wang W, Wu P, Li Y, et al. Genome-wide analysis and expression patterns of ZF-HD transcription factors under different developmental tissues and abiotic stresses in Chinese cabbage[J]. Molecular Genetics & Genomics, 2016, 291(3): 1451-1464.
[13]Khatun K, Nath U K, Robin A H K, et al. Genome-wide analysis and expression profiling of zinc finger homeodomain (ZHD) family genes reveal likely roles in organ development and stress responses in tomato[J]. BMC Genomics, 2017, 18(1): 1-16.
[14]Zhao T T, Hu J K, Gao Y M, et al. Silencing of the SL-ZH13 transcription factor gene decreases the salt stress tolerance of tomato[J]. Journal of the American Society for Horticultural Science, 2018, 143(5): 391-396.
[15]Zhao T T, Wang Z Y, Bao Y F, et al. Downregulation of SL-ZH13 transcription factor gene expression decreases drought tolerance of tomato[J]. Journal of Integrative Agriculture, 2019, 18(7): 1579-1586.
[16]Guo R, Guo H Y, Zhang Q Y, et al. Evaluation of reference genes for RT-qPCR analysis in wild and cultivated Cannabis[J]. Bioscience Biotechnology and Biochemistry, 2018, 82(11):1902-1910.
[17]张晋玉, 晁毛妮, 杜弘杨, 等. 大豆ZF-HD转录因子GmZHD1的克隆及表达分析[J]. 华北农学报, 2017, 32(2): 1-7.
[18]倪万潮, 徐珍珍, 沈新莲. 陆地棉 ZF-HD 蛋白的全基因组分析[J]. 棉花学报, 2016,28(6): 519-526.
[19]Xu Y, Wang Y, Long Q, et al. Overexpression of OsZHD1, a zinc finger homeodomain class homeobox transcription factor, induces abaxially curled and drooping leaf in rice[J]. Planta,2014, 239(4): 803-816.
[20]李珊, 刘永琪, 朱垠豪, 等. 谷子ZF-HD基因家族的鉴定及生物信息学分析[J]. 山西农业大学学报(自然科学版), 2021, 41(5): 13-25.
[21]李朝睿. 马铃薯 ZF-HD 基因家族的鉴定与分析[J]. 山东农业大学学报(自然科学版),2021, 52(3): 384-387.
[22]庞丹丹, 刘玉飞, 田易萍, 等. 茶树ZF-HD转录因子基因家族的鉴定及表达分析[J]. 南方农业学报, 2021, 52(3): 632-640.
[23]Lu S J, Yi S S, Zhang J Q, et al. Isolation and functional characterization of the promoter of SEPALLATA3 gene in London plane and its application in genetic engineering of sterility[J]. Plant Cell Tissue and Organ Culture, 2018, 136(6): 109-121.
[24]Zwack P J, Rashotte A M. Interactions between cytokinin signalling and abiotic stress responses[J]. Journal of Experimental Botany, 2015, 66(16): 4863-4871.
[25]Anna S, Agata D G, Iwona S. The role and regulation of ABI5 (ABA-insensitive 5) in plant development, abiotic stress responses and phytohormone crosstalk[J]. Frontiers in Plant Science, 2016, 7: 1884.
文章摘自:翟莹,高双,王志刚,等.工业大麻ZF-HD转录因子的鉴定及表达分析[J/OL].西南农业学报,1-13[2024-06-11].http://kns.cnki.net/kcms/detail/51.1213.S.20240523.0951.028.html.