摘 要:本发明涉及生物技术领域,特别涉及基于生长素调节因子组合的大麻遗传转化体系的建立。本发明提供了包含ARF19pro启动子,CsWIND2和CsARR5的组合元件、表达载体、培养基以及其在提高大麻外植体的再生效率和/或建立大麻遗传转化体系中的应用。本发明通过优化现有的大麻遗传转化体系,显著提高转化效率,使难以转化且具有重要经济价值的大麻品种能进行高效转化。
权利要求书
1.组合元件,其特征在于,包括:ARF19pro启动子,CsWIND2和CsARR5;
(I)、所述ARF19pro启动子具有如SEQIDNO.3所示核苷酸序列;和/或
所述具有如SEQIDNO.7所示核苷酸序列;和/或
所述CsARR5具有如SEQIDNO.8所示核苷酸序列;或(II)、在如(I)所示的氨基酸序列的基础上经取代、缺失、添加和/或替换1个或多个氨基酸的序列;或CsWIND2(III)、与如(I)或(II)所示的氨基酸序列同源性90%以上的序列。
2.表达载体,其特征在于,包括如权利要求1所述的组合元件。
3.宿主,其特征在于,转染或转化如权利要求2所述的表达载体。
4.培养基,其特征在于,包括TDZ、6-BA、NAA和IAA;
所述TDZ、6-BA、NAA和IAA的质量比包括5:5:2:2。
5.如权利要求4所述的培养基,其特征在于,所述培养基包括R0培养基,以1L体系计,所述R0培养基包括:
6.培养基组合,其特征在于,包括CIM培养基,R1培养基和如权利要求4或5所述的培养基;
以1L体积计,所述CIM培养基包括:
和/或
以1L体积计,所述R1培养基包括:
7.如下任意项在提高大麻外植体的再生效率和/或建立大麻遗传转化体系中的应用:
(I)、如权利要求1所述的组合元件;和/或
(II)、如权利要求2所述的表达载体;和/或
(III)、如权利要求3所述的宿主;和/或
(IV)、如权利要求4或5所述的培养基;和/或
(V)、如权利要求6所述的培养基组合。
8.提高大麻外植体的再生效率和/或建立大麻遗传转化体系的方法,其特征在于,包括基于如下任意项获得大麻植株:
(I)、如权利要求1所述的组合元件;和/或
(II)、如权利要求2所述的表达载体;和/或
(III)、如权利要求3所述的宿主。
9.如权利要求8所述的方法,其特征在于,包括愈伤组织的诱导、侵染和共培养、胚性愈伤组织的诱导、芽的诱导、芽的分化和生根;
(1)、所述愈伤组织的诱导包括:取大麻的外植体,暗培养,诱导生成愈伤组织;
(2)、所述侵染和共培养包括:取所述愈伤组织于如权利要求3所述宿主的菌液中,进行侵染,去除所述宿主的菌液,暗培养,获得宿主侵染的愈伤组织;
(3)、所述胚性愈伤组织的诱导包括:取所述宿主侵染的愈伤组织,培养,获得胚性愈伤组织;
(4)、所述芽的诱导、芽的分化和生根包括:取所述的胚性愈伤组织,切去根部,第一次继代培养,第二次继代培养,生根,获得大麻植株。
10.如权利要求9所述的方法,其特征在于,(3)所述培养的培养基包括如权利要求4或5所述的培养基;或
所述大麻外植体包括大麻植株授粉后30天未成熟种子的胚芽;或
所述大麻包括DMG278和/或YUNMA7。
技术领域
本发明涉及生物技术领域,特别涉及基于生长素调节因子组合的大麻遗传转化体系的建立。
背景技术
大麻(Cannabis sativa L.)起源于中亚地区,作为经济作物在我国有近5000年的栽培和加工历史。据考古发现,早在2700年前,我国西北地区已经有使用大麻素入药的证据。工业大麻是指四氢大麻酚THC小于0.3%的大麻品种,在我国可以合法种植。大麻花叶中的大麻二酚CBD不具有致幻成瘾性,在抗抑郁、抗炎和缓解疼痛等方面具有重要的药用价值,近年来在世界范围内兴起了研究和利用的热潮,其有效成分在医疗、保健、化妆品和食品领域显示出巨大的应用潜力。根据GlobalMarketInsights报告,目前全球工业大麻的种植、加工和利用的分布总体呈现了欧盟、北美(加拿大和美国)、中国三大主产区的格局,工业大麻种植面积占全球80%以上。提高CBD含量是目前工业大麻研究领域的主要目标,选育高CBD、低THC品种是育种家们急需解决的问题。
由于大麻雌雄异株,遗传背景复杂,传统育种方法进展慢效果差。分子定向育种技术具有效率高、针对性强等优势,能够实现优良基因重组和聚合,实现新品种定向选育,是今后工业大麻育种的必然趋势。然而工业大麻是一种再生和遗传转化顽拗型植物,至今未能建立成熟的遗传转化体系,且遗传转化体系的相关研究进展缓慢。
现有技术是将大麻种子在无菌条件下进行培养。在种子萌发后将子叶切下进行4天预培养,通过农杆菌侵染完成瞬时转化。经过1~2个月的无菌培养,子叶再生出的幼芽中能够检测到有相关基因表达,以大麻种子萌发后的子叶为侵染对象,大麻子叶脱分化后能够再分化成幼芽的比例极低,且农杆菌侵染过程本身会进一步抑制外植体再分化。因此,现有技术获得阳性植株的产率极低。
现有技术只能进行大麻瞬时转化。农杆菌侵染大麻子叶后,只有再生幼芽的部分器官中可以检测到外源基因的瞬时表达,并未获得可以稳定遗传的转基因植株。
发明内容
有鉴于此,本发明的目的在于提供基于生长素调节因子组合的大麻遗传转化体系的建立。本发明通过优化现有的大麻遗传转化体系,显著提高转化效率,使难以转化且具有重要经济价值的大麻品种能进行高效转化。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了组合元件,包括:ARF19pro启动子,CsWIND2和CsARR5;
(I)、所述ARF19pro启动子具有如SEQIDNO.3所示核苷酸序列;和/或
所述CsWIND2具有如SEQIDNO.7所示核苷酸序列;和/或
所述CsARR5具有如SEQIDNO.8所示核苷酸序列;或
(II)、在如(I)所示的氨基酸序列的基础上经取代、缺失、添加和/或替换1个或多个氨基酸的序列;或
(III)、与如(I)或(II)所示的氨基酸序列同源性90%以上的序列。
本发明还提供了表达载体,包括所述组合元件。
在本发明的一些具体实施方案中,包括pKSE401载体。
本发明还提供了宿主,转染或转化所述表达载体。
在本发明的一些具体实施方案中,所述宿主包括农杆菌菌株AGL1。
本发明还提供了培养基,包括TDZ、6-BA、NAA和IAA;
所述TDZ、6-BA、NAA和IAA的质量比包括5:5:2:2。
在本发明的一些具体实施方案中,所述培养基包括R0培养基,以1L体系计,所述R0培养基包括:
本发明还提供了培养基组合,包括CIM培养基,R1培养基和所述的培养基;
以1L体积计,所述CIM培养基包括:
和/或
以1L体积计,所述R1培养基包括:
本发明还提供了如下任意项在提高大麻外植体的再生效率和/或建立大麻遗传转化体系中的应用:
(I)、如所述组合元件;和/或
(II)、如所述表达载体;和/或
(III)、如所述宿主;和/或
(IV)、如所述培养基;和/或
(V)、如所述培养基组合。
本发明还提供了提高大麻外植体的再生效率和/或建立大麻遗传转化体系的方法,包括基于如下任意项获得大麻植株:
(I)、如所述组合元件;和/或
(II)、如所述表达载体;和/或
(III)、如所述宿主。
在本发明的一些具体实施方案中,所述方法包括愈伤组织的诱导、侵染和共培养、胚性愈伤组织的诱导、芽的诱导、芽的分化和生根;
(1)、所述愈伤组织的诱导包括:取大麻的外植体,暗培养,诱导生成愈伤组织;
(2)、所述侵染和共培养包括:取所述愈伤组织于所述宿主的菌液中,进行侵染,去除所述宿主的菌液,暗培养,获得宿主侵染的愈伤组织;
(3)、所述胚性愈伤组织的诱导包括:取所述宿主侵染的愈伤组织,培养,获得胚性愈伤组织;
(4)、所述芽的诱导、芽的分化和生根包括:取所述的胚性愈伤组织,切去根部,第一次继代培养,第二次继代培养,生根,获得大麻植株。
在本发明的一些具体实施方案中,(3)所述培养的培养基包括所述培养基;或所述大麻外植体包括大麻植株授粉后30天未成熟种子的胚芽;或
所述大麻包括DMG278和/或YUNMA7。
本发明还提供了经所述方法建立的大麻植株。
在本发明的一些具体实施方案中,(1)所述暗培养包括将所述大麻的外植体置于CIM培养基中,28℃暗培养5天。
在本发明的一些具体实施方案中,(2)所述暗培养包括将所述愈伤组织置于MS固体培养基中,23℃暗培养72小时。
在本发明的一些具体实施方案中,(3)所述培养包括,将所述宿主侵染的胚性愈伤组织,置于R0培养基中35℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,培养3天,温度调回25℃,再培养4天。
在本发明的一些具体实施方案中,(4)所述第一次继代培养包括将所述胚性愈伤组织置于R1培养基中,25℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,每两周继代一次,共继代4次。
在本发明的一些具体实施方案中,(4)所述第二次继代培养包括将所述胚性愈伤组织置于E1培养基中,25℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,每两周继代一次,直到茎长至5-6cm。
在本发明的一些具体实施方案中,(4)所述生根的培养基包括E2培养基。
在本发明的一些具体实施方案中,所述提高大麻外植体的再生效率和/或建立大麻遗传转化体系的方法包括如下步骤:
(a)、愈伤组织诱导:在雌性大麻植株开花后30天左右,取未成熟大麻种子进行无菌处理后切开种壳,将未成熟种子幼胚的胚芽部分约0.5-1cm放置于CIM培养基,28度暗培养5天,诱导愈伤组织生成;
(b)、农杆菌侵染及共培养:取YEP溶液,加入冻存菌液,在28℃条件下过夜培养约16小时,保持200rpm转速摇匀;将菌液离心,之后用MS培养液悬浮,调整OD600吸光值达到0.1;
无菌条件下将所述胚芽转入到农杆菌菌液中,以80rpm转速在20℃±5℃缓慢摇40分钟;倒掉菌液,用灭菌后的滤纸吸干残余菌液;将所述胚芽分散于垫有滤纸的MS固体培养基中,保证每段胚芽均接触到滤纸,23℃暗培养72小时;
(c)、胚性愈伤组织的诱导:将所述胚芽转移到R0培养基,确保根部插入培养基中,35℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,培养3天;温度调回25℃,再放4天;
(d)、芽的诱导、芽的分化和生根:切去伸长的根部,把茎的部分转移到R1培养基,保证每段胚芽均接触到培养基;每两周继代一次;愈伤组织经继代后,愈伤组织转成米粒状颗粒,将其转入E1培养基上,每两周继代一次,直到茎长至5~6cm,切掉下端黑死部分,移到E2培养基生根;生根后的幼苗移至温室,25℃,50μmol·m-2·s-1光密度,20h小时光照/4小时黑暗。
本发明包括但不限于取得了如下有益效果:
1.现有技术是以大麻种子萌发后的子叶为侵染对象,大麻子叶脱分化后能够再分化成幼芽的比例极低,且农杆菌侵染过程本身会进一步抑制外植体再分化。因此,现有技术获得阳性植株的产率极低。通过对10种较为常见的大麻品种进行试验后,现有技术的平均阳性率为0.1%,本发明涉及的技术以在雌性大麻植株开花后30天左右,未成熟种子的胚芽作为外植体材料,且在农杆菌侵染前进行特殊预培养处理,极大增加阳性率,通过对10种较为常见的大麻品种进行试验后,现有技术的平均阳性率为10%。
2.现有技术只能进行大麻瞬时转化。农杆菌侵染大麻子叶后,只有再生幼芽的部分器官中可以检测到外源基因的瞬时表达,并未获得可以稳定遗传的转基因植株。本发明涉及的技术提供了一种农杆菌介导的高效且稳定的大麻遗传转化系统的设计和构建方法。通过使用ARF19pro驱动生长调节基因CsWIND2和CsARR5的编码核酸序列的基因编辑表达构建载体,对类胡萝卜素脱饱和酶基因(CsPDS1)进行碱基敲除,获得基因编辑植株以及稳定遗传的转基因植株。现有技术并不能够进行基因编辑以及产生稳定可遗传的转基因植株。[0062]3.受遗传背景影响,不同品种大麻幼胚胚芽的芽再生效率差异很大。为了提高转化成功率,申请人对国家麻类种质资源中期库中45个大麻品种的幼胚胚芽的平均芽再生效率进行评估,筛选出最适合进行农杆菌侵染的品种2个:DMG278(芽诱导率18.26%)和YUNMA7(芽诱导率14.71%)。这两个品种均可以作为本申请中涉及的农杆菌介导的转化的模式品种。
4.愈伤组织能否正常生长是决定农杆菌侵染后芽诱导率的关键因素。大麻侵染后的诱导培养基中植物激素的组成和浓度对于愈伤组织诱导效率影响很大。为了促进大麻幼胚胚芽愈伤组织生长,申请人对于植物外植体组培过程中常用的4种植物激素噻重氮苯基脲(TDZ)、6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)和引哚乙酸(IAA)的诱导效率进行研究,摸索出最适合大麻的愈伤组织诱导培养基配方,解决了愈伤组织生长较慢影响转基因效率的问题。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
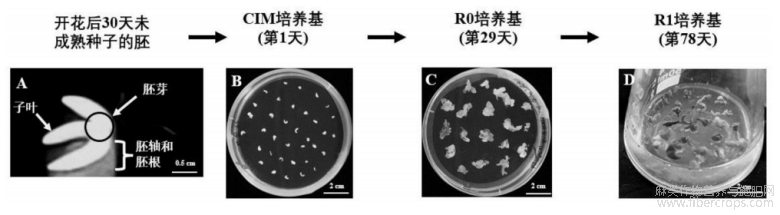
图1示YUNMA7不同外植体的愈伤组织诱导和芽再生;其中,各发育阶段的描述如下:A示开花后30天未成熟种子的胚;B示授粉后30天从未成熟种子中分离的胚芽;C示在体外培养29天后形成的愈伤组织;D示在体外培养78天后的芽;A比例尺:0.5厘米;B?D比例尺:2厘米;
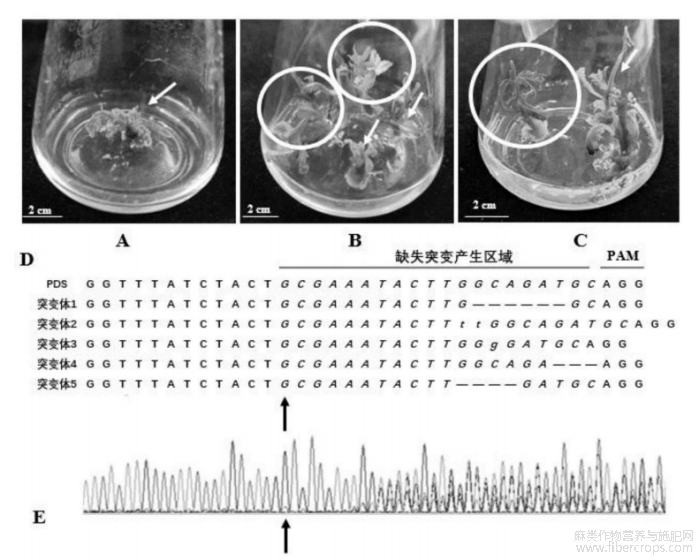
图2示CsPDS1被编辑后产生的白色芽和其他嵌合体芽,以及突变所在位置的测序结果;其中,A示从愈伤组织中发育出的表现为全部或部分白色的基因编辑芽;B和C分别示上部芽为绿色和下部芽为白色的嵌合组织(白色圈),以及发育异常的白色芽(白色箭头);D和E示突变所在位置的测序结果及其色谱图,黑色箭头指示突变,黑线表示基因编辑的靶向序列和Cas9编辑蛋白识别序列(PAM);
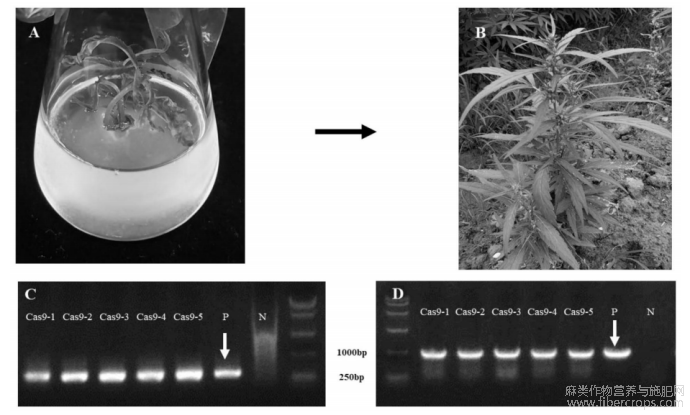
图3示转基因大麻幼苗和转基因筛选结果;其中,A示从转基因幼苗的茎中再生的芽;在农杆菌侵染后获得一株携带CsWIND2–CsARR5共表达组合的基因编辑空载体的转基因幼苗W25?1;将W25?1茎切成块,并在含卡那霉素的再生培养基中孵育6周;从茎外植体分离出多个芽;B示从W25?1茎再生的转基因幼苗;经过5周在R1培养基中孵育后,所有幼苗都转移到土壤中;在温室中生长时,每3周对顶端第1片完全展开的叶子采样;C和D示从W25?1再生的5个幼苗的转基因特异性PCR结果;在第2轮筛选中,使用引物AtU6?F1/R1和CsCAS9F2/R2进行转基因特异性PCR,这些植物(Cas9?1到Cas9?5)被鉴定为转基因植物;P:阳性对照的DNA样本,N:阴性对照的DNA样本;白色箭头:特异PCR产物;
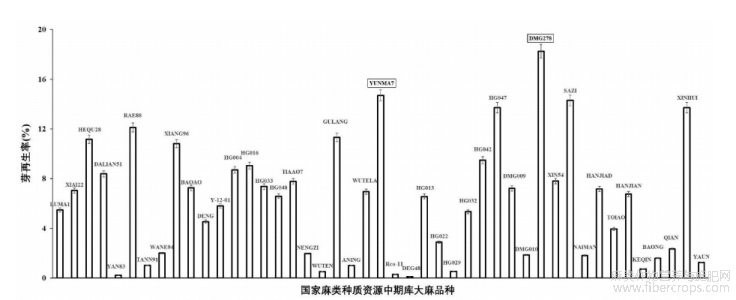
图4示大麻品种对未成熟胚胎胚芽芽再生率的影响;对于每个品种,从未成熟胚胎中分离90?130个胚芽,在CIM培养基培养后进行农杆菌侵染,后转移到R0培养基;芽再生率计算为每个品种的再生芽/总愈伤组织的百分比,对于DMG278为18.26%,对于YUNMA7为14.71%。
具体实施方式
本发明公开了提供基于生长素调节因子组合的大麻遗传转化体系的建立,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明以大麻幼胚为侵染对象,通过特异表达启动子共表达生长调节基因CsWIND2和CsARR5,显著提高了阳性植株产率。本发明采用以下技术方案:
一种大麻遗传转化系统,该遗传转化系统包含生长调节基因CsWIND2和CsARR5表达的基因编辑载体,能够在愈伤组织中强表达。生长素响应因子ARF19在大麻愈伤组织中表达量最高,因此采用生长素响应因子auxinresponsefactor19(ARF19)的启动子ARF19pro驱动生长调节基因CsWIND2和CsARR5的高水平表达。
基因序列(ARF7pro?CsWIND2)如SEQIDNO.1所示:
1-2001bp:ARF19pro启动子2002-3123bp:CsWIND2
3124-3377bp:NOS终止子。
基因序列(ARF7pro-CsARR5)如SEQIDNO.2所示:
1-2001bp:ARF19pro启动子
2002-2703bp:CsARR5
2704-2957bp:NOS终止子
ARF19pro启动子:
SEQIDNO.3:CCATTGTTATTTTGAAGCTAGATCCTTCGCCATTTCACTCTGTTCAGTAAATCAAAATTTGAAGACCTTTTTTTTTTGTATATTATCCTAACGTGACAACCTTAAACATTAGTGGCCTGTTTTTTTTTTTCCTTTTGATTTGTAACACGAGGTCTTCAATCCAACTGCAATGCTGACTTATTATTTTGAATACAGAGTCTATAACCGCCTGAAGGAATAAGTAAATTAACATGGAATAACGATGGAAGATTGATAAATATATTAACATCTCAAATATTGCATTAGGAAGACTACATTATAGGAACACAACCTCCTGCAAAATTATAGCAAAACAAGGAAGACTACATTATTTAATTGCTGATCTATAAATGTGAGAAACTTTAAGTATGGGACAAAGCTCTAAGCACTTGCTTTGGACTGAAATAACTTCAAAGTCAACTATTGCATGCAGCAAAATAATAATAATAATAATAATAATAATAATAATAATAATAATTTCTCGAAGTGCATTAGTTTAACTGAGTTATGTATTGATCATATATAGTGAAGTGTTATAACGTTAGAAAGGTTAACAATTAATTGCATGTCAGTCTTATTCGAAGGACAGTAATCCTATCATCGTGTGTAAACCACTTGCTATTAGTGTTTCACTATTAGTCCACCTTATGAATCGTGTAGATATATACTTGATAATTCCAATTCTTAATTTCGCTTTATTCATCCATTTTTCTAAAACAAAGGTTTCAACGGCACAAAAACTCTACCATTATATTGGAAATGTGCTATAATTTGTGCTACATAAAAAATTAACGTTCCTTTAGAAGAAAAATCTCAACTCCGCCACAAAATTCAGACAATACAAGGTGTGCAGCAAATCCTATTAAGAGACATCTGAGACAAACTACGAAAGCACAGCCATAACATCCGACGCCCTCAAAGCTATGTAGTCACCATCTTTGCCCTTGAAGTCATTCCCTGCATATTTAGAGTACATGACAGTGTTCCCAGGTGCGACGGACAGTGGTTTCCTGTTCCCTTCCTCATCCAAAGGACCAGGTCCAACTGCAATTACCTGTTAAACAAATAGCAACCATCATCAACAATCTCATTTCCAAGAGTGAACTATTACAAGTAGTAAAGAATATCCAAATCCAATAACGAATACTCACCGTGCCAATAGAGGGCTTCTCCTTACTTGCTTCAGTCAGCAACAGCCCCCTGCTGTCTTCTCCTCAGCCTCTGCAATCTGAAAGCACATATTTTAAATGTGTCATTACCATTGTACACCAACAACAGTACATTTTTCCAATGCAACTTCATTTAATAAAAGATGGCTCTTCAGAGGATTAAATAATCATATGAAAAGAGATTACAATAGGTCAAGTTGCCAGGTAACAAACCTTGATTAAGACTCTATCATTCAAGGGCTTGAGATCTTTGACATCATCAGTTTCAAGAATACCAACAATGTCATCATCCTTCAATATAAGATGCTTTGAACCATTGAATTCCAGCTCTGTCCCAGCATACTTGGAGTAAACAACTTGGCTGCCAGCCTACTTGAAAAAAGCAATCGAGGGTCACAAATGAAAGTCTTTTATTACTCAAAAAAGAAAGCATTTATCAAAATTTTATAAGCAAATCTATTACCTTCACACTGACTTCCACTTTTGCCTTCCCAACTGCCCTGCCTTCTCCAACAGCAACAACCTCTCCACCTTGAGGCTTCGATTGAGCTGTGGTTGGAAGCAATATTCCACCTTGAGTTTTCTCATCTGCGGTCTTGAGCTTCACGAGAACTCTGTCACCCAAAGGTTTAATTGATGTGTACTGAAATTTCAAATCACATTTTACATGTAAGATAATATACAAAAGGAAAAAAAAAAACAATTTTAGCATATTTCAGATCGTGCACAACGTATTCACTATTGAATTTATGACATGAGACCCTCAAAGTTGTAGACCTATGGCACTGAAAAATAAATACAATTTCATAAACCA
本发明农杆菌介导的大麻幼胚遗传转化体系建立的具体操作步骤如下:
(1)愈伤组织诱导。取开花后30天的未成熟大麻种子用75%乙醇清洗5分钟,20%次氯酸钠清洗25分钟,再蒸馏水漂洗干净。用镊子和手术刀切开种壳,将未成熟种子幼胚的胚芽部分放置于CIM培养基,28度暗培养5天,诱导愈伤组织生成。
(2)农杆菌培养。包含ARF19pro-CsWIND2和ARF19pro-CsARR5的编码核酸序列的表达建体导入AGL1根癌农杆菌。在剥种子当天,在三角瓶中加YEP溶液10mL(加抗生素),加入冻存菌液50μL,在28℃条件下过夜培养约16小时,保持200rpm转速摇匀;将菌液倒入2mL离心管离心,之后用MS培养液悬浮,每次吸取200μL悬浮菌液加入30~40mL新的悬构浮液中,最终OD600吸光值达到0.1(溶液比较清亮,但比未加菌液的悬浮液浑浊)。
(3)农杆菌侵染及共培养:无菌条件下将胚芽约100~150个,转入到30mL农杆菌菌液中,以80rpm转速在20℃±5℃缓慢摇40分钟。倒掉菌液,用灭菌后的滤纸吸干残余菌液,吹10分钟使表面稍为干燥。将胚芽分散布于垫有滤纸的MS固体培养基中,保证每段胚芽均接触到滤纸,进行暗培养(23℃)72小时。
(4)胚性愈伤组织的诱导。胚芽转移到R0培养基,确保根部插入培养基中,每盘50个,35℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,培养3天。温度调回25℃,再放4天。
(5)芽的诱导。切去伸长的根部,把茎的部分转移到R1培养基,保证每段胚芽均接触到培养基。25℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,每两周继代一次,共继代4次。愈伤组织经继代后,有的愈伤组织转成米粒状颗粒,将其转入E1培养基上,进一步分化,第一次将胚性愈伤从皿中挑取到分化培养基的时候,尽量分布紧密,分布密度为4个/cm2,植物细胞的生长具有群体效应,分布太散,容易死亡。
(6)芽的分化及生根。外植体放置于E1培养基,25℃,50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,每两周继代一次,直到茎长至5-6cm,切掉下端黑死部分,移到E2培养基生根。生根后的幼苗移至温室,25℃,50μmol·m-2·s-1光密度,20h小时光照/4小时黑暗。[0093]本发明提供了一种提高大麻基因再生效率的方法:向大麻植物细胞导入由生长素响应因子ARF19的启动子ARF19pro驱动生长调节基因CsWIND2和CsARR5的编码核酸序列的表达构建载体,从大麻植物细胞再生完整植株。
本发明还提供了一种在大麻中进行基因编辑的方法,向大麻植物细胞导入由生长素响应因子ARF19的启动子ARF19pro驱动生长调节基因CsWIND2和CsARR5的编码核酸序列的表达构建载体。向大麻植物细胞导入至少一个包含至少一种外源核酸序列的表达构建体,其中至少一种外源核酸序列编码基因编辑系统的组分,并从大麻植物细胞再生完整植株。
本发明还提供了一种农杆菌介导的大麻转基因方法,包括以下步骤:
a.愈伤组织诱导。在雌性大麻植株开花后30天左右,取未成熟大麻种子进行无菌处理后切开种壳。将未成熟种子幼胚的胚芽部分(约0.5-1cm)放置于CIM培养基,28度暗培养5天,诱导愈伤组织生成。
b.农杆菌培养。在剥种子当天,在三角瓶中加YEP溶液10mL(加抗生素),加入冻存菌液50μL,在28℃条件下过夜培养约16小时,保持200rpm转速摇匀;将菌液倒入2mL离心管离心,之后用MS培养液悬浮,每次吸取200μL悬浮菌液加入30-40mL新的悬浮液中,最终OD600吸光值达到0.1。
c.农杆菌侵染及共培养。无菌条件下将胚芽转入到农杆菌菌液中,以80rpm转速在20℃±5℃缓慢摇40分钟。倒掉菌液,用灭菌后的滤纸吸干残余菌液,吹10分钟使表面稍为干燥。将胚芽分散布于垫有滤纸的MS固体培养基中,保证每段胚芽均接触到滤纸,进行暗培养(23℃)72小时。
d.胚性愈伤组织的诱导。胚芽转移到R0培养基,确保根部插入培养基中,每盘50个,35℃,
e.芽的诱导。切去伸长的根部,把茎的部分转移到R1培养基,保证每段胚芽均接触到培养基。每两周继代一次。愈伤组织经继代后,有的愈伤组织转成米粒状颗粒,将其转入E1培养基上,进一步分化,第一次将胚性愈伤从皿中挑取到分化培养基的时候,尽量分布紧密,植物细胞的生长具有群体效应,分布太散,容易死亡。
f.芽的分化及生根。外植体放置于E1培养基,每两周继代一次,直到茎长至5-6cm,切掉下端黑死部分,移到E2培养基生根。生根后的幼苗移至温室,25℃,50μmol·m-2·s-1光密度,20h小时光照/4小时黑暗。
在本发明的一些具体实施方案中,步骤a中,以在雌性大麻植株开花后30天左右,未成熟种子的胚芽作为外植体材料。
在本发明的一些具体实施方案中,步骤a中,以胚芽作为外植体材料需要在含有特定植物激素组合的CIM培养基中暗培养5天,才能进行农杆菌侵染,以1L体系计,该激素组合为:1mg2,4-D、0.25mgKinetin和100mgCaseinHydrolysate。
在本发明的一些具体实施方案中,步骤e中,以胚芽作为外植体材料需要在含有特定植物激素组合的R0培养基中继代培养,才能诱导产生胚芽,以1L体系计,该激素组合为:0.5mgTDZ,0.5mg6-BA,0.2mgNAA,0.2mgIAA。
在本发明的一些具体实施方案中,步骤f中,以胚芽作为外植体材料需要在含有特定植物激素组合的E1培养基中继代培养,才能诱导根系产生,以1L体系计,该激素组合为:0.2mgNAA,0.5mgIBA,0.01mgZeaRIB。
本申请中涉及的生长调节基因CsWIND3、CsBBM、CsAGL15、CsWIND2、CsARR5、CsGRF3和CsGIF1的cDNA序列(起始密码子和终止密码子以下划线标注)。50μmol·m-2·s-1光密度,16h小时光照/8小时黑暗,培养3天。温度调回25℃,再放4天。
>CsWIND3(LOC115722430)cDNA(SEQIDNO.4):ATGGATGATCATGATCATAATCAATATCCCAAAATGGAAACTTTCTTACCAAAAGGATTAATGCCCTCTTATTTTCAAGGCATATCCTCAAATGGGTCAAATTTTTTCAAAGATCCAAACTTGTTAAGTTCTTTAACACCAACTTATTATCTTGATCATGAAGATCATGATAATGATGAAAAAAATGTTATGGTATCTACTTATAATAACACTTATGCTACTACTTATCATAACACTTCTTCTTCTTCTTCTTCTTCTCTTCCTTTTGTTCCTCTAAATCTCTCTGATCATCACAATCAACAACAATCAAAAGGGTTCAATGGTTATAATTGGCTTAGCCCAACAAAGACTCAACCAATGAAAAACACTGGATTATCATCATCGCTACAAAGTCAAAGTCAAAGTCAAAATCAAAGACAGAAGTCAACATTTTCATCGGTTAAGTTATTTAGAGGTGTGAGGCAGAGACATTGGGGAAAATGGGTAGCTGAGATTAGATTACCAAGAAACAGAACAAGGGTATGGCTTGGAACATTCGAGACGGCGGATGAAGCCGCCATGGCTTATGACACTGCAGCTTACATGTTGAGAGGGGATTTTGCTCATTTGAATTTTCCTCACATGAAAAATCAACTCAAGGCTAATTCTCTTAATGGAGCAATTGTTGCTCTTCTTGAAGCTAAACTTCAAGCCATTTCAAATGCTAGTGTTATTTCTAATAATACCAATAATGAATTATCATCATCATCATCACCAAAGAAGATTAAGAAGAATGTGTCATTGAAAAGTTCAAAAGATTATTATGATCATGATCATAAGGAAGTGATTATGGATTCTTCTTCTTCTTCTAATAATAATAATAATAATCATAATGAATTAGTCATTGGTGATGTTGAAGCTGTTCAACTAAGTAGAATGCCTTCTTTGGATATGGATATTATTTGGGATGCTCTTTTGGTTTCTGATTAA
>CsBBM(LOC115718863)cDNA(SEQIDNO.5):ATGCATGGACTAATACTCATCTACATACCCTCCATTGAAACCATATTAACTCTCACTTCTCTTAATAAGGTCTCTCTCTTTTCAATCTACATATATAATATGGGTTCTATGAACTGGTTAGGTTTCTCTCTTTCACCTCAAGAACCTCATCATCATCAAGATCACTCTCAGTCAACAGTCTCTCATCACGATCACCGCCTTGATGGCTTCAACTCTGATGAAATCTCCGGAAACGATGTCTCCGGCGAGTGCTTCGATCTCACTTCCGATCATCACTCCACTCATGCTCCTTTTGGCATACTCGAAGCTTTCAACAGATCAAACAATAATAATCACTCTCAAGATTGGAACAATATGAACTCGACCAACTCATCGGACTTTTCTATGCTAATGGGAAGTAATAATAACCAAAACCAACAACAACACGAGCAACCGAAGCTGGAAAACTTTCTCGGCCGACACTCTTTCGCCGATCATCACAATACATACAACACTAGCACTACTACAGCCGACTACATGTTCCAAGCCTCATGCGCCGCTTCCTTGAACATCTCATCCGAAGCCGCAGTCGCAGCCGCCGCGCCTACCGGTGTAAGTGCCGGAGTTGGAGGAGCTGGAAGCTCCATTGGGCTGTCTATGATCAAGACGTGGCTTAGGAACCAACCTGCCCAGACTCAGCCGGCTGAGACTACTACCAATAATAAGAATGACTGCAGCGGCGGTGGAGGAGGTGGAGCCGGTGCAACTACTGCGGCAGCGAGTACAACTACTCATCAGACTCTTTCTCTGTCTATGAGTACTGGATCGCAGTCTAGCTCAGCTTTGCCTCTTCTTACGACTGGGAGTGGTGGGGAGAGTTCTTCTATATCGGATAATAATAAGCACCCTAGAACGGTAACGACAGTGGCGGTGGCTACGGCCGCTGGGGTTGATAGTCCGACAACCGCCGCAATAGAGGCTGTGCCTAGAAAATCCATTGATACTTTTGGACAAAGAACATCTATATACCGTGGTGTAACCAGACATAGATGGACAGGTAGATATGAGGCTCATCTATGGGATAATAGTTGCAGAAGAGAAGGACAAACTCGCAAGGGAAGACAAGTTTACTTGGGTGGTTATGACAAGGAAGAAAAGGCAGCTAGAGCTTATGATCTTGCAGCATTGAAATATTGGGGTACCACAACCACTACCAATTTTCCTATCAGCAATTACGAAAAAGAAGTGGAAGAAATGAAGCACATGACAAGGCAGGAATATGTAGCATCTTTGCGAAGGAAGAGTAGTGGGTTCTCTCGTGGTGCGTCCATTTATCGAGGGGTAACAAGACACCATCAGCACGGGAGATGGCAAGCAAGAATTGGACGAGTTGCGGGAAACAAAGACCTGTATTTGGGCACATTCAGTACACAAGAGGAAGCAGCAGAAGCATACGACATCGCAGCTATAAAATTCCGAGGACTAAACGCAGTAACCAACTTCGACATGAGCAGATACGACGTCAAATCCATATTAGAGAGCAGCACACTCCCCATAGGAGGAGCAGCCAAGAGACTAAAAGACGCCGAACAAGCCGAGATAATGACAGCTGTCGAGTGCCAGCAAAGAACCAGTAACAATATTATTGTCGAACCAGACAACATGACCTCACCGCTCACAGACGCAATCACCAATTACAATGCAGCCGCAGTGGCTGCGGCTGCTGCTGCCGTTGCTCATGGCCACCATGGCGGTGGCTGGCCAGCCTTGGCAGCTTTCCAACAACCATTCACTATGCATAACTACCCTTATGGTAATGGACAGAGCCGAGGACTTTGGTGCAAGCAAGAAGTTGAAGATTCTGATCATAGCAATACTCATGCCTTTCATGATCAGATTCAGCTGAGCAACACTCACAATTTCTTTCAGCCAAACAACAATTCTAACTCAGTTTTGCATAATCTAATGGGGATGGACTCTTCTTCAATGGAACACAGCTCAGGTTCGAACTCTGTTATGTACAGTAGTAGTAATAACAATAATAATGGAGGTGATCATCATAACGGGTACGGAAACGGCAGTGGATATAATGTCGTTCCTATGGCTACCGTCATAACAAACGACAACAGTAGTAATAATAACGGTTTTGGTGATCATCATCATCAGCAGCAGCAGCAGCATGAAAATAATAATAATGTGTTTGGTAATTCTAGTAACGATCCTTATAGCCATGCTAGGAGCTTGTACTACATGTCAACACAGCAGTCCCCTGTGACGGTGGGCGTTGTTAAAGGTACAGGGTATGATCACCAACAGGGCTCGGCTTGCAGCAATAATTGGGTTCCTACTGCTGTTCCATCTCTTGGACCAAGGTCATCCAGTATTAACATGGCTCCATTCACTGTGTGGAACGACTCCTAG
>CsAGL15(LOC115710309)cDNA(SEQIDNO.6):ATGGGTAGGGGTAAGATTGAGATTAAGAGGATTGAAAATGCTAATAGCAGACAAGTTACTTTCTCTAAAAGAAGGGCTGGTTTGCTTAAAAAGGCTCAAGAACTTGCTATTCTTTGTGATGCTGAGGTTGCTGTTATAATCTTTTCTAATACAGGGAAGCTTTTTGAGTATTCGAGTTCTGGTATGAAAAGAACACTGGCAAGGTATAATAAATGTGTAGATTATCCTGAAGGTGCTATTGTAGACAAAACAGAGAAGCAAGATTCTAAGGAGGTTGATGATTTGAAAGATGAAATTGCAAAGCTACAACGAAAACAATCTCGTTTGTTAGGCGAAGACTTAAGTGGAATGAGCTCGAAAGAATTGCAGCACCTTGAACACCAACTAAATGATGGATTAATTTCGGTGAAGGAAAGAAAGGAGAAATTACTGAAGGAGCAACTAGAACAATCAAGACTACAGGAACAGCGTGCTGTACTTGAAAACGAAACATTGCGCAGACAAATTGAAGAGCTTCGATGTTTATTTCCTCGAGCTGATTGCACGGTTCCATCTTACCTTGAGTACTACCCCATTGAAAAGAAGAATTCTAGTGCTAATCATAGTGACATTGGACCAGACCAGAACTCCAATTTTGCAGCCGAGAAAGGAGACTCTGACACCACATTGCATTTAGGGTTGGCTAGTGATGTTTACAGAAAGAGGAAATCTCCTGAGCAAGAAATGCACTCCACAGACTCAGGAAGCAACATGGGCCTACTTTGA
>CsWIND2(LOC115713946)cDNA4(SEQIDNO.7):ATGGCAGCAGCTATAGATTTTTACAGTAGTAGCAGCAGCAGCAGCAGCCAAGCACCAGTTTTCTCAGATCCTTTTAGAGAAGAGCTCATGATAGCACTTGTGCCTTTTATGAAAAGTGCTTCACCAGCAGCTTCTCCCTCTACTTCTTATACTTCTTCTTCTTCTCCTCCTTCATCTTCTTTTTCTTCTTACCCTTCTTGCTCTTATTCTCCACTCTCCTCAACCCAATCAAACTATTTCCCTGAAACCCAAGACTTCTCCAACCAGGTGTGCTTTCAGCCACAGACCGGATCATTAGGCCTTAACCAGCTCACTCAATCTCAGATTCTCCAAATCCAAGCCCAAATTTATTTCCAACAACAACAACAACAAAAACAAAAACAACAAATGGCAGCCATGGCTAAGGCCTCAATCAATAGCCAGTGGCAGAGCCAAAACCCCCAAACCCTTAGCTATCTCAGCCCAAAAGCCATCCCCATGAAACACGTTGGTACTCCCCCAAAAGCTAACAAGCTCTACAGGGGAGTTAGACAGAGGCATTGGGGGAAATGGGTTGCCGAGATAAGACTCCCTAAGAACCGAACTCGCCTCTGGCTTGGTACCTTTGACACAGCCGAGGAAGCTGCTTTGGCTTATGATAAAGCAGCTTATAAGCTCAGGGGAGAGTTTGCTCGTCTCAATTTCCCTCATCTCCGCCATGAAGGAGCCCATGTTACCGGCGCTTTTGGCGAGTACAAGCCTCTGCATTCTTCCGTTGATGCGAAGCTTCAAGCCATTTGCCAAAGCTTGGCTAATAATAATAATAACAATTCGCAGAAACAAGTGAGTTCTGGCGAGTCCTGTTCGGAGGCAGAGGAGAAACCGACAATAATAGTACCAGTAGCTCCAATGGAGTCGAATTTGGTCTCTGATAATTCATCGACAGGTGAACCGAAAGCCGAGTTAGAAGGCTCTTCGTCATCGTTGTCTTCGCCTTTGTCTGATGAGTCTTCAGCAGGGTCATCTTCACCGGAGTCTGATATAACATTCTTGGATTTTACCTCCGATTCTCAATGGGATGACACACAGAATTTTGATCTGGGCAAGTACCCTTCTGTGGAGATTGATTGGGATTCTATTTAA
>CsARR5(LOC115711466)cDNA(SEQIDNO.8):ATGGCGGCGATGGCTAGTGAAATTCTCAGACGCAGTTTAGCGGAAAGTGTTAAGATTTCTAATGGGTCTGGCTCAGGGGAGCTTCATGTTCTTGCTGTTGATGATAGCCTTGTGGACCGTAAAGTCATTGAACGACTGCTGAAGATCTCTTCCTGTAAAGTGACTGCTGTGGAAAGTGGAACTAGAGCTCTGCAATATCTGGGATTGGATGGCGAGAAGAGCTCAGTTGGATTTGATGCTCTTAAGGTGAATCTGATAATGACAGACTATTCAATGCCAGGGATGACAGGATATGAGCTTCTTAAAAAGATCAAGGAATCATCTGCTTTCAGAGAGGTTCCAGTAGTGATAATGTCTTCAGAGAACATCATGACTCGTATTGATAGATGTTTAGAGGAAGGAGCTGAAGAGTTTATAGTGAAGCCAGTAAAACTCTCTGATGTGAAACGCTTGACCAGTTTCGTAATGAAAGGGGAAGGAAAAGAGAATGGAGATGGAGAAAGAGTGAACAAGCGAAAGCTTGAAGATGATGATGACAGCAGCAGCCCCGTGTTGTCGTCACAATCGTCGTCGCCACCACTTTCGCCTAAGTCCTCTTTGGATTCATGTAATCAACCAACCGACGAACAACTGTCTTCTTCCCCGTCTTCACCCGAGTGCTCACCAAAGAGGCCTAGATTGCAGAGCACTGATTCACTGTAA
>CsGRF3(LOC115702269)cDNA(SEQIDNO.9):ATGGACTTCCATCTGAAGCAATGGAGAAATCAGCAACATGAGTCAGAACATCACCAACAACATTCTGCAAAGATACCAAAACTTGTTATCGAAACCCATCACATGAAACAAGACCTCTCTTCTACTTGTTCTGAACCTCTTCCTCTGTTTGTACCTGAGCCACCAAACATCACTAAAATGATCACAACTGGTACTCTGTCTACTGATTCAACTACTTCTCCCACTACTAGAATCCCAAGAGGAGGAATGGGTAGTTACTTTAGTTTGGCCCAATGGCAAGAACTAGAGTTACAAGCTTTGATATTTAGGTACATGTTAGCTGGTGCTACTGTTCCTTCTGAGCTTCTTCAACATATTAAGAAAAGCTTTAATCTTCTTCATACGACACCGTATTTCTTGCATCATTCTCTTCAACCTTATCCCCATTTTCAACCTTCCCCTACTTTGTTACAGTCGGGTTATTGGGGAAAAGCATCCATGGATCCGGAACCTGGTCGGTGCCGGAGAACAGACGGGAAGAAATGGCGGTGTTCAAGAGATGTGGTGGTTGGTCAAAAGTACTGTGAGCGCCACATGCACCGTGGAAGAAATCGTTCAAGAAAGCCTGTGGAAATCCCCACACCCACCACCACCACCACCGGCGGCGGAAGACTCGCCGGGGACGGCGTCGGAAGAGGGACTCTTGCTTCTAACAATGGTCCATCTCCTTTGTCAACGTCATCTAATGCAGCCCATTTCTCACTTTCAATGCCAACATCCTCCATAGATCTCCTCCATCTCAACAACCGGAGTAACGCTTCAGATGTTAAAAATGAAAATAAGGACTTGTTTAAACCCCATAATGAGGTCTCCGGCGACGGCAAATCGGACGGTCACATACTCCGGCACTTCTTTGATGACTGGCCGAGATCACTTCAAGAATCAGGAAATGTAGAAATTAATAATAATAATAATAATAATAATAACAATAACAATAATAGGATGAGGAAGAGTCCAATGAGCTCAGCTTCAAGCTTATCAATTTCCATAACGGGAAACAACTCATCATCAACTTCTGATATTTCGTTGAAGTTGTCAACTGGTGGAAACGGAGAGGAAATGGGCCACCCAGAAGCCCATTCTGATCGTCAGCAGCAGTCTCAGTTGGGCTGGGCCTCGAGTGGATGGGCTTCAAACCCAATGGCCTCAATGGGTGGGCCGCTGGCTGAGGCCCTGCGATCCTCCAACTCCAATTCATCATCTCCTACTAGTGTTCTCCATCAGTTGCCTCCTCGTTCTTCTGCCTCTGACACTTGCATTGTCAGCACTTAA
>CsGIF1(LOC115720645)cDNA(SEQIDNO.10):ATGCAGCAGCACCTGATGCAGATGCAGCCCATGATGGCAGCCTATTATCCCAACAACGTCACCACTGATCACATTCAACAGTATTTGGATGAAAACAAGTCACTGATCCTGAAGATTGTTGAGAGCCAGAATTCAGGAAAATTGGGTGAATGTGCAGAGAACCAAGCTAGGCTGCAGCGAAACCTCATGTACCTGGCTGCTATTGCTGATTCTCAGCCCCAGCCTCCTACAATGCATTCTCAGTATCCTTCAAGTAGTATTATGCAGCCTGGAGCACATTACATGCAACAGCACCAACAAGCTCAGCAGATAACTCAACAATCACTCATGGCGGGAGGCTCGTCCATGCTGTACAACCAGCAGCCATTTACAGCTTTGCAACAGCAAGCACTGCACAACCAGCTCGGCATGAGCTCTGGTGGAAACTCGGGACTTCACATGCTGCAAAGTGACATGGGTAGCGCTGGAGGCAGTGGGCAGCAGCTTGGAGGTGGAGGATTTCCTGATTTCAGCCGTGGCTCTGGAGGAGAAGGGATGCATAGAGGAATGGCTGGCGGTAGTAAGCAAGATATGGGAAGTTCTGGATCGGCTGAAGGCCGAGGAGGGAGCTCTGGAGGTGACGGGGGTGAGACCCTTTACTTAAAATCTGCCGATGATGGGAATTAA
本申请中涉及的CsPDS1的cDNA序列以及阳性鉴定所需引物序列(起始密码子和终止密码子以下划线标注,编辑位点加粗显示)。
>CsPDS1(XM_030651587.1)cDNA(SEQIDNO.11):AIGTCTCAGTGGGGTT
阳性鉴定引物序列如下:
AtU6-F1(SEQIDNO.12):CATAGTTTGTCCCAGGATTAGAATGA
AtU6-R1(SEQIDNO.13):CCGACTCGGTGCCACTTTTTC
CsCAS9F2(SEQIDNO.14):ACAGAGATCACTCTGGCCAATG
CsCAS9R2(SEQIDNO.15):AGCTGAGACAGGTCGATGCG
本发明取得了如下有益效果:
1.现有技术是以大麻种子萌发后的子叶为侵染对象,大麻子叶脱分化后能够再分化成幼芽的比例极低,且农杆菌侵染过程本身会进一步抑制外植体再分化。因此,现有技术获得阳性植株的产率极低。本发明涉及的技术以在雌性大麻植株开花后30天左右,未成熟种子的胚芽作为外植体材料,且在农杆菌侵染前进行特殊预培养处理,极大增加阳性率,通过对大麻品种DMG278进行试验后,现有技术的阳性率为14.85%。
2.现有技术只能进行大麻瞬时转化。农杆菌侵染大麻子叶后,只有再生幼芽的部分器官中可以检测到外源基因的瞬时表达,并未获得可以稳定遗传的转基因植株。本发明涉及的技术提供了一种农杆菌介导的高效且稳定的大麻遗传转化系统的设计和构建方法。
通过使用ARF19pro驱动生长调节基因CsWIND2和CsARR5的编码核酸序列的基因编辑表达构建载体,对类胡萝卜素脱饱和酶基因(CsPDS1)进行碱基敲除,获得基因编辑植株以及稳定遗传的转基因植株。现有技术并不能够进行基因编辑以及产生稳定可遗传的转基因植株。[0124]3.受遗传背景影响,不同品种大麻幼胚胚芽的芽再生效率差异很大。为了提高转化成功率,申请人对国家麻类种质资源中期库中45个大麻品种的幼胚胚芽的平均芽再生效率进行评估,筛选出最适合进行农杆菌侵染的品种2个:DMG278(芽诱导率18.26%)和YUNMA7(芽诱导率14.71%)。这两个品种均可以作为本申请中涉及的农杆菌介导的转化的模式品种。
4.愈伤组织能否正常生长是决定农杆菌侵染后芽诱导率的关键因素。大麻侵染后的诱导培养基中植物激素的组成和浓度对于愈伤组织诱导效率影响很大。为了促进大麻幼胚胚芽愈伤组织生长,申请人对于植物外植体组培过程中常用的4种植物激素噻重氮苯基脲(TDZ)、6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)和引哚乙酸(IAA)的诱导效率进行研究,摸索出最适合大麻的愈伤组织诱导培养基配方,解决了愈伤组织生长较慢影响转基因效率的问题。
如无特殊说明,本发明提供的提供基于生长素调节因子组合的大麻遗传转化体系的建立中所用原料及试剂均可由市场购得。
下面结合实施例,进一步阐述本发明:
实施例1大麻外植体选择对芽再生发生的影响
为了评估不同外植体类型的再生效率,申请人对工业大麻品种YUNMA7的种子进行了表面消毒处理,并在Murashige&Skoog(MS)培养基中培养。大约17天后,从这些幼苗上收集了真叶、子叶和胚芽。此外,从YUNMA7植株授粉后的10天、15天、30天和35天收集了未成熟种子胚的胚芽。所有外植体都在CIM培养基中培养。与早期或晚期收集的愈伤组织相比,在开花后30天(D30)胚芽产生的愈伤组织最多(平均为25.71%)(表1)。在为期4周的愈伤组织诱导过程中,申请人观察到真叶诱导率只有10.18%,子叶中为12.62%,胚芽中为11.81%(表1)。再经过额外的2周,增殖组织被转移到连续光照下的26℃再生培养基中(50μMm^-2s^-1),为期5周。D30胚胚芽的约14.71%形成了芽(图1),而其他三种外植体的愈伤组织中芽再生率最高的真叶为5.31%,远低于未成熟种子中胚芽的再生效率(表1)。
表1YUNMA7不同外植体愈伤组织诱导率及芽再生率
注:愈伤组织诱导率及芽再生率以百分比的形式表示;不同字母(a,b或c)用来标明差异显著(p<0.05)。
实施例2生长调节基因CsWIND3、CsBBM、CsAGL15、CsWIND2、CsARR5及其组合对大麻遗传转化效率的提高
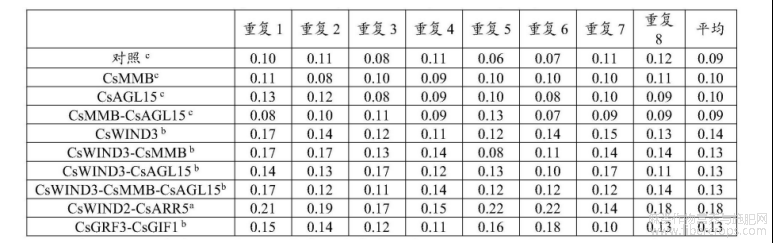
为了增强和加速芽形成,我们通过表达对诱导芽器官具有积极影响的生长调节基因来重新编程植物分生组织的分化过程。为了比较它们对再生效率的影响,申请人从YUNMA7品种中扩增了CsWIND3、CsBBM、CsAGL15、CsWIND2和CsARR5的编码区域。我们设计了8种组合,将它们的cDNA片段克隆到pKSE401载体中,使用生长素响应因子ARF19的启动子ARF19pro驱动其表达,并分别转化到农杆菌菌株AGL1中。从DMG278的未成熟颗粒中分离的D30胚芽被农杆菌AGL1(北京华越洋生物技术有限公司,GX9131?100)接种40分钟,倒掉菌液,用灭菌后的滤纸吸干残余菌液,吹10分钟使表面稍为干燥。将胚芽分散布于垫有滤纸的MS固体培养基中,保证每段胚芽均接触到滤纸,进行暗培养(23℃)72小时。然后转移到含有100mg/L卡那霉素的R0培养基中。确保根部插入培养基中,每盘50个,35℃,50μmol·m?2·s?1光密度,16h小时光照/8小时黑暗,培养3天。温度调回25℃,再放4天。CsWIND2–CsARR5共表达组合和四种携带CsWIND3的共表达组合的平均再生效率比空载体对照高1.7倍(表2)。与对照相比,单独的CsBBM、CsAGL15及其共表达组合的平均再生效率并未显著促进芽再生。在所有生长调节基因组合中,CsWIND2–CsARR5共表达组合的表现最佳,再生效率为18%,高于对照的9%。
表2生长调节基因对胚芽再生频率的影响
注:箱形图显示含有不同生长调节基因共表达组合的pKSE401载体以及对照(空pKSE401载体)的芽再生频率,不同字母(a,b或c)用来标明差异显著(p<0.05)。
实施例3携带CsWIND2?CsARR5共表达组合的基因编辑载体对大麻基因成功编辑并获得稳定遗传的转基因植株
在所有生长调节基因组合中,CsWIND2–CsARR5共表达组合诱导愈伤组织芽再生的表现最佳,再生效率为18%,高于对照的9%。因此,将它们的cDNA片段克隆到pKSE401载体中,使用生长素响应因子ARF19的启动子ARF19pro驱动其表达,并分别转化到农杆菌菌株AGL1中,用于靶向类胡萝卜素脱饱和酶基因(CsPDS1)基因编码区的gRNA(SEQIDNO.16:GCGAAATACTTGGCAGATGC)构建装配,对进行该基因进行碱基敲除,获得基因编辑植株以及稳定遗传的转基因植株。申请人分离了大约560个胚芽。在R0培养基中孵育4周后,总共有144个未成熟胚芽发育出胚性愈伤组织。然后将这些愈伤组织转移到含有50mg/L卡那霉素的R0培养基中。在连续光下孵育5周后,总共有101个愈伤组织发育出芽,胚性愈伤组织再生效率为18%。在这些芽中,86个具有带有绿叶的嵌合组织芽显示出白色和发育异常。只有15个愈伤组织产生了白色苗,占生成的芽的约14.85%。由于CsPDS1失活,所有这些芽都没有形成完整的植物,且表现为叶绿素不足,生长受到抑制(图2A、B和C)。从这4个白色芽和其他嵌合体芽中提取了DNA后,通过测序以识别在靶向区域内的任何插入或缺失。在样本中观察到5种缺失突变的产生(长度从3bp到6bp),这些缺失突变导致了CsPDS1的移码突变(图2D和E)。
申请人将携带CsWIND2–CsARR5共表达组合的基因编辑空载体通过农杆菌侵染的方法获得稳定遗传的转基因植株。在孵育6周后,从每个再生的芽中取样第一片完全展开的叶子,并使用特定于引物(AtU6-F1/R1)进行鉴定。最终,我们获得了一个携带基因编辑载体片段(T-DNA)的转基因幼苗,并将其命名为W25-1。为了繁殖更多幼苗并确认pW25sgT-DNA是否已经稳定地插入W25-1的基因组中,将W25-1茎切成块并在含有卡那霉素的再生培养基中孵育6周。从W25-1的茎外植体中出了5个芽(图3A),这些芽被转移到诱导根生的培养基,然后被种植在土壤条件下。每隔三周对第一片完全展开的叶子进行取样并鉴定T-DNA是否存在(图3B)。根据PCR结果鉴定得出,从W25-1中繁殖的5个植株内的T-DNA片段已经稳定插入基因组,可被确认为转基因植株(图3C和D)。阳性对照为携带CsWIND2–CsARR5共表达组合的基因编辑空载体,阴性对照为非转基因DMG278植株叶片提取DNA。
实施例4从不同大麻品种的幼胚胚芽中筛选出最适合进行农杆菌侵染的品种
受遗传背景影响,不同品种大麻幼胚胚芽的芽再生效率差异很大。为了提高转化成功率,申请人对国家麻类种质资源中期库中45个大麻品种的幼胚胚芽的平均芽再生效率进行评估,筛选出最适合进行农杆菌侵染的品种。经消毒后,这45个大麻品种的幼胚胚芽被切下后进行农杆菌侵染处理,在R0培养基中培养以估算其再生能力。在本研究中,DMG278可达到18.26%;YUNMA7平均芽诱导率可达14.71%。两个品种的诱导率差异并不显著,因此这两个品种均可以作为本申请中涉及的农杆菌介导的转化的模式品种(图4)。DMG278是由RedCherryBerry和YUNMA7杂交培育的F2代品系。RedCherryBerry是一种以Skunk#1和CaliforniaIndica产生的优势杂交品种。YUNMA7是中国的商业大麻品种。所有品种均来自中国农业科学院麻类研究所国家麻类种质资源中期库。
实施例5大麻侵染后的诱导培养基中植物激素的组成和浓度的筛选
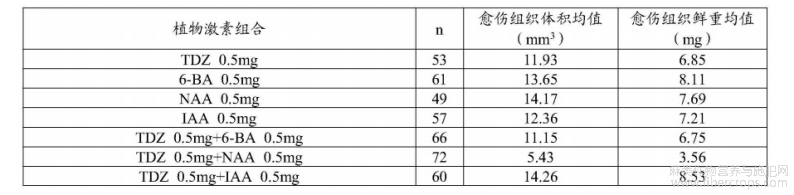
大麻侵染后的诱导培养基中植物激素的组成和浓度对于愈伤组织诱导效率影响很大。为了促进大麻幼胚胚芽愈伤组织生长,申请人对于植物外植体组培过程中常用的4种植物激素噻重氮苯基脲(TDZ)、6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)和引哚乙酸(IAA)的诱导效率进行研究,摸索出最适合大麻的R0培养基配方,解决了愈伤组织生长较慢影响转基因效率的问题(表3)。
表3不同植物激素组合对于大麻幼胚胚芽愈伤组织诱导效率
注:*代表该组合促进愈伤组织生长效果最明显(P<0.05)。
实施例6培养基的制备
本申请中涉及的一种农杆菌介导的大麻转基因方法的培养基配方及其方法。
(1)CIMmedium(1L)
pH调制5.6,121℃灭菌30分钟。
(2)R0(1L)
pH调制5.6,121℃灭菌30分钟。
(3)R1(1L)
pH调制5.6,121℃灭菌30分钟。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
文章摘自国家发明专利:基于生长素调节因子组合的大麻遗传转化体系的建立,发明人:张小雨,刘永蓓,程超华,粟建光,唐蜻,戴志刚,杨泽茂,陈基权,邓灿辉,申请号:202311769311.X,申请日:2023.12.21