摘 要:我国土壤镉污染已成为全社会关注的焦点,污染治理已迫在眉睫。由于特点突出和较强的重金属耐性,剑麻是镉污染土壤修复潜在目标植物,但镉胁迫下剑麻生理响应尚不清楚。针对此问题开展镉胁迫下剑麻生理响应研究,结果表明:不同浓度Cd胁迫剑麻叶片中MDA含量在不同时段均呈显著升高,同一处理浓度随着处理时长的增加MDA含量也呈现上升的趋势;短时间Cd胁迫,低浓度(<20mg/kg)对剑麻叶绿素含量有促进作用,高浓度(>20mg/kg)有抑制性,而随时间增长剑麻叶片叶绿素含量总体呈现下降的趋势。研究结果为利用剑麻修复镉污染土壤技术提供理论依据。
关键词:剑麻;镉胁迫;生理响应;土壤修复
我国土壤镉污染面积大,地域分布广,严重威胁农业可持续发展以及人们的生命安全,已成为全社会关注的焦点,众矢之的[1-2]。因此,土壤镉污染治理已迫在眉睫。相对于传统工程修复技术,植物修复技术以其操作简便、环境友好、修复成本低廉性和工程处理简易等优点备受欢迎[3-4]。剑麻是具有根系发达、抗逆性强、适应性好等特点的多年生经济作物,同时具有较强的重金属耐性,加之与剑麻产品的加工与食物链不挂钩,可兼顾经济效益和生态效益,是镉污染土壤修复潜在目标植物[5-6],然而其理论依据较为欠缺,镉胁迫下剑麻生理响应尚不清楚。针对存在的问题,开展镉胁迫下剑麻生理响应研究,以期为利用剑麻修复镉污染土壤技术提供理论依据。
1材料方法
以H.11648剑麻幼苗为主要试验材料,长势一致,株高为15cm左右,采用霍格兰Hoagland营养液进行培养。设置6个浓度梯度0mg/kg、20mg/kg、40mg/kg、60mg/kg、80mg/kg、100mg/kg,在种植盆内添加不同浓度的CdCl2·2.5H2O溶液,每隔1周更换一次营养液和处理液,3个重复,每个重复5株苗。每10d、20d、30d、40d、50d、60d分别测定MDA活性和叶绿素含量。剑麻MDA活性使用南京建成MDA检测试剂盒测定,叶片叶绿素含量采用丙酮提取法测定[7]。
2结果分析
2.1Cd胁迫对剑麻丙二醛含量的影响
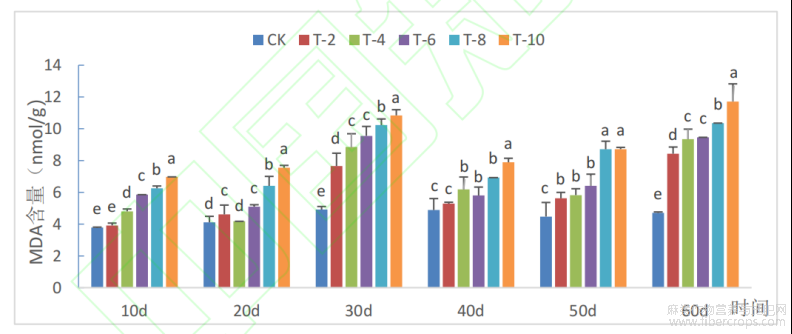
从图1可以看出,在镉胁迫10d时,当浓度为20mg/kg时,与对照相比没有显著性差异,这表明在抗氧化酶的保护下,细胞膜并没有受到活性氧的损害;浓度大于20mg/kg时,MDA含量随浓度的增加而增加。第30d和第60d处理组较对照组MDA含量增长速率最快;30d时,80mg/kg和100mg/kg较对照组分别增长了108.13%和120.47%;60d时,浓度为20mg/kg、40mg/kg、60mg/k、80mg/kg、100mg/kg较对照组分别增加了78.91%、98.51%、100.85%、119.85%、148.69%。MDA含量的增加说明,细胞膜受到的破坏越严重。处理时长60d,浓度为100mg/kg时,较对照组含量增长最多,增长了148.69%。不同浓度Cd胁迫剑麻叶片中MDA含量在不同时段均呈显著升高,同一处理浓度随着处理时长的增加MDA含量也呈现上升的趋势。同一浓度长时间胁迫对剑麻叶片细胞膜的破坏随时间的延长而加重。
注:柱状图所标字母(abcd等)表示不同处理之间的差异存在显著性(p<0.05),而字母相同则表示组间的差异不显著。
图1 Cd胁迫对剑麻叶片MDA的影响
2.2Cd胁迫对剑麻叶片叶绿素含量的影响
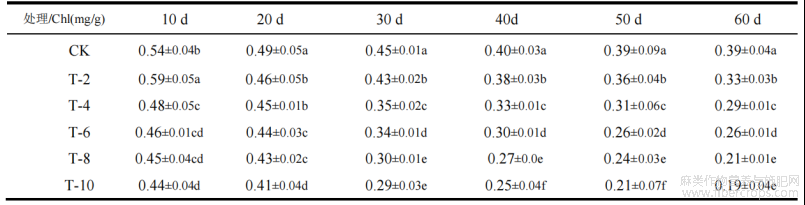
Cd胁迫对剑麻叶绿素的影响如表1所示。不同浓度Cd胁迫时,处理10d,叶绿素含量随着镉浓度的增加,呈现先增加后降低的趋势,浓度为20mg/kg时,对剑麻叶绿素含量有促进作用,较对照组上升了7.4%;浓度为40mg/kg、60mg/kg、80mg/kg、100mg/kg时,较对照组分别下降了11.11%、14.81%、16.67%、18.51%,其叶绿素含量分别为0.48mg/g、0.46mg/g、0.45mg/g、0.44mg/g。由此可见短时间Cd胁迫,低浓度(20mg/kg)对剑麻叶绿素含量有促进作用,高浓度(>20mg/kg)有抑制性。处理时长为20d至60d时,随时间变化,剑麻叶片叶绿素含量总体呈现下降的趋势。处理60d时,随处理浓度的增加,处理组较对照组下降了15.38%、25.64%、33.34%、46.15%、51.28%,浓度为100mg/kg叶绿素含量减少量最多。随处理浓度的变化,可以看出镉含量浓度越高剑麻叶片叶绿素含量越低,与浓度呈负相关。可能是高浓度长时间的镉胁迫使剑麻叶绿体结构受到了不同程度的破坏,导致其不能进行正常的代谢活动,从而影响了叶绿素的含量。
表1Cd胁迫对剑麻叶片叶绿素含量的影响
注:所标字母(abcd等)表示不同处理之间的差异存在显著性(p<0.05),而字母相同则表示组间的差异不显著。
3讨论与结论
3.1讨论
低浓度镉胁迫(<40mg/kg)对剑麻根系生长在早期有促进作用;高浓度(>40mg/kg)对剑麻根系生长有明显的抑制作用;剑麻根系为镉富集的主要器官,对Cd具有极强的累积性[8]。当植物在逆境下,丙二醛(MDA)的含量也将发生相应的变化,其变化情况可以反应植物受到胁迫的大小、质膜透性的变化规律、电解质外渗的状况等,是衡量植物是否受到迫害的一个重要标志,因此受到Cd胁迫的植物,可以用丙二醛含量作为衡量指标[9-11]。本研究发现MDA随胁迫浓度升高和时间延长而升高,与小麦Cd胁迫研究结果基本一致[12]。Cd处理后的蚕豆幼苗根部和土豆的块茎[13]中MDA含量也显著升高。处理时长10d,浓度为20mg/kg时,与对照组没有显著性差别,表明短时间低浓度镉胁迫对剑麻叶片合成丙二醛基本上没有影响,说明剑麻可以应对低浓度的镉胁迫,抗氧化酶系统被激活后可以清除镉胁迫所带来的自由基,以维持植物体内的正常代谢及生长[9]。处理时长60d,浓度为100mg/kg时,较对照组含量增长最多,增长了148.69%,表明剑麻叶片受到的氧化损伤严重;MDA产生量与Cd胁迫浓度成正相关,说明随着镉浓度的增加对细胞膜系统损害程度也在逐渐加深,导致细胞的氧化还原反应失衡[9-11]。
叶绿素作为光合作用的主要色素对光能的接收,传递和转化起着无可取代的作用,叶绿素含量与光合作用有着密切的联系。重金属胁迫会影响叶绿素含量,叶绿素增长受到明显的抑制,原因在于重金属进入植物组织后,会直接干扰叶绿素的生物合成,重金属离子会使叶绿素酶的活性升高,从而造成叶绿素分解速度加快[9]。本研究也证明了这一点,不管是浓度的增加,还是处理时长的增加,都会导致镉胁迫下剑麻叶片叶绿素总含量下降,Cd胁迫下叶片叶绿素含量降低已经在很多实验中被验证。2019年Kapoor等人在镉胁迫芥菜的研究中发现,对照组叶绿素含量为26.75mg/g,而处理组叶绿素含量为13.38mg/g,叶绿素含量降低了13.37mg/g[14];在镉胁迫柽柳和银水牛果实验中,发现总叶绿素(Chl)、叶绿素a(Chla)和叶绿素b(Chlb)含量下降,且与浓度成负相关[15]。Cd胁迫造成叶绿素含量降低的原因可能是:(1)根系对镉的积累抑制了Fe离子的吸收与转化,缺铁影响了合成叶绿素的前期物质卟啉环的合成;(2)Cd胁迫产生了大量的ROS,直接破坏了叶绿素的合成[9-10]。因此,叶绿素含量是研究重金属对植物毒害作用的一项基本指标[10]。
3.2结论
不同浓度Cd胁迫和处理时长剑麻叶片中MDA含量均呈显著升高;低浓度Cd胁迫(<20mg/kg)短时间对剑麻叶绿素含量有促进作用,而高浓度的(>20mg/kg)则有抑制性,且叶绿素含量与处理时长呈负相关。
参考文献
[1] 李婧,周艳文,陈森,高小杰.我国土壤镉污染现状、危害及其治理方法综述[J].安徽农学报, 2015,21(24):104-107.
[2]宋玉婷,雷泞菲.我国土壤镉污染的现状及修复措施[J].西昌学院学报(自然科学版),2018,32(03):79-83.
[3]申强,吴军,周军,周惠,徐金益.植物对重金属镉(Cd)抗性的研究综述[J].上海农业科技,2015(02):30-33+13.
[4]周骏,闫国杰,施曙东.土壤修复技术进展及国外发展趋势[J].广州化工,2016,44(22):12- 14+23.
[5]李福燕,李士平,李许明,郭彬,陈柳燕,漆智平.剑麻与石灰对镉污染土壤修复研究[J].广东农业科学, 2007, (09):46-48.
[6]Lugon-Moulin N, Zhang M, Gadani F, et al. Critical review of the scienceand options for reducing cadmium in tobacco (Nicotiana Tabacum L.) and other plants. Adv Agron. 2004;83:111–180.
[7]邱念伟,王修顺,杨发斌,等.叶绿素的快速提取与精密测定[J].植物学报, 2016, 51(5):667-678.
[8]Li J, Ge LF, Liu P, et al. Exploring Cadmium Stress Responses in Sisal Roots: Insights from Biochemical and Transcriptome Analysis.Plos one, 2023.DOI: 10.1371/journal.pone.0288476
[9]李莹莹,何梦玲,姚尹伊,等.镉胁迫下广藿香幼苗的生理响应[J].科学技术与工程, 2023,23(21): 8996-9003.1
[10]杨雨婷,谭淑端,董方旭,等.海南野生狗牙根对镉胁迫的生理生态响应[J].西南农业学报, 2018, 31(10):2086-2090.
[11]黄玉敏,邓勇,李德芳,等.镉胁迫对大麻幼苗生长及生理生化影响[J].中国麻业科学, 2017, 39(5):227-232.
[12]Amirjani M R. Effects of cadmium on wheat growth andsome physiological factors[J]. International Journal ofForest, Soil and Erosion, 2012, 2(1): 50-58.
[13]Nouairi Issam, Jalali Karima, Essid Sabrine. Alleviation of cadmium-induced genotoxicity and cytotoxicity by calcium chloridein fababean (Viciafaba L. var. minor) roots[J]. Physiolo-gy and Molecular Biology of Plants, 2019, 25(4): 921-931
[14]Kapoor Dhriti, Singh Mahendra P., Kaur Satwinderjee, et al. Modulation of the functional components of growth, photosynthesis,and an-ti-oxidant stress markers in cadmium exposed Brassica juncea L. [J]. Plants, 2019; 8: 260-273
[15]崔振,李昌晓,李晓雪,贺燕燕. 柽柳和银水牛果对镉胁迫的生理响应与耐受积累特征[J].西北农林科技大学学报:自然科学版,2018, 46(3):70-78
文章摘自:陈河龙,李静,谭施北等.镉胁迫下剑麻生理响应分析[J/OL].热带农业科学,1-4[2024-03-08].http://kns.cnki.net/kcms/detail/46.1038.S.20240220.1346.008.html.