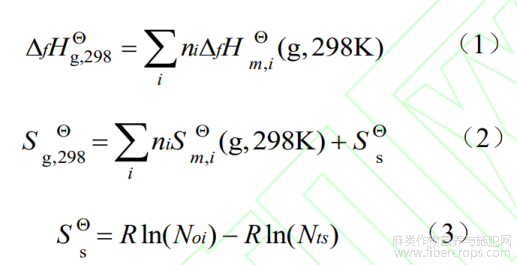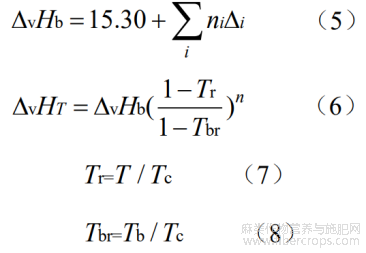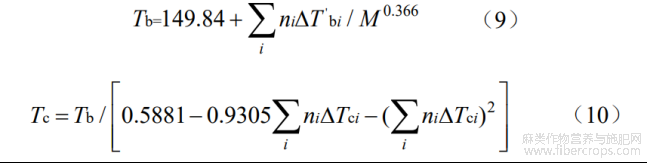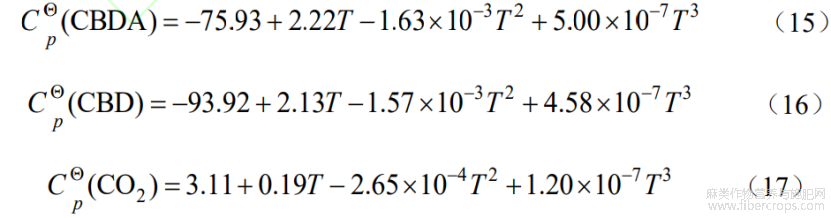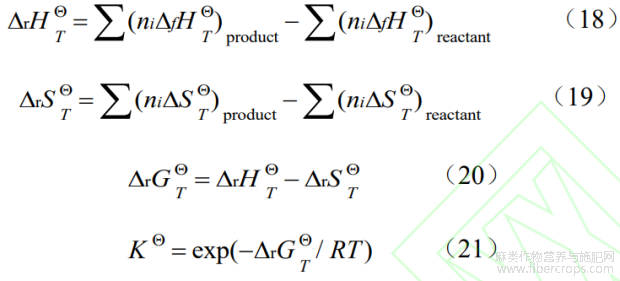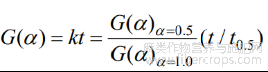摘 要:为揭示工业大麻中大麻二酚酸(cannabidiolic acid,CBDA)脱羧转化机理,本研究以工业大麻(Cannabis sativa L.)为原料,采用基团贡献法和 Watson 公式获得工业大麻中 CBDA 脱羧转化生成大麻二酚(cannabidiol,CBD)过程中各组分基本热力学参数。在此基础上,根据经典热力学公式确定 40~140 ℃温度范围内工业大麻中 CBDA 转化生成 CBD 反应吉布斯自由能,并得出反应平衡常数及平衡转化率。通过热脱羧转化实验,分析温度及工业大麻花叶含水量对 CBDA 脱羧转化的影响,结合 CBD 转化生成率最终确定大麻 CBDA 热脱羧转化机理函数模型及转化活化能。研究结果表明:在 40~140 ℃温度范围内,CBDA热脱羧转化可自发进行,且随着温度升高自发进行趋势越大。在热脱羧转化过程中,CBD 转化率增长与温度和含水量呈正相关。通过动力学函数模型拟合,工业大麻花叶中 CBDA 脱羧转化最概然模型符合 F1 模型,转化活化能为 83.77 kJ/mol。综上所述,在 40~140 ℃温度范围内工业大麻中 CBDA 可自主脱羧转化生成 CBD,研究结果可为工业大麻产业化加工获得高含量 CBD 条件选择提供理论支持和实验支撑。
关键词:工业大麻;大麻二酚酸;大麻二酚;热力学;动力学模型;转化活化能
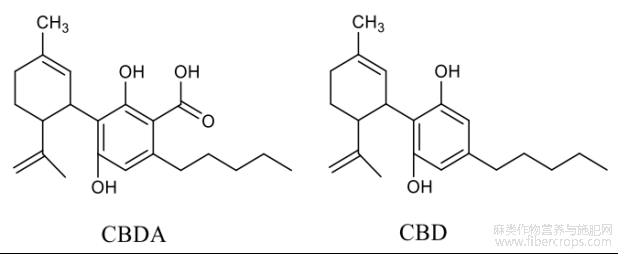
工业大麻(Cannabis sativa L.)又称汉麻、火麻,多为雌雄异株,在我国种植和使用历史悠久,为大麻科(Cannabinaceae)大麻属(Cannabis)一年生草本植物,是我国传统经济作物[1,2]。迄今为止,工业大麻中已发现植物大麻素及其他植物类活性物质包括萜烯、酚类、脂质、生物碱等成分[3]。在这些成分当中,以植物大麻素中药用非精神活性物质大麻二酚(cannabidiol,CBD)(见图 1)研究最为突出,其在癫痫、自闭症谱系障碍、焦虑、抑郁以及抗肿瘤的治疗方面有着很好的效果[4]。以工业大麻为原料生产 CBD 的方法主要有溶剂提取和超临界 CO2 流体萃取两种[5]。目前,CBD 在工业大麻植物体内通过大麻二酚酸(cannabidiolic acid,CBDA)转化过程已成功揭示,但相应转化理论却鲜有报道,无法依靠理论手段指导工业大麻中 CBDA 向 CBD 进行高效转化,难免在 CBD 生产的过程中造成植物成分的资源浪费。
图1 两种大麻素结构
本研究通过基团贡献法和 Watson 公式对工业大麻中 CBDA 受热脱羧转化 CBD 转化过程中各组分基本热力学参数进行计算,根据经典热力学公式对工业大麻中 CBDA 在常压和温度在 40~140 ℃转化生成 CBD 反应吉布斯自由能进行确定,并得出反应平衡常数及平衡转化率,对工业大麻中 CBDA 能否在常规条件下自发脱羧转化的可能性进行判断。研究结合温度、花叶含水率等影响因素对工业大麻中 CBDA 脱羧转化生成 CBD 含量的影响,确定工业大麻中 CBDA 脱羧动力学函数模型,并计算得出转化活化能,为工业大麻产业化加工获得高含量 CBD 条件选择提供理论支持和实验支撑。
1 材料与方法
1.1 材料与试剂
工业大麻原料由黑龙江省农业科学院提供;去离子水实验室自制;无水乙醇(分析纯,天津市富宇精细化工有限公司);磷酸(色谱纯,天津市科密欧化学试剂开发中心);乙腈(色谱纯,湖北弗顿科技技术有限公司)。
1.2 仪器与设备
DHG-9145A 电热恒温鼓风干燥箱(上海一恒科科学仪器有限公司);Startorious 1721 电子分析天平(德国赛多利斯集团);STA 449 同步热分析仪(德国耐驰公司);1525 分析型高效液相色谱仪(美国 Waters 公司)。
1.3 实验方法
1.3.1 工业大麻中大麻二酚酸脱羧转化体系热力学理论基础
1.3.1.1 转化体系下各物质标准摩尔生成焓、标准摩尔熵计算
工业大麻中大麻素类物质主要由植物体表面腺毛体分泌形成[6],常以油状液态形式存在花叶表面(见图 2),其中工业大麻中 CBDA 在常压下脱羧转化生成 CBD 反应式如图 3。
图2 工业大麻腺毛表附大麻素状态图
图3 工业大麻中CBDA脱羧转化生成CBD反应式
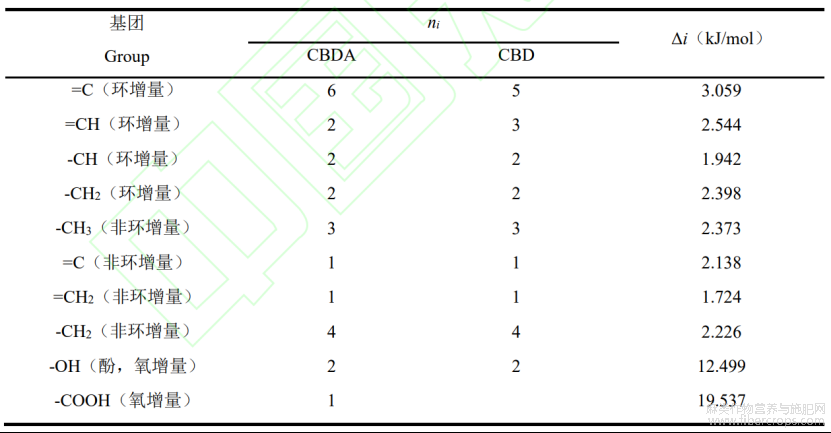
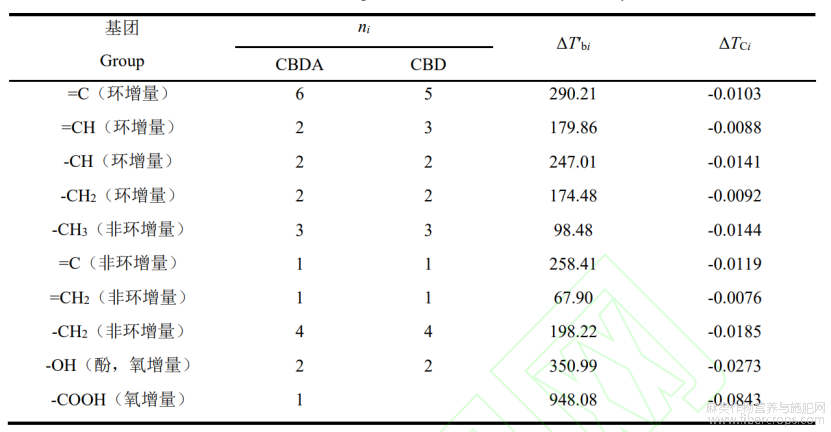
由于天然植物活性成分复杂,基本热力学参数相对缺乏,通过对活性成分进行基团估算是解决此类问题的重要手段。Benson 基团贡献法应用广、精度高,其估算原则是通过以原子或原子团为中心,确定基团参数的同时考虑邻近基团的影响,根据邻近基团的不同划分基团,从而确切估算化合物的气态标准摩尔生成焓、标准摩尔熵[7]。CBDA 脱羧转化生成 CBD反应通过 Benson 基团贡献法对各组分在 298 K 时气态标准摩尔生成焓(DfH g,298Q)和标准摩尔熵(Sg,298Q)进行估算,各基团贡献值[8]见表 1。反应中 CO2 气态标准摩尔生成焓(DfH g,298Q)和标准摩尔熵(Sg,298Q)参照文献值[9],Benson 基团贡献法估算公式如下[10]:
公式中,i为i型基团;ni为第i种基团数量;![]() 、
、![]() 为i组分理想气体组分的标准摩尔生成焓、标准摩尔熵贡献值;S为对称熵;Noi为分子中光学异构体数;Nts为分子中总对称数;R为普适气体常数。
为i组分理想气体组分的标准摩尔生成焓、标准摩尔熵贡献值;S为对称熵;Noi为分子中光学异构体数;Nts为分子中总对称数;R为普适气体常数。
表1 Benson基团贡献法估算CBDA、CBD的![]() 和
和![]() 各基团贡献值
各基团贡献值
注:Cd—双键碳原子;CB—单环芳烃中碳原子。
1.3.1.2 转化体系下各物质理想气体比热容估算
计算 CBDA 转化体系下各物质在不同温度下气态标准摩尔生成焓(DfH g,TQ)、标准摩尔熵(Sg,TQ),需通过计算转化体系各组分理想气体比热容(CpQ)才能获得。Benson 基团贡献法也可以估算各组分理想气体比热容,但只给出6个温度点的基团理想气体比热容贡献值,范围相对较大。相比较之下Joback基团贡献法估算理想气体比热容具有良好的精确性和准确度,对352个化合物进行计算,平均误差 1.41%[8]。因此,本反应采用Joback法进行对各组分理想气体比热容估算。各组分Joback基团贡献值[11]见表2,计算公式如下[12]:
表2 Joback基团贡献法估算反应中各组分ΘCp的基团贡献值
1.3.1.3 转化体系下不同温度下物质蒸发焓计算
由于植物活性成分在植物中通常以液态或者是半液态的形式存在,所以转化体系下CBDA 在植物体内脱羧考虑是以溶解液态的形式进行。在计算反应体系下各物质在不同温度下液态摩尔生成焓(DfH 1,TQ)和标准摩尔熵(S1,TQ)前,需先通过Joback和Reid基团贡献法对各物质在相应在沸点的蒸发焓(DvHb)进行计算,然后根据Watson公式得出不同温度下的蒸发焓(DfHT)。Joback和Reid基团贡献值见表3,计算公式如下[13-14]:
Tr为某温度下的对比温度值,Tbr为正常沸点下的对比温度值,Fishtine提出n与对比沸点Tbr有关:n=0.74Tbr-0.116(0.57<Tbr<0.71);n=0.30(Tbr<0.57);n=0.41(Tbr>0.71)[11]。
表3 Joback和Reid基团贡献法估算CBDA、CBD的ΔvHb基团贡献值
在计算ΔvHT中还需确定转化体系中物质的沸点温度(Tb)与临界温度(Tc),二者计算采用Marrero-Morejon和Pardillo-Fontdevila提出的M-P法来进行计算,M-P法估算公式通过引入计算物质摩尔质量,计算精度显著提高[15]。M-P法基团贡献值见表4,计算公式如下:
表4 M-P法估算CBDA、CBD的Tb、Tc基团贡献值
1.3.1.4 转化体系下不同温度下液态标准摩尔生成焓和标准摩尔熵计算
由根据生产加工中工业大麻脱羧转化CBD实际条件,选择40~140℃(313~413K)温度范围,根据公式(11)和公式(12)对不同温度下各组分液态标准摩尔生成焓和标准摩尔熵进行计算。不同温度下气态标准摩尔生成焓、标准摩尔熵根据公式(13)和公式(14)计算得出[16]。
1.3.2 工业大麻中大麻二酚酸脱羧转化影响因素及机理参数确定
1.3.2.1 大麻二酚失重温度确定
为确保CBDA脱羧转化过程中CBD在受热生成的过程中不被失重降解,通过热重分析确定CBD失重温度。检测条件:高纯氮气作为保护气,吹扫速率50mV/min,升温速率10℃/min。
分别将工业大麻花叶原料置于热鼓风烘箱中,考察40、60、80、100、120、140℃温度进行热脱羧30min处理。处理结束后,准确称取各批样品0.3g,分别通过无水乙醇作为转化产物CBD的提取溶剂,按照料液比1∶10,冰浴超声30min后,经5000r/min离心8min,收集提取上清液。重复5次合并提取液,经适当稀释定容进行CBD含量测定。
1.3.2.3 含水量对工业大麻中大麻二酚酸脱羧转化的影响
参照《中国药典》2020 版四部干燥失重方法[17]确定阴干后工业大麻花叶原料原有含水量后,分别加入不同比例超纯水,置于25℃环境下密闭饱和过夜,使工业大麻花叶含水量分别达到20、40、60、80、100%。然后,通过热鼓风烘箱进行热脱羧转化处理,设定温度90℃,脱羧时间30min。处理结束后,提取方法同“1.3.2.2”一致,经适当稀释定容进行CBD含量测定。
1.3.2.4 工业大麻中大麻二酚酸脱羧转化最概然机理函数及活化能确定
结合1.4.2影响因素,将工业大麻花叶通过鼓风加热分别在温度95、100、110、120℃,脱羧时间分别为1.5~56min,进行CBDA脱羧转化处理。处理结束后,提取方法同“1.3.2.2”一致,经适当稀释定容进行CBD含量测定。
1.3.2.5 含量测定方法
通过高效液相色谱法对工业大麻中CBDA热脱羧生成CBD的含量进行测定,液相方法为:紫外检测器,检测波长220nm;色谱柱为DiamonsilC18反相色谱柱;流动相为乙腈:0.1%磷酸水(73∶27);流动相流速1.0mL/min;进样量10µL。
2 结果与讨论
2.1 工业大麻中大麻二酚酸脱羧转化体系热力学结果分析
由Benson基团贡献法计算得出CBDA和CBD气态标准摩尔生成焓分别为-704.19、-357.66kJ/mol,标准摩尔熵分别为954.35、900.41J/(mol·K)。根据Joback基团贡献法估算工业大麻中CBDA脱羧转化各组分理想气体比热容与温度(T)之间的函数关系式如下:
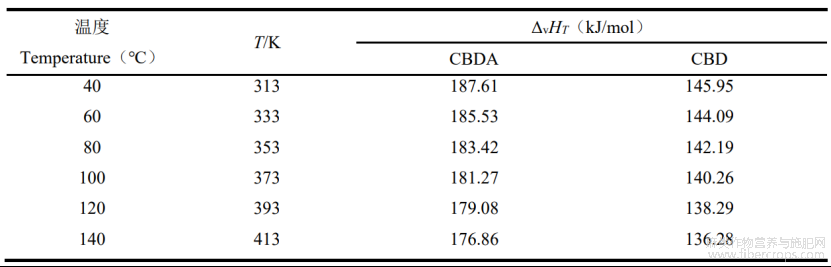
通过Joback和Reid基团贡献法、Watson公式得到CBDA和CBD在不同转化温度下的蒸发焓如表5。
表5 CBDA和CBD在不同温度下的蒸发焓
最后根据1.4项下公式计算得出工业大麻中 CBDA 脱羧转化体系下各组分在不同温度下的DfH g,298Q、DS g,TQ和DfH 1,TQ、DS 1,TQ如表6。
表6 反应各组分在不同温度下的气或液态标准摩尔生成焓和标准摩尔熵
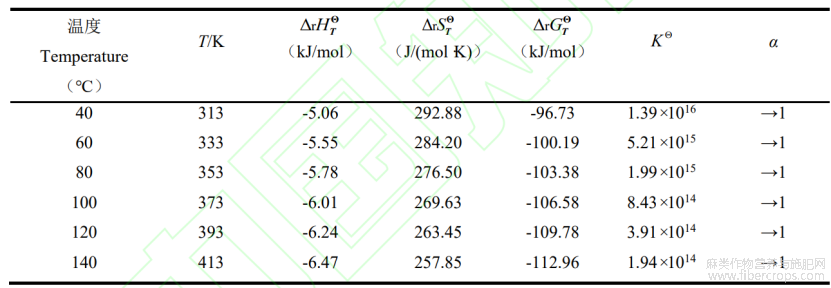
由上述结果,CO2在313~413K下气态标准摩尔生成焓为-392.91~-388.63kJ/mol、标准摩尔熵为215.70~227.53J/(mol·K),与专著[18]中给出在298.15~400K下CO2气态标准摩尔生成焓为-393.51~-393.586 kJ/mol、标准摩尔熵为 213.783~225.305 J/(mol·K)结果相当,说明此方法估算可靠。通过经典热力学公式(18)、公式(19)、公式(20)计算得出 CBDA 在不同温度下热脱羧转化焓变(DrHTQ)、熵变(DrSTQ)和转化的吉布斯自由能(DrGTQ)。不同温度下平衡常数(KQ)可由公式(21)经所确定该温度下的DrGTQ值计算得出,平衡转化率(α)可由 CBDA 反应式及KQ数学关系定义式,经软件Mathematica13.0进行计算确定。具体结果见表7。
通过上述热力学数据分析得出,在40~140℃脱羧转化温度内,DrGTQ均为负值,并随着温度的增加,DrGTQ值越小。说明该转化在40~140℃范围下可自发进行反应,并且随着温度升高,自发进行趋势越大;根据在不同反应温度下CBDA转化KQ及α,理论说明反应能够进行充分转化。
2.2 工业大麻中大麻二酚酸脱羧转化影响因素及机理参数结果分析
2.2.1 大麻二酚的TG分析
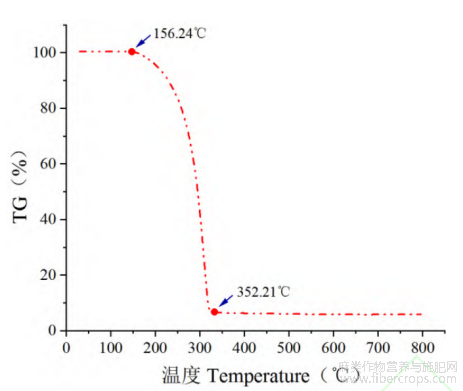
CBD 在升温速率为10K/min下TG热分析曲线见图 4。通过对 TG 曲线分析等知:
图4 CBD-TGA曲线
CBD在156.24℃开始失重,直至352.21℃失重完全。因此为保证CBD在热脱羧生成的过程中不因温度过高导致失重变化,所以最高热脱羧温度选择不应超过156.24℃。
2.2.2 温度对工业大麻花叶中大麻二酚酸脱羧转化影响
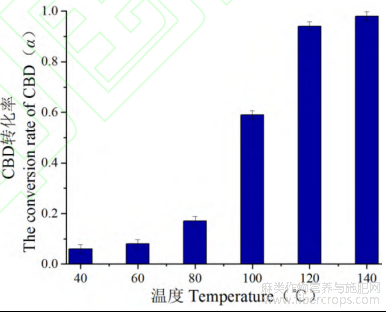
分别对工业大麻在不同温度下进行CBDA脱羧转化,CBD生成量随温度变化关系如图5所示。
图5 工业大麻花叶中CBDA在不同温度下生成CBD转化率
根据图中工业大麻在温度40~140℃范围内脱羧转化生成CBD的转化率得知,在脱羧转化相同时间内,随着温度的增加,CBD的转化含量增加。在40~60℃内,随着温度的升高,CBDA脱羧转化生成CBD含量相对较少,增加趋势不明显。当温度从60℃逐渐增长到140℃时,CBD转化含量急剧增加,并在140℃反应α趋近于1,这与转化体系热力学分析结果相同。说明随着温度的升高,脱羧体系中CBDA分子中内能增加,活化分子数增多,更容易发生脱羧转化。
2.2.3 含水量对工业大麻花叶中大麻二酚酸脱羧转化影响
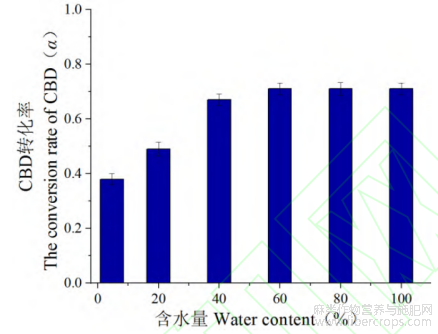
通过对不同含水量的工业大麻花叶在温度90℃下热脱羧30min进行CBD转化,转化结果如图6。
图6 工业大麻花叶中CBDA在不同含水量下CBD转化率
根据不同含水量热脱羧转化结果分析得知,工业大麻花叶在有一定含水率的条件下,热脱羧转化含量相对于阴干花叶含量明显提高,随着含水比例的增加,CBD转化含量增加。在含水率60%左右,CBD转化生成含量几乎达到最高,随着含水量继续增加,CBD转化生成含量几乎不变。这表明随着体系中含水量增加,增加了CBDA在转化体系的扩散范围,在一定程度上增加了CBDA分子的碰撞几率,使得脱羧转化容易发生。
2.2.4 工业大麻中大麻二酚酸脱羧转化最概然机理函数及活化能确定
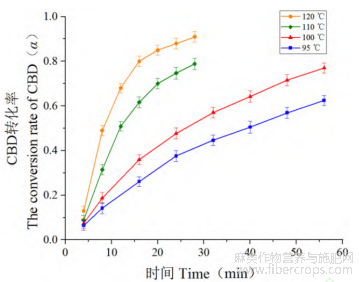
工业大麻花叶原料在不同温度下随时间变化受热脱羧转化生成CBD转化率曲线如图7。
通过等温分析法对阴干工业大麻和含有水分的工业大麻作物CBDA脱羧过程对数据进行分析,其中CBDA分解动力学函数如下。
α为CBD转化率;mi为i时刻CBD生成量;m0为初始CBD量;mt为完全脱羧CBD转化量。
根据对各种经典转化动力学函数模型分析总结得出[19],扩散模型Dn、随机成核和随后生长模型An及相边界反应模型Rn较为适用本研究条件下工业大麻中CBDA脱羧分解转化机理。8种分解动力学机理函数如表8所示。
表8 8种分解动力学机理函数
通过公式(22)、(23)及8种分解动力学机理函数,采用约化时间图法确定工业大麻中CBDA脱羧分解转化最概然机理函数。令
其中G(α)α=0.5和G(α)α=1.0代表当α=0.5和α=1.0时积分形式下G(α)具体数值;t0.5表示α达到0.5时所需要的时间。
则常见8种分解动力学机理函数可得为:
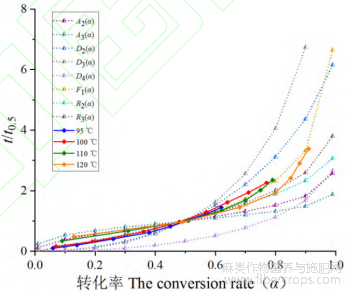
将公式(24)~(31)8种常见分解动力学机理模型作为理论曲线,将工业大麻在不同温度下脱羧转化CBD的α-(t/t0.5)曲线作为实验曲线,通过对比实验曲线与理论曲线的吻合程度,进而确定最概然机理函数。
图8 四种不同温度下工业大麻中CBDA脱羧转化生成CBD的α-(t/t0.5)曲线
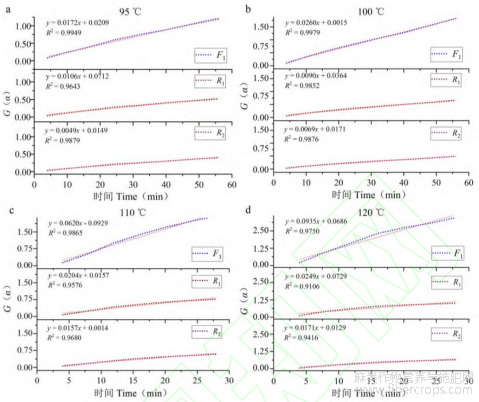
根据图8中工业大麻在不同温度下脱羧转化α-(t/t0.5)实验曲线与8种分解动力学机理函数α-(t/t0.5)标准曲线对比发现,F1、Rn模型较为符合工业大麻中CBDA受热转化生成CBD含量曲线,因此使用F1、R1、R2来得到工业大麻花叶各个温度下的脱羧生成t-G(α)曲线,通过对曲线线性拟合,确定最大概然机理函数。其中拟合方程斜率k为工业大麻在该温度条件下转化速率,R2为曲线表征拟合度,具体曲线结果如图9所示。
图9 工业大麻CBDA在四种不同温度下脱羧实验曲线与理论函数曲线拟合
根据R2拟合度越大,实验结果与理论模型符合程度越高[20]。通过不同状态下工业大麻在四种温度条件下三种动力学机理函数F1、R1、R2拟合t-G(α)曲线R2表征拟合度分析得出,F1函数模型表征线性拟合度符合程度最高,因此F1分解机理函数为本实验中CBDA受热脱羧分解最概然函数模型。
根据确定最概然机理模型,得出工业大麻中CBDA在四种不同温度下脱羧转化速率参数见表9。
表9 工业大麻中CBDA在四种不同温度下脱羧反应速率参数
通过Arrhenius方程[21]可知,转化速率k与转化温度T之间有下式关系:
式中:A为表观指前因子;E为活化能:R为气体普适常数。
通过对公式两边分别取对数,得出下式:
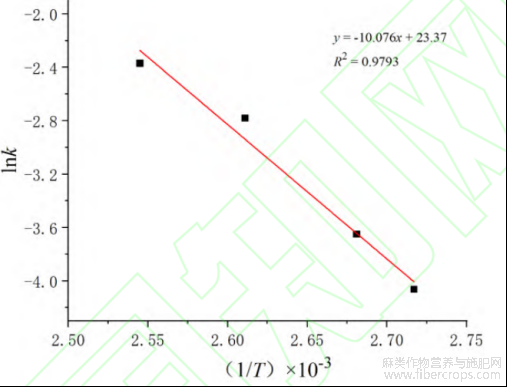
根据公式绘制工业大麻中CBDA脱羧转化F1函数模型的1/T-lnk散点曲线如图10,其中-E/R表示斜率,lnA为截距。
图10 工业大麻中CBDA脱羧反应F1函数模型1/T-lnk散点曲线
根据Arrhrnius方程计算得到工业大麻中CBDA脱羧转化活化能E为83.77kJ/mol,说明1molCBDA常态分子转变成具有反应作用的活化分子所需要的最低能量为83.77kJ。
3 讨论与结论
本研究通过基团贡献法和及Watson公式对工业大麻中CBDA脱羧转化体系各组分基本热力学参数进行计算。根据经典热力学公式得出在40~140℃温度下,随着温度的增加,反应DrGTQ值越为负值。说明在反应在40~140℃范围内可自发发生转化反应,随着脱羧温度升高,脱羧转化进行趋势越大。根据不同温度下DrGTQ值计算得出CBDA转化KQ及α,理论说明该反应能够进行充分转化。
为防止转化产物CBD因高温降解失重,通过热重分析得出脱羧反应最高温度不应该超过156.24℃。通过考察工业大麻含水量及环境温度对CBDA转化脱羧生成CBD的影响研究发现,随着环境温度及工业大麻花叶中含水量的增加,工业大麻中CBDA脱羧生成CBD转化率增加,说明在保证CBD不被降解失重的前提下,适当增加工业大麻花叶中含水量及温度,可提高工业大麻中CBDA脱羧转化进程。根据实验结果与常见8种分解动力学函数模型进行转化对比,确定工业大麻花叶中CBDA热脱羧转化最概然模型为F1模型,并通过Arrhrnius方程计算工业大麻花叶脱羧转化活化能E分别为83.77kJ/mol,理论揭示了1molCBDA常态分子转变成具有反应作用的活化分子所需要的最低能量。
参考文献
[1] Yang YH. History of Cannabis plant classification[J].Plant Fiber Prod(中国麻业),2003,25:9-11.
[2] Su FF, Yang G, Zheng YG. Research on the current situation of Cannabis sativa L. planting and breeding[J].China J Chin Mater Med(中国中药杂志),2022,47:1190-1195.
[3] Hanuš LO, Meyer SM, Muñoz E, et al. Phytocannabinoids:a unified critical inventory[J].Nat Prod Rep,2016,33:1357-1392.
[4] Xie R, Hao DL, Yang JY,et al.A mini-review on anti-tumor effect of cannabidiol[J].China J Chin Mater Med(中国中药杂志),2022,47:6541-6550.
[5] Chen C, Pan ZL. Cannabidiol and terpenes from hemp–ingredients for future foods and processing technologies[J].J Fure Foods,2021,1:113-127.
[6]Zhang J, Su JG, Tang Q,et al. Advances in research on the glandular hairs of Cannabis sativa L.[J].J Henan Agric Sci(河南农业科学),2022,51:10-17.
[7]Wang LL, Chen JY, Liang JZ, et al. Thermodynamic analysis of esterification of abietic acid with methanol by group contribution method[J].Ciesc J(化工学报),2013,64:1900-1906.
[8] Dong XF, Fang LG, Chen L.Physical property estimation principle and computer calculation(物性估算原理及计算机计算)[M].Beijing:Chemical Industry Press,2006:173-180.
[9] Dean JA. Lange's Handbook of Chemistry(兰氏化学手册)[M].Beijing: Science Press,2003:969.
[10] Poling BE, Prausnitz JM, O’Connell JP. The properties of gases and liquids:5th Edition(气液物性估算手册:第五版)[M]..Beijing:Chemical Industry Press,2006:65-66.
[11] Ma PS. Chemical data(化工数据)[M].Beijing:China Petrochemical Press,2003:113−135.
[12] Li D,Ding TM, Tian HS.Thermodynamics analysis of ethyl acetoacetate synthesis from ethyl acetate by ester condensation[J].Nat Gas Chem Ind(天然气化工-C1 化学与化工),2016,41:12-14.
[13] Fonseca L, Cremasco MA.Group contribution methods to predict enthalpy of vaporization of aromatic and terpene ketones at 298.15 K[J].Fluid Phase Equilib,2021,538:113009.
[14] Wan SY,S L. Thermodynamic analysis and experimental verification of a new route for direct diethyl oxalate synthesis[J].J Fuel Chem Technol(燃料化学学报),2021,49:121-128.
[15] Zheng WL, Jiang LH, Wang YM, et al. Research progress on estimation of critical temperature of organic compounds by group contribution method[J].Sci Technol Chem Ind(化工科技)2017,25:63-70.
[16] Wang W, Qian WZ, Liu BY, et al. Thermodynamic analysis of synthesis reaction of acetyl tributyl citrate[J].J Liaocheng Univ:Na Sci(聊城大学学报:自科版),2021,34:29-36.
[17] Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China:Vol Ⅳ(中华人民共和国药典:第四部)[M].Beijing:China Medical Science Press,2020:1114.
[18] Rumble JR.CRC Handbook of Chemistry and Physics:104th Edition[M].Boca Raton, FL:CRC Press/Taylor & Francis,2023:9-11.
[19] Hu RZ, Shi QZ. Thermal analysis kinetics(热分析动力学)[M].Beijing:Science Press,2001:174.
[20] Li JR, Zhu JG, Zhu SJ, et al. Calcium carbonate decomposition kinetics under rapid heating[J].China Powder Sci Technol(中国粉体技术),2018,24:1-7.21 Department of Physical Chemistry, Tianjin University. Physical chemistry(物理化学)[M].Beijing: Higher Education Press,2017:565-566.
文章摘自: 蔡宏达,刘梦然,王崑仑,唐翠曼,王彬,高继往,赵修华. 工业大麻中大麻二酚酸脱羧转化体系研究[J].现代农业科技,2023,24(027):95-99.