摘 要:【目的】探索苎麻植株各器官对镉胁迫的耐受策略,为苎麻耐镉育种及其耐镉分子机制研究提供理论指导。【方法】以镉富集型种质‘湘苎XB’和镉耐受型种质‘湘苎3号’为材料,设置不同浓度(0,50,100,200mg/kg)镉胁迫的盆栽实验,分析苎麻各器官中镉的亚细胞分布和化学形态,以及地下器官细胞壁成分变化。【结果】(1)镉主要分布在苎麻各器官的细胞壁和可溶性组分中,两者镉占比在地下器官和叶中均超过90%,茎中镉占比超过85%。(2)苎麻地下器官主要以NaCl提取态镉为主,其镉占比均超过50%,茎和叶中迁移性更强的有机镉和水溶性镉占比显著增加。(3)影响地下器官中镉滞留的因素包括地下器官细胞壁成分和NaCl提取态镉占比增加,且滞留效果受基因型影响。【结论】苎麻各器官通过改变镉的结合形态增强耐镉能力,细胞壁和液泡在提高镉耐受能力方面起重要作用,地下器官中细胞壁主要成分的增加有助于镉滞留。。
关键词:苎麻;镉胁迫;耐受机制;细胞和亚细胞水平
苎麻(Boehmeria nivea L.)又称“中国草”,作为纤维植物和饲用植物开发利用已经有上千年历史[1]。中国作为苎麻的分布与利用中心,种植面积长期占据全球的95%以上。然而,随着石化纤维的大量被利用及粮食安全担忧不断提升,全球范围内的苎麻种植面积都持续萎缩[2]。中国作为苎麻的主要生产国,对全世界苎麻产业有着近乎垄断的优势,曾为中国出口创汇提供了重要来源。作为纤维质量极优的物种,苎麻在未来纤维类生物基产品制备领域具备战略优势[3]。因此,必须采取行之有效的措施推动中国苎麻行业的转型升级发展,以维持中国在相关领域的持续优势。苎麻作为具备耐受重金属、耐贫瘠、耐旱等多重环境胁迫的作物种类,利用不适合粮食作物生长的边际性土地种植苎麻,可有效缓解苎麻种植面积持续萎缩的趋势[2]。在所有边际性土地中,重金属污染休耕地主要处于中国南方,开发难度较低,水肥条件优越。比如,目前湖南有不适合种植粮食作物的重金属污染休耕地约2666.67hm2[2-4]。苎麻作为非食用型的经济作物,在重金属污染的休耕地上种植不存在食品安全的担忧;另外,苎麻具有较强的环境胁迫耐受能力,废弃矿山的复垦地也可作为扩展苎麻种植面积的后备土地资源,这不但可遏制苎麻种植面积萎缩的局面,而且凭借苎麻发达的地下根系统、较强的重金属吸附能力还可实现土壤改良的目的[5-6]。但上述潜能的实现需要建立在具备可种植苎麻新品种的基础上。因此,培育具备耐重金属、高产、优质苎麻新品种是亟待攻关的重要方向。
重金属耐受机制是育种的前提与基础,揭示苎麻耐受重金属胁迫的相关机制是亟待解决的关键科学问题。目前,关于苎麻耐受重金属胁迫响应机制的研究主要集中在分子生物学层面。有研究指出镉敏感苎麻品种受镉胁迫后BnHMA1表达量增加,加速镉转运,进而削弱重金属毒害作用[6]。镉胁迫可以诱导BnPCS1的过表达,进而增强苎麻植株镉耐受能力[7]。但相关研究还不多且系统性不强,导致现有分子育种技术在耐镉苎麻新品种培育中应用还存在局限。基因表达的结果往往体现在植株形态、组织与细胞结构等方面的变化。因此,明确重金属胁迫条件下苎麻在组织结构及细胞等分子上位水平的耐受策略,然后再深入分析调控相应上位耐受策略的分子过程,可增强苎麻耐重金属分子机制研究的目标性,进而提升相应分析效率和结果准确性。
目前,关于从苎麻组织与细胞结构层面减轻镉离子毒害作用的研究较少。高等植物在重金属胁迫条件下,其植株可通过形成屏障组织减少对重金属的吸收,植物分泌物与重金属离子螯合减轻其毒性,体内重金属的区室化隔离与植物体外泌解毒等途径以适应重金属胁迫[8]。基于此,本研究将探究细胞壁的吸附固定和液泡区室化隔离对苎麻植株耐镉能力的贡献,进而明确各器官在亚细胞水平上的耐受策略;同时通过分析根、茎、叶各器官中不同形态镉含量的差异,探究苎麻植株如何通过改变镉离子迁移性和毒性以增强植株镉胁迫的适应能力;再利用相关性分析考察影响苎麻地下器官中镉滞留的关键因素,进一步阐明地下器官适应镉胁迫的响应机制。本研究结果可为苎麻耐镉育种以及更深入的分子水平耐镉机制研究提供理论指导和技术支持。
1材料和方法
1.1试验材料
选取‘湘苎XB’和‘湘苎3号’,个品种作为研究对象,笔者所在团队前期研究结果表明所选2个品种均为同时具备重金属和贫瘠土壤耐受性的苎麻基因型,其耐镉阈值均在150mg/kg之上[9-10]。其中,‘湘苎XB’属于镉富集型种质,而‘湘苎3号’属于镉耐受型种质,且‘湘苎XB’对贫瘠土壤的耐受能力强于‘湘苎3号’[2]。2个种质的种植材料均采集于湖南省长沙市湖南农业大学耘园实验基地内(北纬28°11'10″,东经113°04'05″,海拔58m)。
1.2试验设计及取样方案
研究结果表明,2种参试材料均能在50~150mg/kg镉含量土壤中生长良好[11],但当镉含量超过150mg/kg时,苎麻各性状开始下降[11-12]。基于此,研究共设4个镉胁迫浓度处理,分别为0(对照组,不添加镉),50,100,200mg/kg,每个处理设3个重复。于2023年春季挑选长势健壮的苎麻根茎(约200g)作为繁殖材料,种植在无孔塑料方盆中(65cm×40cm×15cm),每盆种植4株苎麻。自然光照、15~27℃下连续培养15d后,添加相应浓度的CdCl2·2.5H2O溶液进行镉胁迫处理。栽培土选用育苗营养基质,其有机质和腐殖酸含量大于55%,pH为6.0。为保证养分供应,培养期间使用Hoagland完全营养液浇灌3次,每次间隔50d,连续培养150d后收获植株。收获后,新鲜苎麻植株样品分为地下器官(根和根茎)、茎和叶3个部分。将样品洗净后,一部分用于各器官亚细胞组分分离(2.0g样品)和不同化学形态镉的提取(0.2g样品),剩余样品在烘箱中105℃杀青1h后65℃烘干至恒重,粉碎过100目筛并保存于自封袋,用于后续测定地下器官、茎和叶中镉含量。
1.3测定指标及方法
1.3.1镉含量测定
将植物样品在80℃烘干至恒重后,粉碎过100目筛密封保存。称取0.3g样品放入消煮管中,加入HNO3和HClO4(体积比为3∶1)8mL,静置6~10h。将样品置于石墨消解仪内,温度控制在160℃消化,直至无红棕色浓烟产生,消解产物在240℃条件下赶酸至1mL,以上操作均在通风橱中进行。将赶酸后的样品用超纯水定容至50mL,用0.22μm微孔测滤定膜溶过液滤中溶的液镉,含用量电。感耦合等离子技术(ICP-MS)
1.3.2木质纤维素含量测定
将苎麻各器官样品洗净、烘干、粉碎过筛后,参照标准《木质纤维素类生物质原料化学成分的测定第5部分:纤维素、半纤维素、果胶和木质素的测[1]定3]。》(NB/T34057.5—2017)测定木质素、纤维素含量。
1.3.3亚细胞组分分离与镉含量测定
参考Weigeiw[14]等和Fu[15]等的方法,利用改进的差速离心技术分离不同器官的不同亚细胞组分[6。具体步骤:准确称取植物组织鲜样(根、茎叶)2.0g,加人20mL预冷的4℃提取液[25mmol/l蔗糖+50mmol/lTris-HCl缓冲液(pH为7.5)+1mmol/1二硫赤鲜糖醇]后研磨成匀浆匀浆液于尼龙布(100m网目)筛分,残渣为细胞壁组分;滤液在600g条件下离心10min,沉淀为细胞核组分;上清液在2000g条件下离心15min沉淀为叶绿体组分;上清液在10000g条件下离心20min,沉淀为线粒体组分,上清液为可溶组分。全部操作在4℃下进行。所得的各亚细胞组分烘干加人HNO:和HCIO体积比为3:1)进行消解并测定镉含量。
1.3.4不同化学形态镉提取与测定
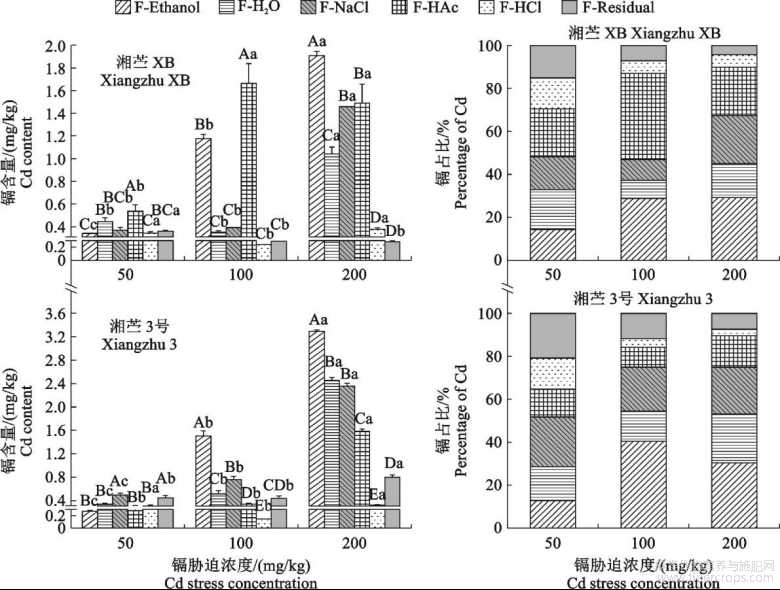
参考Fu等[15]化学试剂逐步提取法提取植株地下器官、茎、叶中不同形态的镉离子。按照以下溶液进行逐步提取:(1)80%乙醇(记为F-Ethanol),提取无机镉,以硝酸盐/亚硝酸盐镉、氯化物镉和氨基苯酚镉为主;(2)去离子水(记为F-H2O),提取水溶性Cd;(3)1mol/LNaCl(记为F-NaCl),提取果胶酸盐和蛋白质结合的Cd;(4)2%HAc(记为FHAc),提取磷酸盐结合态镉,含CdHPO4和Cd3(PO4)2等;(5)0.6mol/LHCl(记为F-HCl),提取草酸结合的镉。具体步骤:分别准确称取苎麻地下器官、茎、叶鲜样0.2g,依次加入上述提取液20mL,研磨成匀浆,25℃下150r/min振荡22h,于4℃下10000g离心10min后吸取上清液,再加入相同提取液20mL,相同振荡条件振荡2h后,4℃下10000g离心10min后吸取上清液,合并2次上清液得到相应提取态组分样品。将提取后所得沉淀物以此类推进行逐步提取。5种提取后溶液定容至50mL,剩余残留态镉(记为F-Resdual),经过烘干、消解和定容后,用0.22μm微测孔定滤溶膜液过中滤镉溶含液量,用电感耦合等离子技术(ICP-MS)测定溶液中镉含量。
1.3.5数据处理
所有测定指标利用SPSS26.0先进行单因素方差分析(one-wayANOVA),再进行处理间0.05水平的差异显著性检验及多重比较;试验数据间的相关关系采用皮尔逊相关性分析。数据均以“平均值±标准误”表示。滞留率用于表征植物根系在吸收镉后将其固定或保留在根部的能力[17]。滞留率=[地下器官中的镉含量-地上部(茎和叶)镉含量)]/地下器官镉含量×100%。
2结果与分析
2.1镉胁迫对苎麻各器官中镉积累的影响
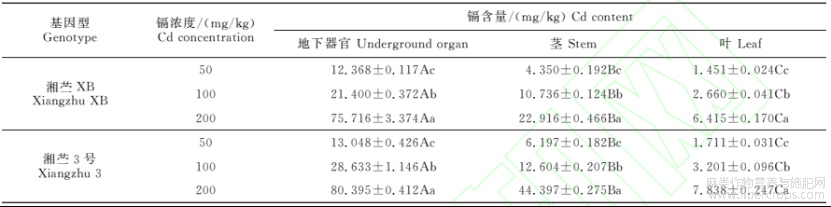
‘湘苎XB’和‘湘苎3号’各器官中镉含量均随着镉胁迫浓度增加而上升,且各浓度处理间均差异显著(P<0.05),器官之间又表现为地下器官>茎>叶,且各器官间均存在显著差异(表1)。其中,处理浓度间比较,2份种质地下器官中镉含量均值在200mg/kgCd处理下分别是100mg/kg和50mg/kg处理的3.12倍和6.14倍。两种质间比较,‘湘苎3号’地下器官、茎和叶中镉含量均不同程度高于相应其各浓度处 镉含量分别为‘湘苎XB’则分别为36.49,12.67,3.51mg/kg。尤其在200mg/kgCd处理下,‘湘苎3号’茎秆中镉含量是相应‘湘苎XB’的1.94倍,即‘湘苎3号’对镉富集能力强于‘湘苎XB’,但整体上两种质之间含量无显著差异。不同器官之间比较,苎麻植株各器官镉含量(所有处理平均值)表现为地下器官(38.59mg/kg)>茎(16.87mg/kg)>叶(3.88mg/kg),且此趋势在供试的2个品种间和3个镉处理浓度间稳定存在。
2.2镉胁迫对苎麻地下器官中镉含量及镉形态的影响
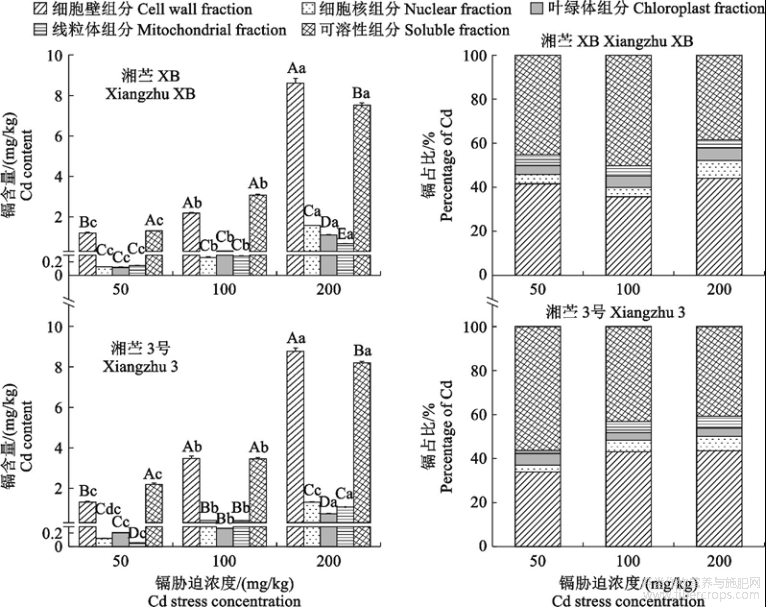
2.2.1地下器官亚细胞组分中镉含量和占比
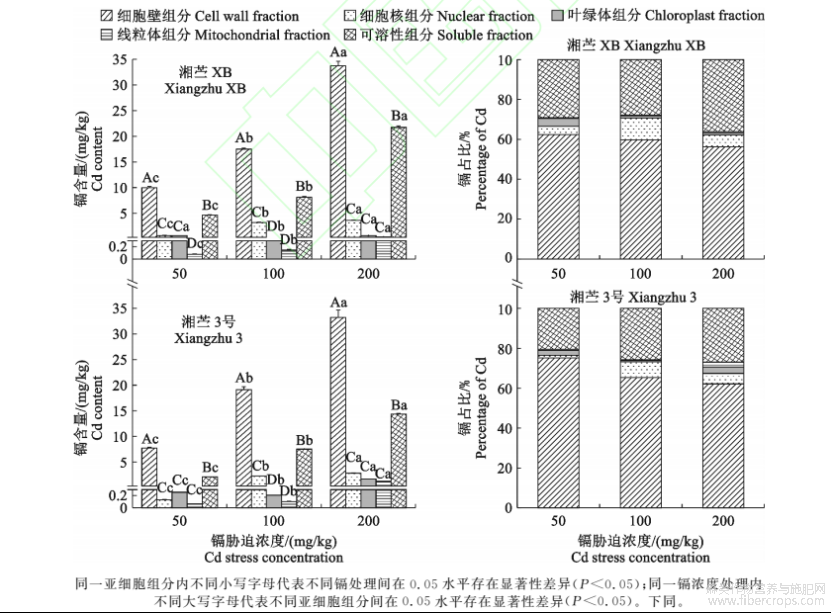
由图1可知,‘湘苎XB’和‘湘苎3号’地下器官细胞壁、细胞核和可溶性组分中镉含量均随镉胁迫浓度增加而显著上升(P<0.05)。
表1不同浓度镉胁迫下苎麻各器官中镉积累量
注:同列不同小写字母表示同一种质不同镉处理间存在显著性差异(P<0.05),而同行不同大写字母表示同一镉浓度处理不同器官间存在显著性差异(P<0.05)。
图1不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’地下器官亚细胞组分中镉含量和占比
随着镉处理浓度升高,各亚细胞组分中镉含量占比却呈现细胞壁中镉含量占比下降,可溶性组分镉含量占比上升趋势。在200,100mg/kgCd胁迫处理下,‘湘苎3号’地下器官细胞壁中镉含量占比较50mg/kgCd胁迫处理分别降低23.89%和13.00%,可溶性组分中镉含量占比分别增加31.95%和26.13%。虽然各亚细胞组分中镉含量占比有变化,整体上仍表现为地下器官中镉离子主要分布在细胞壁和可溶性组分,并且细胞壁组分中镉占比更高。其中,‘湘苎XB’细胞壁和可溶性组分中镉占比之和达90.48%(所有处理平均占比),‘湘苎3号’达90.29%,进入细胞核、叶绿体和线粒体组分的镉所占比例不超过总镉含量的10%。
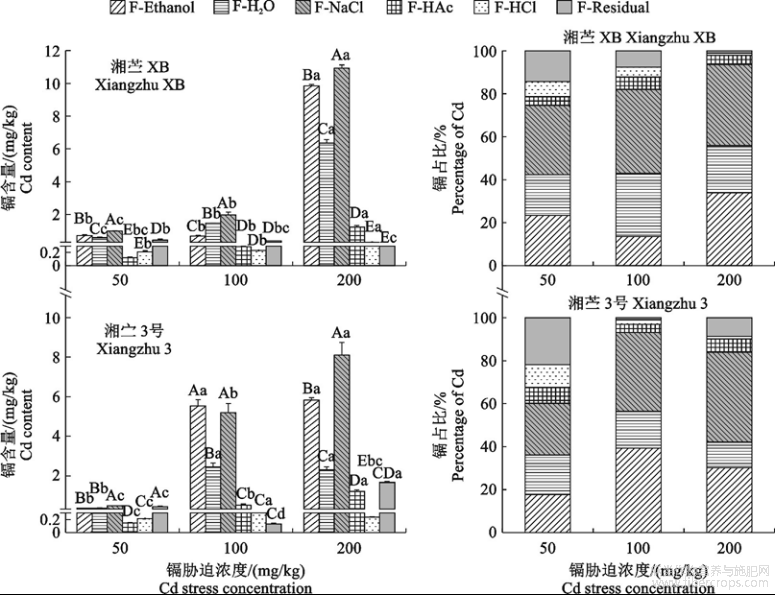
2.2.2地下器官中不同化学形态镉含量和占比
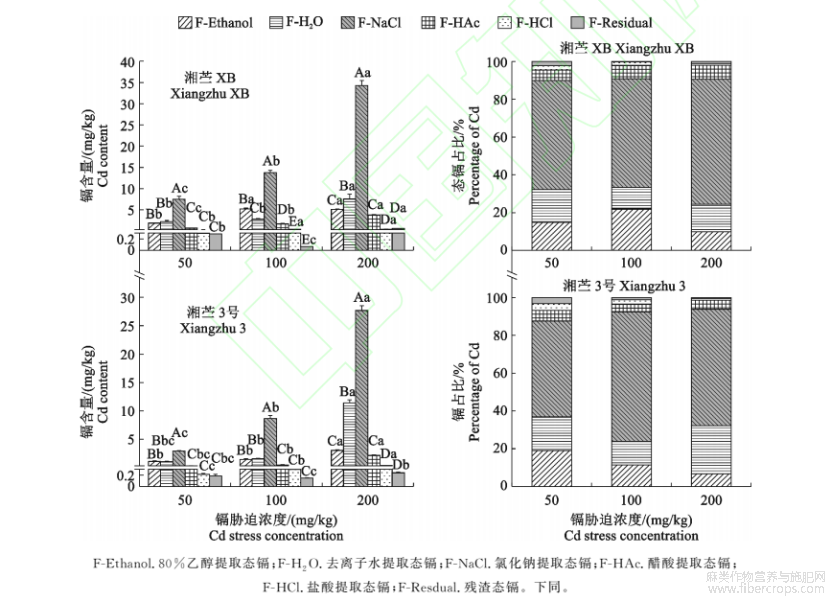
由图2可知,随着镉胁迫浓度增加,地下器官中残留态镉含量先降后升,并在100mg/kgCd处理下最低,此时‘湘苎XB’和‘湘苎3号’分别比50mg/kgCd处理降低77.00%和19.57%。其他形态镉含量均呈显著递增趋势(P<0.05),并以F-NaCl提取态镉含量增幅最大,200mg/kgCd胁迫处理‘湘苎XB’和‘湘苎3号’F-NaCl提取态镉含量分别是50mg/kgCd胁迫处理的3.59倍和9.42倍。但随着镉胁迫浓度升高,不同化学形态镉占比存在不同的变化趋势。F-NaCl提取态镉作为地下器官中镉含量和占比最高的形态,在‘湘苎XB’和‘湘苎3号’中占比分别达60.46%和60.35%。
图2不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’植株地下器官中不同化学形态镉含量及占比
在200mg/kgCd胁迫时,‘湘苎XB’F-NaCl提取态镉占比较50mg/kg和100mg/kg分别显著增加了14.55%和15.46%。‘湘苎3号’F-NaCl提取态镉占比随着镉胁迫浓度增加呈现先升后降趋势,在镉胁迫浓度为100mg/kg时达到最大值(68.71%)。‘湘苎XB’的F-Ethanol提取态镉占比随镉胁迫浓度增加先增后降,在100mg/kgCd胁迫下最高(21.81%),分别是50mg/kg和200mg/kgCd胁迫的1.47倍和2.20倍。‘湘苎3号’F-H2O提取态镉占比随着镉胁迫浓度增加表现为先降后增,在100mg/kgCd胁迫下最低(12.38%),较50mg/kgCd胁迫降低了30.70%,而在200mg/kgCd胁迫时增加了2.06倍。F-HAc、F-HCl和F-Residual提取态镉占比整体偏低,其占比均在10%左右,且随镉胁迫浓度增加整体呈下降趋势。
2.2.3地下器官中镉滞留率
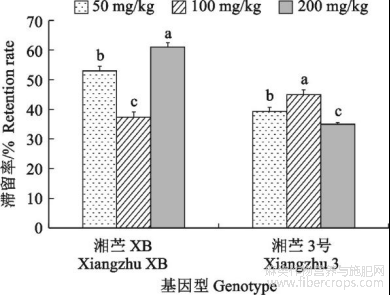
由图3可知,镉处理浓度与基因型对苎麻地下器官中镉滞留率有显著影响(P<0.05)。整体来看,镉处理浓度对地下器官中镉滞留率的影响在‘湘苎XB’和‘湘苎3号’之间呈相反趋势,即‘湘苎XB’随镉胁迫浓度增加表现为先降后增,‘湘苎3号’则表现为先增后降。在镉胁迫浓度为100mg/kg时,地下器官镉滞留率在‘湘苎XB’中达到最低值(37.33%),而在‘湘苎3号’中达到最高值(45.00%)。比较2个基因型,整体上表现为‘湘苎XB’地下器官对镉的滞留能力强于‘湘苎3号’,其滞留率均值高出‘湘苎3号’10.67%。
图3不同浓度镉胁迫下苎麻植株地下器官中镉的滞留率
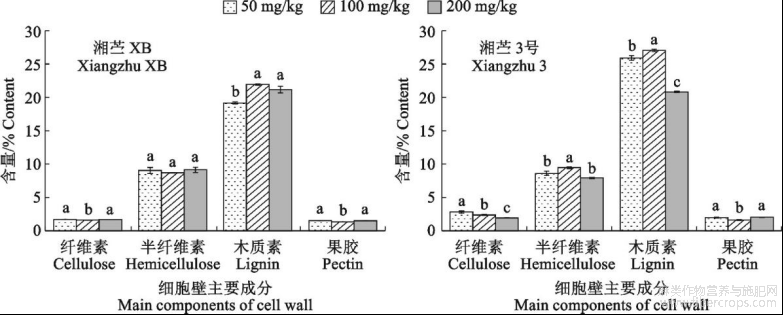
2.2.4地下器官细胞壁的主要成分含量
细胞壁作为苎麻地下器官滞留镉的关键组分,其主要成分含量受镉胁迫影响后产生了显著变化(图4)。‘湘苎XB’细胞壁中纤维素和果胶含量在100mg/kgCd胁迫下显著偏低,分别仅占1.60%和1.35%;木质素含量在100mg/kgCd胁迫时达到21.92%,显著高于50mg/kgCd胁迫时的含量;而半纤维素含量在不同浓度镉胁迫之间未呈现出显著性差异。‘湘苎3号’细胞壁中纤维素、半纤维素和木质素含量在镉胁迫浓度为200mg/kg时较100mg/kgCd胁迫分别显著降低了18.56%、16.45%和23.03%;果胶含量在100mg/kgCd胁迫下显著偏低,仅占1.60%。
图4不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’地下器官细胞壁中的主要成分含量
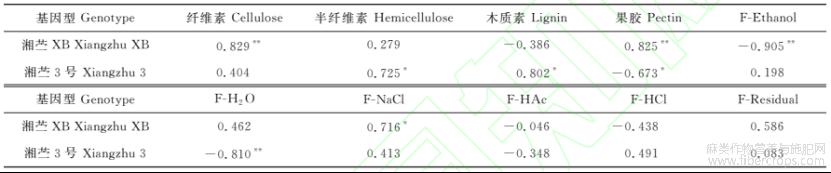
2.2.5地下器官细胞壁的成分含量和各化学形态镉占比与镉滞留率的相关性
苎麻地下器官细胞壁的成分含量与镉滞留率的相关性分析(表2)表明,‘湘苎XB’的镉滞留率与细胞壁中纤维素含量和果胶含量均呈极显著正相关(P<0.01)。‘湘苎3号’的镉滞留率与地下器官细胞壁半纤维素含量和木质素含量呈显著正相关(P<0.05)。在200mg/kgCd胁迫时,‘湘苎XB’镉滞留率较100mg/kgCd胁迫时增加63.41%,其纤维素和果胶含量较100mg/kgCd胁迫时也分别增加了5.58%和10.75%。此时,‘湘苎3号’镉滞留率较100mg/kgCd胁迫处理减少了22.22%,相应的半纤维素和木质素含量也较100mg/kgCd胁迫处理显著减少了16.45%和23.03%。可见,在200mg/kgCd胁迫时,‘湘苎XB’地下器官细胞壁成分中纤维素和果胶的形成对镉滞留具有明显促进作用,而‘湘苎3号’地下器官细胞壁中半纤维素和木质素合成受到抑制,其镉滞留能力也有所降低。
另外,‘湘苎3号’的镉滞留率与地下器官细胞壁中果胶含量呈显著负相关(P<0.05),但其相关性及果胶含量都偏低,果胶含量对‘湘苎3号’镉滞留的影响较小。
表2同时显示,‘湘苎XB’地下器官中镉滞留率与其F-Ethanol提取态镉占比呈极显著负相关,与F-NaCl提取态(P<0.05)和F-Residual残渣态(P>0.05)镉占比呈正相关。说明在镉胁迫处理下,‘湘苎XB’地下器官中镉离子由容易迁移的F-Ethanol提取态转化为较难迁移的F-NaCl提取态和难以迁移的残渣态,实现对镉的固定与滞留。对‘湘苎3号’而言,其地下器官中镉离子滞留率主要与FH2O提取态镉占比呈显著负相关,与F-NaCl和F-HCl提取态呈不显著正相关。即‘湘苎3号’地下器官中镉离子由易迁移的F-H2O提取态镉离子转化为较难迁移的F-NaCl和F-HCl提取态,实现对镉的固定与滞留。可见,苎麻地下器官中镉结合形态的转换也是影响其镉滞留的因素之一。
表2苎麻植株地下器官细胞壁的主要成分含量和不同化学形态镉占比与其镉滞留率的相关性
注:*和**分别表示在P<0.05和P<0.01水平显著相关。
2.3镉胁迫对苎麻植株茎和叶中镉含量及镉形态的影响
2.3.1茎和叶亚细胞组分中镉含量和占比
由图5、图6可知,随着镉胁迫浓度增加,‘湘苎XB’和‘湘苎3号’茎、叶细胞壁和可溶性组分中镉含量存在显著上升趋势(P<0.05),如‘湘苎XB’茎的细胞壁组分中镉含量由50mg/kgCd胁迫处理下的1.21mg/kg增加至200mg/kgCd胁迫处理下的8.60mg/kg。
镉在茎和叶亚细胞组分中的分布与地下器官相似,主要分布在细胞壁和可溶性组分中,但其将镉离子更多地区隔在可溶性组分中,细胞壁滞留镉占比次之,这与地下器官不同。其中,‘湘苎XB’和‘湘苎3号’茎秆细胞壁和可溶性组分中镉占比之和分别为85.08%(所有处理平均占比,分别为40.42%和44.66%)和86.92%(分别为40.22%和46.70%),叶片细胞壁和可溶性组分中镉占比之和分别高达93.48%(分别43.25%和50.23%)和92.25%(分别为42.22%和50.04%)。此外,‘湘苎XB’和‘湘苎3号’茎秆细胞核、叶绿体和线粒体组分中镉占比均超过10%,而叶片细胞核、叶绿体和线粒体组分中的镉占比仅分别为6.52%和7.75%。随着镉胁迫浓度增加,‘湘苎3号’茎秆可溶性组分中镉占比存在显著下降趋势,由50mg/kg处理的56.22%下降至200mg/kg处理的40.75%。但随镉胁迫浓度增加,‘湘苎XB’和‘湘苎3号’叶片可溶性组分中镉占比均呈显著上升趋势,如‘湘苎3号’叶片可溶性组分中镉占比由50mg/kg处理的47.03%上升至200mg/kg处理的51.88%。
2.3.2茎和叶中不同化学形态镉含量和占比
由图7可知,‘湘苎XB’和‘湘苎3号’茎秆中F-NaCl提取态镉含量随镉胁迫浓度升高而显著增加(P<0.05),如200mg/kg镉胁迫处理分别较50mg/kgCd处理增加了11.02倍和16.88倍。同时,‘湘苎XB’和‘湘苎3号’茎秆中F-NaCl提取态镉占比范围分别为32.37%~39.08%和24.03%~41.79%,均显著高于其他提取态镉,表现与地下器官一致,且随镉胁迫浓度增加其占比整体上有所递增。在镉胁迫环境下,‘湘苎XB’和‘湘苎3号’茎秆中F-Ethanol和F-H2O提取态镉占比显著高于地下器官,在100mg/kgCd胁迫时,‘湘苎XB’F-H2O提取态镉占比高达29.37%,‘湘苎3号’F-Ethanol提取态镉占比高达39.24%;F-Ethanol和F-H2O作为迁移能力较强的化学形态,‘湘苎XB’二者占比之和随镉胁迫加强而显著增加,而‘湘苎3号’二者占比之和则先增后降,200mg/kgCd胁迫处理时二者占比之和较100mg/kgCd处理降低了25.54%。
图5不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’茎的亚细胞组分中镉含量和占比
图6不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’叶的亚细胞组分中镉含量和占比
图7不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’茎中不同化学形态镉含量和占比
图8不同浓度镉胁迫下‘湘苎XB’和‘湘苎3号’叶中不同化学形态镉含量和占比
随着镉胁迫浓度增加,‘湘苎XB’茎中F-HAc、F-HCl和F-Residual提取态镉占比之和整体上有所降低,而‘湘苎3号’茎中F-HAc、F-HCl和F-Residual提取态镉占比之和在200mg/kg镉胁迫下较100mg/kgCd胁迫时增加了2.37倍(图7)。
从图8可知,‘湘苎XB’和‘湘苎3号’叶片中不同化学形态镉含量较地下器官和茎中显著减少。但随着镉胁迫浓度增加,其中F-Ethanol和F-H2O提取态含量占比之和也明显增加,这2种镉形态之和占比在叶中最高。当镉胁迫浓度≥/kg时,‘湘苎3号’叶中态镉占比超过50%,均值达到53.80%。而F-NaCl提取态镉不是叶片中镉的主要结合形态,其均值在2个苎麻种质中分别仅占15.75%和21.78%(所有镉处理的均值)。另外,苎麻叶片中F-HAc提取态镉所占比例增加,如100mg/kgCd胁迫‘湘苎XB’叶片中F-HAc提取态镉占比可达40.24%;‘湘苎3号’叶片中F-HAc提取态镉占比均值可达12.29%,分别是茎和地下器官中的2.13倍和2.55倍。
3讨论
3.1镉胁迫对2种基因型苎麻植株镉吸收与积累的影响
根系是镉离子进入植株体的第一道屏障,根对镉的固持作用会限制镉向地上部分转运,植物将镉滞留在根系中可能是植物应对重金属胁迫的方式之一[18]。植株应对镉胁迫时,地下器官作为植株最先接触重金属的器官,其适应性对植株耐受镉胁迫至关重要。本研究中,苎麻各器官中镉含量随着镉胁迫浓度增加显著上升,且大部分镉积累在地下器官中,这与Lai[19]和闫雷等[20]的研究相似。当镉胁迫浓度达到200mg/kg时,‘湘苎3号’向茎运输镉含量更高,进一步证实其植株向上运输镉的能力较强[12]。在耐镉阈值范围内,虽然2种基因型苎麻均能吸附土壤中的重金属镉,但‘湘苎3号’的吸附效果适优应于能‘力湘评苎价X体B系’。 ‘湘苎XB’适应苎麻贫瘠贫土瘠壤土的能力较强,而‘湘苎3号’则较弱。因此,‘湘苎XB’更适合用于修复贫瘠的矿区重金属污染土壤,而‘湘苎3号’则在修复重金属污染的休耕地时能发挥最佳效果。
3.2 2种基因型苎麻各器官亚细胞组分对镉胁迫的响应
细胞壁的吸附固定和液泡区室化隔离作用是植物细胞适应镉胁迫和解镉毒的关键机制[21]。有研究指出,细胞壁能固定大量的镉离子,减少重金属镉进入细胞,减轻对植物细胞的伤害[15]。而液泡作为可溶性组分的主要组成部分,其内部丰富的有机酸可与重金属离子螯合,并将其隔离在液泡中,降低重金属对植物组织或器官产生的毒害作用,从而表现出重金属的内部耐受作用[22],是镉在植物各器官中结合的第二位点[23]。本研究发现,在镉胁迫环境下,‘湘苎XB’和‘湘苎3号’地下器官、茎和叶中镉离子大部分被富集在细胞壁和可溶性组分,其占比均超过80%。因此‘湘苎XB’和‘湘苎3号’各器官均是利用细胞壁的吸附固定和液泡区室化隔离作用缓解镉毒。这与旱柳(Salix matsudana Koidz.)[24]美洲商陆(Phytol accaamericana L.)[15]和栾树(Koelreuteria paniculata Lamx.)[25]中的研究结果相似。但与之不同的是,这2种基因型苎麻植株镉离子分布在不同器官中存在差异,地下器官的细胞壁组分中镉占比均超过50%,而茎和叶可溶性组分中镉占比略高于细胞壁组分中的镉占比。有研究指出,当细胞壁结合的镉离子达到饱和时,镉会以游离态进入细胞质并产生毒害,此时液泡通过区室化阻隔作用将镉离子螯合在植物液泡中[26],而该过程受液泡中酶基因调控,可将根系细胞质中镉转运到液泡中进行隔离储存,Daisei等[27]对水稻(OryzasativaL.)的研究结果表明,低镉积累品种的OsHMA3通过选择性地将镉隔离到根液泡中,限制了镉从根部到地上组织的迁移。因此,苎麻各器官将镉分布在细胞壁和可溶性性组分是行之有效的解毒策略,根据其各器官适应镉胁迫所产生的解毒策略,后续深入分析调控耐受镉胁迫的分子机制具有重要意义。
3.3 2种基因型苎麻器官镉化学形态对不同浓度镉胁迫的响应
有研究指出,镉化学形态的转换是植物细胞解镉毒的关键机制[28],并且镉的化学形态与其毒性和迁移能力直接相关,随着提取剂极性增强,所提取镉在植株体内的毒性和迁移能力不断降低[15]。无机镉(F-Ethanol提取态镉)和水溶性镉(F-H2O提取态镉)的迁移性和毒性最强;果胶酸盐和蛋白质结合态镉(F-NaCl提取态镉)迁移性较低,毒性最低[29];磷酸盐结合态镉(F-HAc提取态镉)、草酸结合的镉(F-HCl提取态镉)和残留态(F-Resdual提取态镉)迁移性和毒性也逐级降低[30]。本研究结果显示,苎麻地下器官在镉胁迫下作为镉富集的主要器官,并主要以果胶酸盐和蛋白质结合态镉存在,镉占比均超过50%,该形态以高占比形式存在被认为是植物中减轻镉毒性重要方式,从而减轻对地下器官的损伤[31]。同时,随着镉胁迫浓度增加,苎麻地下器官中F-NaCl提取态镉占比有所上升,以提高苎麻地下器官的耐镉能力。另外,镉的化学形态对地下器官中镉滞留率具有显著影响。Li等的研究结果[32]表明,镉迁移能力的降低对增强地下器官镉滞留率具有重要作用,有助于提升植物适应镉胁迫。本研究中,苎麻地下器官在受到镉胁迫时有将迁移能力强的无机镉和水溶性镉转化为迁移能力弱的果胶酸盐和蛋白质结合镉以及磷酸盐结合态镉的趋势,以增强地下器官对镉的滞留能力,减少镉离子向地上部分转运,降低镉毒害作用。与地下器官不同的是,在适应镉胁迫的阈值范围内,2种不同基因型苎麻植株茎和叶中无机镉和水溶性镉占比较高。但为缓解镉胁迫对茎和叶生长的影响,茎通过提高F-NaCl提取态镉占比,叶通过提高F-HAc提取态镉占比,降低镉的迁移性和毒性,缓解镉毒害发生。
3.4 2种不同基因型苎麻细胞壁成分对地下器官滞留镉的影响
根系是镉离子进入植株体的首道屏障,将镉滞留在根系中是植株应对重金属胁迫的方式之一[33]。本研究发现,苎麻地下器官是镉富集的主要器官。通过亚细胞分布研究发现,细胞壁组分在吸附固定镉离子过程中发挥重要作用。细胞壁作为保护植物免受重金属毒害影响的重要保护屏障[18],其主要成分包括纤维素、半纤维素、木质素和果胶等,对重金属具有一定的螯合作用[34];并且,细胞壁上含有丰富的带负电荷的官能团,能与重金属阳离子发生反应,是细胞壁能滞留镉的关键原因[35-36]。有研究表明,细胞壁上半纤维素和果胶带有的负电荷基团与镉离子发生静电结合,这主要受到PME14和XCD1等基因调控[37]。在水稻耐盐胁迫的研究中,UGE3过表达能提高纤维素和半纤维素的含量,从而增强水稻对盐胁迫和渗透胁迫的耐受性[38-40]。本研究发现,镉胁迫引起细胞壁成分含量变化,细胞壁成分含量变化会影响地下器官对镉的滞留能力。‘湘苎XB’地下器官中的纤维素和果胶含量增加,以及‘湘苎3号’地下器官中半纤维素和木质素含量增加均增强了对镉的滞留能力。然而,不同程度的镉胁迫对不同基因型苎麻地下器官细胞壁成分含量和镉滞留能力的影响存在显著差异。马莹等[29]的研究也证实镉胁迫会导致‘中苎1号’等基因型苎麻半纤维素含量变化,通过增加细胞壁中的半纤维素含量以应对镉胁迫,这进一步支持了细胞壁成分在响应镉胁迫中的重要作用。因此,通过明确细胞壁成分含量增加类型,并对其合成酶相关基因进一步分析,有助于后续深入研究提升植物耐镉能力。
4.结论
‘湘苎XB’和‘湘苎3号’具有较强的镉耐受能力,在应对不同浓度镉胁迫时,其植株各器官均通过调节镉的选择性分布以及转换镉的结合形态以减轻镉毒害作用。其中,根系的细胞壁吸附固定作用、茎叶的液泡区室化隔离作用及镉形态从迁移-毒性强的形态向迁移-毒性弱的形态转化是苎麻植株应对镉毒害的重要策略。综合2个基因型苎麻品种的表现,‘湘苎XB’更适合用于修复贫瘠的矿区重金属污染土壤,而‘湘苎3号’则在修复重金属污染的休耕地时能发挥最佳效果。
参考文献
[1]朱守晶, 史文娟. 苎麻液泡膜质子焦磷酸酶基因BnVP1的克隆及镉胁迫下的表达分析[J]. 农业生物技术学报, 2021, 29(8): 1485-1494.ZHU S J, SHI W J. Cloning of the vacuolar H+-pyrophosphatases gene Bn VP1 fr om ramie (Boehmeri an ivea ) an d expressionanalysisundercadmiumstress[J].JournalofAgri-cultural Biotechnology, 2021, 29(8): 1485-1494.
[2]吴胜兰.苎麻种质对贫瘠土壤适应性评价及其机制[D]. 长沙: 湖南农业大学, 2021.
[3]VAHID S, YING C. Bast fibres: Structure, processing, properties, and applications[J].I nternational Materials Reviews, 2019, 64(7): 381-406.
[4]戴先焙, 蒋桂韬, 戴求仲. 种植苎麻修复重金属污染耕地[J]. 湖南农业, 2015(8): 28. DAI X B, JIANG G T, DAI Q Z. Planting ramie (Boehmeria nivea) to remediate heavy metal contaminated farmland[J]. Hunan Agriculture, 2015(8): 28.
[5]SUN W, JI B, KHOSO S A, eta l. An extensive review on restoration technologies for mining tailings[J]. Environmental Sciencea nd Pollution Research, 2018, 25: 33911-33925.
[6]苏小惠, 佘玮, 杨瑞芳, 等. 苎麻重金属ATP酶BnHMA1基因的克隆及表达分析[J]. 植物生理学报, 2020, 56(7): 15311540.SU X H , SHE W , YANG R F,e ta l. C loning and ex pression patter nanalysisofr amie heavymetal transpor tingA TPase geneBnHMA1[J].PlantPhysiologyJournal,2020,56(7): 1531-1540.
[7]张蕾, 全芮萍, 陈建福, 等. 苎麻BnPCS1响应重金属镉胁迫功能分析[J]. 农业生物技术学报, 2023, 31(9): 1846-1856.ZH AN G L, QUAN R P , CHEN J F,e ta l. Function al a naly- sisofr amie(Bo ehmerianiv ea)BnP CS1 inresponse toheavy metalcadmiumstress[J].JournalofAgriculturalBiotech-nology, 2023, 31(9): 1846-1856.
[8]韩旭, 丁国华. 植物对重金属的耐受性和吸收、转运特性的研究进展[J]. 安徽农业科学, 2016, 44(4): 106-109.HAN X, D ING G H. R esearch advance s o f plan t tolerance, absorpti on andtra nsportchara cteristics ofhe avyme tals[J].JournalofAnhuiAgriculturalSciences,2016,44(4):106-109.
[9]佘玮, 揭雨成, 邢虎成, 等. 苎麻耐镉品种差异及其筛选指标分析[J]. 作物学报, 2011, 37(2): 348-354.SHE W, JIE Y C , XIN G H C,e ta l . Comp arison and screen- ing indicatorsfor ramie (Boehmeria nivea) genoty pestole rant tocadmium[J].ActaAgronomicaSinica,2011,37(2):348354.
[10]YANG B, ZHOU M, SHU W S,e ta l. Constitutional tolerance to hev y metals of a fiber c rop, ramie( Boehmeria nivea) ,and itspotentialusage[J].EnvironmentPollution,2010,158:551-558
[11]曹德菊, 周世杯, 项剑. 苎麻对土壤中镉的耐受和积累效应研究[J]. 中国麻业, 2004(6): 14-16.CAO D J, ZHOU S B, XIANG J. Ramie tolerance to Cd in soil and its accumulation effect[J]. Plant Fiber Sciencesi n China, 2004(6): 14-16.
[12]林欣, 张兴, 朱守晶, 等.苎麻对重金属Cd污染的耐受和富集能力研究[J].中国农学通报, 2015, 31(17): 145-150.LIN X, ZHANG X, ZHU S J,e ta l. Tolerance and accumulation ab ility of rami e to hea vy metal cadmi um pollu tion[J]. ChineseAgriculturalScienceBulletin,2015,31(17):145-150.
[13]国家能源局. NB/T 34057.5—2017木质纤维素类生物质原料化学成分的测定 第5部分: 纤维素、半纤维素、果胶和木质素的测定[S]. 北京: 国家能源局, 2017.
[14]WEIGEL H J, JAGER H J. Subcellular distribution and chemi cal for m of cad miumi n bean plants[J]. Plant Physiology,1980,65(3):480-482.
[15]FU X, DOU C, CHEN Y,e ta l. Subcellular distribution and chemical forms of cadmium in Phytolaccaa mericana L.[J]. Journalo f Hazardous Materials, 2011, 186(1): 103-107.
[16]伍旖旎. 南荻适应镉胁迫的机制探索[D]. 长沙: 湖南农业大学, 2022.
[17]王艳, 王彤, 朱四喜, 等. 芦竹中六价铬的富集、转运及其亚细胞的分布[J]. 安全与环境学报, 2020, 20(6): 2295-2302. WANG Y, WANG T, ZHU S X, et al. Accumulation, translocation and subcellular distribution of Cr (Ⅵ)i n Arun-dod onax[J]. Journal of Safety and Environment, 2020, 20(6): 2295-2302.
[18]王学华, 戴力. 作物根系镉滞留作用及其生理生化机制[J]. 中国农业科学, 2016, 49(22): 4323-4341.WA NG X H, DAI L. Immobili zat ion effect and its phys iolo- gyan dbioche micalmecha nismof theca dmiumi ncroproots [J].ScientiaAgriculturaSinica,2016,49(22):4323-4341.
[19]LAI H Y. Subcellular distribution and chemical forms of cadmium in Impatiens walleriana in relatio n to i ts phytoextrac-tionpo tential[J ].Che mosp here,2015,138:370-376.
[20]闫雷,朱园辰,陈辰,等.镉在黄瓜幼苗中的化学形态及亚细胞分布[J]. 农业环境科学学报, 2019, 38(8): 1864-1871.YAN L, ZHU Y C, CHEN C,e ta l. Subcellular distribution and che mic al forms of cadmi um in c ucumb er see dlings[J]. JournalofAgro-EnvironmentScience,2019,38(8):1864-1871.
[21]WEI W, PENG H, XIE Y H, et al. The role of silicon in cad mium alleviation by ric e root cell wall retention and va cuolecompartmentalizationu nder differentdurat ionsofC dex- posur e[J].EcotoxicologyandEnvironmentalSafety,2021, 226:112810.
[22]BALI A S, SIDHU G P S, KUMAR V. Root exudates ameliorate c admium tol erance in plants: A review[J].EnvironmentalChemistryLetters,2020,18:1243-1275.
[23]GUAN Y M, ZHANG H H, PAN W,e ta l. Sulfide alleviates cadm ium t oxici ty in Arabidops is plants by alt ering the chemicalformandthesubcellulardistributionofcadmium [J]. Scienceo ft he Total Environment, 2018, 627: 663-670.
[24]杨卫东, 陈益泰, 屈明华. 镉在旱柳中亚细胞分布及存在的化学形态[J]. 西北植物学报, 2009, 29(7): 1394-1399. YANG W D, CHEN Y T, QU M H. Subcellular distribution and chemicalf orms of cadmiumi n Salix matsudana[J]. Acta Botanica Boreali-OccidentaliaS inica, 2009, 29(7): 1394-1399.
[25]YANG L P, ZHU J, WANG P, et al. Effect of Cd on grow th, phys iologic al response, Cd subcellular dis tribution andchemicalformsofKoelreuteriapaniculata[J].Ecotoxi-cologya nd EnvironmentalS afety,, 2018, 160: 10-18.
[26]舒婉钦, 陈光才, 王树凤, 等. 杞柳4个品种Cd的亚细胞分布、化学形态及其对Cd转运的影响[J]. 植物生理学, 2022, 58(9): 1766-1778. SUW Q, CHEN G C, WANG S F,e ta l. Subcellular distribution, chemical forms of cadmium and the effects on cadmium tra nsportation in four c ultivar s of Sa lix integra [J]. PlantPhysiologyJournal,2022,58(9):1766-1778.
[27]DAISE I U, NAOKI Y , IZUMI K,e ta l. Ge ne limi ting cad- miumaccumulationinrice[J].ProceedingsoftheNational Academy of Sciences of the United States of America, 2010, 107(38): 16500-16505.
[28]MA Y S, JIE H D, TANG Y Y,e ta l. The role of hemicellulose in cadmium tolerance in ramie [Boehmerian ivea (L.) Gaud.][J]. Plants, 2022, 11(15): 1941.
[29]马莹, 黄蓝青, 贾红磊, 等. 乙烯促进木质素合成减少镉吸收和积累提高番茄耐镉性[J]. 中国生物化学与分子生物学报, 2023, 39(7): 980-990.MA Y, HUA NG L Q , JIA H L , eta l. Ethyle ne e nhances Cdtoleran cethrough pro motinglignin syn thesisandr educing cadmium ab sorptionanda ccum ulationint omato[J] .Chine se JournalofBiochemistryandMolecularBiology,2023,39 (7): 980-990.
[30]陈子涵, 任建国, 庞玉新, 等. 镉胁迫对艾纳香抗性生理、亚细胞镉分布和镉化学形态的影响[J]. 种子, 2022, 41(2): 31-39.CHEN Z H, REN J G , PANG Y X,e ta l. Effects of cadmi-um stress on res ista nt physiol ogy , sbcellul ar distribution and chemicalformsofcadmiuminBlumeabalsamifera[J].Seed, 2022, 41(2): 31-39.
[31]CHEN L, GUO L, XIONG Q Q,e ta l. Biochar-mediated Cd accumulatio n in rice grai ns th rough alterin g chemical forms, subcellular distri bution ,andphysiologicalcharacteristics[J].Biochar,2023,5(1):48.
[32]LI H, LU O N, ZHANG J L,e t a l. Do a rbuscular m ycorrhizalfu ngi affectcad miumu pt akekinetics ,subcell ular dis tribu- tionandchemicalformsinrice?[J].ScienceoftheTotal Environment, 2016, 571: 1183-1190.
[33]LI G X, LI Q S, WANG L,e ta l. Subcellular distribution, che micalf orm s, and physiolog ical response t o cadmiu m s tress inHydrillaverticillata[J].InternationalJournalofPhy-toremediation, 2019, 21(3): 230-239.
[34]DE-JESUS-GARCIA R, ROSAS U, DUBROVSKY J G. The barrier func tion of pla nt root s: Biological base s for selec- tiveup takeand avoidan ceofso ilcompounds[J].Functional PlantBiology,2020,47(5):383-397.
[35]郭宝, 李雪姣, 唐静, 等. 水稻木质部伤流液响应镉胁迫的蛋白组鉴定[J]. 植物营养与肥料学报, 2023, 29(9): 1597-1617.GUO B , LI X J, T ANG J ,e ta l. P rot eomici dentifica tion of pr o- teinsin ricexyle msa pinrespons etoca dmium [J].JournalofPlantNutritionandFertilizers,2023,29(9):1597-1617.
[36]ZHENG M M, FENG D, LIU H J,e ta l. Subcellular distribution, che mic al fo rms of c ad mium and rhizosphere microbi al communityint heproce sso fcad mium hyperaccumulat ionin duckweed[J].ScienceoftheTotalEnvironment,2023, 859: 160389.
[37]YU H X, WA NG Y K, HU ANG H G,e ta l . The regulatoryroleofroot in cadm iumacc umulat ionina highcadmium- accumul ating riceline (Oryzasati vaL. )[J].Env ironmental ScienceandPollutionResearch,2021,28(20):1-10.
[38]柏晓娅. XCD1基因调控拟南芥抗镉的机理研究[D]. 合肥: 合肥工业大学, 2014.
[39]TANG Y J, WANG M H, GAO L Y,e ta l. OsUGE3-mediated cell wal l polysaccha rides accum ulati on im proves biomass produc tion, mechanicals trength ,and salttolerance[J].PlantCellEnvironment,2022,45(8):2492-2507.
[40]汪明滔, 刘建伟, 赵春钊. 植物调控盐胁迫下细胞壁完整性的分子机制[J]. 生物技术通报, 2023, 39(11): 18-27.WANG M T, LIU J W, ZHAO C Z. Molecular mechanisms of cell w all integri ty in p lants und er salt stress[J]. BiotechnologyBulletin,2023,39(11):18-27.
文章摘自:李芷薇,伍旖旎,何聪彧,等.苎麻不同器官耐受镉胁迫的策略初探[J/OL].西北植物学报,1-13[2025-01-13].